Introducción
La lipodistrofia congénita generalizada (LCG) es una enfermedad genética autosómica recesiva muy poco frecuente que se caracteriza por la ausencia total o casi total de tejido adiposo.1,2 Las mutaciones másfrecuentes asociadas a la LCG se caracterizan por la pérdida de la función de los genes AGPAT21 , 3 o BSCL2;1,2,4 sin embargo, también se han descrito mutaciones en los genes CAVI, PTRF, PCYT1A y PPAR gamma.1,4
El gen AGPAT2 codifica para la enzima 1-acilglicerol-3-fosfato-0 aciltransferasa 2, la cual es fundamental en la síntesis de los triglicéridos (TG); portanto, la falta de función de esta enzima genera pérdida de tejido adiposo en regiones metabólicamente activas (grasa subcutánea), con la consecuente disminución de los niveles plasmáticos de leptina y acumulación de lípidos en órganos como el páncreas, el hígado y el corazón.1,2,4
Dada la rareza y la baja frecuencia de presentación de la LCG, muchos médicos no están familiarizados con su diagnóstico ni su tratamiento, por lo que el presente reporte quiso exponer el caso clínico de una paciente con esta enfermedad enfatizando las implicaciones metabólicas de padecerla.
Presentación del caso
Paciente femenina de 17 años de edad, proveniente de la región central de Colombia, quien asistió a consulta a una institución de tercer nivel por un cuadro clínico de 3 días de evolución consistente en fiebre, dolor en hombro derecho y sed extrema. Según indicó la joven, desde la infancia padecía de una lipoatrofia generalizada y al momento del ingresó se le registró un índice de masa corporal (IMC) de 17.7 kg/m2 (peso: 47 kilosy talla: 1.53 m), pese a tener hiperfagia. Al examen físico se encontraron rasgos acromegaloides con agrandamiento de manos, pies y mandíbula; hipertrofia muscular generalizada evidente por una disminución marcada del tejido celular subcutáneo; hepatomegalia; xantomasen las superficies extensoras de las extremidades, y acantosis nigricans en pliegues de axilas y cuello.
La joven no tenía alteraciones cognitivas y su desarrollo puberal fue normal con menarquia a los 14 años, sin embargo después de algunos meses presentó amenorrea persistente hasta la fecha de consulta. Como antecedentes, la paciente manifestó que en el mismo año que tuvo su primera menstruación se le diagnosticó diabetes mellitus (erróneamente clasificada como tipo 1) y se le instauró manejo con dosis ascendentes de insulina, pero aunque la dosis total llego a ser de 2.2 UI/Kg/día, no se logró un adecuado control. A los 15 años de edad tuvo un episodio de pancreatitis aguda secundaria a hipertrigliceridemia severa (TG>3 500 mg/dL). Además, en su historia clínica se encontró registro de múltiples hospitalizaciones por infecciones. A los 16 años se le diagnosticó LCG y mediante un estudio de panel genético se estableció que era de tipo 1 por mutación homocigótica en el gen AGPAT2 (NP-006403.2:p.Arg68) (Tabla 1).
Tabla 1 Estudio genético que confirmó el diagnóstico de lipodistrofia congénita generalizada.
| Gen | Variante | Resultado | Patogenicidad | Frecuencia en la población | No. de referencias |
|---|---|---|---|---|---|
| AGPAT2 | NP_006403.2:p.Arg68 NM_006412.3:C.202C>T NC_000009.11:g.l39571989G>A | Homocigosis | Patogénico o asociado con enfermedad (+++) | Variante rara: presente en <1% de los controles | 8 |
Fuente: Elaboración propia.
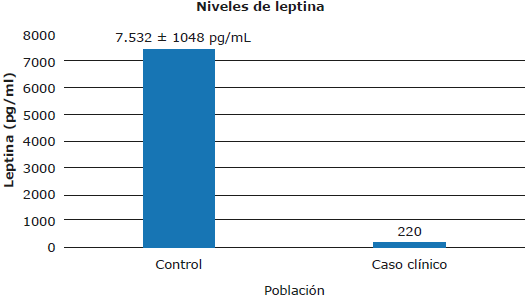
Los niveles séricos de leptina de la paciente al ingreso fueron extremadamente bajos (220 pg/mL) en comparación con los de un grupo de sujetos de referencia con normopeso (7 532 pg/mL en promedio, con desviación estándar de 1 048 pg/mL) (Figura 1) y se decidió hospitalizarla.
Durante su hospitalización se realizó diagnóstico de quiste óseo ubicado en el hombro derecho, infectado por Staphylococcus áureos resistente a la meticilina y asociado a hipertrigliceridemia severa e hiperglicemia sin cetoacidosis. Una vez modulada la respuesta inflamatoria y luego de descartar acidosis metabólica, se midió el péptido C en plasma para confirmar secreción endógena de insulina; luego de ello se decidió adicionar un sensibilizador de insulina (metformina) y un inhibidor de cotransportador de Sodio-Glucosa tipo 2 (SGLT2), con lo que se logró llevar casi a la normalidad los niveles de glicemia y disminuir los requerimientos de insulina a solamente 0.4 UI/kg/día de insulina basal, eliminando así los bolos de insulina preprandiales. Además, se adicionó un fibrato de alta potencia que mejoró los valores de TG y permitió un mejor control glucémico.
Los resultados de laboratorio obtenidos antes y después del respectivo tratamiento se evidencian en la Tabla 2.
Tabla 2 Resultados de laboratorio antes y después del uso de metformina y un iSGLT2.
| Variable metabólica | Valor previo al uso de metformina + iSGLT2 | Valor posterior al uso de metformina + iSGLT2 |
|---|---|---|
| Hemoglobina glicada (HbA1c) | 13.7% | 8.2% (3 meses después) |
| Glucosa en ayunas | 880 mg/dL | 155 mg/dL (1 semana después) |
| Triglicéridos | 3500 mg/dL | 764 mg/dL (1 semana después) |
| Colesterol Total | No hay datos | 198 mg/dL (1 semana después) |
| Colesterol HDL | No hay datos | 22 mg/dL (1 semana después) |
| Colesterol LDL | No hay datos | 76 mg/dL (1 semana después) |
| ALT (0 a 40 U/L | 122 U/L | 111 mg/dL ( 1 semana después) |
| AST (0 a 40 U/L) | 84 U/L | 76 mg/dL ( 1 semana después) |
| Péptido C (1.1 a 4.6 ng/mL) | 2.2 ng/mL | No hay datos |
iSGLT2: inhibidor de cotransportador sodio/glucosa 2; ALT: alanino aminotransferasa; AST: aspartato aminotransferasa.
Fuente: Elaboración propia.
Discusión
Aunque por mucho tiempo se reconoció al tejido adiposo como un órgano destinado únicamente al almacenamiento energético, en la actualidad es bien sabido que posee características propias de un órgano endocrino activo y que tiene la capacidad de secretar hormonas reguladoras de los sistemas inmune, gastrointestinal, nervioso, cardiovascular, gonadal, entre otros.
Los pacientes con LCG se caracterizan por la deficiencia de tejido adiposo subcutáneo,1,2,4 lo que ocasiona que los lípidos permanezcan en la sangre y se acumulen en órganos como el hígado y el páncreas. Los lípidos al interior de los islotes pancreáticos, especialmente los provenientes de las ceramidas y el diacilglicerol, activan la proteína quinasa C (que fosforila en serina y treonina y no en tirosina) y el receptor de insulina, generando así resistencia a la insulina luego que esta se una a su receptor y previniendo la activación adecuada de la vía de señalización AKT/PKB, lo cual perpetúa la insulinoresistencia y se traduce en un aumento en la gluconeogénesis y una disminución del transporte de glucosa y de la lipolisis.5 El exceso de lípidos en el páncreas también estimula la fragmentación del ADN y, como consecuencia, la apoptosis de las células p que rebasan su tasa de replicación, lo que a su vez disminuye la producción de insulina6 y se manifiesta como diabetes mellitus tipo 2 (DM2).
Asimismo, la inhabilidad de almacenar TG en el tejido adiposo es la razón por la que existen depósitos anormales de triacilgliceroles en otros órganos y tejidos con el hígado, donde causan esteatohepatitis no alcohólica;7,8 la piel, donde causan xantomas eruptivos o neoformaciones cutáneas amarillentas constituidas por células macrofágicas ricas en granulaciones lipídicas de TG,9 y la sangre, donde causan hipertrigliceridemia.10
Una de las principales complicaciones de la hipertrigliceridemia es la pancreatitis aguda, una inflamación que suele desarrollarse cuando los TG alcanzan niveles >1 000 mg/dL.11 En los modelos animales se ha demostrado que el exceso de este tipo de grasas en sangre promueve la acumulación de ácidos grasos en el tejido pancreático, dañándolo debido al aumento de radicales libres.12
El déficit de leptina, una de las principales adipoquinas producidas por el tejido adiposo, genera disfunción del eje hipotálamo-hipófisis-gonadal debido a las acciones directas que realiza esta hormona sobre el hipotálamo a través de su efecto sobre neuronas que expresan el péptido relacionado con neuropéptido Y, agouti y proopiomelanocortina y neuronas del núcleo arcuato que expresan bradiquininas, dinorfinas y kisspeptinas.13,14 Es importante mencionar que las kisspeptinas estimulan la secreción de la hormona liberadora de gonadotropina y tienen acciones directas sobre la hipófisis debido a que promueven la liberación de las hormonas luteoestimulante y foliculoestimulante,15 las cuales son indispensables para los ciclos menstruales ovulatorios y regulares.
En el presente caso, el déficit de leptina explica que la paciente haya presentado infecciones a repetición, pues esta hormona regula el sistema inmune: su receptor pertenece a la clase I de la familia de receptores de citoquinas que activan la vía de señalización JAK/STAT y se expresan en todo este sistema.16 Además, la leptina está estrechamente relacionada con la activación y la regulación de las citoquinas y los factores de crecimiento implicados en la respuesta inmune innata y adaptativa.17,18
La leptina también promueve la función fagocítica de los macrófagos, la secreción de citoquinas proinflamatorias, la supervivencia de los neutrófilos y la liberación de radicales libres por parte de los polimorfonucleares;19 modula la actividad de las células asesinas naturales y la producción de leucotrienos; regula negativamente las células T reguladoras, que son las principales reguladoras de la tolerancia inmune periférica;18 favorece el metabolismo glucolítico de las células T, e induce la diferenciación celular de los linfocitos Th17.18,20
Por otro lado, los quistes óseos son una manifestación mucocutánea frecuente en la LCG que se produce por una respuesta osteoclástica aumentada secundaria a la pérdida de tejido graso al interior de la médula ósea.21 Estos quistes son tumores benignos, asintomáticos en la mayoría de casos, cuyo diagnóstico suele revelarse en el momento de una fractura patológica o cuando se sobreinfectan, como en el caso de la paciente reportada.
A pesar de que la LCG es una enfermedad que no tiene cura y de que no existe ninguna opción farmacológica para restablecer el tejido adiposo,1 existen opciones de tratamiento que mejoran las complicaciones metabólicas secundarias a la ausencia de este tejido.
La primera medida que se debe tomar en estos pacientes, principalmente en quienes presentan pancreatitis por síndrome de quilomicronemia, es instaurar una dieta con restricción calórica por carbohidratos1,4 y muy baja en grasa. Después de esto se puede considerar el uso de metformina, una opción económica y de fácil acceso que por medio de la activación de la proteína quinasa activada por AMP promueve la captación de glucosa y la oxidación de ácidos grasos en el músculo; aumenta la oxidación de ácidos grasos en los hepatocitos, e inhibe la producción de glucosa y la síntesis de lípidos en el hígado.22 De igual forma, la metformina es el medicamento de primera línea en el tratamiento de la diabetes secundaria a la LCG, así como de las otras consecuencias de la resistencia a la insulina, como la esteatohepatitis.1,23
Por su parte, los fibratos (estimulantes de los receptores activados de proliferación de los peroxisomas alfa) y los ácidos grasos omega-3 son opciones adicionales a la dieta para evitar las complicaciones de la hipertrigliceridemia.1
A pesar de que los fármacos inhibidores de SGLT2 no son mencionados en las guías de manejo de las lipodistrofias, en esta paciente fueron bastante efectivos respecto a la mejoría de los niveles de hiperglicemia gracias a su mecanismo fisiopatológico basado en la disminución de la reabsorción renal de glucosa independiente de la secreción o acción de la insulina y de la etapa de evolución de la DM2.24
Cuando los medicamentos sensibilizadores a la insulina no logran un adecuado control glicémico, la insulina es una opción de tratamiento; sin embargo, dada la ausencia de tejido adiposo, su absorción no es adecuada y con frecuencia las dosis requeridas son elevadas.
De igual forma, la metreleptina1,25 es un medicamento aprobado en EE. UU. que se usa como complemento de la dieta para el manejo de las complicaciones metabólicas de la LCG; sin embargo, aún no es fácil de conseguir en Colombia, por lo que la dieta, la metformina y los fibratos siguen siendo las terapias de primera línea para disminuir la morbimortalidad en pacientes con LCG en el país.
Conclusión
Es frecuente que el desconocimiento de algunas enfermedades huérfanas lleve a diagnósticos erróneos y que por tanto se instauren enfoques terapéuticos inapropiados que en ocasiones pueden empeorar la condición clínica de los pacientes. En este sentido, el presente caso clínico, que expone las funciones benéficas del tejido adiposo (muchas veces no reconocidas) y discute los aspectos diagnósticos y terapéuticos de la LCG, se convierte en una herramienta para que la comunidad médica reconozca, diagnostique y trate oportunamente a quienes padecen esta extraña enfermedad, siempre teniendo en cuenta que sus principales manifestaciones clínicas son lipoatrofia generalizada, hipertrofia muscular, resistencia a la insulina, hipertrigliceridemia y hepatomegalia.