Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.29 no.1 Bogotá Jan./June 2003
Evaluación de medios de cultivo para el aislamiento de mohos de Trialeurodes vaporariorum (Homoptera: Aleyrodidae)1
Evaluation of different media for isolation of Trialeurodes vaporariorum (Homoptera: Aleyrodidae) molds
ERIKA I. PEREA A.2, ELEONORA ROJAS M.3 YOLA NDA A. PINEDA V4
1 Esta publicación hace parte del proyecto de grado "Mohos asociados con mosca blanca (Homoptera: Aleyrodidae) en tabaco y fríjol de la provincia de García Rovira, Santander, Colombia" para optar ai título de Bióloga. Universidad Industrial de Santander.
2Bióloga. Universidad Industrial de Santander. Bucaramanga. E-mail: eiperea@yahoo.es
3Autor para correspondencia: Bióloga. Universidad Industrial de Santander. Bucaramanga. Calle 55 No. 31 - 74 Antiguo Campestre. Bucaramanga. Santander. Tel.: 6478620. E-mails: eleonorarojas@yahoo.com y elerojman@hotmail.com
4Bacterióloga y Laboratorista Clínico. Msc. Microbiología de Alimentos y Micología, Facultad de Salud, Universidad Industrial de Santander. E-mail: ypineda@uis.edu.co
Resumen. La mosca blanca de los invernaderos, Trialeurodes vaporariorum (Westwood), causa pérdidas económicas en diversos cultivos de la provincia de García Rovira (Santander). Investigaciones encaminadas al estudio de microorganismos nativos en un área determinada se han desarrollado para proporcionar herramientas básicas en el control de insectos plaga. Por lo tanto, la necesidad de conocer más acerca de mohos nativos, posiblemente involucrados como entomopatógenos, motivó este estudio, en el cual se evaluaron tres medios de cultivo diferentes, Medio Completo (MC), Sabouraud al 4% (SDAY/4) y Papa Dextrosa Agar (PDA) en el aislamiento primario de mohos de T. vaporariorum con y sin desinfección previa del insecto utilizando hipoclorito de sodio al 0,4%. Todos los cultivos se revisaron a partir del segundo día hasta completar ocho días de incubación a temperatura ambiente. En los medios de cultivo MC y SDAY/4, los cadáveres de T. vaporariorum presentaron porcentajes de mohos similares y permitieron mejor y mayor aislamiento de ellos; mientras que en PDA, éstos fueron menores e incluso se dificultó el aislamiento. Los porcentajes mayores con presencia de mohos se obtuvieron en las muestras que no fueron sometidas a desinfección y la mayoría de las colonias aisladas se hicieron evidentes en los medios de cultivo después de dos días de incubación. El 70% de las colonias aisladas (612) se identificaron y de éstas se obtuvieron los siguientes géneros: Cladosporium (67%), Fusarium (27,45%), Alternaría (2,12%), Mucor (1,63%), Phoma (1.15%) y Penicillium (0,33%).
Palabras clave: Mosca blanca. Micobiota. Medio completo. Sabouraud al 4%. Papa dextrosa agar.
Summary. üreenhouse whitefly, Trialeurodes vaporariorum (Westwood), causes economic losses of several crops in Qarcia Rovira province (Santander). Some research has been conducted in order to study native microorganisms in specific áreas and give basic tools for insect pest control. Henee the need to know more about native molds that possibly linked as entomopathogenics, motivated this study, in which three different media were evaluated: Complete Agar Médium (CM), 4% Sabouraud Dextrose Yeast Extract Agar (SDAY/4) and Potato Dextrose Agar (PDA) .They were used for primary mold isolation from T. vaporariorum with and without the disinfecting of inseets using 0,4% sodium hypochlorite. All samples were checked after the second and up to eight days of incubation at room temperature. On CM and SDAY/4 careases of T. vaporariorum showed a similar percentages of mold allowing for a better and major mold isolation, than on PDA. The latter showed a lower percentages of T. vaporariorum mold and difficult mold isolation. The greatest percentage of T. vaporariorum mold was obtained from samples that were not disinfected. Most of the isolated colonies were detected on media after two days of incubation. Seventy percent of isolated colonies (612) were identified. They were: C/acfosporíum (67%), Fusarium (27,45%), Alternaría (2,12%), Mucor (1,63%), Phoma (1,15%) and Penicillium (0,33%).
Key words: Whitefly. Mycobiotic. Complete agar médium. 4% Sabouraud dextrose yeast extract agar. Potato dextrose agar.
Introducción
En el departamento de Santander, una de las provincias afectadas por la mosca blanca de los invernaderos en los últimos diez años ha sido García Rovira, donde las poblaciones altas de este insecto causan pérdidas económicas en los sistemas agrícolas, debido al daño directo por la extracción de nutrientes, como también por daños indirectos al ser el insecto vector de virus en los cultivos y por la excreción de miel, que sirve como medio de crecimiento y multiplicación de un hongo negro perteneciente al género Capnodium sp., conocido como fumagina que puede cubrir totalmente la planta reduciendo la fotosíntesis y la respiración, dando como resultado la muerte de la misma. Esta situación es explicable por varias causas, como es el uso excesivo de productos químicos para el control de la mosca blanca, la cual presenta un ciclo de vida muy corto, hábito de mantenerse protegido en el envés de las hojas y un amplio rango de plantas hospederas (Madrigal 1992). El desarrollo de niveles altos de resistencia a insecticidas químicos y el impacto negativo de los pesticidas sobre los enemigos naturales (parasitoides, depredadores y hongos entomopatógenos) de las moscas blancas, promovió el estudio de microorganismos nativos posiblemente entomopatógenos en áreas determinadas, proporcionando herramientas básicas en el control de este insecto plaga. Los resultados hasta ahora obtenidos demuestran que en Colombia existen especies de hongos entomopatógenos ya establecidas, adaptadas al medio, las cuales se podrían seleccionar para ser usadas en planes de control integrado de moscas blancas (Rodríguez 1984a). La efectividad de varias cepas nativas de hongos entomopatógenos y productos comerciales de los mismos se ha evaluado, siendo más patógenas las cepas nativas (Bustillo et al. 1986).
Para estudiar estos organismos patógenos es necesario identificar la micobiota del insecto mediante un aislamiento primario proporcionándoles el sustrato y condiciones adecuadas para su desarrollo, lo cual se hace a partir de Insectos moribundos o cadáveres, depositándolos directamente en medios de cultivo específicos, sin desinfectarlos (Rodríguez 1984a); otros estudios recomiendan sumergir los cadáveres del insecto previamente en soluciones desinfectantes como: etanol al 70%, bicloruro de mercurio o hipoclorito de sodio (Mier et al. 1991). también se ha utilizado el ubicar los cadáveres de los insectos en cámaras húmedas para facilitar la salida del micelio y la esporulación del moho (Rodríguez 1984a; García 1996). Los medios de cultivo comúnmente usados para aislar la micobiota son: el Medio Completo (MC) (Riba y Ravelojoana 1984; Calle 2000; Rodríguez 1984b); Sabouraud al 4% (SDAY/4) y sus diversas modificaciones (Rodríguez 1984a y b; Humber 1992); Papa Dextrosa Agar (PDA) con diferentes combinaciones en su composición (Rodríguez 1984a y b; Mier et ai. 1991; Landa et ai. 1994; García 1996) y Extract Malt Agar (MEA) (Mier eí al. 1991). En las últimas décadas, los estudios de los mohos entomopatógenos actuando sobre moscas blancas se han intensificado; entre ellos se destacan los mohos pertenecientes a las clases Hyphomycetos (Beauueria bassiana, Metarhizum anisopllae, Paecilomyces fumoroseus, Fusarium spp. y Verticitlium íecanii); Zygomycetos (Cnío-mophthora spp.) y Coleomycetos (Ascher-sonía spp.) (Humber 1992).
En este trabajo se evaluaron tres medios de cultivo para el aislamiento primario de mohos de Triateurodes uaporariorum (Westwood) con y sin desinfección previa del insecto utilizando hipoclorito de sodio al 0,4%. Además, se analizó el desarrollo de las colonias de mohos a los dos días de incubación de las muestras y después de dos días hasta completar ocho días. Es importante resaltar que esta investigación es la primera que se realiza en üarcía Rovira (Santander).
Materiales y Métodos
Recolección en campo. Esta investigación se llevó a cabo en la provincia de García Rovira, localizada al oriente del departamento de Santander, en los municipios de Capitanejo, Cerrito, Concepción, Enciso y San José de Miranda en los cuales se ubicaron las áreas productoras de tabaco y fríjol infestadas con mosca blanca. Para obtener el material biológico se escogieron, al azar en los cultivos hospedantes, seis hojas y/o foliólos con presencia de mosca blanca y en buen estado, ubicadas en los sitios con mayor densidad foliar; según Mier
et al. (1991) la autosombra propicia el desarrollo de los insectos y los hongos. Además, siguiendo la metodología empleada por Anderson et al. (1997) cada hoja se introdujo en una bolsa plástica que en su interior contenía una toalla absorbente estéril y externamente una cinta adhesiva para su cierre; este material de recolección fue previamente elaborado y esterilizado en el laboratorio.
Diseño del experimento. Para el aislamiento primario de mohos asociados a T. uaporariorum se elaboró un diseño experimental, conformado por adultos y/o ninfas de mosca blanca; mohos asociados al insecto; medios de cultivo (MC, SDAY/4 y PDA) y los procesos de desinfección de la mosca blanca (método tradicional o sin desinfección y desinfectando previamente con hipoclorito de sodio al 0,4%), los cuales interactúan directa y competitivamente proporcionando el porcentaje de mohos asociados con mosca blanca. Además, las variables de toma de las muestras en campo, selección en forma aleatoria de las muestras, preparación e incubación de los medios de cultivo, procedimiento de esterilización y desinfección de materiales y equipos se controlaron. Las variables independientes o factores seleccionados en este experimento fueron: factor 1 (medios de cultivo: MC, SDAY/4 y PDA) y factor 2 (desinfección del insecto: con y sin); de acuerdo con los factores seleccionados se utilizó un diseño bifactorial general de A x B (3 medios de cultivo y 2 procesos de desinfección), en donde la variable independiente o de respuesta se expresó como el porcentaje de mohos presentes en T. uaporariorum y se obtuvo de la unidad experimental que es equivalente a la unidad de muestreo de este ensayo, la cual fue la caja de petri desechable de 60 x 15 mm por cada medio de cultivo y con diez individuos de T. vaporariorum, siguiendo el modelo propuesto en Zar (1996):
Yijk:u + Ti + Bj(TB)ij + E ijku: Efecto promedio global
Ti: Efecto del iésimo nivel del factor medio de cultivo
Bj: Efecto del jésimo nivel factor utilización de la siembra
(TB)..: Efecto de la interacción de los factores medio de cultivo - utilización de la siembra
Eijk: Componente del error aleatorio
Hipótesis:
Ho: MC= SDAY/4 = PDA = 0 (efecto del factor medio de cultivo)
H1: Ti≠ 0 Al menos para algún medio de cultivo.
Ho: Con desinfección = Sin desinfección = 0 (efecto del factor utilización de la siembra)
H1: Bj≠ 0 al menos para alguna de las utilizaciones de la siembra
Ho: TB11 = TB12 = TB21 = TB22 = TB31 = TB32 = 0(TB11 = MC CON, TB,12 = MCSIN,TB21 =
SDAY/4 COM, TB22 = SDAY/4 Sin, TB31 = PDA COri y TB32 = PDA SIN)
H,: TBr ≠ 0 al menos para alguno de los tratamientos.
El tamaño de la muestra correspondió a 14 sitios de muestreo por 12 unidades experimentales (14 x 12 =168). Se usaron controles para verificar la calidad y esterilidad de cada uno de los medios de cultivo utilizados.
Aislamiento primario. Con las seis muestras colectadas en campo por cada sitio de muestreo se obtuvieron al azar 120 adultos y/o inmaduros de T. uaporariorum de las hojas infestadas que estaban conservadas en las bolsas plásticas estériles. En la determinación de la micobiota presente en el insecto se utilizaron dos tipos de ensayo; uno de ellos fue depositando directamente 60 cadáveres de T. uaporariorum sobre los medios de cultivo (MC, SDAY/4 y PDA) con una pinza entomológica estéril colocando diez individuos por cada caja petri y en el otro los cadáveres se sometieron a desinfección previa con hipoclorito de sodio al 0,4%. Para este proceso de desinfección fue necesario esterilizar frascos pequeños de vidrio, gasas y agua destilada en autoclave a I21°C por 15 minutos. Además, se diluyó el hipoclorito de sodio comercial de 5,4% a 0,4% utilizando agua destilada estéril. Teniendo todos los elementos estériles para la desinfección y los Individuos de mosca blanca seleccionados (60 individuos), las moscas se desinfectaron en 1 mi de hipoclorito de sodio al 0,4% contenidos en un recipiente de vidrio estéril, agitando constantemente por dos minutos y se enjuagaron con 3 mi de agua destilada estéril por un minuto. Siguiendo la recomendación de Mier et al. (1991), se colectaron los individuos sobre una gasa estéril y se colocaron sobre los medios de cultivo. Los tres medios de cultivo propuestos se distribuyeron en seis cajas de petri desechables estériles, por duplicado, para cada uno de los 14 sitios de muestreo.
Posteriormente, las cajas de petri, de cada sitio de muestreo, se incubaron a temperatura ambiente y se revisaron a partir del segundo día hasta completar ocho días, registrando la evidencia o ausencia de los mohos sobre T. uaporariorum. Cada una de las colonias obtenidas de las muestras se codificaron y aislaron en frascos de vidrio pequeños que contenían tres cuartas partes de Czapek Yeast Extract Agar (CYA), medio recomendado por Pitt y Hocking (1997) y Samson et al. (1995) o MC en pico de flauta. Estos aislamientos se incubaron a ± 25°C entre cinco y siete días hasta lograr su desarrollo completo, luego se conservaron a ± 5°C, para su posterior identificación.
Identificación de mohos asociados con T. uaporariorum. Del conjunto de los mohos que presentaron un completo desarrollo se seleccionaron por sus características macroscópicas comunes y con base en ello se realizaron montajes microscópicos de cada grupo siguiendo la técnica de Humber (1996), en láminas y laminillas con una gota de ácido láctico, para agruparlos en posibles géneros de acuerdo con sus semejanzas micro y macroscópicas. A partir de los resultados de las descripciones macroscópicas y microscópicas se seleccionaron diferentes medios de cultivo para identificación de los mohos aislados (MC; SDAY/4; PDA; CYA; MEA; G25N: 25% Qlycerol Nitrate Agar; DCMA: Dlchloran Chloramphenicol Malt Extract Agar; CY20S: Czapek Yeast Extract Agar with 20% Sucrose; CMA: Cornmeal Agar; OA: Oatmeal Agar; PCA: Potato Carrot Agar y CLA: Carnation Leaf Agar), Para ello se tomaron tres inóculos de cada una de las colonias desarrolladas en CYA y/o MC y se ubicaron equidistantemente en las cajas de petri que contenían los medios de cultivo favorables para el desarrollo e identificación del moho, los cuales fueron incubados a diferentes temperaturas dependiendo del género a determinar. El propósito de esta parte del trabajo fue identificar en lo posible los mohos a nivel de género y/o especie, mediante la utilización de las claves taxonómicas elaboradas por: Humber (1998), Pitt y Hocking (1997), Samson et al. (1995), Melson et al. (1983), Seifert (2000) y Burgess et al. (1994).
Análisis de los datos. Para el procesamiento de los datos fue necesario realizar la transformación de la variable respuesta (porcentaje de T. vaporariorum con presencia de mohos) porque presentaba valores máximos (100%) y mínimos (0%) que ocasionaban diferencias en la varianza de los tratamientos. La transformación de estos porcentajes se llevó a cabo por medio del arco seno a través de la fórmula de Anscombe propuesta por Zar (1996): p'= arcsen √X + 3/8 / n + 3/4, con el fin de estabilizar la varianza. Para verificar la igualdad de las varianzas entre los diferentes tratamientos se aplicó el test de Levene a los datos transformados y se obtuvo un valor de P para la prueba igual a 0.7348 comprobando así la homogeneidad de varianzas en los tratamientos. Además, se utilizó la prueba de Kolmorrogov- Smirnov en donde se estableció que los datos poseen una distribución normal (Fig. 1). Cumplidos estos supuestos se realizó el análisis de varianza (Tabla 1) del cual se deduce que la interacción de los factores analizados no es significativa; por lo tanto se aplicó el test de rangos múltiples de Duncan a cada uno de los factores analizados.

Resultados y Discusión
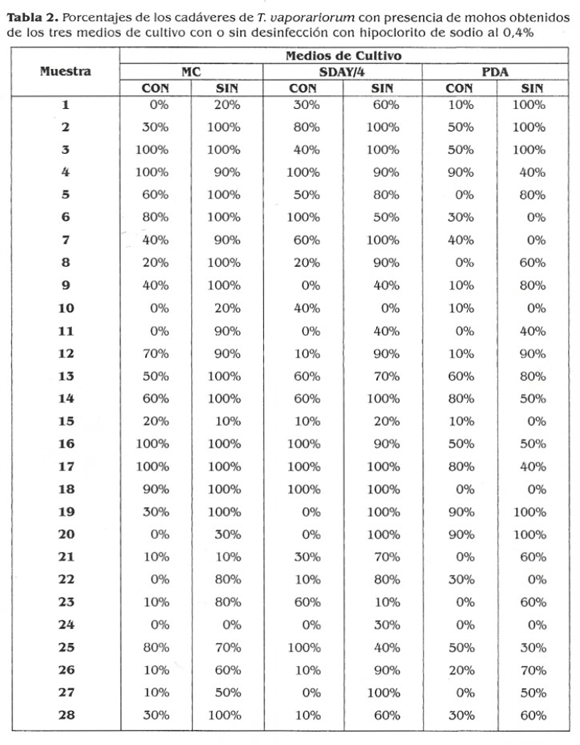
Porcentaje de T. vaporariorum con presencia de mohos y aislamiento primario. Los porcentajes de T. uaporariorum con presencia de mohos obtenidos en las 28 muestras examinadas de los tres diferentes medios de cultivo utilizados para el aislamiento primario de la micobiota relacionada con T. uaporariorum fueron similares en MC y SDAY/4 puesto que se logró mayor y mejor desarrollo de los mohos, velocidad de germinación y buen crecimiento. Estos dos medios contienen en su composición nutricional azúcares, nitrógeno, fósforo, potasio, extracto de levadura y sales necesarias para el aislamiento y producción de mohos entomopatógenos (Rodríguez 1997; Gómez de Oliveira et al. 1997; Riba y Ravelojoana 1984). En FDA los porcentajes de mohos en T. vaporariorum fueron menores como se observa en las muestras 6, 16 y 18 (Tabla 2). La variedad y porcentaje de componentes nutricionales presentes en PDA es menor que en MC y SDAY/4, siendo los carbohidratos la fuente principal de nutrientes; además, no contiene antibióticos; por lo tanto, en este medio se pueden desarrollar las bacterias que se convierten en fuertes competidores para los mohos, los cuales requieren mayor tiempo para su crecimiento y desarrollo (Seifert 2000; Pitty Hocking 1997). Además, la prueba de comparación de medias de Duncan estableció que las medias de MC (50.4) y SDAY/4 (49.7) son similares entre sí, pero deja en claro que las medias difieren de la de FDA (39.2) (fig 2). El porcentaje de mohos en T. vaporariorum se vio afectado por el crecimiento y desarrollo de colonias bacterianas en la mayoría de las cajas con PDA; además, la presencia de bacterias dificultó el aislamiento primario de mohos; por otra parte, algunas colonias aisladas de MC, SDAY/4 y PDA no se desarrollaron en los medios de cultivo (CYA y MC) utilizados para el aislamiento primario, dando como resultado un 30% de pérdidas de colonias aisladas. Lo anterior permite deducir que la complejidad nutricional de los medios de cultivo es un factor fundamental y determinante en el aislamiento primario de mohos.
Los porcentajes de mohos obtenidos de las muestras sometidas a desinfección previa del insecto fueron menores: 68% (19/28) en MC, 64,3% (18/28) en SDAY/4 y 50% (14/ 28) en PDA (Tabla 2). De acuerdo con la prueba de Duncan el efecto de la desinfección del insecto presenta diferencias estadísticamente significativas entre las medias de los dos tratamientos, con desinfección 37.5 y sin desinfección 55.3 (fig 2). Esporas de mohos se encuentran contaminando cualquier material orgánico e inorgánico y podrían ejercer acción antagónica sobre los entomopatógenos por ser saprobióticamente muy competitivos (Mier et al. 1991); por lo tanto, el hipoclorito de sodio ha sido recomendado para reducir y en lo posible eliminar este tipo de esporas (Fitt y Hocking 1997). Más del 50% de las muestras examinadas en MC y SDAY/4, sin desinfección previa del insecto, presentaron porcentajes de mohos superiores a 80% (Tabla 2), probablemente porque el integumento del insecto en cada uno de estas muestras puede presentar esporas de mohos ambientales además de la micobiota nativa del insecto. Sin embargo, con algunas muestras en PDA y SDAY/4 que se desinfectaron se observó porcentaje mayor de mohos (Tabla 2), posiblemente porque en estas muestras el hipoclorito de sodio favoreció el desarrollo de micobiota nativa reduciendo sus competidores, mohos contaminantes. De todas las muestras procesadas en los tres medios de cultivo, con o sin desinfección, sólo dos presentaron porcentajes de mohos muy bajos (muestras 10 y 24) (Tabla 2).
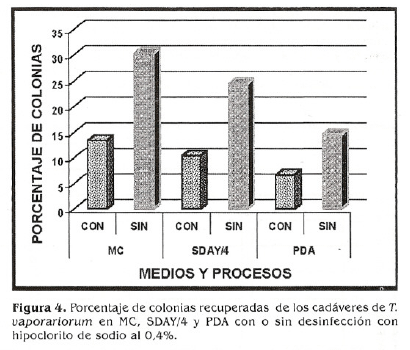
En el aislamiento primario de mohos a partir de 1,680 adultos y/o ninfas de T. vaporariorum ubicados en los medios de cultivo (MC, SDAY/4 y PDA) con y sin desinfección previa del insecto usando hipoclorito de sodio al 0,4%, se obtuvieron 874 colonias de mohos; de las cuales 612 colonias (70%) se recuperaron, mientras que la contaminación bacteriana y el no crecimiento en MC y CYA, impidió la recuperación de la mayoría de las 262 colonias restantes. Las colonias recuperadas alcanzaron crecimiento micelial abundante y se adaptaron a los medios de cultivo (CYA y/o MC) para su posterior identificación. Las colonias aisladas se hicieron evidentes en los medios de cultivo después de dos días de incubación observándose crecimiento micelial sobre el integumento del insecto. F.l mayor número de colonias recuperadas se obtuvo de MC (44%) seguido de SDAY/4 (35%) y sólo el 21% de PDA (Fig. 3); probablemente porque este medio (MC) contiene sales, nitrógeno, fósforo y potasio, elementos nutricionales necesarios e importantes en el desarrollo de los mohos, los cuales no se encuentran en SDAY/4 ni en PDA (Rodríguez 1997). El porcentaje de colonias recuperadas de PDA fue el más bajo puesto que la contaminación bacteriana dificultó este proceso; además, la mayoría de estas colonias provenían de las muestras no sometidas a desinfección debido a que el hipoclorito de sodio redujo el porcentaje de colonias (Fig. 4).
Mohos identificados de T. vaporariorum.
Las 612 colonias aisladas se identificaron; se obtuvieron los géneros; Cladosporium (67%), Fusarium (27,45%), Alternaría (2,12%), Mucor (1,63%), Phoma (1,15%) y Penicillium (0,33%) (Fig. 5). Los géneros predominantes fueron Cladosporium y Fusarium; del primero de ellos se conoce, por la literatura, que la mielecilla excretada por el insecto es un sustrato propicio para su crecimiento y desarrollo (Fransen 1987) y con respecto a Fusarium se conoce que es de distribución mundial, capacidad amplia de adaptación en diferentes hospederos debido a la gama enzimática que posee (Pitt y Hocking 1997; Samson el ai. 1995), causante de fitopatologías en cultivos de tabaco y frijol, como la pudrición radicular causada por F. solani (Prada eí al. 1994), el marchitamiento foliar ocasionado por F. oxysporum (1CA 1990) y algunas especies de este género han sido consideradas patógenas de T. vaporariorum (Humber 1992; Madrigal 1992).
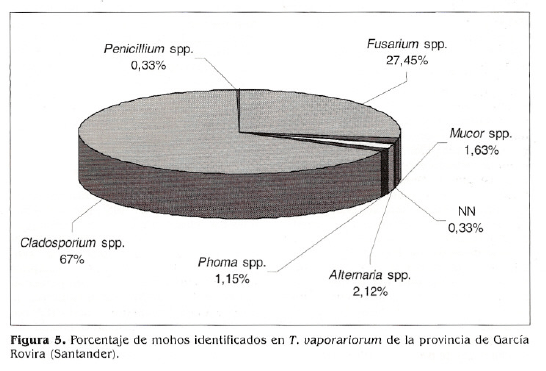
Las colonias de los géneros Cladosporium, Fusarium y Alternaría se aislaron de los tres medios de cultivo y se obtuvieron con o sin desinfección previa del insecto, debido a que son géneros poco exigentes, comúnmente considerados saprofitos y contaminantes de cadáveres de insectos y en medios de cultivo en el laboratorio (Humber 1998; Humber 1992). El género Phoma se encontró exclusivamente en MC con desinfección, puesto que de los tres medios propuestos es el que ofrece número mayor de componentes nutricionales y además la utilización del hipoclorito de sodio redujo posibles competidores de este género, factores que contribuyen a su crecimiento y desarrollo. Penicillium se aisló únicamente de PDA con y sin desinfección; este género es de los contaminantes principales que se encuentran en el ambiente y PDA es un medio que por su composición nutricional favorece y facilita el desarrollo de estos mohos contaminantes. Mucor se desarrolló en MC y SDAY/4 sin desinfección, debido a que estos medios contienen extracto de levadura, nitrógeno, fósforo y potasio; además, este moho presenta un metabolismo rápido puesto que posee micelio aseptado, lo que facilita su propagación y crecimiento y más aún si la muestra no ha sido desinfectada, pues el hipoclorito de sodio afecta su desarrollo (Fig. 6).

Conclusiones
- De los tres medios de cultivo evaluados, el que proporcionó las condiciones mejores para el desarrollo y crecimiento de los mohos debido a su complejidad nutricional fue el Medio Completo (MC). En el aislamiento primario de mohos asociados con T. vaporariorum se obtuvo un 44% en Medio Completo (MC), seguido de un 35% en Sabouraud al 4% (SDAY/4) y sólo del 21% en Papa Dextrosa Agar (PDA). Además, la prueba de comparación de medias de Duncan estableció que las medias de MC (50,4) y SDAY/4 (49,7) son similares entre sí pero difieren de la media de PDA (39,2) con un nivel de significancia de p < 0,5 (0,01629).
- El hipoclorito de sodio al 0,4% disminuye el porcentaje de mohos en T. vaporariorum y es recomendado para eliminar o reducir mohos contaminantes como son los géneros Aspergillus y Penicitlium. En este trabajo no se aislaron especies de Aspergillus y el porcentaje de Penicillium fue muy bajo (0,33), tanto en las muestras desinfectadas como en las no desinfectadas, posiblemente porque estas especies no están presentes en el integumento de los cadáveres de T. vaporariorum o están en muy bajos porcentajes. De acuerdo con la prueba de Duncan el efecto de la desinfección del insecto presenta diferencias estadísticamente significativas entre las medias de los dos tratamientos, con desinfección 37,5 y sin desinfección 55,3 con un nivel de significancia de p < 0,5 (1,09 x 10-6).
- De las 612 colonias identificadas se obtuvieron los géneros: Cladosporium (67%), Fusarium (27,45%), Alternaría (2,12%), Mucor (1,63%), Phoma (1,15%) y Penicillium (0,33%), siendo Cladosporium y fusarium los géneros predominantes asociados con T. vaporariorum que afecta los cultivos muestreados de tabaco y frijol de la provincia de García Rovira.
- En hojas y/o foliólos de tabaco y fríjol, de los sitios muestreados de la provincia de García Rovira, no se aislaron, de T. vaporariorum, los géneros conocidos comúnmente como entomopatógenos (Beauveria, Verticillium y Metarhizium) a pesar de que se utilizaron los medios de cultivo y las condiciones adecuadas para su crecimiento y desarrollo, posiblemente por la competencia con otros mohos predominantes o por que en el momento del muestreo no estaban presentes dentro de la micobiota del insecto.
Agradecimientos
Los autores agradecen a la Universidad Industrial de Santander "UIS", especialmente a las Escuelas de Biología y Bacteriología -Laboratorio Clínico por su contribución académica y préstamo de equipos; a la Compañía Colombiana de Tabaco por su apoyo y colaboración incondicional, en particular al Doctor José Daniel Tinoco Gutiérrez; al Instituto Colombiano Agropecuario "ICA" por su ayuda técnica y logística, orientada por el Doctor Alfonso Eduardo Acosta Acuña y al estudiante de ingeniería industrial Danilo Abril Hernández por su aporte en la organización de los datos y el análisis estadístico.
Literatura citada
ANDERSON, K. P; BELLOTTI, A.; CALVERT, L.; CARDONA, O; LEGG, J.; MARKHAM. P.; MARKHAM, R.; MORALES, F.; NEUENSCHWATIDER, R; RUS, L.; SITHANANTHAM, S. 1997. Manejo integrado sostenible de moscas blancas como plagas y vectores de virus en los trópicos. Fase I. Estandarización de métodos para las actividades del proyecto manejo integrado de moscas blancas. CIAT, Colombia. 38 p. [ Links ]
BURGESS, L. W.; SUMMERELL, B. [A.; BULLOCK, S.; GOTT, K . P ; BACKHOUSE, D. 1994. Laboratory manual for Fusarium Research.Third Edition. Fusarium Research Laboratory. Department of Crop Sciences. University of Sydney and Royal Botanic Gardens. Sydney.133 p. [ Links ]
BUSTILLO, A. F..; GONZÁLEZ, J. E.; TAMAYO, P J. 1986. Evaluación del hongo Verticilium lecanii en el control de mosca blanca, Trialeurodes vaporariorum (Westwood) en frijol. Revista Colombiana de Entomología 12 (2): 26-31. [ Links ]
CALLE, J. 2000. Vers un controle microbiologique des populations colombiennes de Triatominae, insectes vecteurs de la maladie de Chagas. Thése présentée pour obtenir le grade de Docteur de l'Université de París V. París. 140 p. [ Links ]
FRANSEN, J. J. 1987. Asc/iersonia aleyrodis as a microbial control agent of greenhouse whitefly. Tesis presentada para obtener el título de Doctor de la Universidad de la Lan-dobouwuniversiteit te Wageningen.167 p. [ Links ]
GARCÍA, G. J. 1996. Evaluación de cepas nativas de Verticillium lecanii (Zimm) Viegas (Deuteromycete; Moniliales) en el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood). Trabajo de Grado de Ingeniero Agrónomo. Universidad nacional de Colombia, Facultad de Agronomía, Bogotá. 121 p. [ Links ]
GÓMEZ DE OLIVEIRA, M.; TINTI DE OLIVEIRA, N.; DE LUMA, E. A. 1997. Characterization of new biotypes of P157 strain of Metarhizium anlsopllae var. anisopliae, got by treatment with gamma radiation. Boletín Micológico (Brasil) 12 (1-2): 41-48. [ Links ]
HUMBER, R. A. 1992. Collection of entomopathogenic fungal cultures: Catalog of strains. U.S. Department ofAgriculture. Agriculture Research Service. ARS-110. 177 p. [ Links ]
HUMBER, R. A. 1996. Fungi - identification. p 153-185. En: Biological techniques in ¡nvertebrate pathology. (L. A. Lacey, ed.). Academic Press, London. [ Links ]
HUMBER, R. A. 1998. Entomopathogenic fungal identification. APS/ESA Joint Annual Mee-ting. USDA- ARS. Plant Protection Research Unit. US. Plant, Soil & Nutrition l.aboratory. Tower Road. lthaca. United States of América. 26 p. [ Links ]
ICA. 1990. Tabaco, p. 45- 51. Memorias curso sobre el tabaco. Creced, provincia de García Rovira, Santander, Junio. Instituto Colombiano Agropecuario. Estación Experimental El Arsenal. [ Links ]
LANDA, Z.; OSBORME, L.; LÓPEZ, F.; EYAL, J.1994. A bioassay for determining Pathogenicity of entomogenus fungi on whiteflies. Florida Agricultura! Experiment Station Journal 0910: 341-350. [ Links ]
MADRIGAL, A. 1992. Nuevos aportes al manejo integrado de la mosca blanca de los invernaderos. Memorias Seminario sobre Homópteros de importancia económica: mosca blanca, áfidos y Orthezia. p. 1-12. Cali. Sociedad Colombiana de Entomología. [ Links ]
MIER, T.; RIVERA, F.; BERMÚDEZ, J. C; DOMÍNGUEZ, Y.; BENAVIDES, C; ULLOA, M. 1991. Primer reporte en México del aislamiento de Verticillium lecanii a partir de la mosquita blanca y pruebas de patogenicidad in uitro sobre este insecto. Revista Mexicana de Micología 7: 149-156. [ Links ]
NELSON, P. E.; TOUSSOUN, T. A.; MARASAS, W. F. O. 1983. Fusarium species. An illustrated manual of identification. The Pennsylvania State University Press. University Park and London. United States of América. 193 p. [ Links ]
PITT, J. I.; HOCKING, A. D. 1997. Fungi and food spoilage. Second Blackie Academic & Professional. Great British University Press, Cambridge. 592 p. [ Links ]
PRADA, P; RODRÍGUEZ, A.; CARDONA, C. 1994. Evaluación de un sistema de manejo integrado de plagas de la habichuela en la provincia de Sumapaz (Cundinamarca). p. 67-77. En: Memorias Seminario sobre Manejo integrado de mosca blanca y técnicas de aplicación de pesticidas, Santa Fe de Bogotá, Cundinamarca, Mayo. Sociedad Colombiana de Entomología. [ Links ]
RIBA, G.; RAVELOJOANA, A. M. 1984. The parasexual cycle in the entomopathogenic fungus Paecifomi/ces fumosoroseus (Wize) Brown and Smith. Canadian Journal of Microbiology 30: 922- 926. [ Links ]
RODRÍGUEZ S., D. A. 1984a. Hongos entomopatógenos registrados en Colombia. Revista Colombiana de Entomología 10 (1-2): 57- 64. [ Links ]
RODRÍGUEZ S., D. A. 1984b. Preparación de medios de cultivo para el aislamiento de hongos entomopatógenos y cría de insectos. Memorias Seminario sobre Patología de insectos. Medellín. p. 94-105. Antioquia, Mayo. Sociedad Colombiana de Entomología. [ Links ]
RODRÍGUEZ S., D. A. 1997. Biología y manejo de chisas. Edición. Editorial Produmedios. Colombia. 31 p. [ Links ]
SAMSON, R. A.; HOEKSTRA, E. S.; FRISVAD, J. C; FILTENBORG, O. 1995. Introduction to food-borne fungi. Fourth Centraalbureau Voor Schimmelcultures Baarn Delft. Netherlands. 322 p. [ Links ]
SEIFERT, K. 2000. Fuskey: Fusarium Interactive Key. (World Wide Web Page: http://www.res.agr.ca/brd/fusarium/) Agriculture and Agri - Food. Canadá. Ottawa. [ Links ]
ZAR, J.H.1996. Biostatistical analysis. Third Prentice HallUnited States of América. 662 p. [ Links ]
Recibido: May. 15 / 2002 Aceptado: Ago. 09 / 2002