Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.30 no.1 Bogotá Jan./June 2004
Efecto de hongos entomopatógenos sobre la garrapata del ganado Boophilus microplus (Acari: Ixodida): uso de activadores de patogenicidad
Effect of entomopathogenic fungi on the cattle tick Boophilus microplus (Acari: Ixodida): use of pathogenicity activators
KARIM RAYMOMD C.1, FABIOLA ROJAS B.1, EFRAÍN BENAVIDES O.2, ALBA MARINA COTES 3, LAURA VILLAMIZAR3, VAMIA RONDEROS J.4 , PAOLA GARCÍA M.4
1 Estudiantes de Bacteriología (Tesistas). Universidad Colegio Mayor de Cundinamarca. Bogotá, D. C. E-mails: lisa70k@hotmail.com, fabbyross@hotmail.com
2 Autor para correspondencia: Médico Veterinario, M. Se., Ph. D. Investigador Principal. Programa de Salud Animal, Centro de Investigación en Salud Animal. Corporación Colombiana de Investigación Agropecuaria, CORPOICA. A. A. 59144. Bogotá, D. C., Colombia. Email: ebenavid@andinet.com
3 Respectivamente, Ph. D. Fitopatología. Investigadora Principal. E-mail: acotes@corpo¡ca.org.co; Química Farmacéutica, M. Se. Investigadora. E-mail: laurafernandav@yahoo.es. Laboratorio de Control Biológico CORPOICA, C. I. Tibaitatá.
4 Investigadores principiantes. Programa de Salud Animal, Centro de Investigación en Salud Animal. Corporación Colombiana de Investigación Agropecuaria, CORPOICA.
Resumen. En sistemas artrópodo-patógeno se ha demostrado la bondad del uso de activadores de patogenicidad para favorecer el crecimiento, esporulación y adherencia de hongos entomopatógenos sobre artrópodos. El objetivo del trabajo fue estudiar la actividad biocontroladora de dos aislamientos de Metarhizium anisopliae (Mt019 y Mt020) sobre la garrapata Boophilus microplus, examinado el uso de activadores de patogenicidad empleados durante la fase de cultivo del hongo. Se utilizó un diseño completamente al azar que evaluó tres tratamientos aplicados por aspersión: cultivo en agar tradicional (EM), medio más activador de patogenicidad inespecífico (S) y este mismo medio adicionado de un activador específico para la garrapata (SA). La unidad experimental fue un grupo de diez teleoginas (cinco réplicas) y la concentración del hongo fue constante a 108 conidios ml-1. El análisis de resultados se basó en los parámetros IEC (índice de Eficiencia de la Conversión) y ER (Eficacia Reproductiva), que indican la capacidad reproductiva de la garrapata y del PCIEC (Porcentaje de Control de IEC) y del PCONER (Porcentaje Control del ER), asociados con la eficacia del hongo. Se demostró efecto de los activadores de patogenicidad en los dos hongos evaluados; siendo el valor del IEC inferior (p<0,01) en los grupos con activador. En el caso de ER los valores en grupos con activador fueron inferiores, pero no significativos estadísticamente. El grado de control (PCIEC y PCONER) fue significativamente superior (p< 0,01) en los dos tratamientos con activador en ambos parámetros para los dos aislamientos de hongo. Se concluye que el uso de activadores de patogenicidad durante la fase de cultivo es un proceso que asegura un mejor efecto biocontrolador de los hongos sobre la garrapata.
Palabras clave: Metarhizium anisopliae. Control biológico. Virulencia. Oviposición.
Summary. In arthropod-pathogen systems, the valué of using pathogenicity activators to improve growth, sporulation capacity and adherence of entomopathogenic fungi to arthropods has been demonstrated. The objective of the work was to study the biocontrol activity of two isolates of Metarhizium anisopliae (Mt019 and Mt020) on the tick Boophilus microplus, by examining the use of pathogenicity activators used during the fungal culture phase. A completely randomized design was used, testing three treatments applied by aspersión: culture on traditional agar (EM), media plus unspecific pathogenicity activator (S) and the same media with a tick-specific activator (SA). The experimental unit was a group of ten engorged ticks (five replícales) and fungal concentratlon was constant at 108 conidia ml-1. Analysis of the results was based on the parameters IEC (Conversión Efficiency Index) and ER (Reproductive Efficacy), indicators of reproductive capacity of the tick and PCIEC (Percentage Control of IEC), and PCONER (Percentage Control ER), associated with fungal efficacy. There was an effect of pathogenicity activators on the two fungi evaluated; the IEC valué was lower (p< 0,01) ¡n groups with activator. In the case of ER, valúes were lower for groups with activator but not statistically significant. Control levéis (PCIEC and PCONER) were significantly higher (p< 0.01) in the two treatments with activator for both parameters in the two fungal isolates. It was concluded that the use of pathogenicity activators during the culture phase is a process that ensures a better biocontrol effect of fungi on ticks.
Key words: Metarhizium anisopliae. Biological control. Virulence. Oviposition.
Introducción
La garrapata común del ganado Boophilus microplus es el ectoparásito que provoca las pérdidas económicas mayores en el sector ganadero del mundo. Se distribuye en Centro y Sudamérica, Asia, Australia, el sur de Plorida, Tanganyika, Mozambique y Madagascar (Shaw 1966). Datos notificados por la FAO, en 1984 (Betancourt et al. 1992), indican que la infestación por garrapatas y los costos involucrados en su control, significan una pérdida mundial para la ganadería bovina de cerca de U.S. $7.3 cabeza/año. En las condiciones colombianas, se ha calculado que las pérdidas asociadas con las garra patas y moscas para la ganadería asciénden a 76.713 millones de pesos anuales (Benavides 2001). El daño se asocia de forma directa tanto con la capacidad hematófaga de estos artrópodos, como con la transmisión de agentes causantes de enfermedad; también existen pérdidas indirectas relacionadas con los costos del control.
El uso de acaricidas ha sido la principal estrategia para el control de garrapatas; sin embargo, éstas han desarrollado resistencia a todos los ingredientes activos existentes en el mercado, como arsenicales, clorados, organofosforados, diamidinas, piretroides sintéticos y lactonas macrocíclicas, impidiendo su control efectivo en el ámbito mundial (Benavides et al. 1999); por este motivo se ha fomentado un gran interés en la evaluación, desarrollo y uso de métodos alternativos de control parasitario, que minimicen la utilización de pesticidas. Dentro de las principales alternativas que se han propuesto se incluyen, el desarrollo de planes de aplicación estratégica o táctica del pesticida intentando disminuir la intensidad de aplicación de los acaricidas, la rotación de praderas, el empleo de animales resistentes a los parásitos y la aplicación de vacunas antigarrapatas. Se ha sugerido que estas alternativas sean integradas bajo Programas de Manejo Integrado de Plagas (MIP), los que investigan sobre la factibilidad del uso de diferentes métodos no químicos de control y están basados en estudios de dinámica poblacional (Walker et al. 1988). Dentro de estas alternativas para el control se destaca el uso posible de hongos entomopatógenos (Camacho et al. 1998).
Investigaciones con hongos entomopatógenos demuestran que las diferentes condiciones de cultivo tienen un efecto sobre la virulencia de los conidios (Lañe y Trinci 1991). Incorporar varios componentes cuticulares de insectos al medio de cultivo de los hongos entomopatógenos produce un aumento significativo de la virulencia de dichos microorganismos, incrementando la actividad biológica, efecto posiblemente debido a la activación de sistemas enzimáticos en los hongos, los cuales son determinantes en su actividad biocontroladora sobre el insecto (Bidocha y Khachatourians 1991).
Se encontró que adicionar activadores de patogenicidad al medio de cultivo de Metharizium spp., cuando éste entra en contacto con la cutícula del insecto, estimula la producción de enzimas extracelulares de actividad sinérgica que degradan los componentes cuticulares (Clarkson y Charnley 1996). Villamizar et al. (2001) demostraron que la incorporación al medio de cultivo de un homogeneizado de alas y patas de langosta y de salvado de trigo, incrementó significativamente la actividad biocontroladora de Metharizium anísopííae sobre Rhammatocerus schistocercoides (Orthoptera: Acrididae), además establecieron una correlación positiva entre la actividad de la enzima quimioelastasa proteasa PR1 y la virulencia de los conidios de M. anisopliae.
Para el desarrollo del presente trabajo se consideró como aspecto prioritario la búsqueda de alternativas que mejorasen el desempeño de los biocontroladores, teniendo en cuenta que en un trabajo previo, Hernández y Moreno (2001) seleccionaron las cepas de M.anisopliae, Mt019 y Mt020 por su mayor actividad biocontroladora contra Bo. microplus, pero también debido a los avances alcanzados en la definición de nuevos métodos de aplicación de los hongos (aspersión vs. inmersión). Por otra parte, trabajos realizados en el laboratorio de ectoparásitos del CEISA evaluaron cambios en las técnicas de incubación de las garrapatas adultas, luego de realizados las exposiciones al hongo, perfeccionando el manejo del bioensayo.
Por lo tanto, el objetivo del presente trabajo fue el evaluar el efecto de la adición de compuestos potencialmente activadores de patogenicidad al medio de cultivo del hongo, sobre la actividad biocontroladora de M. anisopUae contra la garrapata Bo. microplus, utilizando una prueba de evaluación in vitro.
Materiales y Métodos
El trabajo consistió en el desarrollo de una prueba ín uiíro donde el diseño experimental fue completamente al azar, con cinco réplicas por tratamiento, siendo la unidad experimental de diez individuos por caja de Petri. Además se emplearon dos controles: a) control tratado (individuos asperjados únicamente con Ttoeen 80 al 0,1%; y b) control absoluto (individuos no asperjados). Después del ensayo, las cepas de los hongos se mantuvieron a temperatura de 25°C (±2°), HR 80% (±10%) y un foto periodo de 24 h luz.
Hongos entomopatógenos
Cepas. Se evaluaron dos accesiones del hongo M. anosopliae codificadas como Mt019 y Mt020, que fueron suministradas por el Banco de Qermoplasma del Laboratorio de Control Biológico de CORPO1CA. El criterio para la elección de éstas fue la evidencia de mayor efectividad contra la garrapata Bo. microplus como se detectó en estudios previos sobre el tema (Hernández y Moreno 2001).
Proceso de reactivación de las cepas. Los hongos se reactivaron sobre 10 garrapatas adultas ingurgitadas, las que fueron infectadas mediante un proceso de inmersión en 20 mi de suspensión fúngica, manteniéndose a temperatura de 25°C durante 10 días. El hongo fue aislado a partir de algunos individuos que presentaron completa esporulación, mediante pasaje sobre el medio Saboureaud - Rosa de Bengala (S.R.B.), cuya composición por litro es de 2 g sacarosa, 6,4 g agar agar, 3 g neopeptona, 1,6 g gelatina, 0,15 g rosa de bengala.
Garrapatas
Cepas. Se trabajó con garrapatas adultas ingurgitadas (teleoginas) de la cepa denominada Palma de Vino II- 02, suministrada por el Banco de Germoplasma del Laboratorio de Ectoparásitos del Programa de Salud Animal de CORPOICA; esta cepa se considera resistente a compuestos organofosforados, piretroides sintéticos y endectocidas, y se aisló en el año 1999 en Valledupar, Cesar; desde entonces se ha mantenido como colonia de laboratorio mediante pasajes sobre terneros susceptibles.
Teleoginas. Las garrapatas adultas se obtuvieron a partir de infestación artificial de un bovino susceptible mantenido en una unidad de aislamiento ubicada en las instalaciones del Centro de Investigaciones en Salud Animal de CEISA (Ciudad Universitaria, Bogotá, D. C.). La recolección de individuos se realizó a partir del día 21 post infestación.
Desarrollo del bioensayo
Para la ejecución del bioensayo se emplearon 400 garrapatas adultas ingurgitadas de Bo. microplus: 200 para el bioensayo con la cepa Mt019 y 200 para el ensayo con la cepa Mt020. El hongo crecido en cada medio de cultivo se consideró como un tratamiento, al igual que ambos controles. Cada tratamiento estuvo compuesto por cinco réplicas.
El bioensayo se realizó en las instalaciones del Laboratorio de Control Biológico de CORPOICA - Tibaitatá (Mosquera, Cundinamarca), mientras los controles se trabajaron en el Laboratorio de Salud Animal en CORPOICA- CEISA, para minimizar la posibilidad de exposición al hongo. Se requirieron 50 especímenes por tratamiento, pesándose grupos de 10 individuos que se adhirierona cajas de Petri con ayuda de cinta doble faz. El inoculo se preparó a partir de las cepas de M. anisopliae, previamente reactivadas en el medio S.R.B.; después de diez días de crecimiento, se realizó un precultivo líquido en caldo Saboureaud que se mantuvo en agitación constante durante 48 h; luego de lo cual el cultivo líquido se utilizó para inocular dos bandejas que contenían una matriz sólida de producción; una de ellas fue suplementada con un activador de patogenicidad inespecífico (S), la otra fue adicionada de un activador específico (SA). La concentración del activador específico fue de 3,3 x 10-3g cm-2 y éste fue disperso sobre el activador inespecífico. También se realizó el cultivo del hongo sobre el medio tradicional extracto de malta (EM) en una tercera bandeja.
Después de diez días del crecimiento y esporulación del hongo sobre el medio de cultivo se realizó una suspensión fúngica a partir de cada uno de éstos, que contenía una concentración de 1 x 108 esporas ml-1; para verificar la concentración requerida se realizó un recuento de los conidios en la cámara de Neubauer. El hongo se aplicó a las garrapatas mediante la aspersión de 0,4 mli de la suspensión a cada unidad experimental por medio de atomizadores que dispensaban un tamaño de gota que varió entre 150 - 250 μm. Luego de este proceso, las cajas de Petri se ubicaron en recipientes plásticos que contenían toallas de papel absorbente humedecido y permanecieron recubiertas con fibra de polietileno, por un período de 14 días.
Se realizó un registro visual diario del inicio de la postura de las garrapatas y del día en que fue evidente la esporulación del hongo sobre las teleoginas. El día catorce después del inicio del ensayo se retiró la totalidad de la oviposición por unidad experimental para ser pesada en una balanza analítica y después ubicada en viales de vidrio con tapón de gasa, para permitir la ventilación de los huevos y observar su eclosión.
Parámetros evaluados
Con los datos obtenidos se calculó el índice de Eficiencia de la Conversión (IEC), un parámetro cuantitativo utilizado para determinar la conversión del peso de una hembra ingurgitada (Benavides et al. 1989). Este parámetro se calculó dividiendo el peso de los huevos producido por unidad experimental sobre el peso de las teleoginas, de acuerdo con la siguiente expresión (Drummond et al. 1971):
IEC = Peso de los huevos de la Unidad Experimental/ Peso de las hembras de la Unidad Experimental al inicio del ensayo
Posteriormente, se confinaron los viales en cámara húmeda por catorce días más, registrando el inicio de la eclosión de larvas a partir de los huevos. Entonces, se calculó el Porcentaje de Eclosión de larvas realizando un conteo de cascarones mediante la ayuda de un estereoscopio. Con estos datos se determinó la Eficiencia Reproductiva o ER; cuyo cálculo se realizó acorde con la fórmula (Drummond et al. 1971; Benavides et al. 1989):
ER = ({IEC x Porcentaje de Eclosión x 20.000}), donde 20.000 es una constante y equivale al número de larvas obtenidas de un gramo de huevos
La Eficiencia Reproductiva (ER) de cada grupo de garrapatas tratado se comparó con la ER de los grupos control. Este parámetro, el Porcentaje de Control del ER denominado PCONER, se determinó, tal como se describe abajo. Del mismo modo se calculó el PCIEC, el cual es el Porcentaje de Control del IEC:
PCOMER = {(ER Grupo control - ER del tratado) / ER Qrupo Control} x 100.
PCIEC = {(IEC Grupo control - IEC Grupo tratado) / IEC Qrupo Control) x 100
Análisis estadístico
Los datos crudos del ensayo se estructuraron en una hoja de cálculo en EXCEL, la que se utilizó para la determinación de los diversos parámetros. La información obtenida para cada parámetro se sometió a un análisis de estadística descriptiva para cada hongo y tratamiento, incluyendo el cálculo de promedio, varianzay desviación estándar; además de la estadística no paramétrica (medianay cuartiles). Los resultados se sometieron a un análisis de varianza de una vía (Bailey 1981), mediante el paquete estadístico Xlstat (http://www.xlstat.com/indexfr.html). En este programa, una vez establecido mediante una prueba de Fischer que el tratamiento afecta las variables, los promedios de cada grupo son comparados entre sí mediante una prueba de rangos múltiples de Bonferroni.
Resultados y Discusión
Producción de masa fúngica
Al cultivar los aislamientos en el medio con activador específico y con activador inespecífico, se evidenció que los conidios de la cepa Mt019 presentaron un color verde de una tonalidad más clara que los de la cepa Mt020, el crecimiento de ambos aislamientos fue abundante con presencia de un micelio firme, con alta esporulación. El crecimiento micelial para ambos aislamientos se observó a los cinco días y los conidios se evidenciaron a partir del día décimo. En cuanto al crecimiento sobre el medio Extracto de Malta, la aparición de micelio en las dos cepas ocurrió al sexto día y los conidios se apreciaron a partir del día doce.
Después de realizado el bioensayo, para las garrapatas que fueron asperjadas con la suspensión de la cepa Mt019, el hongo presentó un crecimiento parcial muy difuso con evidencia únicamente de conidios; las teleoginas mostraron un aspecto seco. En contraste con lo anterior, el crecimiento de la cepa Mt020 sobre las teleoginas fue abundante y presentó tanto micelio como conidios. El promedio de días de crecimiento del hongo después del bioensayo, fue de 6 presentándose con ambas cepas una inhibición de la oviposición a partir del día tres.
Efecto sobre los parámetros reproductivos de la garrapata
Al analizar el parámetro IEC de Mt019 (Tabla 1) se encontraron diferencias significativas entre tratamientos, formándose tres grupos estadísticos; en el primero, en el que se ubicaron los valores menores para la variable, estaban los tratamientos S, con un valor de IEC de 0,018, y SA, con un IEC de 0,047; en el segundo grupo estadístico, con un IEC de 0,141 estaba el tratamiento EM y por último se ubicaron los controles. La evaluación del parámetro IEC para la cepa Mt020 presentó diferencias estadísticas entre los tratamientos y controles; S y SA se agruparon estadísticamente con valores de 0,006 y 0,040 respectivamente; mientras que S y EM con un valor de 0,118 conformaron el segundo grupo; el tercer grupo lo constituyeron los controles, que para este bioensayo tuvieron los mismos valores tanto para el aislamiento Mt019 como para el Mt020 (C = 0,340, CA = 0,393) (Tabla 1).
Estos resultados demuestran el efecto benéfico del uso de los activadores de patogenicidad durante la fase de cultivo del hongo; tanto cuando se usó el activador específico, como con el inespecífico, el valor del IEC fue significativamente menor, a cuando se aplicó el hongo cultivado en medio sintético y éstos a su vez estadísticamente inferiores a los IEC de los controles. El valor menor del IEC indica que hubo una menor postura por parte de las garrapatas; es decir, que cuando se cultivó el hongo con los dos activadores, el efecto del microorganismo sobre la oviposición de las garrapatas fue mayor que cuando se aplicó el hongo cultivado en medio extracto de malta, sugiriendo un aumento de la actividad biocontroladora de los activadores tanto específico, como mespecífico sobre las dos cepas de M. anisopliae, sin observarse diferencias entre los niveles de control alcanzados para los dos potenciales inductores de virulencia. Este aumento de la virulencia del hongo cultivado en presencia de los activadores, podría atribuirse a una estimulación por parte de estos sustratos en alguno de los pasos determinantes en el mecanismo de acción del biocontrolador.
Los potenciales inductores de virulencia podrían haber producido un incremento en la capacidad de germinación de los conidios, aumentando la posibilidad de infección de la garrapata, tal como lo señalaron Villamizar et al. (2001), quienes observaron un aumento en la capacidad de germinación de los conidios de N. anisopliae cuando éste fue cultivado en presencia de algunos potenciales inductores de virulencia y dicho aumento en la germinación estuvo directamente relacionado con un aumento en la patogenicidad de los conidios. Por otro lado, los inductores pudieron aumentar la capacidad de producción de enzimas como la proteasa PR1 y las quitinasas que facilitan el proceso de penetración por parte del microorganismo y cuya actividad puede ser mejorada cuando se adicionan determinados sustratos al medio de cultivo, como lo indicaron Villamizar y Cotes (2001), quienes hallaron un aumento en la virulencia de M. anisoplie contra la langosta llanera, cuando se adicionó al medio de cultivo un homogeneizado de alas y patas de langosta o salvado de trigo. Para la bacteria Serratia sp. también se encontró una aumento en la actividad enzimática y biocontroladora contra la polilla guatemalteca de la papa Teda solaniuora, cuando la bacteria se cultivó en presencia de un homogeneizado de larvas de la polilla y de salvado de trigo (Bosa et al. 2001).
Resultados similares a los obtenidos en el presente trabajo, fueron publicados por Bidocha y Khachatourians (1991) quienes determinaron que sustancias encontradas en la cutícula de M. sanguinipes principalmente proteínas ricas en alanina, prolina y amionoácidos hidrofóbicos, incrementaron la germinación conidial en el hongo Beauueria bassiana y la subsecuente penetración hifal, aumentando la actividad biocontroladora.
Para el parámetro ER, en el cual se determina no sólo la capacidad de postura de la garrapata, sino la eclosionabilidad de los huevos (Tabla 2), los tratamientos S y SA no presentaron diferencias estadísticas entre sí, sugiriendo nuevamente que los dos activadores empleados en este estudio, tienen el mismo efecto inductor de patogenicidad sobre M. anisopliae. El tratamiento EM no presentó diferencias estadísticas con los tratamientos S, SA y los control, con asociaciones estadísticas independientes hacia ambos extremos. Sin embargo, los resultados numéricos indican que los conidios provenientes del cultivo en medio extracto de malta son menos virulentos que los cultivados en los medios con activador. Los valores para el ER de la cepa Mt019 producida en los diversos tratamientos fueron superiores a los obtenidos con la cepa Mt020, lo que sugiere que el aislamiento Mt020 es más virulento que el Mt019.
Efecto biocontrolador
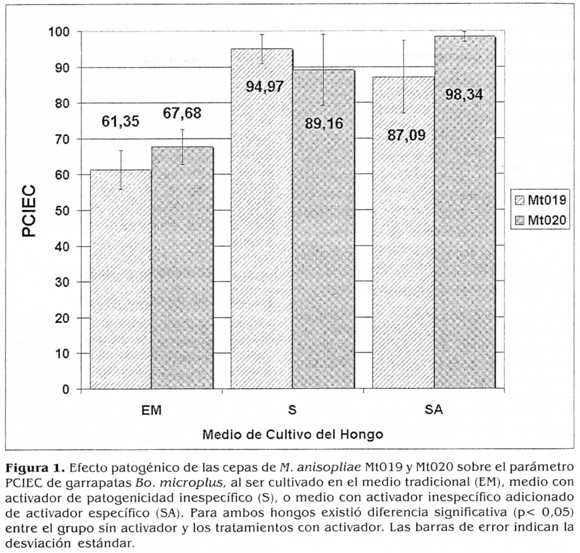
El efecto biocontrolador definitivo de cada hongo y cada tratamiento se examinó mediante los parámetros PCIEC y PCONER. Para su cálculo se utilizó el valor de IEC y ER obtenido en cada réplica, el cual fue cotejado contra el valor promedio de estos parámetros obtenido en todos los controles. Para el PCIEC en Mt019 (Fig. 1), el nivel de control en el tratamiento sin activador (EM) fue de 61,35%; la adición de los activadores de patogenicidad incrementó significativamente (P< 0,05, prueba de Bonferroni) el grado de control hasta 87,09% para medio SA y hasta 94,97% en el medio S; no encontrándose diferencias entre los dos últimos. Similar situación se observó con el hongo Mt020, los valores de PCIEC fueron: SA= 98,34%y S= 89,16%; valores significativamente superiores del obtenido con el hongo cultivado en EM siendo de 67,68%. Estos resultados confirman nuevamente que para las dos cepas utilizadas en el estudio, los activadores sí tuvieron un efecto inductor de la virulencia contra la garrapata Bo. microplus, siendo factible su utilización en medios de producción masiva para producción industrial, que permitan obtener biomasa de alta calidad para el desarrollo de bioplaguicidas.
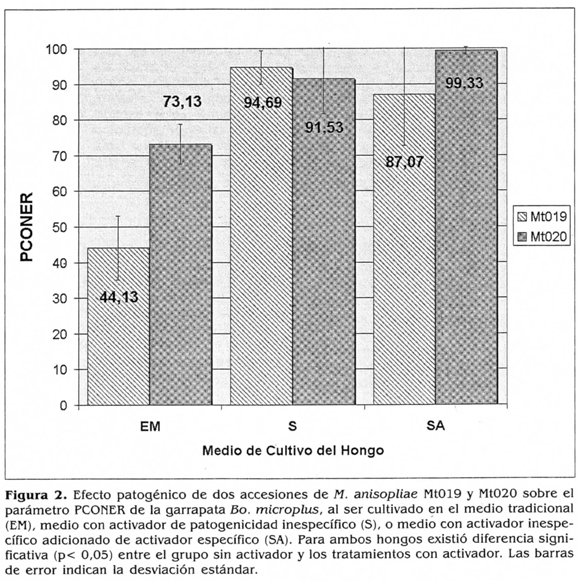
La figura 2 presenta los valores de PCONER alcanzados para ambos hongos con y sin activadores. En el caso del hongo Mt019 con el activador ¡nespecífico (S) el PCONER fue del 94,68%, este valor no fue diferente estadísticamente del índice obtenido con el activador específico (SA= 87,06%). Estos tratamientos presentaron diferencias (p< 0,05) respecto al PCONER del hongo crecido en EM (44,13%). En cuanto a la accesión Mt020, ésta presentó mejor efecto entomopatógeno con relación a la cepa Mt019, cuando ambas se cultivaron sin activador (EM= 73,13%), pero la adición de los activadores de patogenicidad al medio incrementó significativamente el efecto biocontrolador (SA= 99,32%; S= 91,52%), no siendo estos últimos valores significativamente distintos entre sí.
Si se tiene en cuenta que el parámetro PCONER combina el efecto del biocontrolador sobre la postura de la garrapata (IEC) y sobre la capacidad de la eclosión de los huevos, cotejando los valores obtenidos contra los controles; los resultados obtenidos en el presente trabajo sugieren que los activadores, además de tener un efecto significativo sobre la actividad biocontroladora de los conidios de M. anisopliae, pudieron haber potencializado los efectos subletales del hongo entomopatógeno, de la misma manera como lo describieron Hernández y Moreno (2001), quienes observaron disminución en la oviposición y eclosión de huevos de la garrapata Bo., microplus cuando fue tratada con conidios de W. anisopliae. Be, bassiana y Verticiüium lecanii. Este efecto también fue descrito para el trip de la flor de las leguminosas, Megalurothrips sjostedti, cuando al inocular larvas del insecto con conidios de M. anisopliae, en los adultos sobrevivientes se observó una disminución en las fecundidad, porcentaje de eclosión de huevos y longevidad (Ekesi y Maníanla 2000).
Conclusiones
• Utilizando un modelo in vitro de evaluación, aplicando por aspersión el hongo entomopatógeno Metarhizium anisopliae sobre la garrapata del ganado Boophilus microplus, el aislamiento denominado Mt020 presentó un mayor efecto biocontrolador; tanto en el parámetro PCIEC (Porcentaje de Control del índice de Eficiencia de la Conversión) como en el PCONER (Porcentaje de Control de la Eficiencia Reproductiva), en comparación con el aislamiento Mt019.
•El presente trabajo permitió concluir que la utilización de activadores de patogenicidad en el medio de cultivo, tanto inespecíficos como específicos, aumenta notablemente la actividad biocontroladora de Metarhizium anisopliae sobre la garrapata Boophilus microplus.
Agradecimientos
Los autores expresan sus sentimientos de gratitud hacia un sin número de personas que de una u otra manera colaboraron en el éxito de este trabajo, particularmente al auxiliar Aldemar Zúñiga por el manejo de animales experimentales en CEISA y a todos los profesionales y estudiantes del Laboratorio de Control Biológico del programa MIP en Tibaitatá. Este estudio fue financiado con recursos del convenio CORPOICA - Ministerio de Agricultura, recursos de inversión 2001.
Literatura citada
BAJLEY, N. T. J. 1981. Statistical methods in biology. Second Edition. Hodder y Stoughton Ltd. 216 p. [ Links ]
BENAVIDES O., E. 2001. Control de las pérdidas ocasionadas por los parásitos del ganado. Carta Fedegan N° 69, julio - agosto, (Anexo coleccionable "Manejo Integrado de Plagas y Enfermedades en explotaciones ganaderas 6"), p. 52-63. [ Links ]
BENAVIDES O., E.; ROMERO N., A.; RODRÍGUEZ B., J. 1999. Situación actual de resistencia de la garrapata Boophilus microplus a acaricidas (Primera entrega). Carta FEDEGAN 59: 17-22. [ Links ]
BENAVIDES O., E.; GONZÁLEZ, L. R.; MARTÍNEZ, R. H.; PARRA, G. D.; VILLAR, C. C. 1989. Espectro de sensibilidad a acaricidas de una colonia de la garrapata Boophilus microplus establecida en el piedemonte Llanero. Revista ICA 24 (1): 24-31. [ Links ]
BETANCOURT, J. A.; GARCÍA, O.; ROQUEME, L.; NAVARRETE, M. 1992. Distribución y niveles de infestación por garrapatas en bovinos de Córdoba, Noroeste de Sucrey Noroeste de Antioquia. Colombia. Revista ICA 27 (1): 63-76. [ Links ]
BIDOCHA, M.; KHACHATOURIANS, G. 1991. Growth of the entomopathogenic fungus Beauveria bassiana on cuticular components from the migratory grasshopper, Melanoplus sanguinipes. Journal of Invertebrate Pathology 5: 165-173. [ Links ]
BOSA, C. F.; COTES, A. M.; LUQUE, J. E. 2001. Efecto de la composición del medio de cultivo, los pases sucesivos y la actividad enzimática de Serratia sp., sobre su actividad biocontroladora hacia Teda solinovora Fovolny. Resúmenes. XXVIII Congreso Sociedad Colombiana de Entomología, p. 44-45. Pereira. [ Links ]
CAMACHO, E.; MAVARRO, G.; RODRÍGUEZ, R.; MURILLO, E. 1998. Efectividad del Verticillium lecanii sobre la fase parasítica de la garrapata Boophilus microplus. (Acari: Metastigmata: Ixodidae). Revista Colombiana de Entomología 24 (1-2): 67-68. [ Links ]
CLARKSON, J.; CHARNLEY, A. K. 1996. New insights into the mechanisms of fungal pathogenesis in insects. Trends in Microbiology 4 (5): 197-202. [ Links ]
DRUMMOMD, R. O.; GLANDEY, W.; WHETSTONE, T.; ERNEST, S. 1971. Laboratory testing of insecticides for control of the winter tick. Journal of Economic Entomology 64: 686-688. [ Links ]
EKENSI, S.; MANIANIA, N., K. 2000. Susceptibility OfMegalwothips sjostedti developmental stages to Metarhizium anisopliae and the effects of infection on feeding, adult fecundity, egg fertility and longevity. Entomología Experimentalis et Applicata 94: 229-236. [ Links ]
HERNÁNDEZ, F.; MORENO, R. 2001. Evaluación de la actividad biocontroladora de hongos entomopatógenos sobre dos cepas de la garrapata Boophilus microplus. Trabajo de grado para optar al titulo de Médico Veterinario. Universidad de La Salle. Facultad de Medicina Veterinaria. Bogotá, Colombia. 156 p. [ Links ]
LAME, B.; TRINCI, A. 1991. Influence of cultural conditions on the virulence of conidia and blastospores of Beauveria bassiana to the green leafhopper, Hephotettix virescens. Mycological Research 95 (7): 829-833. [ Links ]
SHAW, R. D. 1966. Culture of an organophosphorus-resistant strain of Boophilus microplus and an assessment of its resistance spectrum. Bulletin of Entomological Research 56 (4): 389-405. [ Links ]
VILLAMIZAR, L.; COTES, A.; URIBE, D. 2001. Relación entre la actividad enzimática y la virulencia de Metarhizium anisopliae sobre la langosta llanera (Orthoptera: Acrididae). Revista Colombiana de Entomología 27 (3-4): 107-114. [ Links ]
VILLAMIZAR, L.; COTES A. 2001. Efecto de las condiciones de cultivo sobre factores determinantes en el mecanismo de acción de Metarhizium anisopliae. Resúmenes. XXVIII Congreso Sociedad Colombiana de Entomología, p. 44. Pereira. [ Links ]
WALKER, A. R.; BENAVIDES O., E.; BETANCOURT E., A. 1988. Manejo integrado de plagas para el control de garrapatas. Carta Ganadera 25 (8): 52-57. [ Links ]
Recibido: Abr. 22 / 2003 • Aceptado: Jul. 30/ 2003