Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.30 no.1 Bogotá Jan./June 2004
Hongos asociados con termitas y termiteros en plantaciones de eucalipto
Fungí assocíated with termites and their nests in eucalyptus plantations
ANA ISABEL GUTIÉRREZ G.1, YAMILLÉ SALDARRIAGA O.2 SANDRA URIBE S.3, FABIO PINEDA G.4
1 Bióloga. Investigador asociado al Grupo de Micología. Instituto de Biología, Facultad de Ciencias Exactas y Naturales. Corporación de Patologías Tropicales. Universidad de Antioquia. E-mail: anisa@matematicas.udea.edu.co
2 Autor para correspondencia: Licenciada en Biología y Química. M. Se. Profesor de Micología. Instituto de Biología, Facultad de Ciencias Exactas y Naturales. Corporación de Patologías Tropicales. Universidad de Antioquia. A. A. 1226, Medellín, Colombia. Fax: 2330120. E-mail: ysaldar@matematicas.udea.edu.co
3 Ingeniera Agrónoma. M.Sc. Ph. D. Profesora posgrado de Entomología. Facultad de Ciencias. Universidad Nacional de Colombia. Sede Medellín. E-mail: Suribe@perseus.unal.med.edu.co
4 Licenciado en Biología y Química. M, Se. Profesor de Micología. Instituto de Biología, Facultad de Ciencias Exactas y Naturales. Corporación de Patologías Tropicales. Universidad de Antioquia. E-mail: fpgutier@matematicas.udea.edu.co
Resumen. La región de San Sebastián de Buenavista, Magdalena (Colombia), se caracteriza por ser una de las más importantes en la producción de madera derivada de cultivos de eucalipto. Actualmente se han registrado pérdidas económicas grandes en las empresas madereras que operan en San Sebastián por el daño causado por termitas. Estas pérdidas alcanzan aproximadamente el 83,6% de la producción en el área de estudio. Las medidas de control realizadas son pocas empleándose fundamentalmente insecticidas químicos. En la región no se han realizado estudios de reconocimiento de las termitas que atacan los eucaliptos ni de los microorganismos asociados a ellas. Estos estudios son importantes ya que algunos microorganismos entomopatógenos pueden estar regulando las poblaciones de termitas en condiciones naturales, o tener utilidad potencial como agentes de control microbiológico. En este trabajo se registran los géneros de termitas presentes en la reforestadora y los hongos asociados a los termiteros y sustratos cercanos. Las termitas encontradas corresponden a los géneros Microcerotermes, Amitermes y Coptotermes, En total se obtuvieron 252 aislamientos de hongos correspondientes a 31 géneros y 29 especies. Los aislamientos füngicos se agruparon en categorías de acuerdo con su origen. Se resaltan aquellos reconocidos como entomopatógenos o registrados previamente en asocio con termitas. Entre los hongos más importantes se encuentran: Aspergillus spp. (33,3%), Fusarium spp. (21%), Penicillium spp. (7,9%), TYichoderma spp. (6,8%), Paecilomyces spp. (4,8%) y Entomophthora spp. (2,4%).
Palabras clave: Hongos entomopatógenos. Paecilomyces lilacinus. Control microbiológico. Termitas.
Summary. The región of San Sebastián of Buenavista, Magdalena (Colombia), is characterized for being one of the most important producers of lumber derived from eucalyptus plantations. At present, large economic losses have been registered for lumber companies operating in San Sebastián due to the damage caused by termites. These losses reach approximately 83,6% of the production in the study. The control measures carried out are few, mainly using Chemical insecticides. In this región, studies have not been conducted on recognizing the termites that attack eucalyptus nor on the microorganisms associated with them. These studies are important because some microorganisms may be regulating termite populations under natural conditions, or have potential as microbiological control agents. In this paper we report the genera of termites present in eucalyptus and the fungi associated with their nests and nearby substratos. The termites found belong to the genera Microcerotermes, Amitermes and Coptotermes. A total of 252 fungal isolates corresponding to 31 genera and 29 species were obtained. The fungal isolates were grouped into categories according to their origin. We identify those isolates recognized as entomopathogenics or previously reported in association with termites. Among the most important fungí were Aspergillus spp. (33,3%), fltsarium spp. (21%), Penicillium spp. (7,9%), Trichoderma spp. (6,8%), Paecilomyces spp. (4,8%) and Entomophthora spp. (2,4%).
Key words: Entomopathogenic fungus. Paecilomyces lilacinus. Microbiological control. Termites.
Introducción
Las termitas son insectos sociales con un sistema de castas que incluye obreros, soldados y alados. Las formas aladas se constituyen en reyes y reinas; estas últimas pueden colocar de 2.000 a 3.000 huevos por día, lo cual indica su capacidad reproductiva alta (Watson y Qay 1991).
Estos insectos son altamente perjudiciales para la industria forestal, agrícola, textil y maderera; afectan gravemente la economía y la ecología de un país (Qarcés1997). Las termitas se alimentan de estructuras maderables, árboles deciduos, plantas leñosas, cartón y papel. El daño que ocasionan se debe principalmente a que su dieta alimenticia se basa en lignina y celulosa (Hoyos 1974; Pérez-Arbélaez 1994). Estos insectos poseen una comu nidad microbiana en el tracto intestinal que ayuda a digerir los componentes duros de la madera liberando la celulosa que las nutre (Qrady 1997). Eucalyptus sp. (Myrtaceae: Leptospermoideae) es una es pecie ampliamente distribuida en la zona intertropical que posee múltiples aplicaciones tanto en arboricultura forestal como en la obtención de sustancias antimicrobianas y en la industria maderera. Así mismo, en la producción de papel y en la desecación de terrenos (Hoyos 1974; Lamprecht 1990; Pérez-Arbelaez 1994). Las plantaciones de Eucalyptus colombianas se han visto afectadas significativamente por termitas tanto en los semilleros como en plantaciones adultas (Qarcés 1997). En la reforestadora San Sebastián no se han calculado con precisión los daños económicos. No obstante, se calculan porcentajes por encima del 50% para algunas parcelas. El daño más significativo se ha presentado en Eucalyptus tereticornis, especie que ocupa un área de 1.360 hectáreas en la plantación total del área donde se realizó el estudio (1.700 hectáreas, datos sin publicar).
Entre las familias de termitas que afectan eucaliptos se encuentra Rhinotermitidae, que construye los nidos alrededor de la madera y sobre la superficie de los árboles a través de un sistema de galerías y la Termitidae, que construye sus nidos como montículos sobre el suelo y en los árboles (Qrace 1989). Por lo tanto, estos sustratos han sido considerados fuente ideal para la búsqueda y el aislamiento de microorganismos asociados a termitas con potencial como agentes de control microbial. El control de las termitas ha sido realizado de forma general mediante compuestos preservantes de madera como creosotas, químicos como chlordano, metil bromuro, malatión, deltametrina, preparaciones comerciales de diclorodifeniltricloetano (DDT) y hexacloruro de benceno (Yoshioba et al. 1991; Valerio et ai. 1998). Dichos compuestos además de ser tóxicos persisten en la naturaleza por periodos de tiempo prolongados. También se han utilizado métodos alternativos como el control biológico. Éste incluye el uso de depredadores y patógenos. Entre los patógenos se encuentran principalmente virus, bacterias, nemátodos y hongos (Coppel y Liang 1987; Madrigal 1989; Hassan 1990; Logan et al. 1990; Zoberi y Qrace 1990; Milner 1992; Alves eí al. 1995; Zoberi 1995; Milner eí al. 1998a y b). Los hongos que atacan las termitas en condiciones naturales y otros a los cuales pueden ser susceptibles se consideran una alternativa importante para el control biológico de las mismas. En estudios in vitro se ha demostrado que hongos como Aspergillus flavos, Entomophthora sp. (Espero 1984), Beauveria bassiana (Zoberi y Grace 1990) y Paecilomyces fumosoroseus (Chai 1995) poseen niveles importantes de patogenicidad para termitas. Además, se ha registrado el hongo Metarhizium anisopliae atacando, en condiciones naturales, termitas como Reticulitermes flavipes (Zoberi 1995) y Coptotermes formosanus (Sajap y Kaur 1990). Para el caso particular de termitas, la selección de hongos promisorios como agentes de control biológico debe incluir no sólo características propias del hongo como su capacidad de adaptación y sobrevivencia (en el suelo, en el termitero o en un cebo que lo contenga), sino también, aspectos de la biología de las termitas. Entre los más importantes están la limpieza que se hacen los individuos cuando son infectados con hongos, la remoción y entierro de los cadáveres y la presencia de secreciones de defensa producidas por las termitas (Sajap y Kaur 1990; Delate et al. 1995; Zoberi 1995; Madrigal 1999, Fernández 2001). Adicionalmente, los criterios básicos derivados de pruebas in vitro como porcentaje de mortalidad, DL50, TL50 y mortalidad intrínseca son de gran importancia. En Colombia existen pocos estudios sobre el reconocimiento de hongos entomopatógenos asociados a termitas y en particular a termitas que atacan el eucalipto. En este trabajo se realizó el reconocimiento de termitas de la reforestadora y de hongos asociados a ellas. Este puede considerarse como punto de partida para la selección e implementación del uso de hongos con potencial como agentes de control microbiológico de termitas que puedan incluirse en programas de manejo integrado en las áreas afectadas.
Materiales y Métodos
Origen de los aislamientos
La zona de muestreo está localizada en la municipalidad de San Sebastián de Buenavista (departamento de Magdalena), con una extensión de 7.000 hectáreas. Esta región comprende tres fincas: Los Álamos, El Enredo y Santa María. San Sebastián se encuentra ubicada en la zona de vida bosque seco Tropical (bs-T) caracterizada por tener una temperatura promedio de 28,8°C, una precipitación media anual de 1.787 mm y una altitud de 25 msnm (Borreros 1996; Espinal 1990). El trabajo se realizó en la finca los Alamos, que tiene una extensión de 1.700 hectáreas, con plantaciones de Eucalyptus tereticornis (80%), E. camaldulensis y E. urophylla (20%).
Colección de termitas
Se localizaron las áreas de la Tinca con mayor incidencia de daño registrado por termitas de acuerdo con la reforestadora y se escogieron al azar siete parcelas de 40 x 40 m muestreándose en promedio 20 árboles por parcela. Las termitas se colectaron de la superficie y cavidades internas de los árboles (tanto jóvenes como adultos) y de troncos atacados que se encontraban en el suelo. La recolección se realizó usando pinceles y pedazos delgados de madera. Las termitas se colectaron con su respectivo sustrato: fragmentos de termitero, hojas y suelo. Posteriormente, se depositaron en recipientes plásticos de 16 x 12 cm de diámetro tapados con muselina y sellados con plástico transparente, envuelto en bolsas oscuras dándoles condiciones apropiadas para el transporte al laboratorio. También se colectaron termiteros completos. Las termitas se mantuvieron en recipientes plásticos dentro de una cámara climatizada (WTBbinder 78532, Tuttlingen / Germany) con temperatura controlada (26±0,5°C), humedad relativa (80±5% HR) y en oscuridad o en el invernadero del Instituto de Biología de la Universidad de Antioquia (HR 60%, 24,4°C).
Las termitas colectadas fueron identificadas en la Universidad Nacional de Colombia, sede Medellín, en el laboratorio de Entomología por Jhon Albeiro Quiróz G. y Ana Isabel Gutiérrez G. del Grupo de Micología, Instituto de Biología de la Universidad de Antioquia. La identificación se llevó a cabo con las claves taxonómicas de Constantino (1999), Bach (1997), Nickle y Collins (1988, 1992), Watson y Qay (1991), Nutting (1990) y Weesner (1987).
Aislamiento de hongos
Los hongos se aislaron de termitas muertas (Tm), termitas vivas (TV) colocadas vivas directamente sobre un medio para el crecimiento de hongos, fragmentos de termitero (Ft), madera (M), hojas de eucalipto (He), suelo (S), y troncos secos de eucalipto (Tse). Las muestras se colocaron en cajas de Petri estériles, utilizando papel filtro Watman No. 1 húmedo o con una mota de algodón humedecida con agua destilada estéril para observar el desarrollo de los hongos en estos sustratos. Las cajas se incubaron a temperatura ambiente (22-26°C). Todos los sustratos fueron transferidos, por triplicado, a cajas de Petri con los medios de cultivo Malta Extracto Agar (MEA), Sabouraud Dextrosa Agar (SDA) y Papa Dextrosa Agar (PDA) (Oxoid LTD., Basingstoke, Hampshire, England).
De los hongos obtenidos se hicieron aislamientos puros a partir de cultivos monospóricos siguiendo la técnica descrita por Calle (2000). Se realizaron micro-cultivos de los hongos purificados y se estudiaron las características tanto macroscópicas como microscópicas de los hongos. Se identificaron las especies de los hongos según criterios morfológicosy de cultivo, siguiendo las claves de: Barnett (1967), Nelson et al. (1983), Samson et al. (1984), Vélez (1989), Pardo (1990), Goettel e Inglis (1997), Humber (1997), Papierok y Hajek (1997). Los hongos aislados se conservan en el Laboratorio de Micología, Instituto de Biología de la Universidad de Antioquia.
Resultados y Discusión
En total se obtuvieron 252 aislamientos de hongos, los cuales corresponden a 31 géneros y 29 especies. Las termitas sobre las cuales se realizaron los aislamientos fueron identificadas como Microcerotermes silvestri, Amitermes silvestri (Termitidae) y Coptotermes Wasmann (Rhinotermitidae).
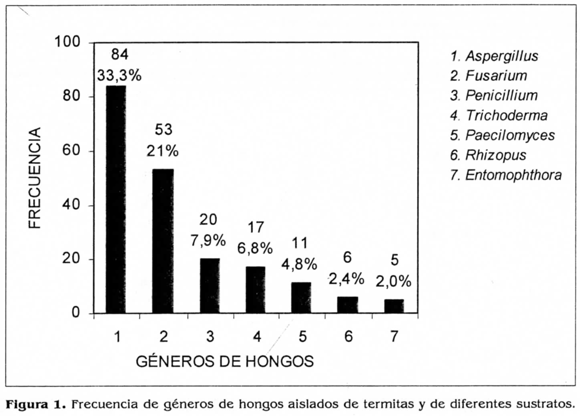
En la figura 1 se indica la frecuencia de los principales aislamientos fúngicos encontrados, la cual se calculó como: número de aislamientos del hongo en las termitas y diferentes sustratos / número total de hongos x 100. De acuerdo con esta figura, los hongos encontrados con mayor frecuencia fueron: Aspergillits (Aspergillus fumigatus, A. niger, A. ochraceus), Fltsarium (F. oxysporum, F. sporotrichiodes) y Penicillium. (Penicillium sp. y P. verrucosum). Aunque menos frecuentes Trichoderma spp. y Paecilomyces lilacinus merecen especial consideración como agentes de control biológico. Así mismo, Entomophthora spp. por su reconocido efecto como entomopatógeno.
En las tablas 1 y 2 aparecen discriminados los géneros y especies de hongos de acuerdo con su fuente de aislamiento; es decir, de las termitas o directamente de los sustratos como suelo, madera, troncos de eucalipto y fragmentos de termitero. Así mismo, se menciona el medio de cultivo utilizado con éxito para el mejor aislamiento, crecimiento e identificación de los hongos en el laboratorio. Géneros como Fusarium, Aspergiilus, Entomophthora, Penicillium y Paecilomyces fueron aislados tanto de termitas como de los termiteros y uno o más sustratos. Esto da cuenta de su asocio a las termitas y a los sustratos cercanos a ellas en las condiciones propias del área de estudio. Dichos hongos aparecen como de especial interés y potenciales candidatos para posteriores pruebas de patogenicidad en el laboratorio y campo.
De acuerdo con el presente estudio y estudios de patogenicidad previos realizados por otros autores, es probable que estos hongos estén regulando las poblaciones de termitas en condiciones naturales en las plantaciones de eucalipto en la reforestadora San Sebastián. Tanto Entomophthora, como Aspergillus, Fusarium y Paecilomyces habían sido encontrados previamente en condiciones naturales o de laboratorio asociados a termitas (Espero 1984; Khan et al. 1990a; Khan et al. 1991; Khan et al. 1994; Chai 1995). in vitro se ha encontrado que termitas expuestas a superficies tratadas con dosis de Entomophthora tan bajas como 1,4 x 103 esp/ml presentaron porcentajes de mortalidad del 95% en 2,5 días (Espero 1984). Las termitas infectadas perdieron locomoción y su cuerpo se tornó amarillento. Después de la muerte el cuerpo del insecto se oscureció y fue cubierto de micelioy esporas consideradas como nueva fuente de inoculo. Entomophthora es un controlador importante en ambientes naturales bajo condiciones cálidas y húmedas. No obstante, su uso como insecticida biológico se dificulta por sus niveles infectivos bajos en condiciones moderadas de humedad y por su producción masiva compleja (Douglas et al. 2001).
En cuanto al género Fusarium, F. avenaceum había sido registrado previamente como patógeno de la termita subterránea Coptotermes formosanus en condiciones de laboratorio (Chai 1995). Aunque este es un hongo entomopatógeno facultativo generalista, dada la obtención de varios aislamientos nativos de la zona de San Sebastián en el presente estudio, valdría la pena realizar pruebas de patogenicidad para evaluar la infectividad en laboratorio y campo. A pesar de que este hongo presenta limitaciones para aplicaciones inundativas por la producción de toxinas y la patogenicidad de algunas especies para plantas y animales, se ha recomendado para aplicaciones localizadas como lo que sería el uso de cebos en el control de termitas.
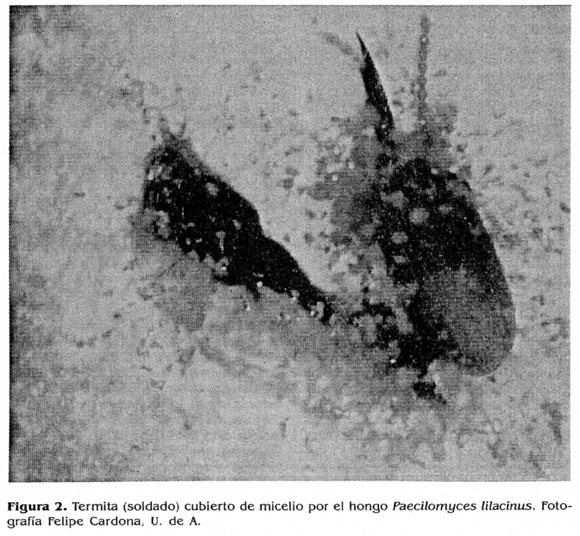
El hongo Paecilomyces es ampliamente reconocido como hongo entomopatógeno por causar la enfermedad llamada muscardina amarilla. Entre las especies entomopatógenas han sido descritas P. farinosus, P. fumosoroseus, P.jauanicus, P. ramosus, P. cinnamomeus y P. lilacinus (Tañada y Kaya 1993). Esta última se ha registrado de forma natural infectando termitas (Khan et al. 1990a, Khan et al. 1991). En el presente estudio P. lilacinus se encontró en una frecuencia alta (Fig. 2).
Goettel e Inglis (1997) señalan que esta especie parece ser más frecuente en regiones cálidas como la región en la cual se encuentran los eucaliptos afectados por termitas. Adicionalmente, es típicamente aislada de suelos, lo cual la convierte en un candidato potencial como biocontrolador en el área de San Sebastián de Buenavista (Magdalena) en especial para las termitas subterráneas como Coptoíermes encontradas en el presente estudio.
El efecto patogénico de otras especies de Paecilomyces como P. caterniarmulatus, P. farinosus y P.variotu ha sido probado en condiciones de laboratorio sobre termitas utilizando como inoculo suspensiones acuosas de 6 x 107 esp/ml aplicadas a una termita cebo. P. fumosoroseus fue el más efectivo mostrando una infectividad del 86,7% (Chai 1995).
El hongo más abundante en el presente estudio fue Aspergillus. Muchas de las especies de este hongo son saprofíticas, lo cual probablemente explica el porcentaje alto y frecuencia de su hallazgo (Fig. 1). No obstante, en condiciones naturales Aspergillus ha sido encontrado infectando un amplio rango de insectos (lanada y Kaya 1993; Ulloa y Herrera 1994). En el presente estudio, tanto en el laboratorio como en el invernadero donde se establecieron algunas colonias, se registraron altos porcentajes de mortalidad de termitas causados por Aspergillus. El efecto patogénico sobre las termitas fue verificado in vitro. Previamente, algunos autores registraron A. ochraceus causando mortalidades altas para termitas en condiciones de laboratorio. En pruebas in vitro se obtuvieron mortalidades del 70% sobre termitas cuando éstas se trataron por aspersión con concentraciones de 1,4 x 103 esp/ml. A. niger causó también altas mortalidades sobre termitas Microtermes unicolor, Microcerotermes champíoni y Heterotermes indicóla cuando fueron puestas a caminar sobre cultivos del hongo durante diferentes tiempos. Observándose porcentajes de mortalidad del 100% a los 10, 20 minutos después de la exposición (Khan et al. 1994).
El hongo Cunninghamella, encontrado en el presente estudio en sustratos relacionados con las termitas, fue previamente registrado en nidos de termitas Reticulitermes flavipes (Ramakrishnan et al. 1999). Este hongo ha sido también reconocido como entomopatógeno de huevos y larvas de Díptera en condiciones de laboratorio y huevos de reptiles en condiciones naturales (Vallejo et al. 1996).
En cuanto a las especies del género Peniciüium se encontraron Penicillium sp., el de mayor frecuencia, seguido por P. uerrucosum y P. chrysogenum, P. paraherquei y P. expansum. Penicillium es quizá el hongo más ubicuo de todos, con gran cantidad de especies (Samson et al. 1984; Ulloa y Herrera 1994). En condiciones de campo se ha evaluado la diseminación del hongo Penicillium verrucosum en termiteros de Anacanthotermes ahngerianus encontrándose persistencia del mismo en las condiciones ambientales evaluadas (lanada y Kaya 1993; Samson et al. 1984 L[j]utikova 1990). Esto sugiere el potencial de algunos de los aislamientos del presente estudio para evaluaciones posteriores. Del hongo Verticillium, conocido como entomopatógeno para algunas especies de insectos, se encontró un sólo aislamiento que corresponde al 1,39% del total de hongos aislados.
Entre los hongos ambientales y saprofíticos aislados se encontraron Mucor (M. circinelloides, M. racemosus, M. hiemalis y M. plumbeus), Syncephallastrum y Zygorrhynchus. Del género Khizopus se hallaron especies como Khizopus stolonifer y Rhizpus arrhizus. Además, Absidia corymbifera, Pythium, AUomyces Javanicus, Acrostalagmus,Acremonium, Byssochlamys, EMscosia, fritirachium, Chalaropsis, Plasmodiophora, Euroiium, Pestalotia, Rhizoctonia y Cladosporium. Estos hongos son saprofitos y viven en el suelo o en lugares húmedos (Samson et al. 1984; Ulloa y Herrera 1994).
En conclusión, de las especies de hongos aislados se encontraron ocho entomopatógenos, los cuales se han señalado previamente para termitas (Espero 1984; Khan et al. 1990a; L[j]utikova 1990; Khan et al. 1991, 1994; Chai 1995; Ramakrishnan et al. 1999). Entre los hongos más promisorios como agentes de control microbiológico para termitas en la reforestadora está Paecilomyces spp. De acuerdo con Wrightetaí. (2001), Paecilomyces fumosoroseus y F, javanicus son útiles para controlar infestaciones de termitas subterráneas, particularmente de la familia Rhinotermitidae entre la cuál se encuentra el género Coptotermes registrado atacando Eucalyptus tereticornis en el presente estudio. Propágalos del hongo como blastosporas y conidias, que pueden ser cultivadas de forma fácil y económica e incorporadas en formulaciones, han sido utilizados con éxito para proteger árboles vivos, estructuras de madera y otros materiales celulósicos susceptibles a la infestación y daños.
Existen diferencias de opinión respecto a la utilidad de aislamientos originarios de los insectos a los cuales se dirigen las aplicaciones de dichos hongos como medida de control. Algunos autores sugieren un aumento en la efectividad cuando los aislamientos provienen de otros hospederos o cuando han sido reactivados sobre el insecto a controlar (Khan et al. 1990b; González et al. 1993). En este sentido los aislamientos encontrados en el presente estudio directamente sobre las termitas y que poseen características de adaptación a las condiciones climáticas y ecológicas del área, deberán seleccionarse cuidadosamente en pruebas de laboratorio y campo, antes de poder recomendarse como elementos de un manejo integrado de termitas. No obstante, su presencia asociada a las termitas en los eucaliptales de la reforestadora los convierte en candidatos potenciales como agentes biocontroladores. Así mismo, es importante considerar aquellos aislados a partir de los sustratos, para los cuales debe verificarse la patogenicidad aún cuando se hayan registrado previamente afectando termitas. Entre los criterios de selección más importantes de los aislamientos, se encuentran los mencionados previamente en la introducción como mortalidad intrínseca de las termitas, dosis letal 50 (DL50) y tiempo letal 50 (TL50), entre otros.
El reconocimiento de los hongos asociados a las termitas en condiciones naturales y de laboratorio constituye un elemento básico como punto de partida para el control microbiológico de las mismas. No obstante, la inclusión de aislamientos derivados de otros insectos con actividades importantes de patogenicidad comprobada y efectividad en campo, debería considerarse en las pruebas de susceptibilidad in vitro
Agradecimientos
Los autores agradecen al personal de la reforestadora San Sebastián por su hospitalidad y colaboración; al profesor Abel Díaz Cadavid M.Sc por el análisis de distribución y frecuencia de los hongos, a la profesora Gloria Machado por la revisión del manuscrito, a Ménica Zuluaga, Beatriz Betancur, Carmen Vásquez, Inés Elena Giraldo y Beatriz Cardona por el soporte técnico y trabajo de campo y a la Corporación de Patologías Tropicales, al Instituto de Biología de la Facultad de Ciencias Exactas y naturales y al CODI de la Universidad de Antioquia por el apoyo y financiación de esta investigación.
Literatura citada
ALVES, S. B.; ALMEIDA, J. E. M.; MOINO, A.; STIMAC, J. L.; PEREIRA, R. M. 1995. Uso de Metarhizium anisoplíae e Beauveria bassiana no controle de Cornitermes cumulans em pastagens. Ecossistema Faculdad de Agronomía "Manoel Carlos Goncalves" 20: 50-57. [ Links ]
BACH, C. 1997. Claves para familias de termitas presentes en Colombia: alados y soldados. Seminario. Universidad Nacional de Colombia sede Medellín. [ Links ]
BARMETT, H. L. 1967. llustrated genera of imperfect fungi. Burguess Publishing Company, Minneapolis (U.S.A.). 225 p. [ Links ]
BURREROS, S. 1996. Diccionario Geográfico de Colombia. Tomo 3. Instituto Geográfico Agustín Codazzi, Bogotá (Colombia), p. 1404-1405. [ Links ]
CALLE, J. 2000. Vers un controle Microbiologique des populations Colombiennes de Triatominae, insectes vecteurs de la maladie de Chagas. Tesis presentada para obtener el titulo de Doctor de la Universite París V.-René Descartes, Facultad de Medicina, Mecker. 141 p. [ Links ]
CHAI, Y. Q. 1995. Preliminary studies on the pathogenicity of some entomogenous fungi to Coptotermes formosanus. Chínese Journal of Biológical Control 11 (2): 68-69. [ Links ]
CONSTANTINO, R. 1999. Clave para as Familias de Cupins que Ocorrem no Brasil. Papéis Avulsos de Zoología 40 (25): 408-448. [ Links ]
COPPEL, M. C.; LIANG, M. C. 1987. Rhabditoid nematodes associated with subterranean termites. Forestry Research Notes N° 274, 5p. [ Links ]
DELATE, K. M.; GRACE, J. K.; TOME, H. M. 1995. Potential use of pathogenic fungi in baits to control the Formosan subterranean termite (Isopt., Rhinotermitidae). Journal of Apply Entomology 119: 429-433. [ Links ]
DOUGLAS, G.; GOETTEL, M.S.; BUTT, T.M.; STRASSER, H. 2001. Use of Hyphomycetous fungi for managing insect pests. En: T.M. Butt; C. Jackson; M. Magan (eds.) Fungi as biocontrol agents. CAB International, 2001: 23-69. [ Links ]
ESPERO, L. V. 1984. Survey of entomogenous fungi associated with termites (Philippines). Scientific Journal 6 (1): 23-24 [ Links ]
ESPINAL, L. S. 1990. Geografía ecológica de Colombia. Universidad Nacional de Colombia sede Medellín, Facultad de Ciencias Agropecuarias, p. 61-62. [ Links ]
FERNÁNDEZ, C. R. 2001. Susceptibilidad de Pliitella xylostella a diferentes aislamientos nativos del hongo entomopatógeno Beauveria basssiana y su efecto adicional sobre otros lepidópteros asociados a la producción de coliflor. Tesis (Magister en Entomología). Universidad Nacional de Colombia sede Medellín, Facultad de Ciencias. 92 p. [ Links ]
GARCÉS, J. E. 1997. Generalidades sobre las principales plagas insectiles en plantaciones forestales de Colombia (Guía de campo). Universidad Nacional de Colombia sede Medellín, Facultad de Ciencias y Ciencias Agropecuarias, Posgrado en Entomología, p. 293- 311. [ Links ]
GOETTEL, M.; INGLIS, G. D. 1997. Fungi Hy-phomycetes. En: L. Lacey (ed.) Manual of techniques in insect pathology. USDA, ARS, Academic Press, Great Britain. p. 213-249. [ Links ]
GONZÁLEZ, G. M. T.; POSADA, F. F. J.; BUSTILLO, P. A. E. 1993. Desarrollo de un bioensayo para evaluar la patogenicidad de Beauveria bassiana sobre Hypothenemus hampeii. Cenicafé 44 (3): 93-102. [ Links ]
GRACE, J. K. 1989. A modified trap technique for monitoring Reticulitermes subterranean termite populations (Isoptera: Rhinotermitidae). Pan-Pacific. Entomologist 65: 381-384. [ Links ]
GRADY, W. 1997. Toronto's war on termites. Canadian Geografic 117 (5): 46. [ Links ]
HASSAN, F. A. 1990. Important insects pests of Casuarina in Egypt. En: Advances in casuarina research and utilization. Proceedingof the Second International Casuarina Workshop. El Cairo (Egypto). p. 102-109. [ Links ]
HOYOS, J. 1974. Árboles cultivados de Venezuela. Monografía N° 20. Sociedad de Ciencias Naturales. Lasalle, Caracas, p. 148-149. [ Links ]
HUMBER, R. A. 1997. Fungi Identification En : L. Lacey (ed.). Manual of techniques in insect pathology. USDA, ARS, Academic Press (Great Britain). p. 153-185. [ Links ]
KHAN, K.; JAYARAJ, S.; GOPALAN, M. 1990a. Testing entomopathogenic fungi against the common agro-forestry termites. En: G.K. Veeresh; B. Mallick; C.A. Viraktamath (eds.) Social insects and the environment. p. 636. [ Links ]
KHAN, K.; JAYARAJ, S.; GOPALAN, M. 1990b. Influence of successive sub-culturing and maintenance of virulence of mycopathogens on termites En: G.K. Veeresh; B. Mallick; C.A. Viraktamath (eds.) Social insects and the environment. p. 637-638. [ Links ]
KHAN, K.; JAYARAJ, S.; GOPALAN, M. 1991. Mycopathogens for biological control of Odontotermes brunneus Hagen. Journal of Biological Control 5: 32-35. [ Links ]
KHAN, K. I.; JAFRI, R. H.; AHMAD, M. 1994. Pathogenicity of Aspergillits niger against various species of termites. Punjab. Univ. Journal of Zoology 9: 9-14. [ Links ]
LAMPRECHT, H. 1990. Silvicultura en los trópicos. Los ecosistemas forestales en los bosques tropicales y sus especies arbóreas. Posibilidades y métodos para un aprovechamiento sostenido. Deutsche Gesellschaft für Technische Zusammenar beit (GTZ) Cooperación Técnica-República Federal de Alemania. Eschborn. p. 276-288. [ Links ]
L[J]UTIKOVA, L. I. 1990. Entomogenous fungi as control agents for termite Anacanthotermes ahngerianus Jacobs (Isoptera, Hodotermitidae). En: G.K. Veeresh; B. Mallick; C.A. Viraktamath (eds.). Social insects and the environment. p. 634-635. [ Links ]
LOGAN, J. W. M.; COWIE, R. H.; WOOD, T. G. 1990. Termite (Isoptera) control in agriculture and forestry by non-chemical methods: a review. Bulletin of Entomological Research 80 (3): 309-330. [ Links ]
MADRIGAL, A. 1989. Reconocimiento de insectos dañinos en plantaciones forestales de la Costa Atlántica Colombiana. Sociedad Colombiana de Entomología. Miscelánea 12: 1-24. [ Links ]
MADRIGAL. A. 1999. Notas sobre control biológico de plagas. Universidad Nacional de Colombia sede Medellín, Facultad de Ciencias Agropecuarias: p. 1-13. [ Links ]
MILNER, R. J. 1992. Selection and characterization of strains of Metarhizium anisopliae for control of soil insects in Australia En: Biológical control of locust and grasshoppers: proceedings of a workshop held at the International Institute of Tropical Agricultura, Cotonou. Republic of Benin. p. 200-207. [ Links ]
MILNER, R. J.; STAPLES, J. A.; LUTTON, G. G. 1998a. The selection of an isolate of the hyphomycete fungus, Metarhizium anisopliae, for control of termites in Australia. Biological control: theory and applications in pest management 11 (3): 240-247. [ Links ]
MILNER, R. J.; STAPLES, J. A.; HARTLEY, T. R.; LUTTON, G. G.; DRIVER, F.; WATSON, J. A. L. 1998b. Occurrence of Metarhizium anisop/iae in nests and feeding sites of Australia termites. Mycol-res [Cambridge University Press, Cambridge] 102: 216-220. [ Links ]
NELSON, P E.; TOUSSOUN, T. A.; MARASAS, W. F.O. 1983. FUsarium species. An illustrated manual for identification. The Pennsylvania State University Press, University Park (U.S.A.). p. 70-145. [ Links ]
HICKLE, D. A., COLLINS, M. S. 1988. The Termite fauna (Isoptera) in the Vicinity of Chamela, State-ef-Jalisco, México. Folia Entomológica Mexicana 77: 85-122. [ Links ]
NICKLE, D. A; COLLINS, M. S. 1992. The termites of Panamá (Isoptera). En: D. Quintero y A. Aiello (Eds.) Insects of Panamá and Mesoamérica. Selected Studies. Oxford University Press, p. 208-242. [ Links ]
NUTTING, W. L. 1990. Insecta: Isoptera. En: D.L. Dindall (ed.) Soil Biology Guide. New York. p. 997-1032. [ Links ]
PAPIEROK B.; HAJEK, A. E. 1997. Fungi Entomophthorales. En : L. Lacey (ed.) Manual of techniques in insect pathology. USDA, ARS, Academic Press (Great Britain). p. 187-212. [ Links ]
PARDO, V. M. 1990. Manual práctico de Micología Agrícola. Universidad Nacional de Colombia sede Medellín, Facultad de Ciencias Agropecuaria. 97 p. [ Links ]
PÉREZ-ARBELAEZ, E. 1994. Plantas útiles de Colombia. Editorial Víctor Hugo, Medellín. p. 502-505. [ Links ]
RAMAKRISHNAN, R.; SUITER, D. R.; NAKATSU, C. H.; HUMBER, R. A.; BENNETT, G. W. 1999. Imidacloprid-Enhanced Reticulitermes flavipes (Isoptera: Rhinotermitidae) Susceptibility to the Entomopathogen Metarhizium anisopliae. Enviromental Entomology 28 (5): 1125-1132. [ Links ]
SAJAR A. S.; KAUR, K. 1990. Histopathology of Metarhizium anisopliae, an entomopathogenic fungus infection in the termite, Coptotermes curvignathus. Pertanika 13 (3): 331-334. [ Links ]
SAMSON, R. A.; HOEKSTRA, E. S.; OORSCHOT, A. N. 1984. Introduction to food-borne fungí. Second edition. Central Bureau voor Schimmelcultures, Institute of the Royal Netherlands, Academy of Arts and Sciences. 247 p. [ Links ]
TANADA, Y.; KAYA M. K. 1993. Insect pathology. Academic Press, Inc. Harcourt Brace Javanovich (U.S.A.). p. 359-361. [ Links ]
ULLOA, M.; HERRERA, T. 1994. Etimología e Iconografía de Géneros de Hongos. Cuadernos 21. Instituto de Biología, Universidad Nacional Autónoma de México. 300 p. [ Links ]
VALERIO, J. R.; SANTOS, A. V; SOUZA, A. P; MACIEL, C. A. M.; OLIVEIRA M. C. M. 1998. Chemical and mechanical control of mound-building Termite species (Isoptera: Termitidae) in pastures. Ann. Soc. Entomol. 27 (1): 125-131. [ Links ]
VALLEJO, L. F.; URIBE, S.; VÉLEZ, I. V. 1996. Identificación de hongos patógenos para Lutzomyia sp. (Díptera: Psychodidae) vectores de leishmaniasis. Revista Colombiana de Entomología 22 (1): 13-17. [ Links ]
VÉLEZ, H. 1989. Curso avanzado de hongos oportunistas. Diagnóstico de laboratorio de los agentes más comunes. Universidad de Antioquia, Facultad de Medicina, Laboratorio de Micología. Bayer Farma. 203 p. [ Links ]
WATSON J. A. L., GAY, F. J. 1991. Isoptera (Termites). En: The Insects of Australia. Vol II. Csiro, Cornell University Press, Ithaca, New York. p. 330-347. [ Links ]
WEESNER, F. M. 1987. Order Isoptera. En: F. W. Stehr (ed.) Immature Insects. Vol I. Kendall/Hunt Publishing Company, Department of Entomology Michigan State University, U.S.A. p. 132-139. [ Links ]
WRIGHT, M. S.; CONNICK, w. J. Jr.; JACKSON, M. A. 2001. Use of Paecilomyces spp. as pathogenic agents against subterranean termites. U. S. Patent Aplication S/N 09/ 989, 287. [ Links ]
YOSHIOBA, S.; FUSE, G.; ENOKI, A. 1991. Termicidal efficacy of organophosphates (I) Degradation of organophosphates in soil. Memoirs of the Faculty of Agriculture of Kinki University 24: 29-36. [ Links ]
ZOBERI, M. H. 1995. Metarhizium anisopliae, a fungal pathogen of Reticulitermes flavipes (Isoptera: Rhinotermitidae). Mycologia 87 (3): 354-359. [ Links ]
ZOBERI, M. H.; GRACE, J. K. 1990. Isolation of the pathogen Beauveria bassiana from Reticulitermes flavipes (Isoptera: Rhinotermitidae). Sociobiology 16 (3): 289-296. [ Links ]
Recibido: Sep. 04/2002 • Aceptado: Feb. 20/ 2003