Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488versión On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.30 n.1 Bogotá ene./jun. 2004
Patogenicidad de diferentes hongos entomopatógenos para el control de Aleurotrachelus socialis (Homoptera: Aleyrodidae) bajo condiciones de invernadero*
Pathogenicíty of different fungal entomopathogens for the control oíAleurotrachelus socialis (Homoptera: Aleyrodidae) under greenhouse conditions
IRINA ALEAN C.1, ANUAR MORALES R.2, CLAUDIA MARÍA HOLGUÍN A.3, ANTHONY C. BELLOTTI4
1* Apartes del Trabajo de Orado del primer autor. Estudiante de Microbiología Agrícola y Veterinaria. Pontificia Universidad Javeriana, Bogotá. E-mail: irinaalean@hotmail.com
2 Asistente de Investigación. Bioecología del Salivazo. Entomología de Forrajes, CIAT. Cali-Valle. E-mail: an.morales@cgiar.org
3 Asistente de Investigación. MIPE. Entomología de Yuca, CIAT. Cali-Valle. E-mail: claudia_holguin@hotmail.com.
4 Autor para correspondencia: Líder del proyecto MIPE y Entomología de Yuca, CIAT. A. A. 6713, Cali, Colombia. E-mail: a.bellotti@cgiar.org
Resumen. En Colombia existe un complejo de ocho especies de moscas blancas asociadas al cultivo de yuca. La especie predominante es Aleurotrachelus socialis Bondar la cual constituye el 92% de la población total y ocasiona pérdidas en rendimiento hasta del 79% en campos experimentales. Con el propósito de ofrecerle a los cultivadores de yuca una opción diferente al control químico con el cual se reduzcan los costos y el impacto ambiental, se evaluó la patogenicidad de varios aislamientos de los hongos entomopatógenos Beauveria bassiana (Bálsamo) Vuillemin, Verticillium lecanii (Zímm.) Viegas y Paecilomyces fumosoroseus (Wize) Brown y Smith, sobre los diferentes estados ninfales y huevos de A. socialis, para determinar el estado de desarrollo más susceptible, seleccionar el aislamiento más promisorio y con éste la concentración letal media (CL50,). Así mismo, se evaluaron diferentes formulaciones comerciales de hongos entomopatógenos sobre el estado de desarrollo más susceptible de A. socialis. Con respecto a la mortalidad se encontraron diferencias significativas entre las especies de hongos utilizadas y el testigo. Se seleccionó el aislamiento CIAT 215 de V. lecanii como el más promisorio por presentar la mortalidad más alta sobre los estados de desarrollo de A. socialis (67,3%). Como estado más susceptible se determinó el de huevo próximo a eclosionar. Sobre este estadio se evaluó el aislamiento CIAT 215 en siete concentraciones y se determinó que la CL50fue de 1,4x107 conldlos/ml con límites de confianza de 3,6x105-1,5x109 conidios/ml. Los productos formulados evaluados presentaron porcentajes de mortalidad inferiores al 50%; sin embargo, mostraron diferencias estadísticas significativas con respecto al testigo.
Palabras clave: Mosca blanca de la yuca. Verticillium lecanii. Concentración letal media (CL50). Hongos formulados. Control biológico.
Summary. A complex of eight whitefly species associated with cassava exists in Colombia. The predominant species Aleurotrachelus socialis Bondar, which constitutes 92% of the total population and causes yield losses of up to 79% in field experiments. In order to offer cassava growers an alternative to chemical control to reduce costs and environmental degradation we assessed the pathogenicity of various strains of the entomopathogenic fungí Beauveria bassiana (Bálsamo) Vulllemin, Verticillium lecanii (Zímm.) Viegas and Paecilomyces fíonosoroseus (Wize) Brown fie Smith on different nymphal stages and eggs of A. socialis in order to determine the most susceptible developmental stage, select the most promising isolate and identify the lethal concentration (CL50). We also evaluated different commercial formulations of entomopathogenic fungí on the most susceptible developmental stage of A. socialis. We observed differences in mortality between the fungal species used and the control treatment. The V.lecanii strain CIAT 215 was selected as the most promising because it presented the highest mortality to A. socialis developmental stages (67,3%). The most susceptible stage were eggs cióse to hatching. We tested the strain CIAT 215 in seven concentrations on this stage and determinated that the CL50 was 1,4x107 conidia/ml with a confidence interval of 3,6x105-1,5x109 conidia/ml. The evaluated commercial formulations caused mortality of less than 50%, however, they were still statistically different than the control treatment.
Key words: Cassava whitefly. Verticillium lecanii. Median lethal concentration. Formulated fungi. Biológical control.
Introducción
Las moscas blancas son la mayor plaga del cultivo de yuca en casi todas las regiones tropicales y subtropicales del mundo, pues además de alimentarse vorazmente de la savia de la planta, son eficientes vectores de virus (Bellotti et al. 2002).
Existe un gran complejo en el Meotrópico, donde quince especies de moscas blancas han sido identificadas alimentándose en yuca: Aleurodicus dispersos Russell, Aleu-ronudus sp., Aleurothrtxus aepim (Qoeldi), Aleurotrachelus socialis Bondar, Bemisia argentinfolü (Bemisia tabaci biotipo B), Bemisia tabaci (Qennadius), Bemisia tuberculata Bondar, Paraleyrodes sp., Tetraleurodes sp., Trialeurodes variabüis (Quaintance), Trialeurodes abutiloneus, (Bellotti 2002), Aleuroglandulus malangae Russell, Tetraleurodes ursorum (Cockerell) (Castillo 1996), Tírialeurodes vaporariorum (Westwood) (CIAT 2000) y Bemisiaafer Priesner&r Hosny (CIAT2001).
En el norte de Sur América (Colombia, Venezuela y Ecuador) A. socialis es la especie predominante causante de considerables daños al cultivo; también se encuentra en Brasil aunque en menor proporción donde no produce daño económico (Parias 1994).
La importancia económica de los daños causados por las moscas blancas radica en que afectan el rendimiento de raíces de yuca y la disponibilidad de estacas para la siembra. Las pérdidas en rendimiento muestran que existe una correlación negativa entre la duración del ataque y la producción de raíces. Ensayos en campo realizados por CIAT - CORPOICA Nataima, Tolima, registraron en Colombia pérdidas en rendimiento hasta del 79% (Bellotti y Vargas 1986). Dichas pérdidas son producidas directamente por la disminución de la savia circulante por el floema de la planta e indirectamente por la mielecilla excretada por el insecto, la cual sirve como medio de crecimiento al hongo saprofito Capnodium sp., conocido comúnmente como fumagina (Byrne et al. 1990; Byrne y Bellows 1991). Este hongo puede tener un efecto adverso en la fotosíntesis, al impedir la llegada de la luz a la superficie foliar (Bellotti y Vargas 1986).
El control químico de las moscas blancas es generalmente muy difícil por su morfología y características autoecológicas (sustancias cerosas como un componente de la cutícula, la colonización en el envés de la hoja y el desarrollo rápido de altas poblaciones). Además, las moscas blancas representan un grupo de insectos con la habilidad de desarrollar poblaciones que son altamente resistentes a plaguicidas químicos (Landa 1992). Los agricultores reaccionan frente al ataque del insecto con el uso indiscriminado de insecticidas, generando una serie de efectos negativos para el equilibrio ambiental y la salud de hombres y animales.
El control microbiológico se presenta como una buena alternativa dentro del manejo integrado del cultivo. De los microorganismos que causan enfermedades a los insectos, incluyendo bacterias, hongos, virus y nemátodos, sólo los hongos entorno-patógenos han sido registrados como los capaces de infectar a los insectos pertenecientes a la familia Aleyrodidae, a través de la penetración de su cutícula (Fransen 1990).
En Colombia y otros países se han realizado estudios con hongos entomopatogenos sobre varias especies de moscas blancas, donde se demuestra el potencial de los hongos para controlar este insecto plaga. La mayoría de los estudios publicados han evaluado sobre ninfas de los primeros estadios de mosca blanca los hongos entomopatogenos Aschersonia aleyrodis, Beauveria bassiana, Paecilomyces spp. y Verticiüium lecanii; solamente Osborne et al. (1990) utilizaron ninfas de IV instar. García (1996) evaluó varias cepas nativas de V.lecanii sobre ninfas de II instar de Trialeurodes vaporariorum y obtuvo con la cepa codificada como C26 una mortalidad del 90%. En ensayos específicos sobre A. socialis, Sánchez y Bellotti (1997) evaluaron diferentes especies de hongos entomopatogenos sobre ninfas de IV instar de A. socialisy establecieron una cepa de la especie B.bassiana como la más virulenta, con una mortalidad del 95%; posteriormente se evaluó esta cepa sobre ninfas de I, II y III instar de A. socialis y se determinó el segundo instar como el más susceptible por presentar la mortalidad más alta (55%).
El objetivo general de esta investigación fue evaluar la patogenicidad de diferentes hongos entomopatogenos en el control de la mosca blanca de la yuca A. socialis. Los objetivos específicos fueron (1) Evaluar la patogenicidad de aislamientos de hongos entomopatogenos de las especies B. bassiana, V. lecanii y P. fumosoroseus sobre huevos y ninfas de A. socialis bajo condiciones de invernadero, (2) Establecer el estado de desarrollo de A. socialis más susceptible a los hongos entomopatóreactivación, (3) Determinar la concentración letal cincuenta y noventa (CL50 y CL50) del aislamiento más virulento sobre A. socialis, (4) Realizar el control de calidad de diferentes formulaciones comerciales de hongos entomopatogenos existentes en el mercado nacional y (5) Evaluar la patogenicidad de estas formulaciones comerciales utilizadas para controlar otras especies de moscas blancas sobre A. socialis.
Materiales y Métodos
Esta investigación se realizó en el laboratorio y cuarto de cría de Bioecología y MIP del Centro Internacional de Agricultura Tropical (CIAT), localizado en el municipio de Palmira, departamento del Valle del Cauca, a 1.000 msnm.
El material vegetal utilizado para evaluar los aislamientos de hongos entomopatogenos sobre huevos y ninfas de A.socialis correspondió a plantas de yuca de 30-40 días de siembra de la variedad CMC 40, sembradas en potes plásticos con suelo estéril de 1 kg, los cuales se mantuvieron en casa de malla a una temperatura de 30 ± 2°C y una humedad relativa de 50-60%.
Los adultos de A. socialis utilizados en los diferentes ensayos fueron tomados de la colonia establecida en CIAT desde 1992, sobre plantas de yuca de la variedad CMC 40, mantenidas en invernadero a una temperatura de 27 ± 2°C y una humedad relativa de 60-70%.
Reactivación de los hongos entomopatógenos
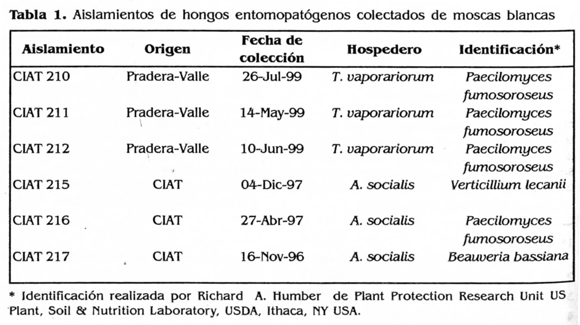
Entre 1996 y 1999 se realizaron varias exploraciones de campo en diferentes zonas yuqueras del país con el fin de colectar hongos entomopatogenos asociados a las moscas blancas presentes en el cultivo. De los aislamientos colectados se escogieron 6, los cuales se encontraban almacenados en el cepario del CIAT en la técnica de papel filtro seco a una temperatura de -20°C (Tabla 1). Estos hongos se sembraron en medio PDA y posteriormente se reactivaron sobre adultos de A. socialis. Para la de la colonia se tomaron 20 genos, adultos con un aspirador bucal y se introdujeron en cajas de Petri de 60 x 15 mm. Las cajas contenían papel filtro húmedo con agua destilada estéril. Sobre estos adultos se inocularon los hongos entomopatogenos aplicando sobre cada individuo veinte microlitros de una suspensión concentrada de conidios. Este procedimiento se realizó con cada uno de los aislamientos nativos. Los insectos se dejaron en estas condiciones por un período de cinco días, después de este período, los adultos con presencia de micelio se sembraron en medio de cultivo PDA.
Una vez purificados los hongos se les realizó un pase sobre "agar insecto" al 0,5%; para la preparación de este agar se colectaron adultos de A. socialis de la colonia establecida en CIAT y de campo. Se maceraron y se adicionaron a agar PDA esterilizado previamente a razón de 0,5 g del macerado por cada 100 ml de agar. Se llevó nuevamente a la autoclave a una presión de 100 libras durante 10 minutos, se vertió el agar en cajas de Petri de 60 x 15 mm y sobre éste se sembraron los seis aislamientos. Posteriormente se les realizó otro pase sobre "agar insecto" con macerado de huevos y ninfas de A. socialis (Fig. 1) siguiendo el mismo procedimiento anterior.
Determinación del estado de desarrollo más susceptible y selección del aislamiento más promisorio
Para infestar las plantas de yuca, se aspiraron de 20-50 adultos de A. socialis y se introdujeron en jaulas pinza ubicadas en las hojas de la planta. Al cabo de 24 h se retiraron los adultos. Este procedimiento se realizó 4, 7, 14 y 23 días después con el fin de obtener todos los estados de desarrollo del insecto en el momento de la aplicación.
La aplicación de los hongos sobre las ninfas y huevos de A. socialis se realizó con un microaspersor, a una presión de salida de 10 PSI. El cubrimiento se evaluó sobre una tira de papel hidrosensible. El volumen asperjado por tratamiento fue de 4,0 ± 0,5 mi de suspensión. Después de la aplicación las plantas se llevaron a un cuarto de cría a una temperatura de 28 ± 2°C y una humedad relativa del 80-90%.
La evaluación se realizó con un microscopio estereoscópico a emergencia de adultos. Se contabilizaron exuvias, ninfas vivas y ninfas muertas con y sin evidencias de micosis. Las ninfas muertas sin evidencia de micosis se ubicaron en cajas de Petri con papel filtro húmedo por 4-5 días para determinar la presencia o no del hongo.
El diseño experimental utilizado fue completamente al azar, con 10 repeticiones por tratamiento. Como unidad experimental se consideró cada hoja de la planta sobre la cual se colocó una jaula pinza y en la que sólo se dejaron 30 ninfas o huevos de A. socialis. Los controles consistieron en agua destilada estéril y agua destilada estéril más Tween 80 al 0,05%. Esta misma metodología se empleó para determinar la concentración letal media y noventa (CL50y CL90 y evaluar las formulaciones comerciales de hongos entomopatógenos.
Se seleccionó como el aislamiento más promisorio aquel que produjo los niveles más altos de infección sobre todos los estados de desarrollo del insecto y como estado más susceptible el que presentó el porcentaje de mortalidad más alto frente a los demás estados evaluados.
Concentración letal media y noventa
(CL50 y CL90)
Después de tener el estado de desarrollo más susceptible a los hongos entomopatógenos, se evaluó sobre éste el aislamiento más promisorio en las concentraciones 1x103, 1x104, 1x105, 1x106, 5,0x106, 1x107, 5,0x107 conidios/ml, además del testigo. Los datos obtenidos en. las evaluaciones se sometieron a un análisis Probit para calcular la CL50 y CL50.
Evaluación de productos comerciales
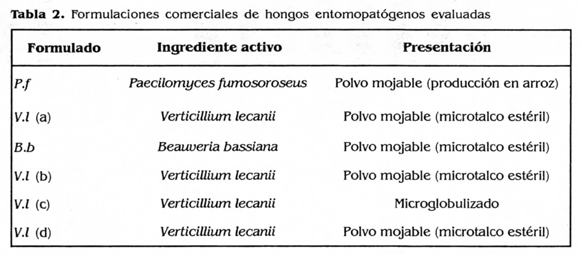
Se evaluaron seis formulaciones comerciales de hongos entomopatógenos en la dosis recomendada por cada casa comercial sobre el estado de desarrollo de A. socialis más susceptible a los aislamientos nativos (Tabla 2). Así mismo, se les realizó un control de calidad según la metodología establecida por Cenicafé (Vélez et al. 1997). Se determinaron los valores para conteo de conidios, viabilidad de éstos a las 24 h, pureza. pH y humectabilidad de los productos formulados. Además se evaluó la patogenicidad de estas formulaciones en la dosis recomendada por cada casa comercial sobre el estado de desarrollo más susceptible.
Resultados y Discusión
Estado de desarrollo más susceptible y aislamiento más promisorio
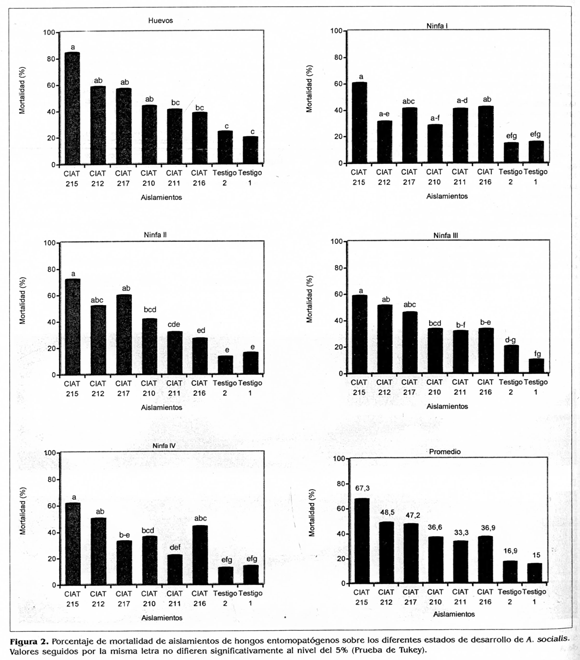
De los seis aislamientos nativos evaluados sobre los diferentes estados de desarrollo de A. socia/is, el aislamiento CIAT 215 de V. lecanli presentó los porcentajes de mortalidad más altos, superiores al 50%, sobre todos los estados de vida del insecto y una mortalidad de 67,3% en promedio (Fig. 2). Este fue seguido por el CIAT 212 de P. fumosoroseus y CIAT 217 de B. bassiana con 48,5 y 47,2% de mortalidad, respectivamente. Los testigos presentaron una mortalidad promedio del 16%, inferior a todas las cepas evaluadas (Fig, 2). Estos resultados no coinciden con los señalados por Sánchez y Bellotti (1997) quienes evaluaron diferentes cepas de B. bassiana, M. anisopliae, Fusarium sp. y V. lecanii sobre ninfas de cuarto instar de A. socialis y determinaron una cepa de B. bassiana como la cepa más virulenta.
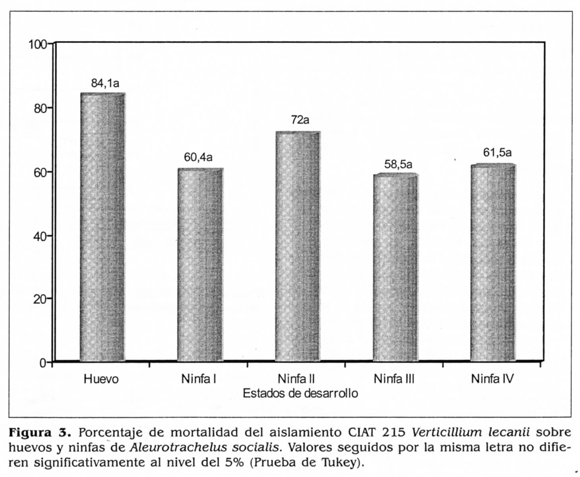
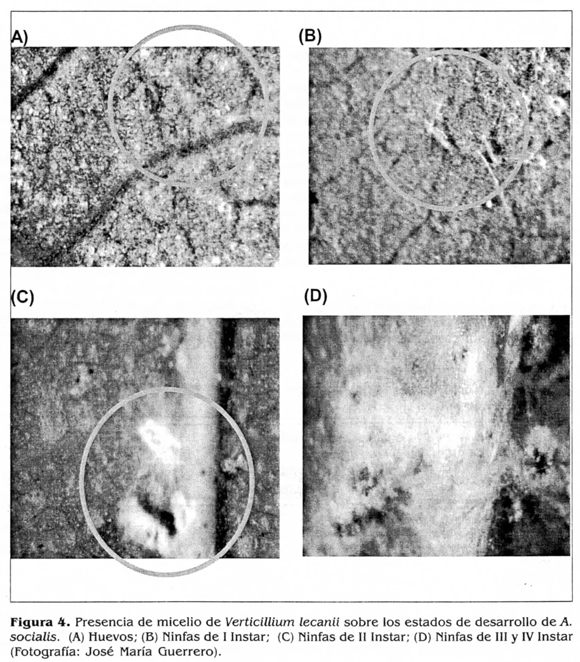
De los cinco estados de desarrollo de A. socialis evaluados, el aislamiento CIAT 215 de M lecanii presentó los porcentajes de mortalidad más altos sobre huevos próximos a eclosionar 84,1% y ninfas de II instar 72,0% (F = 129,56, Pr > 0,0001). Aunque no se presentaron diferencias significativas entre estos dos estados de desarrollo, se seleccionó el de huevos próximos a eclosionar como el más susceptible dado que éstos porcentualmente presentan una mayor mortalidad y no han iniciado el daño a la planta. Los demás estadios exhibieron mortalidades de 61,5% para ninfas de IV instar, 60,4% ninfas de I instar y 58,5% ninfas de III instar (Fig. 3). Debido a las características morfológicas de esta mosca blanca que secreta una sustancia cerosa de color blanco, que podría confundirse con el micelio del hongo, se realizó la evaluación a emergencia de adultos, contabilizando las pupas que presentaban aberturas. Se puede afirmar que la aplicación sobre huevos próximos a eclosionar ocasionó una mayor mortalidad; sin embargo, en las evaluaciones hechas al estereoscopio se observaron todos los estados de desarrollo de A. socialis afectados por el hongo (Fig. 4). no obstante, Sánchez y Bellotti (1997) determinaron el segundo instar de A. socialis como el estado de desarrollo más susceptible a la cepa Bb 9501 de B. bassiana. De otra parte, Fransen (1990) mostró que V.lecanii infectaba tanto a ninfas como adultos pero no a huevos de T. vaporariorum. Así mismo, informó que las ninfas de segundo instar fueron las más susceptibles. Sin embargo. Morales y Cardona (1996) determinaron a los primeros estados de desarrollo de T. vaporariorum y B. tabaci como los más susceptibles a diferentes especies de hongos entomopatógenos, siendo los huevos próximos a eclosionar el estado ideal para hacer la aplicación por su tasa de mortalidad alta, determinada por la emergencia baja de adultos.
Concentración letal media y noventa
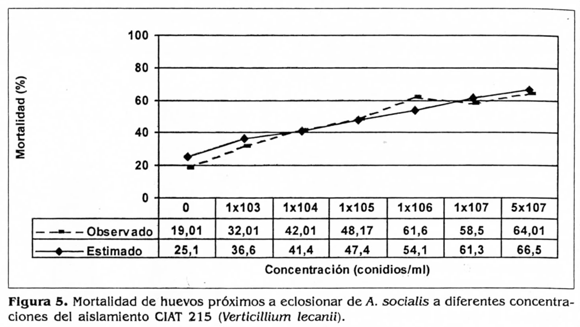
Para el aislamiento CIAT 215 (V. lecanii), a mayor concentración del inoculo se presentó mayor mortalidad de huevos próximos a eclosionar de A. socialis (Fig. 5). El análisis Probit mostró que la CL50 del aislamiento CIAT 215 se alcanzó con una concentración de 1,4x107 conidios/ml con límites de confianza de 3,6x105 1,5x109 conidios/ml. La CL90 se estimó que sería una concentración de 2,3x1012 conidios/ml con límites de confianza de 9,3x109 -4,1x1021 (Tabla 3). Estos resultados plantean la necesidad de utilizar concentraciones muy altas de hongos en campo para obtener niveles óptimos de control.
Control de calidad y evaluación de productos comerciales
En el recuento de propágulos de los productos formulados, hubo una concentración menor a la cantidad de conidios registrada en la etiqueta (Tabla 4). En el mejor de los casos el contenido de conidios por gramo de formulado fue el equivalente al 40% de las conidios que específica la formulación.
En la prueba de viabilidad a 24 h, después de siembra en placas de agar agua, se observó que sólo el formulado P. f. presentó una viabilidad del 95%; en los otros productos la viabilidad fue inferior al 50% (Tabla 4). Una formulación comercial debe tener una germinación superior al 85% en un tiempo de incubación de 24 h, ya que al asperjar en el campo el hongo debe tener un rápido efecto sobre la población del insecto que está atacando y un corto período de exposición a condiciones ambientales (Vélez et al. 1997).
En la prueba de pureza los formulados de V. lecanii (V.l.b y V.l.c) no presentaron el crecimiento de las colonias del ingrediente activo (Tabla 4); por el contrario mostraron contaminación por los hongos Penicillium sp. y Aspergillus sp. Sólo tres formulaciones presentaron una pureza mayor al 95% (P.f., 98%, V.l.a y B.b. 100%).
El intervalo óptimo de pH para una formulación comercial según Vélez et al. (1997) es de 5,5 y 7,0. De las formulaciones evaluadas sólo los productos V.l.a y V.l.d, se encuentran en este rango con un pH de 5,54 y 5,59, respectivamente. Los dos productos con mayor contaminación y menor viabilidad (V.l.b y V.l.c) presentaron un pH de 4,80 y 4,87. Estos productos son de la misma casa comercial en diferentes presentaciones. Es posible que el inerte empleado estuviese contaminado y esto afecte la germinación de las esporas del hongo considerado como ingrediente activo.
Los formulados que mostraron mejor humectabilidad son V.l.b P.f. y V.l.a con 1,3, 2,0 y 4,0 minutos, respectivamente, los formulados de V.l.d y B.b. no presentaron humectación o es muy lenta; al momento de la aplicación éstos podrían formar grumos y ocasionar taponamiento de las boquillas (Tabla 4).
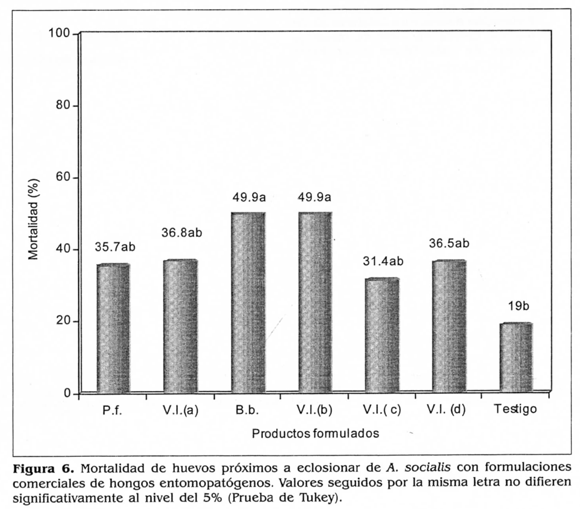
Después de realizar el control de calidad se evaluaron las diferentes formulaciones comerciales sobre huevos próximos a eclosionar de A. socialls. Se encontró que los'productos formulados que se evaluaron produjeron porcentajes de mortalidad inferiores al 50%; sin embargo, se encontraron diferencias estadísticas significativas con respecto al testigo al 95% de confiabilidad (Fig. 6). Esto indica que los productos evaluados no son adecuados para controlar A. socialis. Es probable que se deba a que dichos productos son recomendados para controlar otras especies de mosca blanca que son menos quitinizadas y no presentan cerosidad alrededor de su cuerpo como es el caso de A. socialis.
Se evidencia que la calidad de las formulaciones de hongos entomopatógenos evaluadas no es óptima. Queda la duda si la característica de la formulación es la que afecta la acción entomopatógena del hongo empleado como principio activo y por esto los productos no ejercen un buen control sobre el insecto. Por otra parte, se aprecia el problema de generalizar el control de varias especies de mosca blanca con un sólo aislamiento de hongo entomopa tógeno. Es necesario entonces tener en cuenta las especies del complejo que son consideradas plaga en determinados cultivos, para así mismo seleccionar los aislamientos más virulentos y en cada caso dar una recomendación.
Conclusiones
• El aislamiento C1AT 215 de Verticillium lecanii fue seleccionado como el aislamiento más promisorio para el control de A. socialis por presentar los niveles mayores de infección sobre los diferentes estados de desarrollo del insecto bajo condiciones de invernadero.
• El estado de desarrollo de A. socialis más susceptible a los hongos entomopatógenos es el de huevo próximo a eclosionar, esto favorece el manejo del insecto pues se reflejaría en un menor consumo de la savia elaborada y la disminución de pérdidas en rendimiento.
• El aislamiento CIAT 215 de V. lecanii alcanza su CL50 a una concentración de 1,4x107 conidios/ml y su CL50, a una concentración de 2,3x1012 conidios/ml.
• Los parámetros de control de calidad evaluados indican que las formulaciones comerciales de hongos entomopatógenos existentes en el mercado nacional no cumplen con los requerimientos mínimos exigidos por el ICA.
• Los hongos entomopatógenos formulados para otras especies de mosca blanca evaluados sobre huevos próximos a eclosionar de A. socialis no presentaron un buen control del insecto plaga ya que ningún producto produjo una mortalidad superior al 50%.
Recomendaciones
• Evaluar sobre A. socialis otras especies de hongos entomopatógenos promisorias como Aschersonia aleyrodis que ha sido señalada parasitando diferentes homópteros entre ellos varias especies de mosca blanca.
• Continuar con las evaluaciones de control de calidad y patogenicidad de otros productos formulados sobre A. socialis con el fin de determinar la dosis adecuada para esta especie de mosca blanca.
• Seleccionar el mejor producto comercial formulado a nivel de invernadero para luego ser aplicado en campo.
Agradecimientos
Los autores expresan sus agradecimientos al Dr. R. Humber (USDA) por la identificación de los aislamientos nativos. A Rosalba Tobón, Adriano Muñoz, Osear Yela y Josefina Martínez por su gran colaboración en el desarrollo de esta investigación. A Jaumer Ricaurte y James Silva por la asesoría estadística. Al Dr. Daniel Peck y María Elena Cuéllar por la revisión del manuscrito.
Literatura citada
BELLOTTI, A. C. 2002. Arthropod Pests (p. 209-235). En: Hillocks, R.; Thresh, J.; Bellotti, A. Cassava Biology, production and utilization. CABI Publishing, London. United Kingdom. 332 p. [ Links ]
BELLOTTI, A.; VARGAS, O. 1986. Mosca blanca del cultivo de yuca: biología y control; unidad audiotutoríal. CIAT. Cali Colombia 40 p. [ Links ]
BELLOTTI, A.; ARIAS, B.; VARGAS, O.; REYES, J.; GUERRERO, J. 2002. Insectos y Acares dañinos a la yuca y su control (p. 160-203). En: OSPINA, B.; CEBALLOS, H. (eds.). La yuca en el Tercer Milenio : Sistemas modernos de producción, procesamiento, utilización y comercialización. CLAYUCA. Cali. Colombia. 586 p. [ Links ]
BYRNE, D.; BELLOWS, T. 1991. Whitefly biology. Annual Review of Entomology (United States). 36: 431-457. [ Links ]
BYRNE, D.; BELLOWS, T.; PARRELLA, M. 1990. Whiteflies in agricultural systems (p. 227-262). En: GERLING, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept Ltd. Hants. United Kingdom. 348 p. [ Links ]
CASTILLO, J. 1996. Moscas blancas (Homoptera: Aleyrodidae) y sus enemigos naturales sobre cultivos de yuca (Manihot escalenta Crantz) en Colombia. Tesis de Maestría. Universidad del Valle, Facultad de Ciencias, Departamento de Biología. 174 p. [ Links ]
CIAT 2000. Annual Report, PROJECT-PE 1. Integrated pest and disease management in major agroecosistems. CIAT. Cali Colombia 190 p. [ Links ]
CIAT 2001. Annual Report, PROJECT-PE 1. Integrated pest and disease management in major agroecosistems. CIAT. Cali Colombia 211 p. [ Links ]
FARIAS, A. 1994. Flutuacao populacional de Aleurothrixus aepim em mandioca, em Sao Miguel das Matas, Bahia. Revista Brasileira de Mandioca (Brasil) 13 (2): 119-122. [ Links ]
FRANSEN, J. 1990. natural enemies of whiteflies: Fungi. (p. 187-205). En: GERLING, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept Ltd. Hants. United Kingdom. 348 p. [ Links ]
GARCÍA, J. 1996. Evaluación de cepas nativas de Verticillium lecanii (Zímm.) Viegas en el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood). Trabajo de Grado de Ingeniero Agrónomo. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Bogotá. 121 p. [ Links ]
LANDA, Z. 1992. Biological control of whiteflies with entomopathogenic fungí . Florida Entomologist 75 (1): 456-471. [ Links ]
MORALES, A.; CARDONA, C. 1996. Evaluación de diferentes hongos entomopatógenos sobre las moscas blancas Bemisia tabaci y Trialeurodes vaporariorum. Informe final Convenio CIAT - AgrEvo S.A. CIAT. Palmira. Colombia. 37 p. [ Links ]
OSBORNE, L.; STOREY, G.; McCOY, C.; WALTER, J. 1990. Potential for controlling trie sweetpotato whitefly, Bemisia tabaci with the fungus Paecllomyces fumosoroseus. International Coloquium on Invertebrate Pathology and Microbial Control (5, 1990, Adelaide, Australia). Proceedings and Abstracts, p. 386. [ Links ]
SÁNCHEZ, D.; BELLOTTI, A. 1997. Evaluación de la patogenicidad de hongos Hyphomycetes sobre la mosca blanca de la yuca, Aleurotrachelus socialis. Informe final Convenio Cooperativo CIAT-COLCIENCIAS. CIAT Palmira. Colombia. 21 p. [ Links ]
VÉLEZ, P.; POSADA, F.; MARÍN, F; GONZÁLEZ, M.; OSORIO, E.; BUSTILLO, A. 1997. Técnicas para el control de calidad de formulaciones de hongos entomopatógenos. Federación Nacional de Cafeteros de Colombia, Centro Nacional de Investigaciones de Café Pedro Uribe Mejía. CENICAFE, Chinchiná, Caldas (Colombia). 37 p. [ Links ]
Recibido: Abr. 22/2003 • Aceptado: Ago. 28/ 2003