Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.30 no.1 Bogotá Jan./June 2004
Unión de proteínas de Badilas thuringiensis con vesículas de las microvellosidades del tracto digestivo del gusano blanco de la papa Premnotrypes vorax (Coleóptera: Curculionidae)
Binding of Bacillus thuringiensis proteíns with brush border membranes vesicles of the digestive tract of the Andean potato weevil Premnotrypes vorax (Coleóptera: Curculiontdae)
WILSON MARTÍNEZ O.1, JAIRO CERÓN S.2
1 Autor para correspondencia: M. Se. en Entomología. Laboratorio de Entomología, Instituto de Biotecnología, Universidad Nacional de Colombia, Bogotá. A. A. 14490. E-mail: wilmarti@ibun.unal.edu.co
2 Ph. D. en Biotecnología. Director grupo de Biopesticidas. Instituto de Biotecnología, Universidad Nacional de Colombia, Bogotá. Email: jaceron@ibun.unal.edu.co
Resumen. La exploración del uso potencial de Bacillus thuringiensis como agente de control biológico de plagas requiere estudios básicos acerca de su mecanismo de acción en el insecto blanco seleccionado; de acuerdo con esto, técnicas como el empleo de vesículas obtenidas a partir de las microvellosidades epiteliales del tracto digestivo de los insectos (BBMV) se han constituido en herramientas valiosas a nivel mundial para estudiar dicho mecanismo en proteínas de B. thuringiensis. El objetivo del presente trabajo fue evaluar la unión de las proteínas Cry 3Aa, 3Ba, 3Bb, 3Ca y 7Aa de B. thuringiensis a BBMV's obtenidas a partir del tracto digestivo del gusano blanco de la papa Premnotrypes vorax Hustache, con el fin de determinar la potencialidad de su uso en el control biológico de este insecto plaga de gran importancia económica en los cultivos de papa en Colombia. El trabajo se realizó en el Instituto de Biotecnología de la Universidad nacional de Colombia. La purificación de las BBMV y el mareaje de las proteínas Cry con biotina se realizó de acuerdo con metodologías estandarizadas por los autores. En los ensayos de unión se determinó que mientras que las proteínas Cry3Aa, 3Bb y 3Ca se unieron a las BBMV de P. vorax, las proteínas Cry3Ba y Cry7Aa no lo hicieron; sin embargo, en ningún caso la unión de las proteínas Cry a las BBMV del insecto se relacionó con actividad tóxica hacia larvas de primer instar del insecto blanco. Así mismo, el análisis por blotting de las proteínas que presentaron unión determinó la presencia de dos posibles proteínas receptoras de 70 y 97 KDa, respectivamente, siendo este el primer registro que se hace para este insecto endémico de la zona andina colombiana.
Palabras clave: Plaga. Proteínas Cry. Unión.
Summary. The use of Bacillus thuringiensis as a biológica! pest control agent requires basic studies related to its mode of action in the selected target insect. Tfechniques such as the use of brush border membrane vesicles (BBMV) obtained from epithelial gut tissues of insects have become a valuable tools around the world for studying this mechanism in Bacillus thuringiensis proteins. The objective of this work was to analyze the binding of Cry3Aa, 3Ba, 3Bb, 3Ca and 7Aa B. thuringiensis proteins to BBMV obtained from the digestive tract of Premnotrypes vorax Hustache, in order to explore their potential as biológical control agente for this economically important pest in Colombian potato crops. This work was carried out in the Instituto de Biotecnología at the Universidad nacional de Colombia. Purification of BBMV and protein labeling with biotin were carried our according to methods previously standard ized by the authors. Binding assays showed that while Cry3Aa, CrySBb and Cry3Ca bind to P. vorax BBMV, Cry3Ba and Cry7Aa did not; however, binding was never correlated with toxicity to first instars of the target insect. Protein blot analysis showed the presence of two possible binding proteins of 70 and 97 KDa, respectively, being the First report made for this endemic pest of the Colombian Andean zone.
Rey words: Pest. Cry proteins. Binding.
Introducción
El control biológico de los organismos que afectan la producción agrícola mundial ha tenido en los últimos años gran auge a causa de la nueva orientación ecológica y sustentable de la agricultura (Orr y Charles 1998). De esta forma, herramientas como los insecticidas de origen microbiano han sido involucradas como un elemento valioso dentro de los programas de manejo integrado de plagas (MIP) en diferentes cultivos (Lecuona 1996). Las bacterias son uno de los grupos más estudiados como agentes de control de plagas a nivel mundial, siendo Bacillus thuringiensis Berlier (B. t.) la más representativa (Lecuona 1996). Los productos desarrollados a base de B. t. representan entre el 80-90% del mercado internacional de bioplaguicidas (Van Frankenhuyzen 1993).
La mayoría de estudios con B. t, se enfocan al control de plagas del orden Lepidoptera; sin embargo, también se han desarrollado trabajos con insectos del orden Coleóptera y Díptera, lo cual ha ampliado las perspectivas de investigación y explotación comercial de esta bacteria (Keller y Langenbrunch 1993). A este respecto, dentro de los logros tecnológicos a nivel industrial se destacan productos desarrollados por multinacionales con la variedad de B. t. tenebrionis con actividad reconocida en insectos del orden Coleóptera y plantas transgénicas modificadas con genes de B. t. que expresan proteínas con actividad tóxica hacia coleópteros plaga (McPherson et ai. 1988).
Los modelos para el estudio del mecanismo de acción de B. t. han sido desarrollados utilizando diversas metodologías, principalmente estudios in u/tro, para determinar cada uno de los pasos que siguen las proteínas del cristal desde su ingestión hasta causar la muerte del insecto. Se han desarrollado estrategias como el empleo de intestinos aislados de insectos, que permite un sistema modelo para investigar la bioquímica del proceso de intoxicación en más detalle, separándolo de las complejidades presentes en el insecto intacto (Bravo eí al. 1992a,b). De otra parte, se han generado líneas celulares de insectos (principalmente lepidópteros) lo cual permite identificar los efectos moleculares primarios importantes para la toxicidad de las proteínas de 6. t. como unión a las proteínas receptoras y respuestas citotóxicas; así mismo, se han empleado vesículas obtenidas a partir de las microvellosidades de las células epiteliales del intestino del insecto, que corresponden a las membranas plasmáticas de las microvellosidades del lumen conocidas como BBMV, para estudios electro y quimicofísicos como transporte de iones y unión de las toxinas a las proteínas receptoras (Schwab y Culver 1990).
A pesar de que existen algunos inconvenientes en el uso de modelos in vitro, relacionados con modificaciones de las condiciones reales en las que actúan las 8 endotoxinas de Bt, dichas metodologías son herramientas importantes para un acercamiento al mecanismo de acción de tales proteínas, y específicamente el uso de las BBMV, se ha constituido en una de las técnicas más empleadas para estudios de unión toxina-receptor (Schnepf et ai. 1998).
En Colombia existe un número importante de plagas agrícolas del orden Coleóptera de impacto económico (Vélez 1997). Dentro de éstas, el gusano blanco de la papa Premnotrypes vorax Hustache, es una de las dos plagas más limitantes para este cultivo en el país. Dicho insecto ha permanecido como plaga principal de la papa desde hace más de 50 años cuando apareció en el departamento de Nariño y puede causar pérdidas en la producción de papa hasta de un 90% (Vélez 1997). Se encuentra distribuido en las principales zonas productoras de papa de los departamentos de Cundinamarca, Boyacá, Cauca, Caldas y Antioquia y su control se realiza empleando principalmente insecticidas altamente tóxicos (Rivera y Pinto 2001).
En Colombia se hace necesario realizar investigaciones que permitan desarrollar estrategias que se articulen en sistemas de manejo integrado para el control de esta plaga, minimizando el empleo de productos químicos que generan riesgo para la salud de productores y consumidores, teniendo en cuenta que este tubérculo es uno de los productos de mayor consumo en el país (Pinzón 1993). La implementación de estrategias de control biológico de plagas, como los entomopatógenos tipo B, thuringiensis, implica la realización de investigaciones básicas respecto de su mecanismo de acción para determinar la potencialidad de su empleo. Para el caso del gusano blanco de la papa esto también es válido.
De acuerdo con lo anterior el presente trabajo tuvo como objetivo determinar, mediante una metodología de ensayo in vitro, si existía unión de proteínas Cry de B. thuringiensis, referenciadas como tóxicas para coleópteros, con vesículas del tracto digestivo del gusano blanco de la papa para determinar de forma preliminar el potencial de algunas de estas proteínas para ser utilizadas en el desarrollo futuro de productos tecnológicos que puedan constituirse en nuevas herramientas dentro de un programa de manejo integrado del gusano blanco de la papa en Colombia.
Materiales y Métodos
Purificación de proteínas Cry
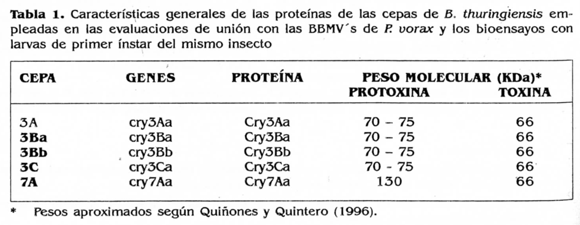
Las proteínas Cry evaluadas se obtuvieron de cepas patrón de B. thuringiensis del Instituto de Biotecnología de la Universidad nacional de Colombia. Las características de las proteínas de las cepas evaluadas se presentan en la tabla 1.
Las cepas se cultivaron en medio agar Luria Bertani a 37°C por 10-15 días, hasta alcanzar un porcentaje de esporulación superior al 90%. La biomasa se recolectó y lavó con agua destilada-desionizada estéril y subsecuentes centrifugaciones a 4°C, 8.000 rpm por 10 minutos para eliminar residuos del medio de cultivo. El material obtenido fue posteriormente liofllizado durante 12 h y almacenado hasta su uso.
Se realizó purificación de las proteínas mediante solubilización de los cristales en solución buffer de carbonato de sodio pHIO (Na2CO3 100 mN, PMFS 100 mN, DTT 2 mN, EDTA 1 mN) por 2 h a 37°C, centrifugación a 10.000 rpm por 15 minutos y nitrado del sobrenadante con membrana de 0,22 mN. Se hizo análisis microscópico para corroborar la ausencia de esporas en las muestras.
El fragmento tóxico de las proteínas fue obtenido con procesamiento de las mismas por la enzima Tripsina (Tipo II de páncreas porcino), mediante la observación previa de la cinética del procesamiento para cada una de ellas, la cual se realizó con exposiciones continuas y a diferentes tiempos de las proteínas a la enzima (Bollag y Edelstein 1991). Se empleó una proporción enzima: protoxina que osciló entre 2:1 y 10:1 con incubación por 12 h a 37°C. Se corroboró el procesamiento de las proteínas mediante electroforesis en gel de poliacrilamida (SDS-PAQE). La toxina en forma soluble fue dializada posteriormente en buffer borato pH 8,6 durante una noche.
Marcaje de toxinasLas toxinas de B. thuringiensis a evaluar fueron marcadas siguiendo el protocolo de Denolf et ai. (1993a), con algunas modificaciones. Se realizó mareaje de las toxinas con biotina empleando un kit para mareaje de proteínas (ECL Protein Biotinilation Module, Amersham). El mareaje se realizó en proporción de 20 µl de biotina por cada 0,6 mg/ml de toxina. Se agitó la mezcla y se dejó en incubación a temperatura ambiente por 1 hora. Se realizó filtrado en columna Sephadex Q25 eluyendo la muestra con solución buffer de fosfatos pH 7,4 y recolectando alícuotas de 500 µl. Se comprobó el mareaje de la toxina mediante una prueba de dot-blot, empleando conjugado de Streptavidina-peroxidasa y revelando con solución de diaminobencidina. Así mismo se corroboró la integridad de la proteína durante el mareaje, mediante SDS-PAQE al 9%.
Purificación de vesículas
La preparación de las vesículas de las microvellosidades de células epiteliales del tracto digestivo de P. vorax (BBMVs) se realizó con la metodología estandarizada por Martínez y Cerón (2003) quienes tomaron como base las metodologías desarrolladas por Wolfersberger et al. (1987) y Macintosh et al. (1994).
El método de purificación se inicia con el macerado de 300 larvas de último instar del insecto en solución buffer MET pH 7,5 (Manitol 300 mN, Tris 17 mN, EGTA 5 mN, DTT 2 mN, PMFS 0.5 mN, Hepes 10 mN, EDTA 1 mN, SBT y neomicina sulfato 1 µg/ml); el material obtenido se centrifuga a 3.500 rpm por 15 minutos y se filtra. Se adiciona solución buffer MET y se homogeniza a 2.000 rpm empleando un macerador de tejidos (Potter-Elvehjem Wheaton). El homogenizado se mezcla con MgCI2 24 mN y se deja en hielo 15 minutos. Se realiza una centrifugación a 4.500 rpm por 15 minutos y el sobrenadante se centrifuga a 16.000 rpm por 30 minutos. La pastilla obtenida se suspende en buffer MET y se repite el proceso descrito una vez más. La pastilla obtenida se suspende en buffer MET, se cuantifica la proteína total presente empleando el método de Bradford (Bollag y Edelstein 1991) y se determina la presencia de las vesículas en el purificado mediante SDS-PAGE en gel al 9% y microscopía electrónica de transmisión. El material restante se almacena en nevera a -70°C.
Ensayos de unión proteínas-vesículas
La unión de la toxina con las BBMV del insecto se evaluó mediante la metodología de Denolf eí al (1993a), modificada. Se descongeló lentamente una alícuota de vesículas y se centrifugó a 13.000 rpm por 40 minutos. La pastilla se resuspendió en buffer PBS con BSA al 0,1%. Las vesículas se mezclaron con una cantidad adecuada de toxina marcada y se incubó por 1 h a temperatura ambiente. Se realizó centrifugación a 13.000 rpm por 40 minutos y se lavó el pellet con el buffer ya descrito. Se centrifugó nuevamente y se resuspendió la pastilla en buffer de carga para realizar posteriormente una electroforesis. Una vez separadas las proteínas se procedió a su transferencia a membrana de nitrocelulosa e incubación de la misma toda la noche en solución buffer de bloqueo pH 7,5 (Acido maleico 100 mN, NaCl 150 mN, reactivo de bloqueo 1%). Los geles obtenidos en la electroforesis se colorearon con azul de Coomasie para corroborar el proceso de transferencia. La membrana bloqueada se lavó, se incubó por 1 h con el conjugado de streptavidina-peroxidasa 1:1000 en PBS y se reveló con diaminobencidina. Cada ensayo se realizó por triplicado para corroborar los resultados obtenidos. Se emplearon como muestras control, la toxina marcada sola y las vesículas solas procesadas de .la misma forma que las muestras problema. En todos los ensayos de unión de vesículas con proteínas biotiniladas se empleó una concentración de purificado de vesículas de 1 mg/ml.
Análisis de proteínas por blotting
Las proteínas de Bt, que presentaron unión a las vesículas de P. vorax en los ensayos iniciales se analizaron con la técnica de blotting (Aranda et al. 1996), con el fin de identificar posibles proteínas receptoras de proteínas Cry presentes en purificado de BBMV.
Las proteínas del purificado de BBMV se separaron mediante electroforesis en gel de poliacrilamida al 9%. Se realizó transferencia de las proteínas a membrana de nitrocelulosa durante 30 min a 20 V. La membrana obtenida se incubó toda la noche en solución buffer TBS (Tris HC1 10 mN, NaCl 150 mN, pH 7,6) y luego se bloquearon los sitios de unión no específica incubándola en buffer TBS + tween 20 0,5% + BSA 3%. Posteriormente, se incubó la membrana por 3 h con la proteína marcada y luego se realizó el revelado incubando inicialmente con el conjugado streptavidina peroxidasa y luego con diaminobencidina en buffer TBS.
Bioensayos
Los bioensayos se realizaron empleando cubos de tubérculos de papa de 0,25 cm3, a los cuales se les aplicaron superficialmente las proteínas de B. thuringiensis ya fueran suspendidas o solubilizadas (Martínez y Cerón 2002). Los cubos de papa se dejaron secar al ambiente y posteriormente se colocaron en placas para cultivo de células de 24 pozos, poniendo un cubo por pozo. Se infestó cada cubo de papa con una larva de primer instar de P. vorax, obtenidas de una colonia del insecto mantenida en condiciones de laboratorio (18°C en promedio). Las placas se sellaron, taparon y se almacenaron por 7 días hasta la lectura del ensayo. En los bioensayos se empleó la proteína en forma suspendida (cristales), soluble y procesada enzimáticamente, para observar si existía algún efecto del procesamiento sobre la toxicidad de la misma (García et al. 2000; Koller eí al.; 1992; Lambert et a/.1992). Las proteínas empleadas en forma soluble fueron solubilizadas en dos condiciones diferentes, acida (pH 4,1) y alcalina (pH 10,0). Para la solubilización a pH 4,1 se empleó una solución buffer universal. Para la solubilización a pH alcalino se empleó una solución buffer de carbonato de sodio. La solubilización se llevó a cabo para ambos tipos de buffer a 37°C, durante 3 h en agitación constante. Una vez solubilizado el material, se centrifugó a 10.000 rpm durante 15 min. El sobrenadante obtenido, que corresponde a la proteína soluble, se dividió en alícuotas y se almacenó a 0°C.
En los bioensayos se empleó una dosis de 10 µg de proteína/cm2 de dieta. Se utilizó en los ensayos con proteína suspendida un testigo absoluto con el agua destilada empleada en los tratamientos y en los bioensayos con proteína solubilizada testigos relativos con las soluciones buffer empleadas en la solubilización de las proteínas.
El diseño experimental utilizado en todos los bioensayos fue completamente al azar (Martínez y Martínez 1997) con tres repeticiones por tratamiento, empleando 24 larvas por repetición. Los ensayos se hicieron por triplicado en días diferentes. La variable respuesta fue el número de larvas muertas por tratamiento.
Resultadosy Discusión
Unión vesículas-proteínas
El mecanismo de acción de B.thuringiensis conlleva varios pasos entre los cuales la unión proteína receptor se considera como uno de los más cruciales para que se ejerza el efecto tóxico sobre un insecto blanco determinado. La unión de proteínas de B. t. se presenta de manera general con proteínas receptoras presentes en purificados de BBMVs del tracto digestivo de diferentes insectos, como ha sido ampliamente registrado en la literatura internacional (Hofmann et al. 1988; Van Rie et al. 1989, 1990; Estada y Ferre 1994; Bravo et al. 1992a,b; Denolf et al. 1993b; Sakai et al. 2000).
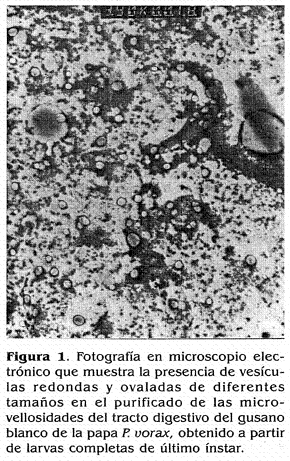
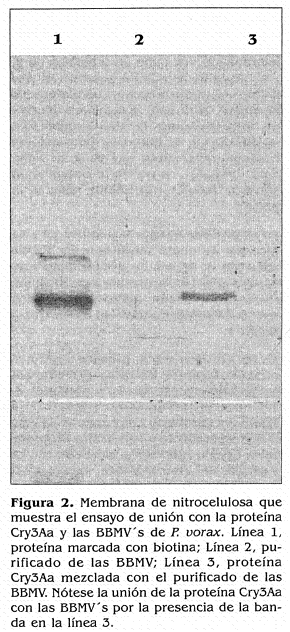
En el presente trabajo se empleó, para las pruebas de unión, purificado de BBMVs obtenido de larvas de gusano blanco de la papa en el cual la presencia de BBMVs se corroboró mediante microscopía electrónica de transmisión como se observa en la figura 1.
En los ensayos con la proteína Cry3Aa se observó la unión de dicha proteína con las proteínas presentes en el purificado de vesículas de P. vorax. Como se aprecia en la figura 2 se presentó una banda en la línea 3 correspondiente a la muestra de la proteína Cry3Aa biotinilada mezclada con las vesículas del insecto blanco, lo cual indicó que hubo unión entre éstas. Así mismo, se observó la presencia de las bandas esperadas en la línea 1 que contiene la muestra de proteína marcada sola y la no presencia de bandas en la línea 2 que contiene sólo muestra de BBMV. Estas dos últimas muestras mencionadas se emplearon como controles positivo y negativo, respectivamente.
En ensayos similares a los desarrollados en el presente trabajo, García eí al. (2000), empleando la proteína Cry3A y vesículas de Leptinotarsa decemlineata (Say) y Tenebrio molitor (Linné) observaron una unión específica de dicha proteína con las proteínas receptoras del tracto digestivo de ambos insectos en forma similar a la unión observada con las vesículas de P. vorax. De igual forma también se ha detectado unión de la proteína CrySAa marcada con yodo radiactivo con vesículas de Diabrotica undecimpunctata howardi Barber (Slaney et al. 1992).
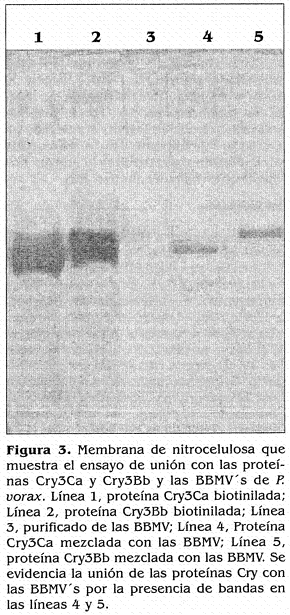
Las proteínas Cry3Bb y Cry3Ca, en forma similar a la proteína Cry3Aa, se unieron a las proteínas de las vesículas de P. vorax (Fig. 3, líneas 4 y 5). Igualmente se observaron las bandas correspondientes a las proteínas solas biotiniladas, en las líneas 1 y 2. Do se vieron bandas en la línea 3 correspondiente a la muestra de purificado de vesículas.
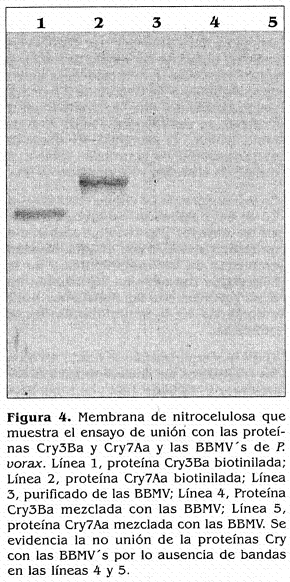
En el caso de las proteínas Cry3Ba y Cry7Aa no se evidenció unión a las vesículas de P. vorax (Fig. 4), Se observaron las bandas de las dos proteínas marcadas Cry3Ba y Cry7Aa (líneas 1 y 2, respectivamente), no se vieron bandas en la línea 3 correspondiente a las vesículas solas, como se esperaba. Por otro lado, tampoco se detectaron bandas en las líneas 4 y 5, correspondientes a las vesículas mezcladas con las proteínas CrySBa y Cry7Aa, respectivamente.
En la literatura no se mencionan ensayos de unión de las proteínas Cry3Ba, Cry3Bb, Cry3Ca o Cry7Aa a vesículas de insectos, por lo tanto los resultados obtenidos son el primer registro que explora la unión de dichas proteínas con el intestino de un insecto del orden Coleóptera. De acuerdo con esto se hacen relevantes los dos tipos de comportamientos de unión observados entre las vesículas de P. vorax y las proteínas Cry evaluadas; por un lado, la unión con las proteínas Cry3Aa, 3Bb y Cry3Ca y por otro lado, la no unión con las proteínas Cry3Ba y Cry7Aa.
Los dos comportamientos mencionados pueden deberse a una conformación distinta de la estructura de las proteínas, específicamente dominios II y III, involucrados en el reconocimiento y unión a los receptores del intestino de los insectos, que las hace expresar diferente afinidad a las vesículas de P. vorax. Vale la pena resaltar los comportamientos de unión de las proteínas Cry3Ba y Cry3Bb, que aunque son proteínas con una alta homología según el esquema de clasificación actual, presentan diferente afinidad por las vesículas del insecto blanco, lo cual concuerda con la alta especificidad de las proteínas de B. t. por un insecto blanco dado.
En vista de los diferentes comportamientos de unión de las proteínas, se seleccionaron las proteínas Cry3Aa, Cry3Bb y Cry3Ca para el análisis por blotting, las cuales fueron las únicas que se unieron al purificado de las BBMV de P.vorax.
Análisis de proteínas por blotting
Las proteínas CrySAa, CrySBb y CrySCa que presentaron unión con las vesículas de P. vorax, se sometieron a análisis por blotting. Los resultados obtenidos en dicho análisis se observan en la figura 5 en donde las líneas 1, 2 y 3 corresponden a las proteínas Cry3Aa, Cry3Bb y CrySCa, respectivamente.
Las tres proteínas evaluadas presentaron un patrón similar de unión a las proteínas del purificado de BBMV del insecto blanco; sin embargo, se observó que las tres proteínas se unieron en mayor proporción a dos proteínas de aproximadamente 97 y 70 KDa. De acuerdo con esto, dichas proteínas pueden constituirse en dos posibles proteínas receptoras de las proteínas Cry mencionadas. En la literatura no son muchos los registros de proteínas receptoras en insectos. Empleando la misma metodología de análisis de proteínas por blotting, Qarczynski et al. (1991) identificaron en BBMV de Manduca sexta (Linné) una proteína de 120 KDa, que posteriormente se identificó como un posible receptor para la proteína CrylAc (Chambers et al. 2000) y una proteína de 210 KDa como receptora de la proteína CrylAb. Para la proteína CrylAc en Spodoptera fhigiperda J.E. Smith ellos encontraron una posible proteína receptora de 148 KDa y en Heliothis virescens (Fabricius) y Heliothis zea (Boddie) encontraron varias posibles proteínas receptoras de 155, 120, 103, 90 y 63 KDa. Así mismo se han descrito proteínas receptoras con función aminopeptidasa en íí. virescens, Limantria dispar (Linné) y Plutella xylostella (Linné) (Aranda 1996).
En insectos del orden Coleóptera, Belfiore et al. (1994) registraron por primera vez una proteína receptora de 144 KDa, presente en el intestino de T.molitor, a la cual se une la proteína Cry3A.
De acuerdo con lo anterior, el presente sería el primer registro que se hace de posibles proteínas receptoras de las proteínas Cry3Aa, Cry3Bb y Cry3Ca de Bt en el intestino de P. vorax, las cuales merecerían una caracterización posterior más detallada.
Bioensayos
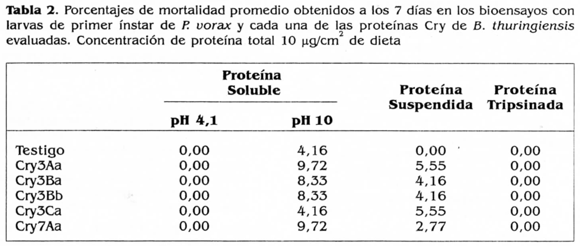
Analizando la actividad tóxica obtenida con las proteínas evaluadas y las características de unión a las vesículas del insecto blanco, se observó un aspecto interesante: aunque las proteínas Cry3Aa, Cry3Bb y Cry3Ca se unieron a las vesículas de P. vorax, estas proteínas no presentaron efecto tóxico sobre las larvas de primer instar empleadas en los bioensayos (Tabla 2). Los resultados obtenidos concuerdan con lo señalado por Slaney eí ai. (1992), quienes encontraron una actividad tóxica baja (9% mortalidad) de la proteína Cry3Aa en larvas de D. undecimpunctata a pesar de que observaron unión de dicha proteína con las BBMV de este insecto. Ellos atribuyen este comportamiento a una afinidad reducida de la proteína por los sitios de unión en la membrana intestinal del insecto y a un cambio muy leve en la permeabilidad de la misma. Lo anterior puede también ser válido para explicar la poca actividad tóxica de las proteínas Cry3Aa y Cry3Ca obtenidas en los bioensayos con P. vorax, aunque se trate de un insecto diferente.
Por lo tanto, los resultados obtenidos muestran que, independientemente de su comportamiento de unión, ninguna de las proteínas evaluadas tuvo un efecto tóxico marcado sobre larvas de primer instar de P. vorax. Estos resultados concuerdan con el planteamiento que a pesar que el proceso de unión entre las proteínas y los receptores se dé, la capacidad de causar la muerte del insecto estará determinada por una unión específica saturable y la consiguiente inserción de la toxina en la membrana intestinal del insecto para la formación del poro (Aranda eí ai. 1996). Lo anterior permitiría plantear que la unión establecida entre las proteínas Cry evaluadas y las proteínas receptoras del purificado de las BBMV fue de carácter no específico y reversible, lo cual no permitió que se realizara la inserción del dominio I en la membrana intestinal de P. vorax y la consiguiente formación del poro.
Otra posible explicación para los resultados observados radicaría en que a pesar de que hubo unión entre las proteínas tóxicas Cry3Aa, Cry3Bb y CrySCa y los receptores del intestino de P. vorax, en condiciones in uitro, otros factores como la presencia de proteasas en el intestino de los insectos capaces de degradar las proteínas Cry haciéndolas no tóxicas, estarían influyendo en la inactividad de dichas proteínas en los ensayos in vivo. Este fenómeno fue descrito por Losevaa et al. (2001) quienes realizaron un estudio del efecto de los cambios en la actividad de proteasas en el intestino del escarabajo de la papa Leptinotarsa decemlineata sobre la proteína Cry3Aa y hallaron que la resistencia de este insecto a dicha proteína se correlacionaba con alteraciones especificas en la actividad de proteasas en el tracto digestivo y una reducción en la unión de las toxinas.
Por otro lado, de acuerdo con ensayos sobre formación de poro con la proteína Cry3Aa en membranas de coleópteros, los cuales han determinado que el pH y la activación de la toxina tienen un papel crítico en este fenómeno (García et al. 2000) y después de haber realizado bioensayos con las proteínas Cry en diferentes presentaciones (suspendidas, solubles y tripsinadas) sin obtener actividades tóxicas significativas, se elimina la posibilidad que este tipo de factores hubieran podido interferir en la toxicidad de las mismas.
Conclusiones
• Las proteínas de B. thitringiensis Cry3Ba y Cry7Aa no presentaron actividad tóxica hacia larvas de primer instar de P.vorax, esto se debió a que el insecto no tiene en su epitelio intestinal proteínas receptoras para dichas proteínas Cry.
• Las proteínas de B. thuringiensis Cry3Aa, Cry3Bb y Cry3Ca no mostraron actividad tóxica hacia larvas de primer instar de P. vorax, a pesar de que se observó la existencia de proteínas receptoras para ellas en el purificado de las BBMV del insecto. Esto es atribuible a dos factores: unión vesículas-proteínas de carácter reversible, sin lograrse la internalización de la toxina en la membrana epitelial del tracto digestivo del insecto o presencia de proteasas en el tracto digestivo de P vorax que degradan las toxinas haciéndolas inactivas.
• La evaluación de las proteínas de B. thuringiensis por blotting permitió identificar dos posibles proteínas receptoras para las proteínas Cry3Aa, Cry3Bb y Cry3Ca en las células epiteliales del intestino de P. vorax, siendo este el primer registro que se hace para un insecto coleóptero endémico de la región andina.
• Las proteínas Cry de Bt evaluadas por no tener una alta actividad tóxica hacia el gusano blanco de la pepa presentan poco potencial para ser empleadas en el control de este insecto plaga; por lo tanto, se hace necesaria la búsqueda de otras cepas que contengan proteínas diferentes para su evaluación.
Literatura citada
ARANDA, E. 1996. Análisis de las interacciones in vitro e in vivo de las d-endotoxinas de Bacillus thuringiensis con el epitelio intestinal de diferentes insectos plaga. Tesis de grado Ph. D. en Biotecnología. Universidad Autónoma del Estado de Morelos, Cuernavaca, México. 100 p. [ Links ]
ARANDA, E.; SÁNCHEZ, J.; PEFEROEN, M.; GÜERECA, L.; BRAVO, A. 1996. Interactions of Bacilius thiiringiensis crystal proteins with trie midgut epithelial cells of Spodoptera frugiperda (Lepidoptera: Moctuidae). Journal of Invertebrate Pathology 68: 203-212. [ Links ]
BELFIORE C. J.; VADLAMUDI R. R.; OSMAM Y. A.; BULLA L. E. 1994. A specific binding protein from Tenebrio molitor (L.) for trie insecticidal toxin of Bactllus thuringiensis subsp. tenebrionis. Biochemical and Biophysical Research Communications 200 (1): 359-364. [ Links ]
BOLLAG, D.; EDELSTEIN, S. 1991. Protein methods. Wiley and Sons Inc. New York, 250 p. [ Links ]
BRAVO, A.; HENDRICKX, R.; JANSENS, S.; PEFEROEN, M. 1992a. Immunocytochemical analysis of specific binding of Bacillus thuringiensis insecticidal crystal proteins to lepidopteran and coleopteran midgut membranes. Journal of Invertebrate Pathology 60: 247-253. [ Links ]
BRAVO, A.; JANSENS, S.; PEFEROEN, M. 1992b. Immunocytochemical localization of Bacillus thuringiensis insecticidal crystal proteins in intoxicated insects. Journal of Invertebrate Pathology 60: 237-246. [ Links ]
CHAMBERS, C.; CARROLL, J.; ELLAR, D. 2000. Characterization of the CrylAc-binding carbohydrate epitopes on Manduca sexta 120 RDa aminopeptidase. Resúmenes. XXXIII Meeting Society for invertebrate pathology. p. 33. Guanajuato, México. [ Links ]
DENOLF, R; JANSENS, S.; VAN HOUDT, S.; PEFEROEN, M.; DEGHEELE, D.; VAN RÍE, J. 1993a. Biotinylation of Bacillus thuringiensis insecticidal crystal proteins. Applied and Environmental Microblology 59 (6): 1821-1827. [ Links ]
DENOLF, E; JANSEN, S.; PEFEROEN, M.; DEGHEELE, D.; VAN RÍE, J. 1993b. TWo different Bacillus thuringiensis deltaendotoxins receptors in the midgut brush border membrane of the european corn borer Ostrinia nubilalis (Hübner) (Lepidoptera: Pyralidae). Applied and Environmental Microbiology 59 (6): 1828-1837. [ Links ]
ESTADA, U.; FERRE, J. 1994. Binding of insecticidal crystal proteins of Bacillus thuringiensis to the midgut brush border of the Cabbage Looper Trichoplusia ni (Hübner) (Lepidoptera: Moctuidae) and selection for resistance to one of the crystal proteins. Applied and Environmental Microbiology 60 (10): 3840-3846. [ Links ]
GARCÍA, I.; SÁNCHEZ, J.; RAUSELL, C.; MARTÍNEZ, A.; DE MAAG, R.; REAL. M.; BRAVO, A. 2000. Specific binding and pore formation activity of Cry3A toxin in membranes isolated from Leptinotarsa decemlineata and Tenebrio molitor. Resúmenes XXXIII Meeting Society for Invertebrate Pathology. p. 33. Guanajuato, México. [ Links ]
GARCZYNSKI, S.; CRIM J.; ADANG, M. 1991. Identification of putative insect brush border membrane binding molecules specific to Bacillus thuringiensis deltaendotoxin by protein blot analysis. Applied and Environmental Microblology 57 (10): 2816-2820. [ Links ]
HOFMANN, C.; VANDERBRUGGEN, H.; HÖFTE, H.; VAN RÍE, J.; JANSENS, S.; VAN MELLAERT, H. 1988. SpecificityofBacií/usíhuringiensis delta-endotoxin is correlated with the presence of high affmity binding sites in the brush border membrane of target insect midguts. Procceedings of the National Academy of Sciences. USA. 85: 7844-7848. [ Links ]
KELLER, B.; LANGENBRUNCH, G. 1993. Control of coleopteran pests by Bacillus thuringiensis. p. 171-191. En: Johnson, H. (ed.). Bacillus thuringiensis An environmental biopesticide: Theory and Practice. Wiley and Sons publishers. London. England. 305 p. [ Links ]
KOLLER.C.; BAUER, L.; HOLLINGWORTH, R. 1992. Characterization of the pH-medlated solubility of Bacillus thuringiensis var. san diego native delta-endotoxin crystals. Biochemical and biophysical research Communications 84 (2): 692-699. [ Links ]
LAMBERT, B.; HOFTE, H.; ANNYS, R.; JANSEN, S.; SOETAERT, J.; PEFEROEN, M. 1992. Novel B. thuringiensis insecticidal crystal protein with a silent activity against coleopteran larvae. Applied and environmental Microbiology 58 (8): 2536-2542. [ Links ]
LECUONA, R. 1996. Control microbiano, utopia o realidad, p. 13-15. En: Lecuona, R. (ed.). Microorganismos patógenos empleados en el control microbiano de insectos plaga. Mariano Mas. Buenos Aires. Argentina. 338 p. [ Links ]
LOSEVAA. O.; IBRAHIM, M.; CANDASA, M.; KOLLERB, N.; BAUERB, L.; BULLA, L. 2001. Changes in protease activity and Cry3Aa toxin binding in the colorado potato beetle: implications for insect resistance to Bacillus thuringiensis toxins. Insect Biochemical and Molecular Blology 32 (5): 567-577. [ Links ]
MACINTOSH, S.; LIDSTER, B.; KIRKHAM, L. 1994. Isolatlon of brush border membrane veslcles from whole dlamonback moth (Lepidoptera: Plutellidae) larvae. Journal of Invertebrate Pathology 63: 97-98. [ Links ]
MACPEARSON, S.; PERLAR, F.; FUCHS, R.; MARRONE, R; LAVRIR, R; FISCHHOFF, D. 1988. Characterization of the coleopteran specific protein gene of Bacillus thuringiensis Var. tenebrionis. Biotechnology 6 (1): 61-66. [ Links ]
MARTÍNEZ, W.; CERÓN, J. 2002. Evaluación de la toxicidad de proteínas de Bacillus thuringiensis Berliner hacia el gusano blanco de la papa Premnotrypes vorax Hustache. Agronomía Colombiana 19 (1-2): 89-95. [ Links ]
MARTÍNEZ, W.; CERÓN; J. 2003. Obtención de vesículas de las microvellosidades del epitelio intestinal del gusano blanco de la papa Premnotrypes vorax. Revista Colombiana de Biotecnología IV (2): 33-37. [ Links ]
MARTÍNEZ, R.; MARTÍNEZ, N. 1997. Diseño de experimentos: Análisis de datos estándar y no estándar. Editora Guadalupe Ltda. Bogotá, Colombia. 479 p. [ Links ]
ORR, D.; CHARLES, P. 1998. Parasitoid and predators. p. 3-34. En: Rechcigl, J. (ed.) Biological and biotechnological control of insect pests. CRC Press. Boca Ratón, Florida. 375 p. [ Links ]
PINZÓN, M. A. 1993. Calendario de siembras, recolección y proceso de comercialización de la papa en Colombia. IICA Colombia. Bogotá. 80 p. [ Links ]
QUIÑONES, L.; QUINTERO, R. 1996. Mecanismo molecular de acción de las deltaendotoxinas de Bacillus thuringiensis . P. 63-112. En: Galán, L. (ed.). Avances recientes en la biotecnología de Bacillus thuringiensis. Universidad Autónoma de Nuevo León. Monterrey, México. 350 p. [ Links ]
RIVERA, G.; PINTO, L. 2001. Evaluación de patogenicidad de aislamientos nativos de hongos entomopatógenos sobre el gusano blanco de la papa Premnotrypes vorax Hustache. Revista Colombiana de Biotecnología 3 (2): 53-65. [ Links ]
SCHNEPF, E.; CRICKMORE, N.; VANRIE, J.; LERECLUS, D.; BAUM, J.; FEITELSON, J.; ZEIGLER D.; DEAN, D. 1998. Bacittus thuringiensis and its pesticidal crystal proteins. Microbiology and Molecular Biology Reviews 62: 775-805. [ Links ]
SCHWAB, G.; CULVER, R 1990. In vitro analysis of Bacillus thuringiensis delta-endotoxin action. p. 36-45. En: Hickle, L. (ed.). Analytical chemistry of Baciiius thuringiensis. American Chemical Soclety. Washington. USA. 306 p. [ Links ]
SARAI, H.; OTAKE, R.; ESAKI, M.; ROMANO, T.; YAMAGIWA, M. 2000. Binding of ICP to the BBMV's and midgut epithella of Culex pipieos and Bombyx morí larvae. Resúmenes. XXXIII Meeting Society of Invertebrate Pathology. p 85. Guanajuato, México. [ Links ]
SLANEY, A.; ROBBINS, H.; LEIGH, E. 1992. Mode of action of Bacillus thuringiensis toxin Cry IIIA: An analysis of toxicity in Leptinotarsa decemtineata (Say) and Diabrotica undecimpunctata Howardi Barben Insecticidal Biochemical Molecules 22 (1): 9-18. [ Links ]
VAN FRANRENHUYZEN, R. 1993. The challenge of Bacillus thuringiensis. p 1-35. En: Johnson, H. (ed.). Bacillus thuringiensis An environmental biopesticide: Theory and Practice. Wlley and Sons publishers. London. England. 305 p. [ Links ]
VAN RIE, J.; JAMSEN, S.; HOFTE, H.; DEGHEELE, D.; VAN MELLAERT, H. 1989. Specificity of Bacillus thuringiensis delta-endotoxins. Importance of specific receptors on the brush border membrane of the midgut of target insects. European Journal of Biochemlstry 186: 239-247. [ Links ]
VAN RIE, J.; JANSEN, S.; HOFTE, H.; DEGHEELE, D.; VAN MELLAERT, H. 1990. Receptors on the brush border membrane of the insect midgut as determinants of the especificity of Baciiius thuringiensis delta-endotoxins. Applied and Environmental Microbiology 56 (5): 1378-1385. [ Links ]
VÉLEZ, R. 1997. Plagas agrícolas de impacto económico en Colombia : bionomía y manejo integrado. Editorial Universidad de Antioquia. Medellín, Colombia. 482 p. [ Links ]
WOLFERSBERGER, M.; LUTHY, R; MAURER, A.; PARENTI, R; SACCHI, V.; GIORDANA, B.; HANOZET, O. 1987. Preparation and partial Characterization of amino acid transporting BBMV's from the larval midgut of the cabbage butterfly. Compendium of Biochemical Physiology 86: 301-308. [ Links ]
Recibido: Mar. O4 / 2003 • Aceptado: May 30/2003