Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.30 no.1 Bogotá Jan./June 2004
Efecto de las condiciones de cultivo sobre la actividad enzimática de Serratia marcescens contra Tecia solanivora (Lepidoptera: Gelechiidae)
Effect of culture conditions on the enzymatic activity of Serratia marcescens against Tecia solanivora (Lepidoptera: Qelechiidae)
CARLOS FELIPE BOSA O.1; ALBA MARINA COTES P.2
1 Autor para correspondencia: B. Se. M. Se. Investigador del Laboratorio de Control Biológico del Programa nacional de Manejo Integrado de Plagas MIP Corpoica - Tibaitatá. Teléfono: 4227300. Km 14 vía Mosquera. E-mail: Carlosfelipeb@yahoo.es
2 Ph. D. ritopatología. Investigadora principal. Laboratorio de Control Biológico. CORPOICA. C. I. Tibaitatá. E-mail: acotes@corpoica.org.co
Resumen. Se evaluó la actividad enzimática de extractos de Serratia marcescens, previamente sometida o no a pases sucesivos en larvas de Teda solanivora Povolny y a crecimientos continuos sobre medios suplementados o no, con los sustratos potenciales inductores de virulencia (salvado de trigo y homogeneizado de larvas del insecto). Con la biomasa de la bacteria producida en estos medios, se prepararon extractos enzimáticos a los cuales se les determinó la actividad de las enzimas N-acetilglucosaminidasa, quimoelastasa proteasa PR-1 y (β-esterasa. Para ello, la bacteria fue sometida a cinco cultivos sucesivos en estos medios y en cada cultivo se evaluaron las actividades mencionadas. Se determinó que los crecimientos sucesivos de la bacteria sobre los medios suplementados con estos potenciales sustratos, afectaron las actividades enzimáticas de los extractos, incrementándose éstas con el tercer crecimiento sucesivo de S. marcescens en los medios suplementados con los sustratos inductores y siendo estas actividades ligeramente mayores cuando la bacteria creció en los medios suplementados con el homogeneizado de larvas del insecto.
Palabras clave: Bacterias entomopatogénicas. Serratia sp. Sustratos inductores. Enzimas.
Summary. The enzymatic activity of Serratia marcescens extracts was evaluated, previously inoculated or not on Ttecia solanivora Povolny larvae, and successively grown in culture media supplemented or not with potential virulence inductors (wheat bran and homogenised T. solanivora larvae). The bacteria biomass obtained from these media were used to prepar enzymatic extracts for which the activiry of the enzymes N-acetilglucosaminidase, quimoelastase protease PR-1 and ^-esterase were determined. The bacteria were grown up in five successive cultures on these media, and in each culture these activities were also evaluated. We determined that successive growth of the bacteria on culture media supplemented with these potential substratos affected the extract enzymatic activities, increasing with the third successive growing of S. marcescens in the supplemented culture media, these activities being slighty higher when the bacteria grew on media supplemented with homogenised insect larvae.
Key words: Entomopathogenic bacteria. Serratia sp. Inductor substrates. Enzymes.
Introducción
En la cutícula de los insectos existen componentes de origen bioquímico que pueden ser utilizados como fuente nutricional para los microorganismos entomopatógenos. Algunos estudios indican que puede existir una relación entre el aumento en la producción de enzimas extracelulares y el incremento en la virulencia de los entomopatógenos, cuando se utilizan medios de cultivo suplementados con estos específicos sustratos inductores (Flach e£ al. 1992; Sampson y Qooday 1998).
St Leger, en 1997, encontró que al adicionar a un medio de cultivo cutícula de larvas de Manduca sexta se obtuvieron las mayores producciones y actividades de enzimas proteolíticas para los hongos Verticillium lecanii, Beauveria bassiana y Metarhizium anisopliae. Así mismo, Qónzales et al. (1999) observaron un incremento en la patogenicidad de cuatro aislamientos de B. bassiana contra adultos de Hypothenemus nampei (Coleóptera: Scolytidae), cuando estos aislamientos se cultivaron continuamente en medios de cultivo suplementados con adultos de la broca del café. Sin embargo, son muy incipientes los estudios que relacionan los mecanismos enzimáticos de los microorganismos biocontroladores con su patogenicidad en insectos. Para el caso de las bacterias como las del género Serratia estos mecanismos no han sido completamente dilucidados (Núñez 1993). En bacterias como Baciltus thuríngiensis y Pseudomonas sp., la producción de enzimas como quitinasas y proteasas parece estar involucrada con el incremento de su virulencia hacia algunos insectos plaga (Flach et al. 1992).
De otra parte, algunas investigaciones indican que los crecimientos o cultivos continuos de los entomopatógenos sobre medios suplementados con sustratos inductores de virulencia, pueden incrementar su patogenicidad hacia los insectos plaga; sin embargo, también se ha demostrado que los continuos cultivos de estos microorganismos, conllevan a procesos de heterocariosis, que tienen como consecuencia la pérdida ó disminución de su virulencia, haciendo necesaria su reactivación periódica sobre los insectos susceptibles (Schaerffenberg 1964).
El conocimiento sobre la adecuada utilización de estos factores diferentes en el crecimiento y producción de los microorganismos entomopatógenos proporciona nuevas herramientas para el desarrollo de entomopatógenos mayormente biocontroladores de los insectos plaga, ya que se pueden desarrollar producciones más eficientes de estos microorganismos, en medios de cultivo suplementados con sustratos inductores adecuados y específicos, además de permitir la selección de los aislamientos más virulentos crecidos previamente sobre estos medios de cultivo suplementarios.
Con el fin de esclarecer y relacionar algunos de los mecanismos enzimáticos en la patogenicidad de bacterias entomopatógenas como las del género Serratia, el objetivo de la presente investigación consistió en evaluar el efecto que producen las inoculaciones sucesivas de la bacteria en larvas del insecto y sus crecimientos continuos en medios de cultivo suplementarios con sustratos inductores de virulencia, sobre las actividades enzimáticas de extractos de S. marcescens. La hipótesis planteada propone lo siguiente: ¿es posible incrementar o, por el contrario, disminuir las actividades enzimáticas de extractos de S. marcescens mediante la combinación de diferentes factores de cultivo, como sus inoculaciones en larva del insecto y sus crecimientos en medios suplementarios con sustratos potencialmente inductores?. En esta publicación se presentan los resultados obtenidos en la determinación de la actividad enzimática de extractos de la bacteria; posteriormente, en otra publicación se presentarán y se relacionarán los resultados obtenidos de la actividad enzimática con la actividad biocontroladora de la bacteria hacia larvas de T. soianiuora.
Esta investigación se llevó a cabo en el Laboratorio de Control Biológico del Programa nacional de Manejo Integrado de Plagas de Corpoica - Tibaitatá y fue ejecutada durante los años 1999 al 2001.
Materiales y Métodos
Aislamiento de bacterias potencialmente entomopatogénicas
A partir de tres muestras de suelo, provenientes de tres zonas geográficas localizadas en el departamento del Amazonas (Colombia), se pesó 1 g de suelo por muestra y se adicionó a un erlenmeyer de 250 mi de capacidad, el cual contenía 100 mi de agua destilada estéril (dilución 1Q-2) y se agitó a 100 rpm durante 30 minutos. Al cabo de este tiempo, se realizaron diluciones seriadas hasta 10-4 en agua destilada estéril, las cuales se sembraron en cajas de Petri que contenían un medio sólido suplementario con quitina coloidal y se incubaron a 28°C durante 7 días. Las unidades formadoras de colonia (UfC), que produjeron un halo de degradación del medio, se repicaron y conservaron en viales con agar nutritivo, cubiertos con aceite mineral a 4°C.
Selección del microorganismo entornopatogénico de T. solanivora
Las bacterias que degradaron el medio de cultivo con quitina coloidal mencionadas anteriormente, un aislamiento de los hongos Paecilomyces fumoso-roseus (Wise) Brown 8c Smith, nomuraea rileyi (Farlow) Samson, Penicillium sp., Trichoderma koningii y Verticillium lecanii (Zimm.) Viegas, un aislamiento de las bacterias Pseudomonas fluorescens, Serratia marcescens, S. tíquefasciens y dos aislamientos de B. thuringiensis, obtenidos del Banco de Qermoplasma del laboratorio de Control Biológico de Corpoica-Tibaitatá (Regional 1), fueron utilizados para seleccionar el microorganismo con potencial actividad biocontroladora de larvas de T. solanivora.
Teniendo en cuenta el tipo de microorganismo evaluado, se procedió a realizar la suspensión madre de la siguiente manera: para la valoración de cada hongo, a partir de su crecimiento a 28°C durante 12 días en cajas de Petri en papa dextrosa agar (PDA), se realizó una suspensión de conidios en una solución de Tween 80 al 0,1%, la cual se ajustó finalmente a una concentración de 108 conidios/mi del hongo, evaluándose todos los aislamientos de los hongos a esta concentración.
En el caso de los aislamientos de B. thuringiensis, a partir de su crecimiento en agar L, durante 10 días a 28°C, se realizó una suspensión madre de cada bacteria en una solución lampón de fosfatos. Posteriormente, mediante densidad óptica en espectrofotómetro a 595 nanómetros, se cuantificó la proteína total de cada suspensión madre bacteriana por el método de Bradford (1976) y finalmente se ajustó a una concentración de 250 µg/ml de proteína total para cada aislamiento de B. thuringiensis, siguiendo el método descrito por Bosa (1996). En el caso de las otras bacterias, a partir de su crecimiento en caja de Petri con medio de cultivo agar nutritivo incubado durante 4 días a 28°C, se realizó una suspensión madre de cada bacteria en agua peptonada estéril al 0,1% pH 7,2 ± 0,2. Esta suspensión se ajustó a una concentración de 108 células/mi, mediante la utilización de una curva de calibración realizada previamente, en la que se relacionó la concentración de células (UFC) y la absorbancia leída en espectrofotómetro a 600 nm.
Para la realización de los ensayos biológicos con las suspensiones de estos microorganismos, se desinfectaron tubérculos de papa variedad pastusa; luego cada tubérculo se sumergió durante 5 minutos en la respectiva suspensión del microorganismo y se dejó secar en una cámara de flujo laminar. Una vez seco, cada tubérculo se colocó en un recipiente plástico que contenía en el fondo una capa de arena estéril de 1 cm de espesor y se infestó con 10 larvas de primer instar de T. solanivora procedentes de una cría del insecto mantenida bajo condiciones controladas. Los recipientes plásticos se taparon y se mantuvieron a 18 ± 2°Cy 70 ± 10% de humedad relativa.
El diseño experimental fue completamente aleatorizado, con 4 repeticiones por tratamiento (microorganismo). La unidad experimental consistió de 10 larvas del insecto por tubérculo, para un total de 40 larvas por tratamiento. Las evaluaciones de mortalidad en los tratamientos se realizaron a partir de los 30 días de iniciado el ensayo, donde se registraron, en forma periódica cada 5 días durante 15 días, el número de pupas presentes en cada unidad experimental y el número total de pupas por tratamiento. Los resultados obtenidos se sometieron a un análisis de varianza y una prueba de comparación de Tukey con un a de 0,05% de significancia.
El aislamiento que presentó la mayor actividad insecticida sobre las larvas de T. solanivora fue seleccionado para las posteriores evaluaciones de su actividad biocontroladora y para la determinación de su actividad enzimática a través del tiempo.
Nedio de cultivo suplementario con los potenciales inductores de virulencia para el crecimiento de S. marcescens
Para evaluar los sustratos potenciales inductores de virulencia, se utilizó un medio de cultivo básico cuya composición por litro fue Agar (15,0 g), K2HPO4 (7,0 g), KH2PO4 (3,0 g), (NH4)2 SO4 (1,0 g), MgSO4. 7H2O (0,1 g). A éste, se le adicionaron como potenciales inductores de virulencia, salvado de trigo comercial y homogeneizado de larvas de T. solanivora a una concentración del 2% P/V.
Salvado de trigo. El salvado de trigo comercial se sometió a un secado durante 24 horas en estufa con corriente de aire a 30°C; posteriormente, el sustrato seco se tamizó a través de una malla con un tamaño de poro de 100 µm.
Homogeneizado de larvas de T. solanivora. Este sustrato se obtuvo a partir de larvas sanas de segundo y tercer instar de T. solanivora, procedentes de la cría del insecto. Para ello se procedió a su deshidratación en una estufa con corriente de aire a 20°C, durante 72 horas. Una vez secas, las larvas se maceraron en un mortero de porcelana y posteriormente se tamizaron en una malla con un tamaño de poro de 100 µm.
Los medios con y sin potenciales inductores se esterilizaron durante 20 minutos y se sirvieron en cajas de Petri. Estos medios de cultivo sólido que contenían los potenciales inductores de virulencia, o sin la adición de éstos, se utilizaron posteriormente para el crecimiento de S. marcescens a 28°C durante 4 días. Los medios de cultivo sólido utilizados (tratamientos) fueron: el medio de agar nutritivo con sales (medio básico), el medio básico suplementario con salvado de trigo y el medio básico suplementario con larvas del insecto. La bacteria crecida en cada uno de estos medios, se utilizó posteriormente para la realización de los bioensayos tendientes a la evaluación de su actividad entomopatogénica y para la determinación de su actividad enzimática.
Evaluación de la actividad enzimática de S. marcescens cultivada en los diferentes medios
Durante cada cultivo sucesivo de S. marcescens y simultáneo a la evaluación de su actividad entomopatogénica, también se procedió a la determinación de la actividad enzimática de la bacteria producida en cada tratamiento.
Para la preparación de los extractos enzimáticos de células de S. marcescens, se tomaron 100 miligramos de células bacterianas de cada tratamiento y se suspendieron en 1 mi de solución buffer Tris-HCI (Trizma ®Base T-8524 Marca sigma) 0,1M pH 8,0 preparado en agua destilada desionizada estéril. Esta suspensión se agitó a 350 rpm a 8°C durante 60 minutos. Posteriormente, esta muestra se sometió a sonicación a 50 KHz durante 2 minutos, luego se centrifugó a 12.000 rpm y 8°C durante 15 minutos, se filtró y el extracto enzimático obtenido fue utilizado para la determinación de la actividad de las enzimas N-acetilglucosaminidasa, quimoelastasa proteasa PR-1 y β-esterasa.
Determinación de la actividad N-acetilglucosaminidasa
Para la determinación de la N-acetilglucosaminidasa se utilizaron los procedimientos descritos por St. Leger et al. (1986a). Inicialmente se elaboró una curva de calibración con p-nitrofenol preparado en un lampón de citrato de sodio (0,2M) a pH 5 y utilizando una longitud de onda de 400 nm. Los resultados obtenidos en las muestras biológicas fueron extrapolados en dicha curva estándar, obteniéndose de esta manera la actividad enzimática que se expresó en (imoles de p-nitrofenol por mg de células bacterianas.
Para la reacción colorimétrica de las muestras biológicas, a cada 0,2 mi de extracto enzimático, se le adicionó 1 mi de solución de p-nitrofenil-M-acetil p-D-glucosaminida Referencia M-9376 marca Sigma, (1 mg/ml en tampón de citratos 0,1 M pH 5,0, preparado en agua destilada desionizada estéril). Esta mezcla se incubó a 35°C durante 30 minutos para permitir la reacción enzimática. Finalizado este tiempo de incubación, a cada muestra refrigerada se le adicionaron 1,5 mi de NH4OH 1M con EDTA disodico (2 mM) y se determinó la absorbancia de la muestra en espectrofotómetro a una longitud de onda de 400 nm. Se realizaron tres repeticiones de cada muestra y'los resultados de absorbancia obtenidos se promediaron e interpolaron en la curva estándar del compuesto pnitrofenol, determinándose así la concentración del producto de la reacción y expresando el resultado en Amóles de pnitrofenol por mg de células bacterianas.
Los resultados obtenidos de las muestras biológicas por tratamiento se evaluaron mediante un análisis de varianza factorial (3x2+1) y una prueba de comparación de medias de Tukey al 0,05% de significancia.
Determinación de la actividad quimoelastasa proteasa PR1
La determinación de la actividad de esta enzima se hizo siguiendo los procedimientos descritos por St. Leger et ai. (1986b), para lo cual, se realizó una curva de calibración estándar de p-nitroanilina. Para cuantificar la actividad PR1 en los extractos enzimáticos, se tomaron 0,2 mi de la solución del sustrato M-succinil-ala-ala-propilfenialanina-p-nitroanilida (1 mM) Referencia S-7388 marca Sigma (disuelto en dimetilsulfóxido), se le adicionaron 0,2 mi del extracto enzimático y 2,5 mi del tampón TTis-HCl (2 mM, pH 8), el cual contenía KC1 0,3M. Posteriormente, en el espectro-fotómetro, se realizaron las lecturas de absorbancia de cada muestra a 410 nm.
Se realizaron dos repeticiones de cada muestra biológica y los resultados de absorbancia fueron promediados e interpolados en la curva estándar del compuesto p-nitroanilina, determinándose así la concentración y expresando el resultado en inmoles de p-nitroanilina por mg de células bacterianas. Los resultados obtenidos de las muestras biológicas por tratamiento, se evaluaron mediante un análisis de varianza factorial (3x2+1) y una prueba de comparación de medias de Tukey al 0,05% de significancia.
Determinación de la actividad β-esterasa
Para la determinación de la enzima β-esterasa se utilizaron los procedimientos descritos por St. Leger et al. (1986c), utilizando la curva de calibración estándar de p-nitrofenol citada previamente. La reacción enzimática se llevó a cabo tomando 0,2 mi del extracto enzimático y adicionándole 1 mi del sustrato p-nitrophenylcaprylato (ri-0752) (1 mg/ml disuelto en dimetilsulfóxido). Esta mezcla se incubó a 35°C durante 30 minutos. Posteriormente, se adicionaron 1,5 mi de NH4OH ID con EDTA disodico 2 mM.
De cada muestra biológica, se realizaron 3 repeticiones y las lecturas de absorbancia se llevaron a cabo a 400 nm. Los resultados obtenidos por muestra, fueron promediados e interpolados en la curva estándar del compuesto p-nitrofenol, determinándose así la concentración del producto liberado y expresando el resultado como nmoles de p-nitrofenol por mg de células.
Los resultados obtenidos de las muestras biológicas por tratamiento se evaluaron mediante un análisis de varianza factorial (3x2+1) y una prueba de comparación de medias de Tukey al 0,05% de significancia.
Evaluación de la actividad entomopatogénica de S. marcescens hacia larvas de primer instar de T. solanivora
Los resultados obtenidos en esta segunda fase de la investigación son presentados y discutidos en otro artículo, donde se relaciona tanto la actividad enzimática como biocontroladora de la bacteria hacia larvas de T. solanivora.
Resultados y Discusión
Selección del aislamiento de S. marcescens potencialmente biócontrolador de larvas de T. solanivora
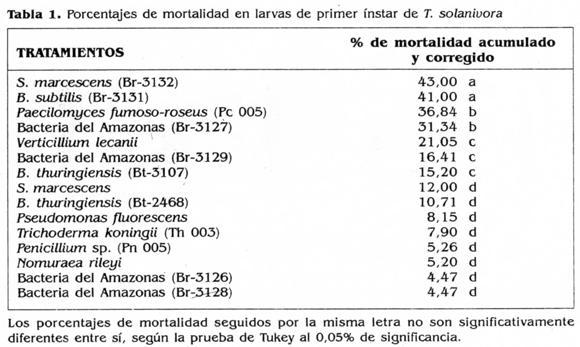
Con el fin de seleccionar un microorganismo biocontrolador de larvas de primer instar de T. solanivora, se evaluaron, en ensayos preliminares, los hongos y las bacterias mencionadas anteriormente. Los porcentajes de mortalidad obtenidos con estos microorganismos evaluados, se muestran en la tabla 1.
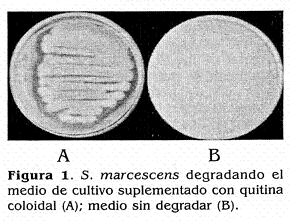
De acuerdo con el análisis de varianza, se obtuvieron diferencias significativas entre varios de los tratamientos utilizados. A su vez, con la prueba de Tukey al 0,05% de significancia (p ¿0,05), los tratamientos correspondientes a los aislamientos Br-3132 de S. marcescens y Br-3131 de B. subtilis presentaron los porcentajes de control, mayores y significativamente diferentes, de 43 y 41%, respectivamente, con respecto a la actividad biocontroladora de todos los demás microorganismos evaluados. Por lo tanto, se seleccionó el aislamiento de S. marcescens (Br 3132) para realizar las evaluaciones de actividad enzimática y biocontroladora, ya que además de presentar la mayor actividad biocontroladora, mostró actividad alta quitinolítica en el medio de cultivo suplementado con quitina coloidal sustrato utilizado como única fuente de carbono (Fig. 1).
Efecto de las inoculaciones en larva y de los crecimientos sucesivos en medio de cultivo suplementado sobre la actividad N-acetilglucosaminidasa presente en extractos de S. marcescens
Durante los cinco cultivos sucesivos, al determinar la actividad M-acetilglucósaminidasa presente en los extractos de S. marcescens, se encontraron diversos rangos de actividad quitinolítica. El análisis estadístico determinó que no hubo diferencias significativas entre las actividades N-acetilglucosaminidasa de los extractos procedentes de cada medio de cultivo, cuando S. marcescens se sometió a la activación en larvas, con respecto a cuando ésta no fue sometida a dicha activación.
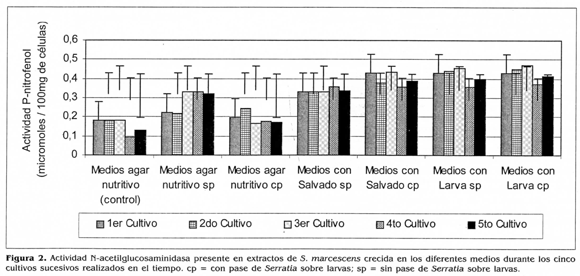
Por otra parte, se encontró que independientemente de la activación de S. marcescens en larvas, las actividades significativamente mayores de N-acetilglucosaminidasa, fueron obtenidas con los extractos de S. marcescens crecida sucesivamente en los medios suplementarios con el homogeneizado de larvas, obteniéndose 0,421 (imoles de p-nitrofenol/g de /células (PMP/g) en promedio. Estas actividades enzimáticas fueron seguidas por las obtenidas cuando S. marcescens creció sucesivamente en los medios suplementarios con salvado de trigo, las cuales fueron significativamente menores que las anteriores y correspondientes en promedio a 0,367 (imoles de PMP/g. Las actividades N-acetilglucosaminidasa menores pero significativamente diferentes fueron obtenidas con los extractos procedentes del crecimiento de la bacteria en los medios de agar nutritivo sin la adición de los sustratos inductores. Es así que cuando S. marcescens no fue sometida a las activaciones en larva se obtuvo 0,236 nmoles de PNP/g y cuando la bacteria no fue sometida a los cultivos sucesivos se obtuvo 0,230 nmoles de PMP/g.
Según el análisis estadístico, fue durante el tercer cultivo sucesivo de la bacteria sometida o no a la activación sobre larvasy crecida en los diferentes medios de cultivo, donde hubo las mayores actividades N-acetilglucosaminidasa; actividades que fueron significativamente diferentes con respecto a las obtenidas en los demás cultivos sucesivos realizados en el tiempo.
En la figura 2 se observa que durante los cinco cultivos sucesivos de S. marcescens, las menores actividades N-acetilglucosaminidasa fueron obtenidas cuando ésta creció en los medios de agar nutritivo, las cuales fueron en promedio de 0,190 (imoles de PMP/g (S. marcescens sometida a la activación en larvas), de 0,284 (imoles de PMP/g (S. marcescens no sometida a la activación) y de 0,153 unióles de PMP/g (S. marcescens no sometida a la activación ni a los cultivos sucesivos).
Durante los cinco cultivos sucesivos de la bacteria, las mayores actividades N-acetilglucosaminidasa, fueron obtenidas con los extractos provenientes de los medios suplementarios con los dos sustratos inductores de virulencia. Es así que cuando la bacteria creció en el homogeneizado de larvas, se obtuvieron actividades de 0,427 nmoles de PMP/g (S. marcescens sometida sucesivamente a la activación) y de 0,417 (¿moles de PMP/g (S. marcescens no fue sometida a la activación en larvas). Estas actividades enzimáticas fueron seguidas por las obtenidas, cuando S. marcescens creció sucesivamente en los medios con salvado de trigo, actividades que fueron significativamente menores que las anteriores y correspondientes a 0,397 nmoles de PMP/g (S. marcescens sometida a la activación) y a 0,337 jimoles de PMP/g (S. marcescens no sometida a la activación) (fig. 2).
Las mayores actividades N-acetilglucosaminidasa, obtenidas cuando S. marcescens creció en los medios con homogeneizado de larvas, pudieron deberse a la composición bioquímica de este sustrato, ya que éste contiene lípidos, proteínas y quitina (St. Leger et al. 1986a). Esta última es la que conforma la cutícula de los insectos y podría haber inducido la producción de exoquitinasas específicas implicadas en la patogenicidad de S. marcescens. Según Thonart et al. (1991), dependiendo del tipo de sustrato adicionado al medio, podría inducirse una mayor síntesis de enzimas y mejorar las características de permeabilidad de las células, permitiendo una mayor disponibilidad de las enzimas extracelulares.
Así mismo, cuando S. marcescens creció en los medios con salvado de trigo, también se obtuvo una mayor actividad Nacetilglucosaminldasa. Esto corrobora lo obtenido por Thonart et al. (1991) quienes señalaron que este sustrato adicionado a un medio de cultivo, produjo una mayor actividad de las enzimas celulasas, B-1,3glucanasas y quitinasas excretadas por Trichoderma viridae. Posiblemente este sustrato induce una mayor excreción de las enzimas, efecto que pudo producirse también en S. marcescens y que se reflejó en un incremento de la actividad N-acetilglucosaminidasa presente en los extractos de células.
Es posible que los cultivos sucesivos de S. marcescens sobre los medios, hubieran causado un efecto inductor de su actividad quitinolítica y/o una represión catabólica en su producción, ya que según Young y Carroad (1981) la producción de una quitinasa extracelular en S. marcescens, depende del balance entre el efecto inductor del sustrato en la producción de esta quitinasa y la represión catabólica causada por el mismo.
Por otra parte, las actividades enzimáticas menores cuando S. marcescens creció en los medios de agar nutritivo, pudieron deberse a una represión en la producción de las quitinasas por efecto de algún componente del medio de cultivo, ya que como lo mencionaron Monreal y Reese (1969) ciertos compuestos adicionados al medio como la glucosa, causaron una represión catabólica en la producción de las quitinasas en una cepa de S. marcescens.
Efecto de las inoculaciones en larva y de los crecimientos sucesivos en medio de cultivo suplementario sobre la actividad quimoelastasa proteasa PR-1 presente en extractos de S. marcescens
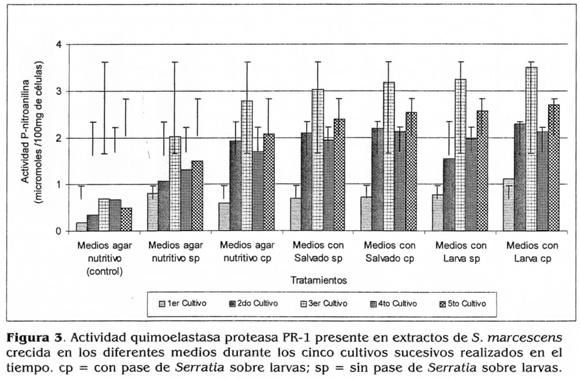
Durante los cinco cultivos sucesivos de la bacteria, se determinó que hubo diferencias significativas para la actividad de esta enzima (p <0,05), cuando S. marcescens fue sometida a la activación en larvas con respecto a su no activación. Esto podría indicar, que la activación de S. marcescens sobre las larvas, indujo aumentos en la actividad proteasa de los extractos.
Por otra parte, las mayores y significativas actividades quimoelastasa proteasa, fueron obtenidas cuando S. marcescens creció en los medios suplementados con los sustratos inductores; con los extractos provenientes del homogenizado de larvas se obtuvo una actividad promedio de 2,192 nmoles de PNA/g, la cual fue estadísticamente diferente a la obtenida con el ex-PMA/g, lo cual indica que la utilización del homogeneizado de larvas ocasiona un efecto inductor mayor sobre la actividad de esta enzima que el salvado de trigo. Por el contrario, cuando S. marcescens creció en los medios de agar nutritivo sin la adición de estos sustratos, se obtuvieron las actividades proteasa significativamente menores de 1,582 umoles de PMA/g en promedio, así mismo en este medio cuando S. marcescens no fue sometida a inoculaciones ni a cultivos sucesivos, se obtuvo una actividad de 0,920 (imoles de PMA/g en promedio (Fig. 3).
Esta actividad enzimática menor, obtenida en los extractos procedentes de los medios de agar nutritivo, podría deberse a que la peptona reprimió la producción de esta enzima en el medio y por consiguiente se obtuvo una actividad quimoelastasa proteasa menor en los extractos. Este comportamiento coincide con lo citado por Dumusois y Priest (1993) con Baciüus sphaericus, ya que cuando creció en presencia de peptona o de extracto de levadura, la síntesis de exoproteasas de la bacteria se vio disminuida, debido a una represión catabólica en la producción de exoproteasas.
También se observó que las actividades quimoelastasa proteasa fueron mayores en los extractos de células cuando S. marcescens creció en los medios suple-mentados con el homogeneizado de larvas; esto indica, que este sustrato de composición cuticular y constituido en mayor proporción por proteínas, posiblemente indujo la producción de exoproteasas de S. marcescens, que hidrolizan los enlaces amino terminales de las proteínas, que constituyen este sustrato. Esto coincide con lo mencionado por Villamizar (1998), quien encontró una inducción en la actividad proteasa de conidios del hongo fl. anisoplíae, cuando el hongo creció en un medio líquido suplementado con alas y patas de la langosta Rhammatocerus schistocercoides.
El efecto inductor del salvado de trigo pudo deberse a un efecto sobre la membrana celular, ya que según Thonart et al. (1991) este sustrato tiene la capacidad de mejorar la permeabilidad de la membrana en algunos hongos, permitiendo una mayor excreción de sustancias. Se podría suponer que posiblemente en S. marcescens, este sustrato ocasionó un efecto similar en la permeabilidad de la membrana bacteriana, facilitando de esta manera, la excreción de exoproteasas en los extractos de células y por consiguiente hubo una mayor actividad de esta enzima, con respecto a las actividades menores obtenidas cuando S. marcescens creció en los medios de agar nutritivo sin suplementar (Fig. 3).
Como se observa en la figura 3, durante el tercer cultivo de S. marcescens en cada medio suplementado o no con los sustratos inductores, hubo un incremento de la actividad proteasa, actividades que con los posteriores cultivos decrecieron con respecto al tercer cultivo. Sin embargo, esta disminución observada en la actividad quimoelastasa, podría estar relacionada con la producción concomitante de otras proteasas, ya que Balakrishnan et al. (1997), observaron que al disminuir significativamente la actividad exoproteasa de un Bacillus sp., alcalofílico, se incrementó la secreción y actividad de otras proteínas de la bacteria.
Este incremento de la actividad enzimática observado durante el tercer cultivo consecutivo de S. marcescens en los medios, podría atribuirse a que el continuo crecimiento de la bacteria en los medios principalmente suplementados, permitió seleccionar genes específicos que codifican para exoproteasas, capaces de degradar las proteínas constituyentes de estos sustratos. De otra parte, las mayores actividades quimoelastasa proteasa se obtuvieron en los extractos cuando S. marcescens creció en los medios con homogeneizado de lar-vas; esto indica, que este sustrato cuticular constituido por proteínas, también induce la actividad de proteasas específicas en S. marcescens. que hidrolizan los enlaces carboxyl y amino terminales de las proteínas que constituyen este sustrato. Decedue et al. (1979) señalaron que los aminoácidos que constituyen los sustratos para el crecimiento de microorganismos son los que principalmente inducen una producción mayor de exoproteasas.
El sustrato celulósico salvado de trigo está constituido por un 63% de fibras, un 15% de proteínas, un 6% de cenizas y un 4% de grasas (Souza et al. 1999). El 15% de proteínas presente en este sustrato, pudo haber inducido la producción y actividad de exoproteasas en las células de Serratia. Así mismo, Biswas et al. (1988) concluyeron que en varias especies de hongos la actividad de algunas enzimas estaba relacionada con la composición del medio de cultivo.
Por otra parte, cuando S. marcescens fue sometida a la activación sobre larvas en cada medio respectivo, se observaron actividades quimoelastasa proteasa ligeramente mayores, con respecto a las obtenidas cuando S. marcescens no fue sometida a la activación (Fig. 3); esto podría indicar, que con la activación de S. marcescens en larvas, se incrementó ligeramente la actividad de esta enzima. Esto puede estar relacionado con lo indicado por Flyg y Xanthopoulos (1983), quienes encontraron que aislamientos de S. marcescens provenientes de insectos, produjeron más enzimas proteolíticas que otros aislados a partir de muestras de suelo o de partes vegetales.
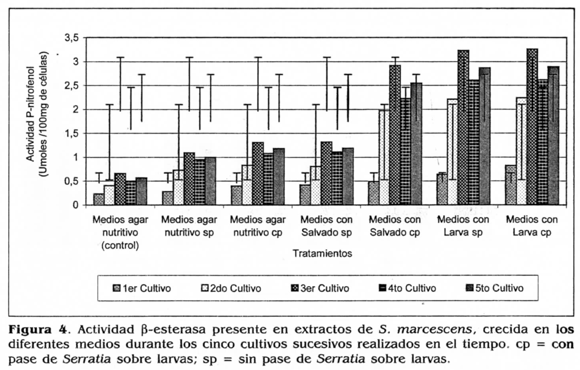
Efecto de las inoculaciones en larva y de los crecimientos sucesivos en medio de cultivo suplementario sobre la actividad β-esterasa presente en extractos de S. marcescens
Para los cinco cultivos sucesivos de 5. marcescens en los diferentes medios, se determinó que hubo diferencias significativas entre las actividades β-esterasa (p <0,05), cuando Serratia fue sometida a la activación en larvas y crecida en cada medio respectivo correspondientes en promedio a 1,790 unióles de PMP/g, con respecto a las actividades obtenidas cuando Serratia no fue activada en larvas y crecida en cada medio respectivo, las cuales correspondieron en promedio a 1,367 limóles de PMP/g.
A su vez, se observó un incremento en la actividad β-esterasa en el tercer cultivo sucesivo de S. marcescens crecida en los diferentes medios suplementarios o no con los sustratos inductores de virulencia. Posteriormente, esta actividad comenzó a decrecer en el cuarto y quinto cultivo (Fig. 4).
Durante los cinco cultivos sucesivos de S. marcescens, se encontró que las actividades menores y significativamente diferentes de esta enzima (p <0,05), fueron obtenidas con los extractos de S. marcescens crecida en el medio agar nutritivo (bacteria sin inoculaciones ni crecimientos sucesivos) obteniéndose en promedio 0,478 umoles de PMP/g; esta actividad fue seguida por 0,963 umoles de PMP/g, obtenida cuando S. marcescens activada en larvas creció en este medio y de 0,812 umoles de PMP/g cuando la bacteria no fue activada y creció en el medio (Fig. 4). Esto posiblemente se debió a que el medio de agar nutritivo no contenía en su composición ninguna fuente de lípidos o esteres grasos, que indujeran la producción de esterasas en la bacteria.
Por el contrario, durante los cinco cultivos de S. marcescens, las mayores actividades β-esterasa se obtuvieron cuando S. marcescens fue sometida o no a la activación en larvas y creció en los medios con homogeneizado de larvas (p ≤ 0,05), obteniéndose 2,371 umoles de PMP/g cuando la bacteria fue activada en larvas y 2,316 umoles de PMP/g cuando S. marcescens no fue sometida a la activación, actividades que no fueron significativamente diferentes entre sí (Fig. 4).
Lo anterior podría indicar, que el sustrato homogeneizado de larvas, en cuya composición están presentes esteres y ácidos grasos provenientes del cuerpo de las larvas, posiblemente sirvieron como sustratos específicos que indujeron una mayor actividad β-esterasa, que hidrolizaron los enlaces éster, fosforil o carboxil de los fosfolípidos constituyentes de este sustrato, resultado similar al obtenido por Villamizar (1998), quien observó un efecto inductor de la actividad esterasa de conidios de N. anisoptiae, cuando el hongo creció en medio líquido suplementario con alas y patas de su insecto hospedero.
Las segundas actividades β-esterasa mayores fueron obtenidas con los extractos de S. marceseens crecida en los medios con salvado de trigo, las cuales fueron significativamente menores que las anteriores (p ≤0,05), siendo en promedio de 2,036 µmoles de PMP/g cuando S. marcescens fue sometida al pase y de 0,973 umoles de PMP/g cuando la bacteria no fue sometida al pase en larvas.
Tal como se observa en la figura 4, la actividad β-esterasa baja obtenida en los extractos de S. marcescens, sometida o no a la activación en larva y crecida en los medios de agar nutritivo sin suplementar y no sometida a activación en larva y crecida en los medios suplementarios con salvado de trigo, podría atribuirse a la escasa proporción de lípidos o esteres grasos que contiene en su composición el salvado de trigo (4% de grasas) y a la ausencia de éstos en la composición del agar nutritivo. Esto posiblemente originó una actividad β-esterasa baja en los extractos de células de S. marcescens.
De otra parte, los resultados observados en la figura 4 indican que, con la utilización del homogeneizado de larvas, se originó un efecto inductor de la actividad β-esterasa. Según Thaler et al, (1998), una amplia variedad de bacterias gram positivas y gram negativas, producen lecitinasas (lipasas) para suplirse de fuentes de lípidos y en algunos casos estas enzimas pueden tener un papel importante en la inducción de la patogenicidad en hospederos blanco; tal es el caso, de la fosfolipasa C de B. thuringiensis, que está relacionada con su virulencia hacia algunos insectos plaga. Qrimont y Qrimont (1978) encontraron una correlación positiva entre la patogenicidad y la producción de lecitinasas (lipasas) en varias bacterias incluyendo especies del género S. marcescens.
Conclusiones
• Los sustratos potenciales inductores, salvado de trigo y homogeneizado de larvas de T, solanlvora incorporados al medio de cultivo, incrementaron significativamente la actividad de las enzimas N-acetilglucosaminidasa y quimoelastasa proteasa de los extractos de células de S. marcescens.
• Las inoculaciones sucesivas (activaciones) de la bacteria sobre larvas del insecto no indujeron una significativa actividad de los extractos enzimáticos de la bacteria.
• Durante el tercer crecimiento sucesivo de S. marcescens sobre los medios suple-mentados con los sustratos salvado de trigo y homogeneizado de larvas, se incrementaron significativamente las actividades quimoelastasa proteasa PR-1 de los extractos de células de la bacteria.
• Los crecimientos sucesivos de la bacteria sobre los medios de cultivo afectaron las actividades quimoelastasa proteasa y β-esterasa, viéndose éstas disminuidas durante el cuarto y quinto cultivo sucesivo de la bacteria sobre estos medios.
Literatura citada
BALAKRISHNAN, H.; SRINIVASAN, M.; RELÉ, M. 1997. Extracellular protease activities in relation to xylanase secretion in an alkalophilic Bacillus sp. Biotechnology Letters 19 (7): 599-601. [ Links ]
BISWAS, S.; MISHRA, A.; MANDA, G. 1988. Xylanase and B-xylosidase production by Aspergillus ochraceus during growth on lignocelluloses. Biotechnollogy Bioenginering 31: 613-616. [ Links ]
BOSA, C. 1996. Desarrollo de una metodología para evaluar la actividad insecticida de cepas nativas de Bacillus thuringiensis para el control de Spodoptera frugiperda J. E. Smith (Lepidoptera: Noctuidae). Trabajo de Orado de Biólogo. Universidad Distrital FJC, Bogotá. 98 p. [ Links ]
BRADFORD, M. 1976. Rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principie of protein dye binding. Analytical Biochemistry 72: 254-284 [ Links ]
DECEDUE, C.; BROUSSARD, E.; LARSOM, A.; BRAYMER, H. 1979. Purification and characterization of the extracellular proteinase of Serratia marcescens. Biochimica et Biophysica Acta 569: 293-501. [ Links ]
DUMUSOIS, C.; PRIEST, r. 1993. Extracellular serine protease synthesis by mosquitopathogenic strains of Bacillus sphaerlcus. Journal of Applied Bacteriology 75: 416-419. [ Links ]
FLACH, J.; PILET, P.; JOLLES, P. 1992. What's new in chitinase research?. Experientia 48: 701-716. [ Links ]
FLYG, C.; XANTHOPOULOS, K. 1983. Insect pathogenic properties of S. marcescens. Passive and active resistance to insect immunity studied with protease-deficient and phage-resistant mutants. Journal of General Microbiology 129: 453-464. [ Links ]
GONZÁLES, M.; VALENCIA, A.; BUSTILLO, A. 1999. Incremento de la patogenicidad de B. bassiana hacia fiypothenemus hampei, utilizando cutícula de broca en el medio de cultivo. Resúmenes. XXVI Congreso de la Sociedad Colombiana de Entomología, p. 156. Julio. Bogotá. [ Links ]
GRIMONT, P; GRIMONT, F. 1978. The Genus Serratia. Annual Review Microbiology 32: 221-248. [ Links ]
MONREAL, J.; REESE, E. 1969. The chitinase of Serratia marcescens. Canadian Journal Microbiology 15: 689-696. [ Links ]
NÚÑEZ, V. 1993. Perspectivas de la biología molecular en el control de larvas de Scarabaeidae de importancia agrícola. En: Diversidad y manejo de plagas subterráneas. A. Morón (ed.). Sociedad Mexicana de Entomología e Instituto de Ecología, Xalapa, Veracruz, México, p 217-233. [ Links ]
SAMPSON, M.; GOODAY, G. 1998. Involvement of chitinases of Bacillus thuringiensis during pathogenesis in insects. Microbiology 144: 2189-2194. [ Links ]
SCHAERFFENBERG, B. 1964. Biological and environmental conditions for the development of mycoses caused by Beauveria sp., and Metarhizium sp. Journal of Invertebrate Pathology 6:8-20. [ Links ]
SOUZA, M.; ROBERTO, I.; MILAGRES, A. 1999. Solid-state fermentation for xylanase production by Thermoascus aurantiacus using responso surface methodology. Applied Microbiologycal Biotechnology 52: 768-772. [ Links ]
ST. LEGER, R. 1997. Biology and Mechanisms of Insect-cuticle Invasión by Deuteromycete Fungal Pathogens. Cap 10. p. 211-225. En: Parásitos and Pathogens of Insects. Vol 2. N. Beckage., S. Thompson.,y B. Federici (eds.) AcademicPress, San Diego, California. [ Links ]
ST. LEGER, R.; CHARNLEY, A.; COOPER, R. 1986a. Cuticle-Degrading Enzymes of Entomopathogenic Fungi: Cuticle Degradation in vitro by enzymes from entomopathogens. Journal of Invertebrate Pathology 47: 167-177. [ Links ]
ST. LEGER, R.; CHARNLEY, A.; COOPER, R. 1986b. Cuticle-degrading enzymes of entomopathogenic fungi: Mechanisms of interaction between pathogen enzymes and insect cuticle. Journal of Invertebrate Pathology 47: 295-302. [ Links ]
ST. LEGER, R.; CHARNLEY, A.; COOPER, R. 1986c. Cuticle-degrading enzymes of entomopathogenic fungi: synthesis in culture on cuticle. Journal of Invertebrate Pathology 48: 85-95. [ Links ]
THALER, J.; DUVIC, B.; GIVAUDAN, A.; BOEMARE, N. 1998. Isolation and entomotoxic properties of the Xenorhabdus nematop/u'Jus Fl Lecithinase. Applied and Environmental Microbiology 64 (7): 2367-2373. [ Links ]
THONART, A.; COTES, A.; CAMPOS, D.; ROBLAIN, D.; LEPOIVRE, P 1991. Modelling of uses of microorganisms in the degradation of natural polymers. En: Production and utilization of lignocellulosics. Galletti (ed.). Geambloux, Belgium. p. 79-89. [ Links ]
VILLAMIZAR, L. 1998. Efecto de la composición del medio de cultivo en la virulencia de Metarhizium anisopüae sobre la langosta llanera Rhammatocerus schistocercoides. Tesis de Maestría para optar al título de Microbióloga. Universidad Nacional de Colombia. Bogotá. 112 p. [ Links ]
YOUNG, M.; CARROAD, P 1981. Dependance of extracellular chitinase activity of S. marcescens QMB1466 on continuos culture dilution rate. Canadian Journal Microbiology 27: 142-144. [ Links ]
Recibido: May. 02 / 2002 • Aceptado: Abr. 15/ 2003