Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.30 no.1 Bogotá Jan./June 2004
Efecto de las condiciones de cultivo sobre la actividad en tomo patogénica de Serratia marcescens contra Teda solanivora (Lepidoptera: Gelechiidae)
Effect of culture conditions on the entomopathogenic activity of Serratia marcescens against Tecla solanivora (Lepidoptera: Gelechiidae)
CARLOS FELIPE BOSA O.1, ALBA MARINA COTES2
1 Autor para correspondencia: B. Se. M. Sc. Investigador del Laboratorio de Control Biológico del Programa nacional de Manejo Integrado de Plagas MIP Corpoica - Tibaitatá. Teléfono: 4227500. Km 14 vía Mosquera. E-mail: Carlosfelipeb@yahoo.es
2 Ph. D. fitopatología. Investigadora principal. Laboratorio de Control Biológico. CORPOICA. C. I. Tibaitatá. E-mail: acotes@corpoica.org.co
Resumen. Se estableció un modelo para evaluar el efecto que sobre la actividad enzimática y biocontroladora de Serratia marcescens, producen sus inoculaciones sucesivas en larvas del insecto y sus crecimientos continuos sobre medios suplementados o no, con los sustratos potenciales inductores de virulencia (salvado de trigo y homogeneizado de larvas de Tecla solanivora Fovolny). A la biomasa de la bacteria producida en estos medios, le fue evaluada la actividad biocontroladora contra larvas del insecto y se prepararon extractos enzimáticos, con los cuales se determinó la actividad de las enzimas N-acetilglucosaminidasa, quimoelastasa proteasa y β-esterasa. Se realizaron cinco cultivos sucesivos de la bacteria y en cada uno se evaluaron las actividades mencionadas. En general, tanto el tipo de sustrato adicionado al medio como los crecimientos sucesivos de la bacteria, afectaron las actividades enzimática y biocontroladora, Incrementándose éstas durante el tercer crecimiento de la bacteria. Las mayores actividades biocontroladoras de S. marcescens sometida o no a la activación en larvas, correspondientes al 65 y 64% de mortalidad respectivamente, se obtuvieron cuando creció en el medio con salvado, seguidas por el 58 y 59% de mortalidad respectivamente, cuando creció en el medio con larvas, actividades que fueron significativamente diferentes de la obtenida cuando S. marcescens creció en el medio sin suplementar (48,5%). A su vez, se determinó una correlación positiva, entre las actividades N-acetilglucosaminidasa y quimoelastasa proteasa con la actividad biocontroladora de S. marcescens, sugiriendo que la actividad de estas enzimas, puede estar relacionada con el mecanismo de acción de las bacterias entomopatógenas del género Serratia.
Palabras clave: Bacterias entomopatogénicas. Serratia sp. Modo de acción. Enzimas.
Summary. A model was established to evalúate the effect of successive inoculations and successive growths in culture media suppiemented or not with potential virulence inductors (wheat bran and homogenised Tecla solanivora Povolny larvae) on the enzymatic and biocontrol actlvity of Serratia marcescens. The bacteria biomass obtained from these media was evaluated for biocontrol activity against insect larvae, and enzymatic extracts were prepared to determined the activity of the enzymes Macetilglucosaminidase, quimoelastase protease PR-1 and jJ-esterase. These activities were evaluated in each of five successive bacteria cultures. In general, both the type of substrate added to the media as well as successive growth affected the biocontrol and enzymatic activities, increasing in the third growth of the bacteria. The greatest biocontrol activities of S. marcescens, with or without activation in larvae, corresponding to 65 and 64% mortality, respectively, were obtained when were the bacteria were grown . in wheat bran médium, followed by 58 and 59% mortality, respectively, when grown in the larval médium, activities that were significantly different than that obtained when S. marcescens grew in médium without supplement (48,5%). In addition, a positive correlation was found between M-acetilglucosaminidase and quimoelastase protease activities and S. marcescens biocontrol activity, suggesting that the activity of these enzymes could be related with the mode of action of entomopathogenis bacteria of he genus Serratia.
Key words: Entomopathogenic bacteria. Serratia sp. Mode of action. Enzymes.
Introducción
Para el control biológico de los insectos plaga como Teda solanivora Povolny se han realizado varios estudios exploratorios utilizando microorganismos entomopatogénicos. Sin embargo, actualmente la mayoría de estos estudios están enfocados básicamente a la evaluación y selección de microorganismos contra diferentes insectos plaga susceptibles; pero estos estudios no esclarecen ni relacionan los mecanismos de acción posiblemente impilcados en su patogenicidad y virulencia hacia los insectos plaga.
En las bacterias entomopatogénicas y específicamente dentro del género Serratía, existen especies asociadas a insectos como S. marcescens, S. liquefaciens, S. plymu.th.ica (Ewing y Martin 1981), S. marinorubra, S. entomophila y S. proteamaculans (Qray 1998); pero los estudios para caracterizar su proceso infeccioso enlos insectos susceptibles son muy escasos. Algunas investigaciones han propuesto que las enzimas quitinasasy proteasas producidas por estos microorganismos, son determinantes en su proceso de patogenicidad y virulencia (Gooday 1994), participando activamente en la degradación de las células epiteliales del intestino medio del insecto, facilitando el acceso de la bacteria al hemocele, aunque son pocos los estudios que relacionan in vivo la actividad de estas enzimas, con la actividad biocontroladora de las bacterias entomopatogénicas.
La actividad de estas enzimas puede verse afectada por factores externos como la composición del medio de cultivo; es así como, la adición de sustratos cuticulares de insectos, puede proporcionar una fuente de nutrición específica para estos microorganismos y conferir un incremento en su actividad biocontroladora hacia los insectos plaga de interés (Flach el al. 1992; Sampson y Qooday 1998). Este fenómeno biológico, posiblemente se debe a la activación por parte del sustrato, de sistemas enzimáticos específicos, los cuales son determinantes en la actividad insecticida de los microorganismos sobre los insectos susceptibles (Lañe y TVinci 1991). Parece ser que otro factor externo importante, involucrado en el incremento o disminución en la patogenicidad de los entomopatógenós contra los insectos plaga, es el sometimiento de éstos a crecimientos sucesivos (Qonzáles eí al. 1999). Sin embargo, este factor hasta el momento no ha sido estudiado y comprobado para el caso de las bacterias entomopatógenas.
Teniendo en cuenta estos factores potencialmente involucrados en el incremento de la patogenicidad y virulencia de los entomopatógenós, y óon el fin de esclarecer y relacionar algunos de los mecanismos enzimáticos específicos de la bacteria entomopatogénica S. marcescens con su actividad biocontroladora hacia los insectos plaga, el objetivo de la presente investigación fue evaluar el efecto que producen sus inoculaciones sucesivas en larvas del insecto y sus crecimientos continuos en medios suplementados con diferentes sustratos potenciales inductores de virulencia, sobre la actividad enzimática y biocontroladora de S. marcescens hacia larvas de primer instar de T.solanivora. La hipótesis de la investigación se refiere: a si los crecimientos sucesivos de la bacteria sobre medios de cultivo suplementados con sustratos potenciales inductores de virulencia, provocan un incremento en su actividad entomopatogénica hacia larvas de T. Solanivora.
Esta investigación se llevó a cabo en el Laboratorio de Control Biológico del Programa nacional de Manejo Integrado de Plagas de Corpoica - Tibaitatá y fue ejecutado durante los años de 1999 al 2001.
Materiales y Métodos
Evaluación de la actividad entomopatogénica de S. marcescens hacia larvas de primer instar de T. solanivora
En la evaluación de la actividad biocontroladora de la bacteria hacia T.solanivora, durante cada uno de los cultivos sucesivos realizados en el tiempo, se utilizaron los siguientes tratamientos:
1. S. marcescens crecida en agar nutritivo (bacteria sin inoculaciones, ni cultivos sucesivos en el medio)
2. S. marcescens sin activación en larvas y crecida en agar nutritivo
3. S. marcescens con activación en larvas y crecida en agar nutritivo
4. S. marcescens sin activación en larvas y crecida en el medio suplementario con salvado de trigo
5. S. marcescens con activación en larvas y crecida en el medio suplementario con salvado de trigo
6. S. marcescens sin activación en larvas y crecida en el medio suplementario con homogeneizado de larvas de T. solanivora
7. S. marcescens con activación en larvas y crecida en el medio suplementario con homogeneizado de larvas de T. solanivora
Este procedimiento metodológico se realizó sucesivamente durante los cinco cultivos de la bacteria con el fin de determinar, en cada uno de ellos, el efecto y la relación que las inoculaciones sucesivas de S. marcescens en larvas (activación de la bacteria) y sus crecimientos continuos en cada uno de los medios mencionados anteriormente, producen sobre la actividad enzimática y biocontroladora de S. marcescens hacia T. solanivora.
El proceso metodológico por el cual se llevó a cabo la inoculación de la bacteria sobre las larvas del insecto (proceso de activación), se describe a continuación:
Activación de S. marcescens en lar-vas de T. solanivora
Durante cada uno de los cultivos sucesivos de la bacteria, los tratamientos que implicaron la activación previa de S. marcescens sobre larvas de segundo instar del insecto, se llevaron a cabo de la siguiente manera: Del crecimiento de la bacteria en una caja de Petrí, que contenía el medio de cultivo respectivo e incubada a 28°C durante 4 días, se realizó una suspensión madre en 9 ml de agua peptonada estéril al 0,1% pH 7,2. Luego, con diluciones, esta suspensión fue ajustada a la concentración 1x108 células/ml utilizando técnicas espectrofotométricas, según una curva estandarizada por Bosa (2001).
Las larvas de segundo instar, se desinfectaron por inmersión en una solución de hipoclorito de sodio (NaHClO) al 0,05% durante 5 segundos; luego, se realizaron 2 lavados sucesivos con agua destilada estéril durante 5 segundos cada uno. Posteriormente, las larvas desinfectadas se colocaron en una caja de Petri estéril, que contenía en el fondo una toalla de papel estéril. Luego estas larvas se sumergieron durante 10 segundos, en la suspensión bacteriana ajustada a la concentración 1x108 células/mi, utilizando una curva que relacionaba densidad óptica vs. unidades formadoras de colonia (UFC) (Bosa 2001). Al cabo de este tiempo, éstas se colocaron en una caja de Petri estéril, que contenía una toalla de papel estéril.
Los tubérculos de papa también se desinfectaron en una solución de hipoclorito de sodio al 0,05% durante 2 minutos; luego, se realizaron 3 lavados sucesivos en agua destilada estéril, durante 5 minutos cada uno. Los tubérculos desinfectados y secos, se cortaron por la mitad y se sumergieron durante 5 minutos en la suspensión bacteriana ajustada. Posteriormente, cada tubérculo inoculado se ubicó en el fondo de un recipiente plástico estéril se infestó con 15 larvas tratadas de segundo instar, el cual finalmente se tapó. Al cabo de los 2 días de realizado el ensayo, las larvas muertas se recolectaron y se colocaron en cámara húmeda a 28°C durante 1 día.
A partir de las larvas incubadas en cámara húmeda, se realizó el aislamiento de la bacteria activada en el medio suplementario con quitina coloidal. Para esto, se pesó 0,1 g de larvas muertas las cuales se maceraron en un mortero de porcelana estéril y el macerado se suspendió en 9 mi de agua peptonada estéril al 0,1% pH 7,2. A partir de esta suspensión madre, se hicieron diluciones seriadas, realizándose la siembra de las diluciones 10-7y 10-8 en cajas de Petri que contenían el medio con quitina coloidal. Después de la incubación durante 4 días a 28°C, se realizó la verificación de las UFC, midiendo el halo de degradación de las colonias en el medio con quitina y se verificó su morfología típica macroscópica y microscópica utilizando la tinción de Qram; posteriormente, las colonias verificadas como típicas se cultivaron en los medios de cultivo respectivos.
Evaluación de la actividad entornopatogénica de S. marcescens sobre larvas de primer instar de T. solanivora
En todos los casos, a partir del crecimiento bacteriano a 28°C durante 4 días, en cajas de Petri que contenían el medio de cultivo respectivo, se procedió a la realización de una suspensión madre en 9 mi de agua peptonada estéril al 0,1% pH de 7,4, la cual se cuantificó utilizando una curva estandarizada de UFC vs. densidad óptica a 600 nm. Posteriormente, se ajustó la suspensión madre a la concentración de 1x108 células/ml.
Por otra parte, se desinfectaron tubérculos de papa variedad pastusa, en una solución de hipoclorito de sodio al 0,05 % durante 2 minutos. Posteriormente, se lavaron 3 veces sucesivas en agua destilada estéril durante 5 minutos cada vez. Los tubérculos desinfectados se sumergieron durante 5 minutos en la suspensión bacteriana correspondiente y finalmente ésta se ajustó a la concentración única de 108 células/mi. Para la infestación de los tubérculos tratados, se utilizó un pincel estéril para recoger las larvas de primer instar provenientes de la cría. Cada tubérculo tratado con la respectiva suspensión bacteriana, se infestó con 20 larvas de primer instar del insecto.
Diseño experimental para los bioensayos
Las condiciones ambientales para los ensayos biológicos fueron similares a las mencionadas para el mantenimiento de la cría. Se empleó un diseño completamente aleatorizado, con 5 repeticiones por tratamiento. Cada repetición o unidad experimental, consistió de 20 larvas colocadas sobre un tubérculo de papa desinfectado y tratado, ubicado en el fondo de un recipiente de poliuretano con 1 cm de arena estéril. Se utilizaron 100 larvas de primer instar de T. solanivora por tratamiento.
Se empleó un testigo tratado (tubérculos desinfectados, tratados con solución de agua peptonada e infestados con lar-vas) y un testigo larva (tubérculos desinfectados, e infestados con larvas). La variable evaluada para cada tratamiento fue el porcentaje de mortalidad en larvas (número de pupas formadas). Las evaluaciones de la variable, se realizaron a partir de los 30 días de efectuado el ensayo, llevando a cabo lecturas periódicas cada 5 días durante 15 días. Esta variable evaluada se describe a continuación:
Porcentaje de mortalidad. El porcentaje de mortalidad acumulado y corregido en cada uno de los tratamientos, se determinó mediante la fórmula de Abbott (Ciba-Geigy 1978):
Porcentaje de Mortalidad corregido = 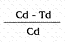
Donde Cd: Infestación en el tratamiento testigo después de la aplicación
Td: Infestación en el tratamiento después de la aplicación
Para el análisis de los resultados, se realizó un análisis de varianza factorial (3x2+1), correspondiente a 3 medios de cultivo x 2 interacciones, que incluyeron S. marcescens sometida o no a la activación sobre el insecto + el tratamiento control. Este análisis se aplicó para cada uno de los cultivos sucesivos realizados a través del tiempo y adicionalmente se realizó una prueba de comparación de medias de Tukey al 0,05% de significancia.
Resultados y Discusión
Efecto de las inoculaciones en larva y de los crecimientos sucesivos de S. marcescens en medios de cultivo sobre su actividad biocontroladora contra T. solanivora
Paralelo a las determinaciones de la actividad enzimática de los extractos de células de S. marcescens, también se realizaron las evaluaciones de la actividad entomopatogénica de suspensiones de S. marcescens ajustadas a una concentración única de 108 células/mi y procedentes de los diferentes medios de cultivo. En cada cultivo sucesivo de la bacteria, realizado en el tiempo, se determinó el porcentaje de mortalidad en larvas y los porcentajes de daño y control del daño en los tubérculos tratados.
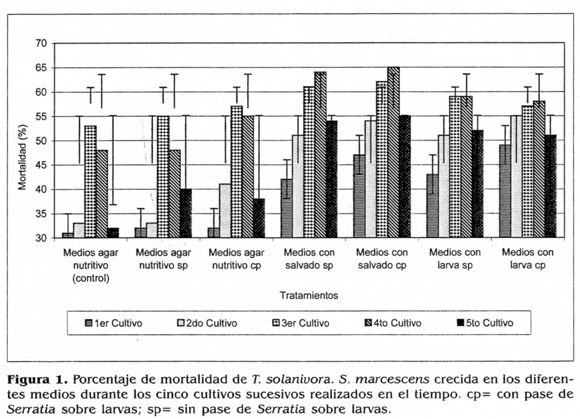
Durante los cinco cultivos sucesivos de S. marcescens no hubo diferencias significativas en la actividad biocontroladora cuando se comparó el efecto de someter o no a la bacteria a la activación sobre larvas del insecto y su posterior crecimiento en los diferentes medios. Esto indica, que la activación previa de la bacteria sobre las lar-vas del insecto, no ocasionó un efecto inductor en el incremento de su actividad biocontroladora (Fig. 1).
Por otra parte, se determinó que durante el tercer y cuarto cultivo sucesivo de la bacteria sobre los medios, se obtuvieron las mayores actividades biocontroladoras, las cuales fueron significativamente diferentes (p<0,05) con respecto a las obtenidas en los demás cultivos sucesivos realizados en el tiempo (Fig. 1).
De acuerdo con los resultados obtenidos durante los cinco cultivos sucesivos, la menor actividad biocontroladora y significativamente diferente (p<0,05) fue obtenida cuando la bacteria, sometida o no a la activación en larvas, creció en los medios de agar nutritivo. Es así que cuando la bacteria sometida a la activación creció en este medio, se obtuvo una mortalidad del 44,91% en promedio y cuando no fue sometida a la activación se obtuvo una mortalidad del 42,09%. Estas actividades, no fueron significativamente diferentes entre sí (p<0,05), ni diferentes de las obtenidas cuando la bacteria creció en agar nutritivo (medio control: bacteria sin inoculaciones en larva ni cultivos sucesivos), con la cual se obtuvo una mortalidad en promedio de 39,69% (Fig. 1).
Por el contrario, durante los cinco cultivos sucesivos de la bacteria, las mayores actividades biocontroladoras y significativamente diferentes de las anteriores (p<0,05), se obtuvieron cuando S. marcescens, activada o no activada en larvas, se cultivó en los medios suplementados con el salvado de trigo y con el homogeneizado de larvas; actividades que no fueron significativamente diferentes entre sí (p<0,05). Cuando la bacteria fue sometida a la activación y creció en los medios con el homogeneizado de larvas, se obtuvo un 54,20% de mortalidad en promedio y cuando ésta no fue sometida a la activación y creció en este medio, se obtuvo una actividad en promedio de 53,35% de mortalidad (Fig. 1). De otra parte, cuando la bacteria fue sometida a la activación y creció en los medios con salvado de trigo, se obtuvo una actividad en promedio de 56,92% de mortalidad y cuando ésta no fue sometida a la activación se obtuvo un 54,81% de mortalidad (Fig. 1).
Es importante destacar que en las determinaciones de la actividad enzimática de los extractos, se presentaron diferencias significativas (p<0,05) cuando S. marcescens creció en el medio suplementado con el homogeneizado de larvas, con respecto a las obtenidas cuando la bacteria creció en el medio suplementado con salvado de trigo. Sin embargo, cuando la bacteria creció en estos dos medios suplementados, no se observaron diferencias estadísticas en las actividades biocontroladoras de la bacteria. Esto podría indicar que los sustratos salvado de trigo y homogeneizado de lar-vas adicionados al medio, posiblemente indujeron una mayor producción y actividad de enzimas en las células de la bacteria.
También esta mayor actividad biocontroladora obtenida a partir del crecimiento de la bacteria en estos medios, posiblemente se debió a los crecimientos sucesivos de S. marcescens sobre estos medios suplementarios, confiriéndole una mayor patogenicidad contra las larvas de T. solanivora y además se indujo una selección de genes posiblemente involucrados con la producción y actividad de enzimas específicas implicadas en la patogenicidad de esta bacteria. Esto coincide con los autores Qrkovic et al. (1995), quienes sugirieron que los aumentos en la virulencia de la bacteria podrían estar relacionados con los genes contenidos en plásmidos, los cuales están presentes en algunas especies del género Serratia. ya que en aislamientos entomopatogénicos de S. entomophila y S. proteamaculans, se encontró un gran plásmido de 105 Kb (PADAP) que contiene genes esenciales, los cuales parecen estar involucrados con el desarrollo de la enfermedad ambarina producida en larvas de Costelytra zealandica (Coleóptera: Scarabaeidae) (Qrkovic et al. 1995).
Durante las evaluaciones de la actividad enzimática de S. marcescens, se observó una relación directamente proporcional entre el incremento de estas actividades y el aumento en el número de cultivos sucesivos de la bacteria; es así que, este comportamiento enzimático estuvo relacionado con los incrementos en las actividades biocontroladoras de la bacteria, siendo éstas máximas durante el tercer y cuarto cultivo sucesivo de la bacteria en los medios. Lo anterior indica, que los sustratos adicionados al medio además de incrementar la actividad enzimática en los extractos, también indujeron aumentos en la actividad biocontroladora de S. marcescens, indicando que posiblemente estas actividades parecen estar relacionadas entre sí (Fig. 1).
Es posible que la utilización y adición de estos sustratos al medio haya mejorado la expresión de los genes de virulencia de la bacteria, además de inducirle una alta especificidad contra T. solanivora, lo que posiblemente conllevó a una mayor virulencia de la bacteria. Según Flyg et al. (1980), la capacidad patogénica de un aislamiento de Serratia depende de: su capacidad invasora, la cual está relacionada con la habilidad de la bacteria para penetrar el intestino de los insectos; de la excreción de diferentes enzimas hidrolíticas como proteasas y quitinasas; de la resistencia pasiva que la bacteria puede mantener dentro del sistema inmune del insecto hospedero; y de la tasa de crecimiento y multiplicación de la misma dentro del insecto. Se podría sugerir que las continuas inoculaciones de S. marcescens en larvas y sus crecimientos sucesivos sobre los medios suplementarios con los sustratos, posiblemente indujeron o potencializaron algunas de estas características.
Aunque la mayoría de las bacterias entomopatogénicas como B. thuringiensis presentan su modo de acción vía ingestión, podría pensarse que algunas bacterias también ejercen su modo de acción por vía cuticular. Según tlawtin et al. (1997), la cutícula de las larvas de lepidópteros está constituida por quitina suave y flexible, que interactúa con los componentes proteicos para producir una estructura de poca rigidez pero de gran distensionalidad. Sin embargo, dada la alta actividad quitinolítica presentada por este aislamiento de S. marcescens, se podría sugerir que ésta es capaz de degradar la quitina de la cutícula de las larvas y alcanzar la hemolinfa para ocasionar la septicemia. Este proceso puede ser muy similar al ocurrido en la degradación de la cutícula durante el proceso de la muda, donde el fluido enzimático excretado por las células epidemiales, que está constituido por proteasas y quitinasas, degrada la vieja cutícula para dar paso a la nueva cutícula (Hawtin et al. 1997). Por lo anterior, se podría sugerir que este aislamiento de S. marcescens, presentó un modo de acción tanto por ingestión como cuticular, lo cual podría haber facilitado su patogenicidad contra T. solanivora.
Como se observa en la figura 1, durante el tercer cultivo sucesivo las mayores actividades biocontroladoras del 62,26 y 61,00% de mortalidad, se obtuvieron cuando S. marcescens, sometida o no a la activación, creció en los medios con salvado de trigo respectivamente; actividades seguidas por el 57,23 y 59,74% de mortalidad, cuando S. marcescens sometida o no a la activación en larvas creció en los medios con homogeneizado de larvas respectivamente. Otros autores como Rabelo et al. (1985) encontraron un comportamiento similar, cuando al evaluar dos cepas del hongo M. anisopliae activadas una sola vez sobre ninfas de Deois flavopicta (Homoptera: Cercppidae) y cultivadas varias veces en medios de arroz, ocasionaron los mayores porcentajes de mortalidad sobre ninfas de este insecto del 65 y 76,6% con el tercer crecimiento sucesivo de estos dos hongos sobre los medios de arroz, valores comparados con el 37 y 65% de mortalidad obtenidos durante el primer crecimiento de estos dos hongos, respectivamente.
Por otra parte, durante el cuarto cultivo sucesivo de S. marcescens, las actividades biocontroladoras mayores, correspondientes en promedio al 65,26 y 64,07% de mortalidad, se obtuvieron cuando S. marcescens fue sometida o no a la activación sobre larvas y cultivada en el medio con salvado de trigo; actividades seguidas por el 58,08 y 59,28% de mortalidad, obtenidas cuando S. marcescens fue sometida o no a la activacióny creció en el medio con homogeneizado de larvas (Fig. 1). Los incrementos ligeros observados en las actividades biocontroladoras durante el cuarto cultivo con respecto al tercer cultivo, no estuvieron relaciotiados con la disminución observada en las actividades enzima-ticas para el cuarto cultivo sucesivo de S. marcescens. Por lo cual se podría sugerir, que además de las enzimas N-acetilglucosaminidasa, quimoelastasa proteasa y β-esterasa, posiblemente otras enzimas o metabolitos, podrían estar involucrados en la patogenicidad de S. marcescens.
Para el tercer y cuarto cultivo sucesivo de S. marcescens en los medios suplementarios, es probable que las larvas muertas dentro de los tubérculos tratados por estos aislamientos posiblemente más virulentos, pudieron servir como reservónos para liberar, las células infectivas dentro de los tubérculos. Esto se debe a que esta bacteria también presenta la ventaja competitiva de sobrevivir como saprofito facultativo, lo cual pudo haber favorecido la infección de otras larvas presentes dentro de los tubérculos, al haber consumido la pulpa del tubérculo infectada con la bacteria.
Aunque los mecanismos de patogenicidad en especies del género Serratia no han sido aún esclarecidos, algunos autores como Callaghan et al. (1996) mencionan que toxinas y enzimas extracelulares como lecitinasas (lipasas), quitinasas y proteasas, pueden estar relacionadas con la patogenicidad de algunas especies del género Serratia. Se podría sugerir que la actividad de las enzimas evaluadas en este trabajo, pueden estar involucradas en la actividad entomopatogénica de S. marcescens.
Por otra parte, durante el quinto cultivo sucesivo las actividades biocontroladoras de S. marcescens decrecieron aún más, con respecto al cultivo anterior. Esta disminución posiblemente se debió a las continuas inoculaciones de S. marcescens sobre larvas, así como a sus crecimientos sucesivos en los medios, lo cual pudo originar la pérdida de algunos genes contenidos en plásmidos que codifican para estas enzimas específicas o una disminución en la actividad de estas enzimas y otros compuestos implicados en la patogenicidad de S. marcescens.
Para el caso de hongos como M. anisopliae y B. bassiana se ha demostrado que sus continuos crecimientos sobre medios de cultivo sintéticos o las inoculaciones sucesivas por insectos no hospederos, han originado heterocariosis y disminución o pérdida total de su virulencia contra el insecto hospedero. La pérdida en la virulencia de estos hongos ha sido relacionada con la disminución en la actividad enzimática de los conidios, ya que sus enzimas son expresadas en menor cantidad (Schaerffenberg 1964; Fox y Jaques 1958).
El crecimiento y metabolismo fisiológico de las bacterias es más rápido a diferencia de los hongos, lo cual implica que las bacterias pueden perder más fácilmente sus genes de virulencia por diversos factores externos, con la consecuente pérdida o disminución de su patogenicidad. Así mismo, la disminución en la actividad biocontroladora de S. marcescens durante el quinto cultivo, pudo deberse, según Qodfray et al. {1999), a que los estados larvales de los insectos presentan en su microbiota intestinal, bacterias saprofitas no patogénicas, las cuales se alimentan dentro del tracto digestivo; sin embargo, estas bacterias pueden adherirse en una alta proporción a los receptores de membrana del tracto intestinal, compitiendo con las bacterias entomopatogénicas por estos sitios de unión. Este fenómeno podría reducir la efectividad de las bacterias entomopatogénicas y en consecuencia, se requeriría de altas concentraciones del biocontrolador para causar una infección en los insectos tratados.
Relación entre la actividad biocontroladora y las actividades enzimáticas presentes en los extractos de S. marcescens. Dado que la excreción y actividad de las enzimas de la bacteria (Bosa y Cotes 2004) pueden determinar el proceso entomopatogénico hacia larvas de T. solanivora, se realizó un análisis de correlación lineal entre estas actividades. Así mismo, se propuso un modelo matemático para correlacionar y cuantificar la actividad de estas variables, con la posibilidad de utilizar la actividad de estas enzimas como marcadores biológicos predictivos de la actividad biocontroladora de aislamientos nativos de Serratia spp.
Relación entre la actividad biocontroladora y la actividad N-acetilglucosaminidasa presente en los extractos de S. marcescens. Al determinar la correlación entre la actividad N-acetilglucosaminidasa (Bosay Cotes 2004) y la actividad biocontroladora de S. marcescens sobre larvas de T. soianiuora obtenidas durante los cinco cultivos, se obtuvo un coeficiente de correlación de 0,8741 (p<0,05), valor que indica una correlación positiva y alta entre la actividad de dicha enzima presente en los extractos de Serratia y su actividad biocontroladora hacia larvas del insecto. Sin embargo, es probable que también otras enzimas quitinasas diferentes de ésta, estén implicadas en el proceso entomopatogénico de S. marcescens, ya que según Khoury et al. (1997), en S. marcescens se han identificado las quitinasas Chil, Chi2, Chi3 y Chi4; sin embargo, no hay datos que relacionen la actividad de estas quitinasas con la actividad biocontroladora de especies de Serratia.
Este resultado permite proponer un modelo matemático para relacionar la actividad de estas dos variables, con la posibilidad de cuantificar la actividad de dicha enzima como un marcador bioquímico predictivo de la actividad biocontroladora de un aislamiento de S. marcescens.
Y = A + B (X)
% de mortalidad = 31,98294436 + 55,33242548 x Actividad N-acetilglucosaminidasa (expresada en µmoles de PNP/ gde células).
Relación entre la actividad biocontroladora y la actividad quimoelastasa proteasa PR-1 presente en los extractos de S. marcescens. Al realizar la correlación entre los porcentajes de mortalidad acumulada y corregida de S. marcescens, con la actividad quimoelastasa proteasa detectada en los extractos de células, se determinó un coeficiente de correlación de 0,8775 (p<0,05), valor que indica una correlación positiva entre la actividad de dicha enzima con la actividad biocontroladora de S. marcescens hacia larvas de T. solanivora, siendo este valor de correlación ligeramente mayor que el obtenido con la actividad N-acetilglucosaminidasa. Este comportamiento enzimático coincide con lo mencionado por Dancer y Chantawannakul (1997), quienes observaron que las proteasas de Paenibacillus larvae (bacteria gram positiva, aeróbica y esporulante), tienen una importante función durante los estados tempranos de la infección en el insecto hospedero. Según estos autores, las proteasas de esta bacteria parecen estar implicadas directamente en el debilitamiento de la respuesta inmune del insecto, ya que estas enzimas degradan los polipéptidos antibacteriales tales como las apidaecinas y cecropinas, producidas durante los estados iniciales de la infección.
En el caso de las bacterias entomopatogénicas no formadoras de esporas, como las especies del género Serratia, las enzimas proteolíticas cumplen una importante función en la virulencia, ya que como estas bacterias carecen de esporas y cristales paraesporales, sus enzimas secretadas deben cumplir con esta función para facilitar la patogenicidad en los insectos. De acuerdo con este valor de correlación, se propone un modelo matemático para relacionar la actividad de estas dos variables. Esto da la posibilidad de utilizar la actividad de dicha enzima, como un marcador bioquímico predictivo de la actividad biocontroladora de aislamientos nativos de Serrafia spp.
Y = A + B (X)
% de mortalidad = 32,77596898 + 9,549201123 x Actividad quimoelastasa proteasa (expresada en µmoles de PNA/g de células).
Relación entre la actividad biocontroladora y la actividad (β-esterasa presente en los extractos de S. marcescens. Al correlacionar los porcentajes de mortalidad acumulada y corregida de S. marcescens, con la actividad β-esterasa detectada en los extractos (Bosa y Cotes 2004), se encontró un coeficiente de correlación de 0,70 (p<0,05). Indicando que posiblemente la actividad de esta enzima no es tan determinante en el proceso entomopatogénico de Serratia sp., con respecto a las actividades enzimáticas anteriores; aunque su actividad podría ser complementaria a otros mecanismos de acción de la bacteria. Esto podría coincidir con lo obtenido por Villamizar (1998), quien determinó un bajo coeficiente de correlación (0,55) entre la actividad esterasa de extractos de conidios de una cepa de M. anisopliae con su actividad biocontroladora hacia adultos de la langosta llanera R. schistocercoides, concluyendo de igual forma que dicha enzima no juega un papel determinante en el mecanismo de acción del hongo.
Conclusiones
• Los crecimientos sucesivos de S. marcescens sobre los medios de cultivo suplementados con estos sustratos, indujeron un incremento significativo de sus actividades enzimáticas y biocontroladoras, siendo mayores a partir del tercer crecimiento sucesivo de la bacteria sobre estos medios.
• Los sustratos potenciales inductores de virulencia salvado de trigoy homogeneizado de larvas de T. solanivora incorporados al medio de cultivo, además de incrementar la actividad de las enzimas N-acetilglucosaminidasa y quimoelastasa proteasa de los extractos de células de S. marcescens, incrementaron su actividad biocontroladora hacia larvas de T. solanivora.
• Se determinó una correlación positiva entre el incremento de la actividad quimoelastasa proteasa PR-1 y N-acetilglucosaminidasa en los extractos de células de la bacteria, con su actividad biocontroladora hacia T. solanivora. lo cual permitió proponer modelos de predicción de la actividad biocontroladora de otros aislamientos nativos de Serratia.
• Esta metodología desarrollada podría ser aplicada en procesos de cultivo a otras bacterias entomopatogénicas y otros insectos plaga.
Literatura citada
BALAKRISHNAN, H.; SRINIVASAN, M.; RELÉ, M. 1997. Extracellular protease activities in relation to xylanase secretion in an alkalophilic Bacillus sp. Biotechnology Letters 19 (7): 599-601. [ Links ]
BISWAS, S.; MISHRA, A.; NAMDA, Q. 1988. Xylanase and B-xylosidase production by Aspergillus ochraceus during growth on lignocelluloses. Biotechnollogy Bioenginering 31: 613-616. [ Links ]
BOSA, C. 2001. Efecto de la composición del medio de cultivo y los pases sucesivos sobre la actividad enzimática y biocontroladora de Serratia marcescens hacia Tecia solanivora Povolny (Lepidoptera: Gelechüdae). Tesis de Maestría en Ciencias Agrarias. Universidad nacional de Colombia, Facultad de Agronomía, Bogotá. 111 p. [ Links ]
BOSA, C.F.; COTES, A. M. 2004. Efecto de las condiciones de cultivo sobre la actividad enzimática de Serratia marcescens contra Tecia soíaniuora (Lepidoptera: Gelechüdae). Revista Colombiana de Entomología 30 (1): 79-85. [ Links ]
CALLAGHAN, M.; GARMHAM. L.; MELSON, T.; BAIRD, D.; JACKSON, T. 1996. The Pathogenicity of Serratia strains to Luciiia sericata (Díptera: Calliphoridae). Journal of Invertebrate Pathology 68 (1): 22-27. [ Links ]
CIBA-GEIGY. 1978. Manual de ensayos de campo. Cómo realizar un ensayo biológico. Bogotá, p. 14-18. [ Links ]
DANCER, B.; CHANTAWAMNAKUL, P. 1997. The proteases of American foulbrood scales. Journal of Invertebrate Pathology 7O: 79-87. [ Links ]
EWING, W.; MARTIN, W. 1981. Enterobacteriaceas. En: Manual de Microbiología Clínica. Cap 18, 2da edición. Barcelona, España, p. 192-223. [ Links ]
FLACH, J; FILET, R; JOLLES, R 1992. What's new in chitinase research?. Experientia 48: 701-716. [ Links ]
FLYG, C.; KERSTIM, K.; BOMAM, H. 1980. Insect pathogenic properties of Serraüa marcescens: Phage-resistant mutans with a decreased resistance to Cecropia Immunity and a decreased virulence to Drosophila. Journal of General Microbiology 120:173-181. [ Links ]
FOX, C.; JAQUES, R 1958. Mote on the greenmuscardine fungus Metarhizium anisopliae (Metsch) as a control for wireworms. Canadian Entomology 90: 314-315. [ Links ]
GODFRAY, H.; BRIGGS, C.; BARLOW, M.; CA-LLAGHAri, M.; GbARE, T.; JACKSOK, T. 1999. A model of insect-pathogen dynamics in which a pathogenic bacterium can also reproduce saprophytically. Proceddings Royal Society of London 266: 233-240. [ Links ]
GONZÁLES, M.; VALENCIA, A.; BUSTILLO, A. 1999. Incremento de la patogenicidad de B. bassiana hacia Hypothenemus hampeí, utilizando cutícula de broca en el medio de cultivo. Resúmenes XXVI Congreso Sociedad Colombiana de Entomología, Bogotá. 156 p. [ Links ]
GOODAY, G. 1994. Physiology of microbial degradation of chitin and chitosan. Biochemistry of Microbial Degradation p. 279-312. [ Links ]
GRAY, D. 1998. Sex Differences in Susceptibility of House Crickets, Acheta domesticas, to experimental Infection with Serratia liquefaciens. Journal of Invertebrate Pathology 71(3):288-289. [ Links ]
GRKOVIC, S.; GLARE, T.;TREVOR, A.; CORBETT, G. 1995. Genes essential for amber disease in grass grubs are located on the large plasmid found in 5. entomophila and S. proteamaculans. Applied and Environmental Microbiology 51 (6): 2218-2223. [ Links ]
HAWTIM, R.; ZARKOWSKA, T.; ARMÓLO, K.; THOMAS, C. 1997. Liquefaction of Autographa califomica Mucleopolyhedrovirus infected insects is dependent on the integrity of virus encoded chitinase and cathepsin genes. Virology 238: 243-253. [ Links ]
KHOURY, C.; MIMIER, M.; HUYMH, M.; GOFFIC, F. 1997. Optimal dissolved oxygen concentration for the production of chitinases by S. marcescens. Biotechnology Letters 19(11): 1143-1146. [ Links ]
LAME, B.; TRIMCI, A. 1991. Influence of cultural conditions on the virulence of conidia and blastospores of Beauveria bassiana to the green leafhopper Nephotettix virescens. Mycologycal. Research 95 (7): 829-833. [ Links ]
RABELO, F.; MOREIRA, W.; SANTOS, G. 1985. Efeito de sucesivas repicagens em arroz na virulencia de Metarhizium anisopliae para Deois flavopicta. Pesquisa Agropecuaria. Brasilia 20 (10): 1115-1118. [ Links ]
SAMPSOM, M.; GOODAY, G. 1998. Involvement of chitinases of Bacillus thurirígiensis during pathogenesis in insects. Microbiology 144: 2189-2194. [ Links ]
SCHAERFFEMBERG, B. 1964. Biológical environmental conditions for the development of mycoses caused by Beauveria sp., and Metarhizium sp. Journal of Invertebrate Pathology 6:8-20. [ Links ]
VILLAMIZAR, I. 1998. Efecto de la composición del medio de cultivo en la virulencia de Metarhizium anisopliae sobre la langosta llanera Rhammatocerus schistocercoides. Tesis de Maestría para optar al título de Microbióloga. Universidad Nacional de Colombia. Bogotá. 112 p. [ Links ]
Recibido: May. 02 / 2002 • Aceptado: Feb. 25/2003