Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.30 no.1 Bogotá Jan./June 2004
Desarrollo de preformulados a base de Nomuraea rileyi para el control de Spodoptera frugiperda (Lepidoptera: Noctuidae)
Development of preformulated producís based on iiomuraea rileyi for control of Spodoptera frugiperda (Lepidoptera: Moctuidae)
LAURA VILLAMIZAR1, CAROLINA ARRIERO2, CARLOS FELIPE BOSA O.3, ALBA MARINA COTES4
1 Autor para correspondencia: Química Farmacéutica M. Sc. Investigadora Laboratorio de Control Biológico. CORPOICA. C.I. Tibaitatá. Km 14 vía Mosquera. E-mail: laurafernanda@yahoo.es
2 Microbióloga Industrial. Pontificia Universidad Javeriana.
3 B. Sc. M. Sc. Investigador Laboratorio de Control Biológico. Corpoica. C.I. Tibaitatá.
4 Ph. D. Fitopatología. Investigadora Principal. Laboratorio de Control Biológico. CORPOICA. C.I. Tibaitatá. E-mail: acotes@corpoica.org.co
Resumen. Homuraea rileyi es el microorganismo que más frecuentemente se encuentra causando epizootias naturales en campo en larvas de Spodoptera frugiperda en diferentes zonas productoras de maíz en Colombia; sin embargo, en el mercado nacional no existe ningún producto registrado a base de este hongo. Por lo tanto, los objetivos del presente trabajo fueron los de desarrollar un método de producción masiva y desarrollar prototipos de bioplaguicida con una cepa del hongo N. rileyi seleccionada por su actividad para el control del gusano cogollero del maíz. Inicialmente se estandarizó un sistema de producción masiva de conidios, para lo cual se evaluaron matrices sólidas como arroz, salvado de trigo y granos de millo, contenidas tanto en bolsas de polietileno de alta densidad, como en bandejas de aluminio y suplementadas con fuentes de nitrógeno orgánico e inoculadas con diferentes tipos de inoculo. Una vez seleccionado el medio en el que se obtuvo el mayor rendimiento de conidios por gramo de sustrato, los conidios fueron separados y utilizados como principio activo para la elaboración de prototipos de bioplaguicida. En el sistema de producción masiva en bolsas, la mayor esporulación se produjo cuando se utilizaron granos de millo, inoculados con fragmentos de medio de cultivo crecido y esporulado de ocho días de edad, siendo ésta de 30 x 108 conidios.g-1. Se desarrollaron dos sistemas de entrega para el bioplaguicida, un concentrado emulsionable con una concentración de 1x10 11 conidios.g-1 y un polvo mojable con una concentración de 1x109 conidios.g-1, con germinaciones del 92 y 87%, respectivamente. Los sistemas de producción masiva resultaron eficientes y económicos para la obtención de conidios y los preformulados representan una alternativa promisoria para el control del gusano cogollero del maíz.
Palabras clave: Fermentación. Bioplaguicida. Formulación. Control biológico.
Summary. riomuraea rileyi is the microorganism that is most frequently found causing natural field epizootics of Spodoptera frugiperda larvae in different maize production zones of Colombia; however, in the national market there are no registered producís based on this fungus. Therefore, the objectives of the present work were to develop a method of mass production and develop biopesticide prototypes with a strain of the fungus n. rileyi selected for its control activity on the fall armyworm. A system for mass production of conidia was initially standardized after evaluating different solid matrices such as rice, wheat bran and mijo grains, contained in both, high density polyethylene bags and aluminum trays, supplemented with different organic nitrogen sources and inoculated with different inoculum types. Once the médium was selected where the greatest conidia production per gram of substrate was obtained, the conidia were separated and used as active starter for elaborating the biopesticide prototypes. In the system of mass production in bags, the highest sporulation took place when mijo grains were used, inoculated with eight day oíd fragments of agar grown with the sporulated fungus, this being at 30 x 108 conidia.g-1. Two delivery systems were developed for the biopesticide, an emulsifying concéntrate with a concentration of 1x1011 conidia.g-1 and a wettable powder with a concentration of 1x109conidios.g-1, with germinations of 92 and 87%, respectively. The systems of mass production were efficient and economical for conidia production and the preformulations represent a promising alternative for the control of the fall armyworm in maize.
Key words: Fermentation. Biopesticide. Formulation. Biológical control.
Introducción
El "gusano cogollero del maíz", Spodoptera frugiperda (J. E. Smith, 1797), es considerado la plaga más importante del maíz en muchas regiones de América (García et al.1999). La gran cantidad de hospederos alternos que tiene esta plaga hace que su dispersión sea amplia, asegurando su supervivencia y la abundancia de sus poblaciones (García 2000). En la actualidad el complejo Spodoptera es uno de los problemas principales en el manejo de plagas en el país. La incidencia alta de esta plaga ha hecho necesario el uso indiscriminado de insecticidas químicos, con dosis de hasta dos y tres veces las indicadas, dejando como consecuencia el desequilibrio biológico y la generación de resistencia (García 1996).
Diferentes trabajos realizados para manejar este insecto, han demostrado que la integración de medidas culturales, físicas, biológicas y químicas selectivas pueden disminuir las poblaciones del mismo, manteniéndolas por debajo de niveles de daño económico (García 1996).
Los hongos entomopatógenos representan una alternativa para el manejo de esta plaga. Entre ellos se destacan Metarhizium spp., Beauveria spp., Verticülíum sp. y riomuraea rileyi, los cuales actúan por contacto, invadiendo el cuerpo del insecto y causando la muerte (León y Pulido 1991). El hongo N. rileyi es una alternativa promisoria para controlar las poblaciones altas de larvas de S. frugiperda, ya que son frecuentes las epizootias naturales ocasionadas por el hongo sobre Spodoptera y otros lepidópteros. Este hongo imperfecto y dimórfico en su desarrollo es diferente de los hongos oportunistas Metarhizium anisopliae (Metschin) Sorokin y Beauueria bassiana (Bals.) Vuill., pues tiene unos requisitos de crecimiento muy exigentes, posee un amplio rango de hospederos y no tiene una fase saprofítica en el suelo (Boucias et al. 2000). N. rileyi no germina, ni crece, ni esporula a temperaturas superiores a 35°C, lo cual indica que no afecta a vertebrados homeotérmicos. Los conidios expuestos a jugos gástricos de humanos se inactivan rápidamente. Cuando se administró a ratas en dosis de 1,1x107 conidios/litro de aire durante una hora no se observaron anormalidades clínicas, patológicas o histopatológicas (Ignoffo et al. 1979).
A pesar de lo promisorio que puede resultar el uso de este entomopatógeno, no existe ningún bioplaguicida registrado a base de este hongo ni en Colombia ni en en el mundo, posiblemente por la dificultad que presenta este microorganismo para su producción masiva, ya que tiene unos requerimientos nutricionales específicos y es de desarrollo muy lento.
El logro de un bioplaguicida a base de este hongo, implica el cumplimiento de diversas etapas que garanticen la obtención de un producto seguro, eficaz y confiable. Dichas etapas comprenden el aislamiento del microorganismo, la evaluación de su actividad controladora, su producción masiva, estudios de preformulación, formulación, determinación de dosis y formas de aplicación, estudios de toxicidad, ensayos de campo, determinación de los mecanismos de biocontrol, estudios de impacto ambiental, caracterización molecular, estudios de mercado y patentamiento, entre otros (Gómez y Villamizar 2000)
Una etapa importante en el desarrollo de estos biocontroladores es la preformulación, la cual se define como el conjunto de actividades organizadas conducentes a la determinación de las características del principio activo y de los cambios químicos, físicos y microbiológicos que éste puede sufrir sólo o al combinarlo con los auxiliares de formulación necesarios para la elaboración del producto final (Gómez y Villamizar 2000).
Basados en los resultados de los estudios de preformulación, se desarrollan los estudios de formulación, cuyo objetivo es lograr la combinación correcta de ingredientes de tal manera que el ingrediente activo junto con los excipientes forme un bioplaguicida estable, efectivo, seguro, de fácil aplicación y aceptable para su uso (Morales 1993).
Los bioplaguicidas pueden ser formulados en diferentes presentaciones: los polvos para espolvoreo que se aplican directamente sobre las plantas empleando equipos adecuados. En éstos, la materia activa se encuentra dispersa en un vehículo inerte sólido y si es necesario se añaden al mismo agentes de fluidez y estabilizantes (Barbera 1976). Los polvos para reconstituir se presentan en forma de un polvo capaz de ser mojado y mantenerse en suspensión en el agua durante un período de tiempo largo (Barbera 1976). Los granulados tienen aspecto de arenilla con tamaños de partícula que oscilan entre 0,2 y 1,5 mm, ésta contiene el principio activo, el vehículo y el adherente (Barbera 1976). Los líquidos emulsionables constan de un principio activo en un medio graso apropiado al que acompañan los coadyuvantes necesarios, en estos productos su dilución en agua produce emulsiones formadas por gotitas finas de la formulación dispersas en agua.
La mayoría de las formulaciones de bioplaguicidas existentes en el mercado para el control de insectos plaga, fitopatógenos y malezas, están basadas en formas secas, polvos mojables o polvos de reconstitución en vehículos oleosos. El diseño de la formulación depende de la plaga, el sitio en que el plaguicida debe ser localizado, las condiciones medioambientales y el tipo de usuario al cual el producto será vendido (Gómezy Villamizar 2000).
Por tal razón, el propósito del presente trabajo fue el de estandarizar un medio de cultivo económico para la producción de conidios de N. rileyi y desarrollar prototipos de bioplaguicida para el control de S. frugiperda.
Materiales y Métodos
Microorganismo y medios de cultivo. La cepa que se utilizó en el presente estudio fue el hongo entomopatógeno N. rileyi, proveniente de Corpoica C.I. Palmira, la cual fue aislada de larvas enfermas de S. frugiperda recogidas en campo. Esta cepa se encuentra conservada en medio extracto de malta - extracto de levadura (YM) bajo aceite mineral estéril a una temperatura de 8°C y fue codificada como Nm 004 en el Banco de Germoplasma del Laboratorio de Control Biológico del Programa nacional de Manejo Integrado de Plagas de Corpoica C.I. Tibaitatá.
Medios de producción masiva. Ya que el principal requerimiento del hongo es la presencia de una fuente de nitrógeno orgánico en el medio de cultivo, se evaluaron diferentes hidrolizados de proteína, adicionados a matrices sólidas adecuadas.
Preparación de los bidrolizados de proteína
Se realizaron hidrolizados proteicos utilizando aquellas fuentes de nitrógeno que indujeron esporulación en los medios en caja de Petri: levadura seca, soya y malta. Los hidrolizados se obtuvieron siguiendo el método propuesto por Díaz y Forero (1997).
Producción masiva. La producción masiva de N. rileyi se realizó en bandejas de aluminio y en bolsas de polietileno de alta densidad que contenían diferentes matrices sólidas (salvado de trigo para las bandejas y arroz y fríjol soya para las bolsas), matrices comúnmente utilizadas en estos dos sistemas de producción.
Preparación de bandejas de aluminio
En bandejas de aluminio de 20 cm de largo por 14 cm de ancho y 3 cm de profundidad, se pesaron 34 g de matriz sólida (salvado de trigo) y se humedecieron con 120 mi del hidrolizado de proteína. Las bandejas se cubrieron con papel de aluminio y se esterilizaron durante 35 minutos a 121°C y 15 psi. Cada tratamiento consistió en la matriz sólida humedecida con cada hidrolizado de proteína. Se utilizaron cinco unidades experimentales por tratamiento.
Preparación de bolsas de polietileno
En bolsas de polietileno de alta densidad dobles, se colocaron 100 g de arroz o millo con 80 mi del hidrolizado de proteína. A las bolsas se les acondicionó un cuello en el que se ajustó un tapón de algodón y se esterilizaron durante 35 minutos a 121°C y 15 psi. Cada tratamiento consistió en la matriz sólida humedecida con cada hidrolizado de proteína. Se realizaron cinco repeticiones por cada tratamiento.
Tipos de inoculo. Con el objetivo de evaluar distintos tipos de inoculo para la producción masiva de conidios de N. rileyi, se probaron para la producción en bandeja los siguientes: suspensión de conidios que contenía 1x107 conidios.ml-1 y precultivo líquido crecido en medio YM sin agar durante 7 días y para la producción en bolsa se utilizó inoculación con fragmentos de medio de cultivo (YM) crecido con el hongo durante 15 días.
Las bandejas se cubrieron con una lámina plástica permeable al gas para evitar posibles contaminaciones y para permitir el intercambio de gases, facilitando el crecimiento del hongo (Marino 2001). Las bolsas se taparon de nuevo con el tapón de algodón y se sellaron con cinta de enmascarar (Gómez y Villamizar 1996).
Las bandejas y las bolsas se dejaron incubando en un cuarto de crecimiento con luz constante a una temperatura de 25°C.
Evaluación de resultadosPara evaluar el rendimiento de cada medio de cultivo, se utilizó la técnica de conteo en cámara de Meubauer, la cual permitió determinar el número de conidios producidos por gramo de medio en cada tratamiento, a los 10 días de incubación. Estos tiempos son los comúnmente utilizados para la producción de conidios de los hongos filamentosos trabajados en el Laboratorio de Control Biológico de Corpoica, seleccionando como óptimo, aquel medio en el que se presentó el rendimiento mayor. De igual manera se determinó el tiempo óptimo de incubación.
Para la evaluación en bolsas, se tomó un gramo del medio esporulado de una unidad experimental y se homogeneizó manualmente en erlenmeyers de 500 mi de capacidad con 300 mi de solución de Ttoeen 80 al 0,1%. Cada evaluación se realizó por triplicado, utilizando tres unidades experimentales (tres bolsas) por tratamiento.
Para la evaluación en bandejas, se tomaron tres muestras de 1 cm2 de medio por cada unidad experimental. Éstas se homogeneizaron en 300 mi de Ttoeen 80 al 0,1% dentro de una licuadora Osterizer® por 30 segundos a velocidad media. Cada evaluación se realizó por triplicado, utilizando tres unidades experimentales (tres bandejas) por tratamiento.
Obtención del principio activo
Utilizando el medio seleccionado, se procedió a la obtención del principio activo consistente en conidios puros y secos. El medio esporulado con el hongo se lavó con una solución de Tween 80 al 0,1% para remover los conidios de la matriz sólida. Se separaron las partículas grandes de esta suspensión, haciéndola pasar por un colador. El líquido resultante se centrifugó en una centrífuga de flujo continuo CEPA 77933® a 32.000 r.p.m. El sedimento consistente en la biomasa húmeda constituyó el principio activo (conidios húmedos) y el tamaño de éstos se determinó por observación al microscopio con un lente micro-métrico. Posteriormente, la biomasa húmeda se extendió en una bandeja de aluminio y se cubrió con papel absorbente para permitir un mejor intercambio gaseoso, con el fin de realizar el secado del principio activo durante 48 h a 25°C. Finalizado el tiempo de secado, los conidios se pulverizaron en un mortero y se tamizaron por una malla de 45 µm para obtener un tamaño de partícula homogéneo.
Elaboración de prototiposCon el principio activo (conidios secos) se elaboraron dos prototipos de bioplaguicida siguiendo metodologías estandarizadas previamente en el laboratorio. Los sistemas de entrega diseñados para el bioplaguicida consistieron en un concentrado emulsionable y en un granulo dispersable.
Caracterización de los prototipos
Viabilidad. Para evaluar la viabilidad se utilizó la técnica de recuento en placa, para lo cual se tomó 0.1 g de cada prototipo y se llevó a un volumen de 10 mi con solución de Tween 80 al 0,1%. A partir de esta suspensión se realizaron diluciones seriadas sembrando las diluciones10-6,107 y 10-8 por triplicado en cajas de Petri con medio YM y se incubaron por 96 horas a 25°C, tiempo en el cual se realizó el conteo de unidades formadoras de colonia (UFC), expresando los resultados como UFC.g-1,
Germinación. Esta prueba permite calcular el número de conidios viables por unidad de volumen o peso en 24 h. Se tomó 0,1 g de cada tratamiento y se llevó a un volumen de 10 mi con Tween 80 al 0,1%. A partir de esta suspensión se realizaron las diluciones 10-2 y 10-3 sembrándolas en cajas de Petri con medio YM. Transcurrido el tiempo de incubación (24 h), se agregó una gota de azul de lactofenol con el propósito de teñir los conidios del hongo. En el microscopio con un aumento de 40X, se realizó la lectura del número de conidios totales (germinados y no germinados) en 10 campos ópticos seleccionados aleatoriamente, expresando los resultados como porcentaje de conidios germinados.
Concentración. La cuantificación de la concentración de conidios permite determinar el número de unidades infectivas por unidad de peso o volumen (Vélez et al. 1997). Se tomó 0,1 g de cada prototipo y se adicionó a un volumen de 500 mi de agua, esta suspensión se agitó vigorosamente y se realizó el conteo de conidios en la cámara de Meubauer, expresando los resultados en conidios por gramo.
BioensayoPara la determinación de la actividad biocontroladora de los preformulados, se llevó a cabo un bioensayo bajo condiciones de laboratorio. Para tal fin, se evaluaron diferentes tratamientos que consistieron en cada prototipo (granulo dispersable y concentrado emulsionable), los excipientes de los dos prototipos, el principio activo (conidios secos), y conidios frescos provenientes de cultivo en caja de Petri. Con cada tratamiento se preparó una suspensión en una solución de Tween 80 (0,1%) y se realizaron diluciones seriadas, las cuales se ajustaron a una concentración de 1x106 conidios.ml-1. Se asperjaron 0,4 mi de cada tratamiento sobre una hoja de higuerilla (Ricinus comunms) y luego cada hoja se infestó con dos larvas de segundo instar de S. frugiperda, provenientes de una cría establecida previamente. Se utilizó un diseño experimental completamente al azar con treinta repeticiones por tratamiento y se utilizó un testigo tratado al cual se le aplicó una solución de Ttoeen 80 (0,1%). Las lecturas de mortalidad se realizaron cada 24 h durante dieciseis días. Los resultados de mortalidad se corrigieren con la fórmula de Schneider-Orelli (Ciba-Geigy 1973).
Análisis estadístico. Para todos los ensayos se utilizó un diseño completamente al azar con tres repeticiones para los ensayos de producción masiva y 30 repeticiones para el bioensayo. Para los estudios de producción masiva, la unidad experimental fue una bandeja o una bolsa y para los bioensayos, la unidad experimental consistió en cada recipiente con una hoja de higuerilla y dos larvas de S. frugiperda. Todos los resultados se sometieron a un análisis estadístico en el programa Statistix, mediante el cual se aplicó una prueba de comparación múltiple de medias de Tükey con una significancia de 0,05.
Resultados y Discusión
Medios de producción masiva. En la producción de N. rileyi realizada en bandejas con salvado de trigo humedecido con cada uno de los hidrolizados proteicos (solución de malta e hidrolizados de levadura y soya), se inocularon 10 mi de suspensión de conidios, observándose crecimiento micelial cinco días después de realizarse la inoculación. El micelio en todos los casos fue blanco y algodonoso y cubrió toda la superficie de la matriz sólida pasados siete días, tiempo después del cual el hongo empezó a esporular produciendo una coloración verde claro en la superficie de la matriz; posteriormente el cultivo tomó un aspecto polvoso y seco en todos los tratamientos. Al décimo día de incubación, el medio estaba totalmente colonizado, con una abundante producción y desprendimiento de conidios.
En los tratamientos inoculados con 10 mi de precultivo líquido, se observó micelio blanco 24 h después de haberse realizado la inoculación y 48 h después se inició la esporulación de color verde claro por toda la matriz sólida. Pasados siete días de incubación, los tratamientos presentaron hiperparasitismo, efecto que no se observó en los tratamientos en los que la inoculación se realizó con suspensión de conidios. Este hiperparasitismo posiblemente se debió a que al inocular el medio con precultivo líquido, la concentración de propágulos es mayor que en la suspensión, lo que favoreció una rápida colonización e iniciación de la esporulación y causó el agotamiento de los nutrientes del medio; sin embargo, al encontrarse el hongo dentro de un sistema con una elevada humedad relativa, los conidios producidos probablemente germinaron y produjeron micelio sobre la capa esporógena generada, por tal razón se recomienda para este tratamiento un tiempo total de crecimiento no mayor a siete días de incubación.
Cuando la matriz sólida se inoculó con suspensión de conidios, el inicio del desarrollo micelial tomó más tiempo que cuando se utilizó como inoculo el precultivo líquido, esto posiblemente se debió a que los conidios de la suspensión requieren un período de adaptación al medio de cultivo, mientras que al inocular con precultivo líquido el hongo se encuentra en crecimiento activo que se expresa como pellets de micelio en el medio líquido y al pasarlo al medio sólido, coloniza fácilmente, iniciando rápidamente la conidiación sobre la matriz sólida.
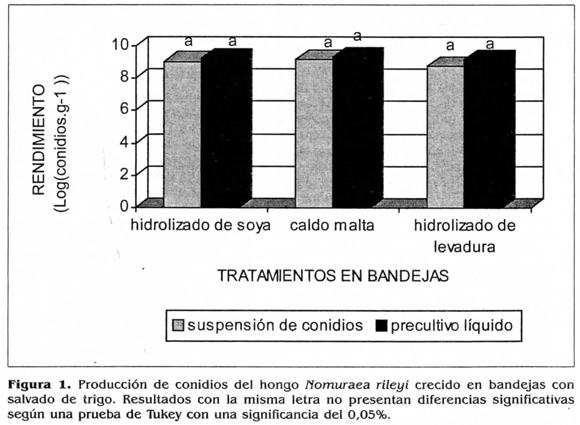
El rendimiento expresado como conidios producidos por gramo de medio de cultivo esporulado para cada sistema de inoculación fue: para el precultivo líquido 1,7x109 conidios.g-1 con el hidrolizado de soya, 1,1x109 conidios.g-1 con el hidrolizado de levadura y 2,1xl09 conidios.g-1 con la solución de malta, mientras que para la inoculación con suspensión de conidios se obtuvieron 1,2xl09 conidios.g-1 con el hidrolizado de soya, 8,9xl08 conidios.g-1 con el hidrolizado de levadura y 1,4x109 conidios.g-1 con el refresco de malta (Fig. 1).
La prueba de comparación múltiple de medias de Tukey, con un a=0,02, no detectó diferencias significativas entre los tratamientos evaluados para la producción masiva en bandejas. Las diferentes fuentes de nitrógeno orgánico utilizadas no tuvieron un efecto determinante en el rendimiento de conidios.gr-1, así como tampoco lo tuvieron los dos sistemas de inoculación evaluados (precultivo líquido y suspensión de conidios). Sin embargo, como se observa en la figura 1, el tratamiento consistente en bandejas con salvado de trigo humedecido con solución de malta e inoculadas con precultivo líquido, presentó el mayor rendimiento (2,1x109 conidios.g-1), por lo cual sería el sistema de multiplicación masiva más adecuado para la producción de conidios de N. rileyi en bandeja. No obstante, la inoculación con precultivo líquido es un proceso que aumenta los costos de producción, ya que se requiere de un tiempo de incubación total de 14 días a partir del cultivo en caja de Petri (siete días para crecer el precultivo en medio líquido y 7 días para el crecimiento en bandeja), incrementando el consumo de energía, materiales y reactivos; mientras que cuando la inoculación se realiza con suspensión de conidios a partir de caja de Petri, sólo se requieren 10 días de cultivo después de la inoculación de las bandejas y la producción de conidios no fue significativamente diferente de la obtenida con precultivo, requiriendo menos tiempo de incubación y resultando en consecuencia más económico. Además, el hecho de utilizar un sistema bifásico de producción, implica mayor manipulación y por lo tanto mayor riesgo de contaminación, como lo señalaron Gómez y Villamizar en 1996, quienes evaluaron la multiplicación de Metarhizium anisopliae en un sistema de producción en dos fases, la primera consistente en un medio líquido de levadura-sacarosa inoculado directamente con suspensión de conidios y la segunda en granos de arroz precocidos, obteniendo una producción de 4,3x108 conidios.g-1 de arroz esporulado y 3x109 conidios.g-1 de arroz esporulado al inocular con precultivo y con suspensión de conidios respectivamente; en este trabajo se seleccionó el sistema de inoculación directa con suspensión de conidios como el más adecuado, ya que la producción en dos fases aumentó el tiempo de incubación, propició una contaminación alta de las unidades experimentales y una mayor producción de micelio, con menor rendimiento de conidios por gramo de arroz que cuando se inoculó con suspensión. Por tal razón, para este estudio se seleccionó como sistema de inoculación la suspensión de conidios provenientes de un cultivo en caja de Petri en medio YM durante 15 días, ya que la producción obtenida no presentó diferencias significativas con respecto a la determinada cuando se inoculó con precultivo y además porque este proceso reduce tiempo, energía, materiales y riesgos de contaminación. El rendimiento mayor utilizando este tipo de inoculación se observó cuando el salvado se suplemento con refresco de malta, siendo éste de 1,4x109 conidios.g-1 de salvado esporulado, seleccionándose este medio para la producción en bandeja. La producción en bandejas con salvado se ha utilizado eficientemente para otros hongos, mostrando rendimientos similares a los obtenidos en este trabajo para N. rileyi, como lo indicó Castillo en el 2000, quien realizó la producción masiva de potenciales hongos antagonistas del hongo fitopatógeno Sclerotium cepivorum en un medio de salvado de trigo suplementado con arroz y obtuvo rendimientos de 2,9x109 conidios.g-1 para Trichoderma sp., de 4,8x109 conidios.g-1 para Beauveria sp., de 3,9x108 conidios.g-1 para Aspergillus sp., de 1,1x109 conidios.g-1 para Clonostachys rosea y de 1x109 conidios.g-1 para Gliocladium virens, considerando este medio de bajo costo, fácil preparación y adecuado para la producción de conidios de estos hongos.
En el sistema de producción de conidios de N. rileyi en bolsas con arroz o millo suplementado con los hidrol izados de proteína, se evaluaron tres métodos de inoculación: precultivo líquido, discos de medio YM esporulado y suspensión de conidios. En todos los casos se evidenció la colonización del sustrato por la presencia de micelio blanco en la superficie de los granos, a partir del séptimo día se observó una coloración verde claro como signo de esporulación, la cual se tornó intensa y homogénea en todas la bolsas (Fig. 2). La producción en bolsas plásticas es de fácil manejo, permite el traslado fácil de las unidades de producción (bolsas), de un lugar a otro y la diseminación rápida del inoculo. Métodos similares de producción masiva sobre granos de cereales en bolsas, han sido indicados para el hongo entomopatógeno Beauveria brongniartii por Aregger (1992), quien obtuvo 3,24 x106 conidios.g-1 de cebada después de 14 días de incubación, 1xl08 conidios.g-1 a los 24 días y 2x109 conidios.g-1 después de 42 días de incubación; Gómez y Villamizar (1996) produjeron conidios de M. anisopliae y M. flavoridiae en bolsas con arroz precocido estéril y obtuvieron rendimientos de 1x011 conidios.g-1 de medio esporulado para las dos especies; igualmente Winder (1999) produjo Fusarium avenaceum en un medio consistente en granos de trigo suplementado con extracto de malta, con un rendimiento de 1x109 conidios.g-1.
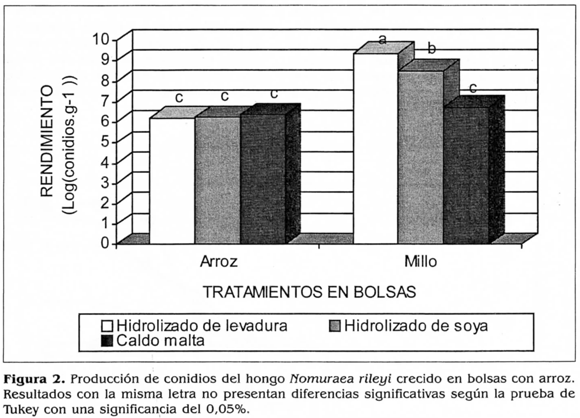
El rendimiento de N. rileyi en conidios por gramo de arroz esporulado obtenidos en el presente estudio con cada tratamiento evaluado fue: con el hidrolizado de soya de 6,5x108 conidios.g-1; con el hidrolizado de levadura de 9,7x108 conidios.g-1 y con la solución de malta de 3,7x108 conidios.g-1. La producción de conidios de N. rileyi por gramo de millo esporulado obtenidos en el presente estudio con cada tratamiento evaluado fue: con el hidrolizado de soya de 5,5x108 conidios.g-1; con el hidrolizado de levadura de 1,9x109 conidios.g-1 y con el refresco de malta de 1,1x108 conidios.g-1.
La prueba de comparación múltiple de medias de Tukey con un a=0,02, no detectó diferencias significativas entre los tratamientos en que se utilizó como matriz sólida arroz y se varió la fuente de nitrógeno orgánico, sugiriendo que los hidrolizados de proteína evaluados tuvieron similar efecto sobre la producción de conidios cuando se realizó el cultivo en este sustrato. La producción en millo en todos los casos fue superior y significativamente diferente de la obtenida en arroz, sugiriendo que el millo es más eficiente desde el punto de vista nutricional para la esporulación de N. rileyi que el arroz, posiblemente debido a que este sustrato presenta una cutícula que dificulta la disponibilidad de nutrientes, mientras que en el arroz, los carbohidratos están muy disponibles, favoreciendo el crecimiento vegetativo por exceso de fuente de carbono y desfavoreciendo la conidiación, la cual se estimula cuando la fuente de carbono está en concentraciones bajas (Galbraith y Smith 1969).
Dentro de los diferentes tratamientos en los cuales se utilizó como matriz sólida el millo, el análisis estadístico detectó diferencias significativas entre la utilización del hidrolizado de levadura y las dos fuentes de nitrógeno restantes, siendo el hidrolizado de levadura el que produjo el mayor y estadísticamente significativo rendimiento de conidios por gramo de sustrato. La mayor producción de conidios con esta fuente de nitrógeno se podría deber a que la levadura no sólo es una fuente de nitrógeno sino que contiene una gran cantidad de nutrientes como microelementos y vitaminas como las del complejo B, para los cuales se ha demostrado su efecto inductor de la esporulación (Villamizar 1998).
Silva y Loch (1987) produjeron 7Y. rileyi en granos de arroz suplementarios con extracto de levadura; sin embargo, el crecimiento del hongo en este medio fue muy pobre. El crecimiento micelial se obtuvo solamente siete días después de la inoculación y una esporulación reducida se observó a los 15 días de incubación, el rendimiento final fue de 6,65x105 conidios.g-1 de arroz, resultado inferior al obtenido en este estudio en el cual se alcanzaron rendimientos superiores a IxlO8 conidios.g-1 de arroz; es decir, aproximadamente 100 veces más conidios que los obtenidos por los mencionados autores. Esta producción mayor podría deberse a diferencias intrínsecas de las cepas de N. rileyi, a la fuente de nitrógeno utilizada, o a diferencias en los niveles de humedad de los granos de arroz que en el presente trabajo pudieron favorecer la esporulación del hongo. Los hidrolizados proteicos y las matrices sólidas utilizadas en este trabajo son una alternativa promisoria para la producción masiva de conidios de N. rileyi, ya que en todos los casos, se obtuvo un buen crecimiento micelial con altos rendimientos de conidios. Los componentes usados para los medios de cultivo son fáciles de conseguir y su costo bajo, lo cual podría hacer a estos medios adecuados para una producción a nivel industrial.
A pesar de que el rendimiento en conidios por gramo de sustrato fue mayor en el mejor tratamiento en bandejas con respecto al mejor tratamiento obtenido en bolsas, la separación de conidios a partir del salvado utilizado para las bandejas fue más dispendiosa y poco práctica para ser utilizada a nivel industrial, por tal razón se seleccionó la producción en millo para continuar con los estudios de preformulación. La separación de conidios a partir de los granos de millo fue muy sencilla y no se observaron pérdidas significativas ya que la superficie del grano quedó totalmente limpia.
Caracterización de los prototipos de bioplaguicida. Se desarrollaron dos prototipos de bioplaguicida diferentes a base de N. rileyi, los cuales consistieron en un concentrado emulsionable y en un granulado dispersable. Estos fueron caracterizados por medio de pruebas de viabilidad, germinación, humedad y concentración (Tabla 1).
Los resultados de concentración obtenidos para los dos prototipos fueron de 1,2 x 109 conidios.g-1 para el granulo dispersable y de 8,1 x 109 conidios.g-1 para el concentrado emulsionable, resultados que no fueron estadísticamente diferentes entre sí. Estas concentraciones se consideran adecuadas para este tipo de productos y son las comúnmente encontradas en los productos comerciales a base de hongos entomopatógenos. Para la reconstitución de los productos se recomendaría una relación de 1 kg en 200 l de agua, que serán utilizados por hectárea, siendo esta cantidad adecuada y similar a la utilizada con plaguicidas químicos, lo que no cambiaría drásticamente las costumbres del agricultor.
En estos prototipos, se obtuvo una viabilidad de 1x109 UFC.g-1 para el granulo dispersable y de 7,6 x 109 UFC.g-1 para el concentrado emulsionable, no siendo estos resultados significativamente diferentes de acuerdo con la prueba de Tukey. Al comparar estos resultados con los obtenidos en concentración, se podría pensar que la mayoría de los propágulos contados al microscopio están viables y que los excipientes o el proceso de formulación no afectó significativamente la viabilidad de las células.
Para la prueba de porcentaje de germinación se observó que el granulo dispersable presentó una germinación significativamente inferior a la del concentrado emulsionable, siendo ésta del 68% para el granulo dispersable mientras que para el concentrado emulsionable, la germinación fue del 91,2%. Estas diferencias en germinación pudieron deberse al proceso de formulación ya que para la elaboración del granulado dispersable, las esporas se ven sometidas a dos operaciones de secado, mientras que para el otro formulado sólo se realiza un secado. Este doble secado pudo haber afectado drásticamente a las células, dicho proceso es uno de los más limitantes en la estabilidad de los microorganismos ya que puede producir pérdida de agua intracelular, cambios enzimáticos, genéticos y daño de la membrana celular (Bahamón et al. 2001).
Los valores de humedad determinados para los prototipos fueron de 9,8 y 6,3% para el granulo y el concentrado emulsionable respectivamente, valores que se encuentran dentro del límite establecido como aceptable para productos de este tipo, el cual debe ser inferior al 10% (Mariño 2001). Sin embargo, en el proceso de formulación podría optimizarse el secado para lograr humedades inferiores al 5% que garanticen mayor estabilidad del microorganismo bajo condiciones de almacenamiento.
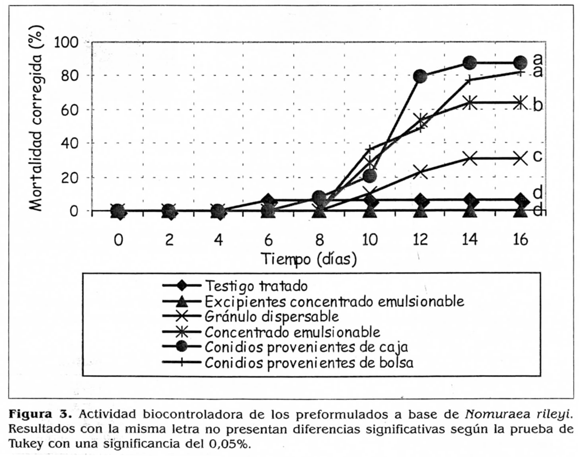
En la determinación de la actividad biocontroladora de los diferentes prototipos, se obtuvieron cuatro grupos que presentaron diferencias estadísticas. El primero, el cual produjo los porcentajes mayores de mortalidad de larvas de S. frugiperda, estuvo conformado por los conidios puros tanto provenientes de caja de Petri como el principio activo de los formulados consistente en conidios puros y secos provenientes del cultivo en millo, con mortalidades acumuladas de 87,1 y 82% respectivamente. El segundo grupo significativo consistió en el concentrado emulsionable, el cual causó una mortalidad del 64%, seguida por el tercer grupo estadístico consistente en el granulo dispersable que produjo una mortalidad del 30,7% y por último, los excipientes y los testigos que causaron mortalidades inferiores al 10% (Fig. 3).
Estos resultados indican que las dos formulaciones afectaron la actividad biocontroladora del microorganismo, obteniéndose porcentajes de mortalidad significativamente inferiores con los prototipos en comparación con los conidios sin formular, lo cual se puede deber a las operaciones de cada proceso o a alguno de los adyuvantes de formulación que podrían afectar las células o interferir en el proceso de infección. También se observaron diferencias estadísticas entre los dos formulados, siendo más eficiente el concentrado emulsionable que el granulo dispersable.
Esto se podría relacionar con los resultados de germinación, ya que como se mencionó anteriormente, los conidios presentes en el granulo dispersable tienen una germinación inferior a la del concentrado emulsionable, siendo éste uno de los parámetros fundamentales en el mecanismo de acción (Clarkson y Charnley 1996), que pudo repercutir en la actividad biocontroladora baja del producto.
Para los dos prototipos, los excipientes o adyuvantes no causaron ningún efecto negativo sobre las larvas del gusano cogollero del maíz, indicando que el efecto biocontrolador de los prototipos se debe a la acción del hongo entomopatógeno.
El concentrado emulsionable se seleccionó para continuar con los estudios de formulación, en los cuales se buscará la causa de la disminución de la actividad biocontroladora en los productos formulados, se ajustará la composición de los prototipos y se optimizarán las operaciones del proceso para lograr una mayor eficiencia biocontroladora.
Conclusiones
• El método de inoculación para el sistema de producción en bandeja mediante el uso de una suspensión de conidios fue el más adecuado.
• La producción masiva sobre las matrices sólidas salvado de trigo suplementario con malta e inoculado con suspensión de conidios en bandejas y los granos de millo suplementarios con el hidrolizado de levadura e inoculados con discos de agar YM crecidos con el hongo durante 15 días en bolsa fueron seleccionados como los sistemas más eficientes para la producción de conidios de N. rileyi.
• Las dos formulaciones afectaron negativamente la actividad biocontroladora del microorganismo.
• El concentrado emulsionable fue el prototipo más adecuado para continuar con los estudios de formulación y optimización.
Literatura citada
AREGGER, E. 1992. Conidia production of the fungus Beauveria brogniartii on barley qnd quality evaluation durin storage at 2°C. Journal of invertebrate Pathology 59: 2-10. [ Links ]
BAHAMÓM, T.; AYCARDI, E.; OROZCO, R; MARÍN, R; BUSTILLO, A. 2O01. Preservación de la patogenicidad de Beaiweria bassiana (Bálsamo) Vuillemin (Moniliales: Moniliaceae) contra la broca del café en diferentes sistemas. Revista Colombiana de Biotecnología 3(1): 80-90. [ Links ]
BARBERA, C. 1976. Pesticidas agrícolas. Capítulo 1-2, Ed. Ediciones Omega, S. A. p. 9-46. [ Links ]
BOUCIAS, D. Q.; TIGAMO, M. S.; SOSA-GOMEZ, D. R.; GLARE, T. R.; INGLIS, P. W. 2000. Genotypic properties of the entomopathogenic fungus Nomuraea rileyi. Biológical Control 19: 124-138. [ Links ]
CASTILLO, N. 2000. Aislamiento, identificación y selección de potenciales hongos antagonistas al hongo Sclerotium cepivorum Berk causante de la pudrición blanca de la cebolla de bulbo (Alliwn cepa L). Tunja, Colombia. Trabajo de grado (Ingeniero Agrónomo). Universidad Pedagógica y Tecnológica de Colombia, facultad de Ciencias Agropecuarias. Escuela de Agronomía. 143 p. [ Links ]
CIBA - GEIGY. 1973. Como realizar un bioensayo. Manual de ensayos de campo, p. 2-10. [ Links ]
CLARKSOM, J.; CHARNLEY, K. 1996. Mew insights into the mechanisms of fungal pathogenesis in insects. Trends in Microbiology 4 (5): 197-202. [ Links ]
DÍAZ, A.; FORERO, M. 1997. Producción y purificación del complejo espora cristal de Bacillus thw'mgiensis HD 137 con actividad contra Spodoptera frugiperda. Bogotá, Colombia. Trabajo de grado (Ingeniero Químico). Universidad nacional de Colombia. Facultad de Ingeniería. 161 p. [ Links ]
GALBRAITM, J.; SMITH, J. 1969. Sporulation of Aspergillus niger in liquid culture. Journal of General Microbiology. Gran Bretaña 59: 31-45. [ Links ]
GARCÍA R., F. 1996. Integración de métodos para el manejo de Spodotera frugiperda (J. E. Smith) p. 59-64. En: Manejo integrado de plagas y enfermedades en maíz y sorgo. Boletín de sanidad vegetal 13. ICA Ed. Produmedios. Palmira. [ Links ]
GARCÍA, F. 2000. Manejo integrado del gusano cogollero del maíz, Spodoptera frugiperda. En: Corpoica-MIP. I Curso-Taller Internacional Control Biológico, componente fundamental del manejo integrado de plagas en una agricultura sostenible. Bogotá, Colombia. A. López-Avila (ed.). p. 146-154. [ Links ]
GARCÍA R., F.; MOSQUERA, A. T.; VARGAS S., C. A.; ROJAS A., L. 1999. Manejo integrado del gusano cogollero del maíz Spodoptera frugiperda (J. E. Smith). Boletín informativo Convenio Corpoica-PROMATTA. Palmira. Mayo. 19 p. [ Links ]
GÓMEZ A., M. I.; VILLAMIZAR R., L. F. 1996. Estudio tecnológico para la producción masiva y preformulación del hongo entomopatógeno Metarhizium sp. para el control biológico de la langosta de los llanos orientales. Bogotá. Trabajo de grado (Químico Farmacéutico). Universidad nacional de Colombia. Facultad de Ciencias. 112 p. [ Links ]
GÓMEZ. M. I; VILLAMIZAR, L. F. 2000. Formulación de bioplaguicidas. En: Corpoica-MIR I Curso-Taller Internacional Control Biológico, componente fundamental del manejo integrado de plagas en una agricultura sostenible. Bogotá, Colombia. Editor A. López-Avila. p.108-112. [ Links ]
IGMOFFO, C. M.; GARCÍA, C.; KAPP, R.W.; COATE, W. B. 1979. An evaluation of the risks to mammals of the use of an entomopathogenic fungus, nomuraea rileyi, as microbial insecticide. Environmental Entomology 8 (2): 354-359. [ Links ]
LEÓN M., G. A.; PULIDO, J. I. 1991. Importancia del control natural del cogollero Spodoptera frugiperda J.E. Smith p. 78-82. En: Memorias seminario Spodoptera frugiperda (El gusano cogollero) en sorgo, maíz y otros cultivos. Cali, Colombia. [ Links ]
MARINO C., P. F. 2001.Caracterización y evaluación de la estabilidad biocontroladora y microblológica de preformulados granulados a base del hongo entomopatógeno Metarhizium anisopliae para el control de la chiza Ancognatha scarabaeoides. Bogotá. Trabajo de grado (Microbiología Industrial) Universidad Javeriana. Facultad de Ciencias. 126 p. [ Links ]
MORALES, L. 1993. Formulación de bioinsecticidas, biotecnología para la producción de bioinsecticidas microbianos centrada en Bacillus thuringiensis. Universidad nacional Autónoma de México. México, p. 85-89. [ Links ]
SILVA, L.; LOCH, L. 1987. Esporulacao do fungo entomopatogenico nomuraea rileyi (Farlow) Samson em meio de cultura a base a graos de arroz polidos. An. Soc. Entomol. Brasil 16 (1): 213-222. [ Links ]
VÉLEZ, P; POSADA, F.; MARÍN, F; GONZÁLEZ, G. M.; OSORIO, V. E.; BUSTILLO, A. E. 1997. Técnicas para el control de calidad de formulaciones de hongos entomopatógenos. Boletín Técnico No 17. Cenicafé. Chinchiná, caldas, Colombia, p. 7-25. [ Links ]
VILLAMIZAR, L.F. 1998. Efecto de la composición del medio de cultivo en la virulencia de Metarhizium anisopliae sobre la langosta llanera Rhammatocerus schistocercoides. Bogotá. Tesis (M. Se. Microbiología). Universidad Nacional de Colombia. 112 p. [ Links ]
WINDER, R. S. 1999. The influence of substrato and temperatura on the sporulatlon of Fusarium avenaceum and its virulence on marsh reed grass. Myvological Research 103 (9): 1145-1151. [ Links ]
Recibido: Abr. 22/2003 • Aceptado: Ago. 11 / 2003