Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.30 n.2 Bogotá jul./dez. 2004
Determinacion del azucar preferencial en la dieta de Lutzomyia evansi (Nuñeztovar) (Diptera: Psychodidae)
Determination of the preferred sugar in the diet of Lutzomyia evansi (Nuñeztovar) (Diptera: Psychodidae)
GILBERTO BASTIDAS R1, MILAGROS OVIEDO2, ALEJANDRA VlVENES J.3 , ADALBERTO GONZALEZ3
1Autor para correspondencia: Profesor e Investigador del Centro de Investigaciones en Enfermedades Tropicales "Dr. J. W. Torrealba" Apdo. 214, adscrito a la Universidad de Carabobo. Valencia-Venezuela. E-mail: bastidasprotozoo@hotmail.com
2Profesora e Investigadora del Centro de Investigaciones Jose Witremundo Torrealba. Laboratorio de Biologia de Lutzomyia e Insectario Pablo Anduze. Trujillo-Venezuela. E-mail: longipalpis@cantv.net
3Investigadores del Centro de Investigaciones Jose Witremundo Torrealba. Laboratorio de Biologia de Lutzomyia e Insectario Pablo Anduze. Trujillo-Venezuela.
Resumen. Los azucares han sido señalados por jugar un papel clave en la biologia y relacion parasito Leishmania - hospedador. Bajo condiciones experimentales se preciso el azucar de preferencia en la dieta de Lutzomyia evansi vector alterno de Leishmania chagasi. A hembras de una colonia de L. evansi y hembras silvestres, postdeprecion de azucares naturales, se les ofreciò a la vez y durante 72 h: fructosa, sacarosa, melezitosa. glucosa, galactosa y maltosa debidamente marcados con colorantes vegetales; bajo lupa binocular se determino el azucar ingerido por el color presente. Los resultados se compararon con los obtenidos con hembras de colonia de L. longipalpis. De 618 hembras de L. evansi ensayadas, en 340 se detecto fructosa (55%) indistintamente del colorante empleado seguido por melezitosa (18,6%) y sacarosa (15,5%). Resultados similares fueron obtenidos con 199 hembras de colonia. En contraste, L. longipalpis prefirio sacarosa (34%), seguida de glucosa (29%) y fructosa (24%). La prueba de antrona evidencio en hembras silvestres la presencia de fructosa en 55,5% de la muestra. Estos hallazgos son relevantes para la biologia de la especie y pudieran ser significativos en el establecimiento y patron de desarrollo del parasito dentro del insecto vector.
Palabras clave: Dieta. Aziicares reductores. Leishmaniosis.
Summary. Sugars have been shown to play an important role in the biology and relationship between the host and parasitic Leishmania. Under experimental conditions the preferred sugars in the diet of Lutzomyia evansi, alternate vector of Leishmania chagasi. were determined. After the depletion of their natural sugars, females from the wild and females from a colony of L. evansi were periodically offered, over a period of 72 hours, fructose, saccarose, melezitose, glucose, galactose and maltose, identified by different vegetable colorings; the ingested sugar was determined by its color under a binocular magnifying glass. The results were compared with those from a colony of L. longipalpis. Of 618 wild L. evansi studied, fructose was detected in 340 females (55%), regardless of the color used, followed by melezitose (18,6%) and saccarose (15,5%). Similar results were obtained from 199 females from the colony. In contrast, L. longipalpis preferred saccarose (34%), followed by glucose (29%) and fructose (24%). The anthrone test detected the presence of fructose in 55,5% of the sample of females from the wild. These discoveries are relevant to the biology of the species and could be significant in the establishment and pattern of parasite development inside the insect vector.
Key words: Diet. Sugar reductors. Leishmaniosis
Introduccion
El azucar es el alimento basico de los mosquitos, es el unico nutriente consumido por machos y probablemente uno de los mas comunes para las hembras, aun cuando ellas necesitan sangre de vertebrado para producir huevos. Se sostiene que los machos toman azucar varias veces durante su vida y las hembras, poco despues de su emergencia (Foster 1995).
En la naturaleza, las fuentes naturales de azucar son nectar, jugos de plantas, (Sandholm y Price 1962; Shleim y Warburg 1986) frutos maduros y secreciones de afidos y coccideos. Scorza et al. (1985)sugieren que el fruto maduro del cafeto puede servir como fuente de azucar para Lutzomyia youngi (Feliciangeli y Murillo, 1987) y Killick - Kendrick (1979) propone que la solucion excretada por los afidos podria ser importante como fuente de energia. Estos carbohidratos son indispensables para los flebotomos adultos de ambos sexos puesto que proporcionan energia para el vuelo y otras actividades y ademas, para las hembras es el complemento de la ingesta sanguinea (Samie et al. 1990). Otros estudios señalan la influencia de la presencia de afidos en la densidad de los flebòtomos, señalandose una accion fagoestimulante de tales secreciones sobre los insectos (Cameron et al. 1995). Asi mismo. los flebotomos muestran preferencia hacia ciertas especies de plantas al momento de realizar la ingesta azucarada y ante diferentes tipos de azucares (Chaniotis 1974; Schlein y Warburg 1986; Castillo 1989).
Trazas de diferentes azucares, monosacaridos y disacaridos, se han detectado en el tracto digestivo de diferentes especies de flebotomos, tanto del Viejo como del Nuevo Mundo; entre estos se mencionan: glucosa, sacarosa, maltosa, arabinosa y melobiosa encontrados libres en la naturaleza y se sugiere la presencia de una enzima invertasa glicosidasa en el intestino capaz de degradar los disacaridos a sus componentes monosacaridos (Young et al. 1980; Castillo 1989: Morton et al. 1991).
La presencia de fructosa y de otros carbohidratos, que por hidrolisis generan fructosa, fue verificada por Young et al. (1980) en Phlebotomus ariasi mediante la prueba de antrona en trio descrito por Van Handel (1967). Empleando otra metodologia, Añez et al. (1994) detectaron por cromatografia de gas, en el intestino y diverticulo esofagico de L. youngi, sacarosa, fructosa, glucosa y maltosa, sugiriendo que estos cuatro azucares son comunmente ingeridos por flebotomos de ambos sexos. Se ignora cual puede ser el azucar preferido por Lutzomyia evansi, considerado vector de leishmaniosis visceral en algunas areas de Colombia y Venezuela (Travi et al. 1990; Aguilar et al. 1998; Feliciangeli et al. 1999; Vivenes 2000).
Ademas de su valor energetico, los azucares influyen de manera significativa en el establecimiento y desarrollo de parasitos leishmanicos dentro del insecto. Ejercen accion quimiotactica sobre estos parasitos determinando su migracion anterior y posterior colonizacion del intestino anterior, asegurando su transmisiòn al hospedador vertebrado. En sentido contrario, pueden inhibir la union de los parasitos a los receptores lectinicos presentes en la superficie del intestino del insecto bloqueandolos o induciendo su liberacion (Molyneux et al. 1986).
Como parte de un estudio sobre biologia de L. evansi y su papel como transmisor de Leishmania chagasi, se investigò la preferencia de azucar por esta especie en ejemplares silvestres y de colonia y se preciso la presencia de fructosa y otros azucares en hembras silvestres.
Materiaies y Metodos
Los ejemplares de L. evansi utilizados en este estudio fueron; poblaciones de colonia de 48 horas de emergencia, obtenidas de acuerdo con Oviedo et al. (1995) y mantenidas en el Centro de investigaciones "Jose Witremundo Torrealba" en Trujillo, Venezuela y poblaciones silvestres coleccionadas sobre trampas Shannon en dos localidades del estado Trujillo de la region andino-venezolana; los Pajones (9° 30'28" LN y 70°33' 19 "LO) y Montaña de Peraza (9°27'05" LN y 70° 31 '33" LO) considerada esta ultima como un foco endemico de leishmaniosis visceral. Asi mismo, se emplearon ejemplares de colonia de L. longipalpis (Lutz y Neiva, 1912) comprobado vector de L. chagasi en el Neotropico.
Se hicieron dos tipos de experimentos:
1) Estudio de la preferencia de azucar por hembras silvestres y de colonia de L. evansi y hembras de colonia de L. longipalpis mediante ingesta de azucares coloreados con colorante vegetal Mc Cormick®, ya que esto permitia probar varios azucares en una prueba competitiva y visualizar en forma practica el carbohidrato ingerido. En el caso de las hembras silvestres de L. evansi, estas se mantuvieron en ayunas durante 72 h a 25°C y 90% de humedad relativa para que depletaran los carbohidratos ingeridos naturalmente. Posteriormente, se les proporciono en trozos de polietileno, soluciones saturadas de fructosa (monosacarido), sacarosa (disacarido), melezitosa (trisacarido), maltosa (disacarido), glucosa (monosacarido) y galactosa (SIGMA) previamente marcadas con colorante vegetal (Mc Cormick) y renovadas cada 24 h.
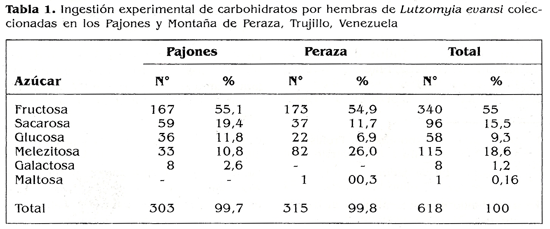
Con la finalidad de evitar un eventual sesgo de escogencia por el color de las soluciones azucaradas, se realizaron 6 replicas en cada una de las cuales se intercambio el color del azucar; los colorantes empleados fueron: rojo, amarillo. azul, verde, anaranjado y morado. Los ensayos se hicieron de manera competitiva; es decir, se le suministro al mismo grupo de insectos, en forma simultanea seis azucares marcados con diferente color. Transcurridas 48 h cada insecto fue disecado y bajo lupa binocular se determino el azucar ingerido por el color presente. Se ensayaron 618 hembras silvestres de L. evansi. de estas 303 se coleccionaron en los Pajones y 315 en Montaña de Peraza.
Igual procedimiento fue empleado para detectar la preferencia de carbohidratos en hembras de colonia de L. evansi y hembras de colonia de L. longipalpis.
2) Investigaciòn de la ingesta natural de azucar por hembras silvestres de L. evansi por medio de la prueba de antrona (Van Handel 1967). Inmediatamente despues de capturados los insectos, fueron narcotizados con dioxido de carbono para evitar la depleciòn de los azucares naturales, y se colocaron en placas de titulacion y fueron triturados (cada uno) con una varilla de vidrio para evitar contaminaciòn. Luego se les agrego 0.16 ml de solucion de antrona al 0.1% (w/v) en 72% (v/v) de acido sulfurico en frio.
La positividad de la prueba fue leida por la aparicion de un color azul, empleando una escala subjetiva (0, +, ++ y + + +) de acuerdo con la intensidad del color desarrollado en un tiempo no mayor de 15 minutos. Los insectos negativos fueron aquellos que no revelaron color en el lapso de una hora.
Resultados
Ingestion selectiva de azucares coloreados
Los resultados obtenidos en la ingestion experimental de carbohidratos se presentan en la tabla 1. Se evidencia que del total de la muestra, 618 flebotomos, el 55% ingirio fructosa seguida de un 18,6% de melezitosa y 15,5% de sacarosa. Los azucares rcstantes glucosa, galactosa y maltosa se ingirieron en muy baja proporcion, lo que muestra una franca preferencia de L. evansi por la fructosa. Cuando se analizan los insectos por area de procedencia para ambas localidades es marcada la preferencia por fructosa, pero en el caso de la ingestion de melezitosa fue mayor en las hembras de Montañas de Peraza con un 26% en comparacion con un 10,8% de las hembras provenientes de la localidad de los Pajones.
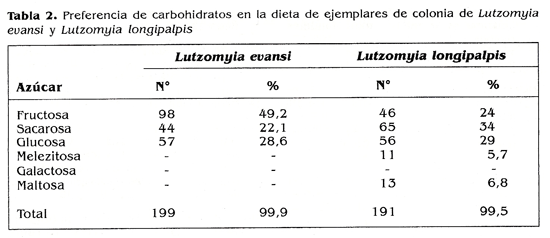
En cuanto a la preferencia por fructosa, resultados similares se observaron en especimenes de colonia, en donde, de 199 hembras ensayadas el 49,2% ingiriò fructosa, independientemente del colorante utilizado. Sin embargo, en las hembras de colonia no se detecto ingestion de melezitosa, solo ingirieron fructosa, glucosa y sacarosa (Tabla 2). En esta misma tabla se muestran los resultados obtenidos en especimenes de colonia de L. longipalpis, en cuyos ejemplares se detectaron los marcadores de sacarosa, melezitosa y maltosa. lo que sugiere que la especie pareciera ser ecleptica en la ingestion de azucares; solo se observa una ligera predileccion por sacarosa, ya que el 34% de las 191 hembras ensayadas mostraron el marcador de sacarosa.
Ingesta natural de azucar
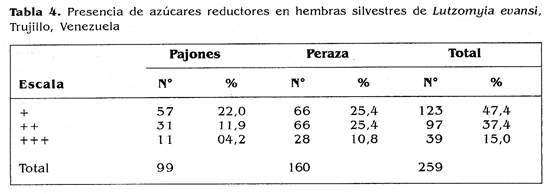
En cuanto a la deteccion de azucares reductores en hembras silvestres mediante la prueba de antrona, se evidencio en general que el 55,5% de las hembras reacciono positivamente en un tiempo no mayor de 15 minutos (Tabla 3). El contenido de fructosa se observo en diferentes conreaccion leida como positiva, desde + hasta + + + .
De los 259 ejemplares reactivos, 47,3% dieron reaccion debilmente positiva (+); el 37,4% dieron reacciones francamente visibles ( ++) y el 15% dieron una reaccion intensamente positiva ( + ++); todo antes de 15 minutos como se ejemplifica en la tabla 4. Los insectos que no reaccionaron con la prueba de antrona despues de una hora de exposlcion fueron considerados como negativos, esto significo el 44% del total de la muestra.
Discusion
Los resultados confirman hechos bien conocidos, a saber, que los flebotomos al igual que otros dipteros Nematoceros ingieren naturalmente azucar como fuente de energia. ajuzgar por su presencia en el tubo digestivo en especimenes recien capturados y en insectos bajo condiciones experimentales (Castillo 1989).
La ingestion experimental de carbohidratos por hembras de L. evansi y L. longipalpis se llevo a cabo empleando como marcadores, colorante vegetal Mc Cormick®. Los insectos no fueron afectados en la selecciòn del carbohidrato por el color ya que cuando hubo preferencia por un carbohidrato indistintamente del color del marcador del azucar empleado. este fue ingerido. Esto confirma lo planteado por Dethier et al. (1956) y Salama (1966) quienes describen que la ingestion de carbohidratos en ciertos insectos es controlado por un sistema de quimiorreceptores localizados en los tarsos, labela, labro y cibario, por lo que el estimulo visual no jugaria parte importante en la seleccion.
Experiencias previas sobre preferencias de azucar en flebotomos han sido realizadas proporcionandoles carbohidratos marcados con colorante vegetal a grupos de insectos por separado, tal es el caso de Chaniotis (1974), quien ensayo la preferencia de 11 azucares por L. trapidoi Fairchild y Hertig, 1952; refiriendo que esta especie acepta en orden de preferencia cinco azucares a saber: sacarosa, fructosa, maltosa, rafinosa y D glucosa.
Los ensayos realizados de forma competitiva pueden representar de mejor manera la existencia de preferencia por un determinado carbohidrato.
A pesar de que estas pruebas fueron solo realizadas con soluciones saturadas de azucar, este hecho pareciera no tener un efecto marcado sobre la aceptacion de la misma, tal como fuera demostrado por Chianiotis (1974).
Bajo este sistema, los ejemplares de L. evansi muestran una franca predileccion por la fructosa, mientras que los ejemplares de L. longipalpis, aunque ingieren la mayoria de los carbohidratos empleados (fructosa, glucosa, sacarosa, melezitosa y maltosa), muestran ligera predilecciòn por sacarosa, resultados similares encontro Castillo (1989) en L. youngi.
Un aspecto importante a resaltar es la diferencia en la aceptacion de un mayor numero de azucares por los especimenes silvestres de L. evansi que los de colonia, resaltando a la vez que el trisacarido melezitosa fue el segundo mas ingerido por ejemplares silvestres, en tanto que los especimenes de colonia no lo ingirieron. Esto pudiera ser explicado por el hecho de que los ejemplares de colonia han sido sometidos al consumo de sacarosa por varias generaciones, mientras que en la naturaleza ellos pudieran tomar nectar floral y extrafloral, que de acuerdo con Foster (1995) a menudo contiene el trisacarido melezitosa.
En el caso de L. longipalpis, a pesar de ser una colonia que ha sido mantenida por 70 generaciones, esta posible explicaciòn de preferencia de azucar de L. evansi no es aplicable, ya que puede ingerir cinco de los seis azucares probados, a saber; fructosa, sacarosa, glucosa, melezitosa y maltosa; esta especie. bajo condiciones de laboratorio, es altamente adaptable a diferentes condiciones.
Es importante resaltar que la lectura de la positividad de la reaccion de antrona fue leida a los 15 minutos, ya que despues de este tiempo no se encontrò reactividad en los ejemplares, contrariamente a lo señalado por Young et al. (1994) quienes describen en su metodologia lectura hasta 120 minutos. El hecho de que L. evansi mostrara marcada preferencia por fructosa plantea la necesidad de llevar a cabo estudios posteriores de la implicaciòn de la fructosa en la bionomia de la especie de Lutzomyia y en la relacion parasito - hospedador en el modelo L. chagasi - L. evansi, ya que la ingesta de azucares puede intervenir en el establecimiento y desarrollo de los parasitos de Leishmania (Molyneux et al. 1986; Muskus 1997).
Agradecimientos
Los autores agradecen al Dr. Jose Vicente Scorza por las revisiones y criticas al manuscrito. Al FONACIT por financiar la investigacion, a traves del proyecto SI- 2002-000501.
Literatura citada
AGUILAR. C. M.; FERNANDEZ, E.; FERNANDEZ, R.; CANNOVA. D.; FERRER, E.; CABRERA, Z.; SOUZA, W.; COUTINHO, S. 1998. Urban visceral Leishmaniasis in Venezuela. Mem. Inst. Oswaldo Cruz 93 (1): 15-16. [ Links ]
ANEZ, N.; LUGO, A., LOAIZA. A.; NIEVES, E., OROZCO, J. 1994. Sugar in the alimentary canal of Lutzomyia youngl (Diptera: Phlebotominae,). Medical and Veterinary Entomology 8: 38-42. [ Links ]
CAMERON, N. M.; MILLIGAN, P. J. M.; CUENTAS, A. L., DA VIES, C. R. 1995. An association between phlebotomine sandflies and aphids in the Peruvian Andes. Medical and Veterinary Entomology 9 (2) : 127-132. [ Links ]
CASTILLO. L. 1989. Mecanismo de adhesion de Leishmania brazillensis en Lutzomyia youngi. Trabajo de Ascenso. Mimeogra-fiado. Nucleo Universitario "Rafael Rancel", Universidad de los Andes. 25 p. [ Links ]
CHANIOTIS, B. N. 1974. Sugar - feeding behavior of Lutzomyia trapidoi (Diptera: Psychodidae) under experimental conditions. Journal of Medical Entomology 11: 73-79. [ Links ]
DF.THIER, V. G.; WOLBARSHT, M. L. 1956. The electron microscopy of chemosensory hairs. Experientia 12 (9): 335-337. [ Links ]
FELICIANGELI, M. D.; RODRIGUEZ. N.; de GUGLIELMO. Z.; RODRIGUEZ, A. 1999. The reemergence of American visceral Leishmaniasis in an old focus in Venezuela. II. Vectors and parasites. Parasite 6: 113-120. [ Links ]
FOSTER, W. A. 1995. Mosquito sugar feeding and reproductive energetics. Annu. Rev. Entomol. 40: 443-474. KILLICK - KENDRICK, R. 1979. The biology of Leishmania in phlebotomine sandflies. Biology of the Kinetoplastida, p. 395-460. Vol II (ed, by W. rt. R. Lumsden and D. A. Evans), Academic Press, London. [ Links ] [ Links ]
MOLINEUX, D.H.; RYAN, L.; LAINSON. R.; SHAW, J. J. 1986. The Leishmania - sandfly interface. Leishmania Taxonomie et Phylo-genese Applications ecoepidemiologiques (Coll. Int. CNRS INSERM, 1984). IMEE. Montpellier. p. 311-321. [ Links ]
MORTON, I.; BRAZIL, R.; WARD, R.; VASCON-CELOS, A. 1991.The presence of fructosa in wild-caught Lutzomyia longipalpis (Diptera: Psychodidae). Mem. Inst. Oswaldo Cruz 86 (1): 125-125. [ Links ]
MUSKUS, C. E. 1997. Papel del LPO y carbohidratos en la virulencia de Leishmania del subgenero Viannia. Tesis de Maestria en Microbiologia y Parasitologia. Universidad del Valle, Departamento de Microbiologia, corporacion CIDEIM, Santiago de Cali-Colombia. 72 p. [ Links ]
OVIEDO, M.; MORENO, O.; GRATEROL, D. 1995. Bionomfa de los vectores de Leishmaniasis visceral en el Estado Trujillo, Venezuela. III - Colonizacion de Lutzomyia evansi. Boletin de la Direcciòn de Malariologia y Saneamiento Ambiental 35(Supl. 1): 269-276. [ Links ]
SAMIE, M.; WALLBANKS. K. R.; MOORE, J. S.; MOLYNEUX, D. H. 1990. Olycosidase activity in the sandfly Phlebotomus papatasi. Comparative Biochemistry and Physiology 96B: 577-579. [ Links ]
SALAMA, H. S. 1966. The function of mosquito taste receptors. J. Insect Physiol. 12: 1051-1060. [ Links ]
SANDHOLM. H. A.; PRICE, R. D. 1962. Field observations on the nectar- feeding habits of some Minnesotta mosquitoes. Mosq. News 22: 346-349. [ Links ]
SCHLEIN. Y.: WARBURG, A. 1986. Phytophagy and the feeding cycle of Phlebotomus papatasi (Diptera: Psychodidae; under experimental conditions. Journal of Medical Entomology 23 (1): 11-15. [ Links ]
SCORZA, J. V.; CASTILLO, L.; REZZANO, S.; MARQUEZ, M.; MARQUEZ, J. C. 1985. El papel del cafeto en la endemicidad de la Leishmaniasis cutanea en Venezuela. Boletin de la Direcciòn de Malariologia y Saneamiento Ambiental 25: 82-88. [ Links ]
TRAVI, B.; VELF.Z, I.; BRUTUS, I.; SEGURA, I.; JARAMILLO, C; MONTOYA. J. 1990. Lutzomyia evansi an alternate vector of Leishmania chagasi in a Colombia focus of Leishmaniasis. Trans, of the Royal Soc. of Trop. Med. and Hyg. 84: 676-677. [ Links ]
VAN HANDEL, E. 1967. Determination of fructosa and fructose- yielding, carbohydrates with cold anthrone. Analytical Biochemistry 19: 193-194. [ Links ]
VIVENES, A. 2000. Lutzomyia evansi hospedero biologico del complejo Leishmania mexicana. Tesis de Maestria en Protozoologia. Mimeografiado. Nucleo Universitario Rafael Rangel Universidad de los Andes. 93 p. [ Links ]
YOUMG, C. J.; TURNER, D. P.; KILLICK-KENDRICK, R.; RIOUX. J. A.; LEANY, A. J. 1980. Fructose in wild - caught Phlebotomus ariasi and the possible relevance of sugars taken by sandflies to the transmission of Leishmaniasis. Trans, of the Royal Soc. of Trop. Med. and Hyg. 74 (3): 363-366. [ Links ]
Recibido: Sep. 25/2003 Aceptado: Feb. 21 / 2004