Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.31 no.1 Bogotá Jan./June 2005
Evaluación de diferentes equipos de aspersión para
la aplicación de nemátodos entomopatógenos
Evaluation of different aspersion equipment for the application
of entomopathogenic nematodes
JUAN CARLOS LARA G.1, JUAN CARLOS LÓPEZ N.2
1 Ingeniero Agrónomo. Disciplina de Entomología. Cenicafé. E-mail: JuanCarlos.Lara@cafedecolombia.com
2 Autor para correspondencia: Microbiólogo. Asistente de Investigación. Disciplina de Entomología. Cenicafé. Plan Alto. Chinchiná, Caldas. Colombia. Tel: ind + 850 65 50. E-mail: JuanCarlos.Lopez@cafedecolombia,com
Resumen. Se evaluaron los equipos de aspersión “Royal Cóndor” jardinera (RCJ), “Royal Cóndor” tradicional (RCT) y “Cálimax Leo Cafetera” (CLC), para determinar el efecto en Juveniles Infectivos (JI) de Steinernerna sp. (Rhabditida: Steinernematidae), sobre su viabilidad y patogenicidad. en condiciones de laboratorio simulando la aspersión de este nemátodo en el control de la broca del café, Hypothenemus hampei (ferrari), Para las aspersiones se utilizaron dosis de 500,000 JI/1,5 L de agua. El equipo CLC se evaluó a 20 y 40 psi. Todos los equipos se ensayaron con y sin filtros para observar si existía daño en los JI, Las aplicaciones se hicieron sobre frascos colectores de 80 ml, Posteriormente en dichos frascos y haciendo cuatro mediciones cada media hora se contó el número de JI vivos y muertos en cada aplicación. Mediante el método de infección en larvas de Galleria mellonella (L.), en cajas multipozo con papel filtro, se evaluó la virulencia de los JI después de cada aplicación en relación 10:1 (JI:larva) a las 24, 48 y 72 h después de la inoculación. Los resultados de viabilidad de los JI utilizando los diferentes equipos para aplicarlos usándolos con y sin filtros a diferentes presiones fueron similares estadísticamente. Estos oscilaron entre 96,57% ± 0,10 para CLC (40 psi) con filtros y 98,97% ± 0,08 para RCT sin filtros. La virulencia de los JI, sobre las larvas de G. mellonella, tampoco se afectó registrándose mortalidades del 100% al cabo de 72 h. Los resultados indican que es posible el uso de los equipos aquí evaluados para la aplicación de estos nemátodos sin que sufran deterioro en su acción sobre los insectos a los cuales van dirigidos.
Palabras clave: Juveniles infectivos. Broca del café. Equipos de aspersión.
Summary. “Royal Condor” garden (RCJ), “Royal Condor” traditional (RCT) and “Calimax Leo Cafetera” (CLC) sprayers were evaluated to determine the effect on viability and pathogenicity of Infective Juveniles (lJ) of Steinernema sp. (Rhabditida: Steinernematidae) under laboratory conditions, simulating the aspersion of this nematode in the control of the coffee berry borer, flypothenemus hampei (Ferrari). Doses of 500,000 lJ/1.5 L of water were used for the aspersions. The CLC was evaluated at 20 and 40 psi, AlI the sprayers were evaluated with and without filters to observe ifdamage to lJs existed. The applications were made in 80-ml collection bottles. Later, in the same bottles and making four measurements each half hour, the number of uve and dead IJs were counted in each application. Using the infection method in larvae of GaUeria mellonella (L.), in multiwell boxes with paper filter the virulence of the lJs was evaluated after each application in a ratio of 10:1 (IJ:larva) at 24, 48 and 72 hours after the inoculation. The results of viability of IJ5 using the different equipment to apply them with and without filters at different pressures were statistically similar. These oscillated between 96.57%±0.10 for CLC (40 psi) with filters and 98.97% ± 0.08 for RCT without filters. The virulence of the lJs on the larvae of O. meflonella was not affected either, registering mortalities of 100% after 72 hours. The results indicate that it is possible to use the equipment evaluated here for the appiication of these nematodes without them undergoing deterioration in their action on the insects to which they are directed.
Key words: Infective juvenhle. Coffee berry borer. Aspersion equipment
Introducción
La broca del fruto del café, Hypothenemus hampei. (Ferrari), introducida a Colombia en 1988, es la plaga más importante que ataca el café. Actualmente infesta cerca de 800.000 hectáreas de café, afectando el patrimonio de más de medio millón de familias cafeteras (Bustillo 2002).
Para su control en la zona central cafetera debido a la topografia muy pendiente, las aspersoras motorizadas de espalda tienen un rendimiento por jornal muy similar al de las convencionales de espalda (Rivillas 1977). Este hecho, sumado a su alto valor. limita su uso solamente a fincas de topografia plana o poco pendiente (Rivillas et al. 1999).
La eficiencia de la aplicación de un plaguicida demanda el desarrollo de sistemas que integren el tipo de formulación, el equipo y el método de aspersión. Igualmente, para realizar una aplicación correcta, es necesario asperjar en el momento oportuno, con una cobertura máxima, una dosis correcta y un tamaño de gota óptimo (Villalba 2003).
El éxito de cualquier control fitosanitario depende del momento oportuno, de la calidad del producto y de la precisión de su aplicación, teniendo siempre presente la menor contaminación ambiental. En otras palabras, el éxito depende de “La Tecnología de Aplicación” (Villalba 2003).
El fin de todos los métodos y sistemas de aplicación es la distribución uniforme del ingrediente activo (para el caso los nemátodos) sobre el objetivo (frutos de café en los platos de los árboles). Técnica y prácticamente es imposible lograr una distribución uniforme y óptima en cantidades tan pequeñas. lo que obliga a recurrir a agentes o medios de dilución. El diluyente más usado es el agua. La gota constituye, por lo tanto, el vehículo o medio de transporte para hacer llegar la sustancia activa a su destino (Villalba 2003).
Dentro del grupo de organismos considerados con potencial para el control de la broca en el suelo, están los nemátodos entomopatógenos (Commonwealth Institute of Biological Control 1990; gustillo 1991; Georgis y Hom 1992) destacándose las familias Steinernematidae, Heterorhabditidae, Allantonematidae y Mermithidae (Allard y Moore 1989; Hominick y Collins 1997; Smiths 1997) siendo consideradas las dos primeras como las más apropiadas para controlar plagas del suelo, debido a sus hábitos crípticos (Georgis y Hom 1992). Estos organismos poseen una característica particular al estar asociados con bacterias entomopatógenas. Avances en la producción masiva, formulación y métodos de aplicación, han permitido considerarlos en programas de control contra insectos cuyo hábitat es el suelo (Georgia y Horn 1992; López 1999).
Las pantallas y los filtros de los equipos de aspersión deben permitir el paso de los nemátodos. Steinernerna carpocapsae puede pasar a través de pantallas con aberturas tan pequeñas como l00 u de diámetro, pero aberturas mayores son requeridas para especies más grandes como 3. glaseri y Heterorhabditis megidis; por lo tanto, el retiro de los filtros y de las pantallas se recomienda generalmente, aunque éste requiere la recalibración del equipo. La mayoría de los sistemas de aspersión no desarrollan la suficiente presión para dañar los nemátodos. En general, los nemátodos no se deben someter a presiones que excedan las 300 psi en los tanques de los equipos y tampoco a temperaturas superiores de los 30°C (Grewal 1998).
Téniendo en cuenta las consideraciones anteriores, se sometieron los juveniles infectivos de Steinernema sp. a temperaturas de aproximadamente 25°C y presiones de 20 y 40 psi, las cuales son generadas por los diferentes equipos de aspersión más utilizados en la zona cafetera, con el fin de evaluar, en condiciones de laboratorio, el efecto sobre la viabilidad y virulencia.
Materiales y Métodos
El experimento se desarrolló en el laboratorio de Entomología de Cenicafé cuya temperatura promedio es de 25°C y la humedad relativa de 78%.
Para la multiplicación del nemátodo entomopatógeno se utilizaron larvas de Gallería mellonella, las cuales se obtuvieron de una cría con dieta artificial en el laboratorio. En dicha cría las larvas se desarrollaron hasta el estado de pupa, luego de esto se pasaron a recipientes con trozos de madera encerados con agua miel para que emergieran los adultos y pudieran depositar allí sus huevos. Posteriormente, dichos huevos se colocaron en dieta (225 g de miel de abejas, 150 ml de glicerina, 310 g de salvado de trigo, 90 g de levadura y 45 g de cera de abejas) y se llevaron a completa oscuridad con una temperatura de 30°C durante 35 días aproximadamente. Luego, las larvas de último ínstar se colectaron y se utilizaron para la producción fn vivo de los juveniles infectivos (JI) del nemátodo.
El nemátodo entomopatógeno nativo utilizado fue Steinernema sp. proveniente de Montenegro (Quindío). La producción de los JI de dicho nemátodo se realizó mediante infección tópica de larvas de último instar de G. mellonella, utilizando una concentración de 200 JI en un volumen de 1,5 ml de agua, en cajas de Petri con papel filtro. Posteriormente, las larvas que presentaron sintomatología típica de infección por nemátodos, se colocaron en cajas de Petri con papel filtro estéril (cámara seca) y se llevaron a una temperatura de 25 ± 2° C durante 7 días. Luego de este tiempo, las larvas se pasaron a trampas modificadas “White”, para recuperar los JI. estos se colectaron, se lavaron sucesivamente en agua y se concentraron por decantación, siendo almacenados en contenedores aireados a una temperatura de 12°C.
Los equipos de aspersión evaluados para la aplicación de JI de Steinernema sp. fueron: de palanca (Royal Cóndor tradicional y Jardinera) con y sin filtros, de presión previa retenida (Cálimax Leo cafetera) a 20 y 40 psi con y sin filtros. Además, las boquillas utilizadas fueron las TX3 con descargas de 190 cc/mm a 40 psi y de 120 cc/mm a 20 psi.
Para cada equipo evaluado se utilizó una concentración de 500.000 JI de Steinzer nem sp. por 1,5 1 de agua. Posteriormente, se procedió a realizar las aplicaciones de los JI sobre frascos colectores de 80 ml usando los equipos con y sin filtros (los tratamientos se aprecian en la tabla 1). Luego se tomaron cinco muestras cada media hora de cada uno de los frascos haciéndose diez lecturas de viabilidad (relación entre el número de JI totales y el número de JI vivos De allí, con los JI vivos, se procedió a infectar veinte larvas de Galleria mellonella por tratamiento para evaluar la virulencia a las 24. 48 y 72 horas.

Anàlisis estadìstico
Las variables evaluadas fueron: viabilidad de los JI después de la aplicación (relación entre el total de JI y los JI vivos) y la virulencia de los JI después de la aplicación evaluada en tres tiempos distintos (24, 48 72). En el análisis estadístico se tuvieron en cuenta los promedios y variación para las variables descritas, el análisis de varianza bajo el diseño del experiménto propuesto al 5% y la prueba de comparación de tukey al 5%, para comparar los promedios de los factores por separado en caso de que la interacción fuera significativa y que la anova mostrara efecto de ellos.
Resultados y Discusión
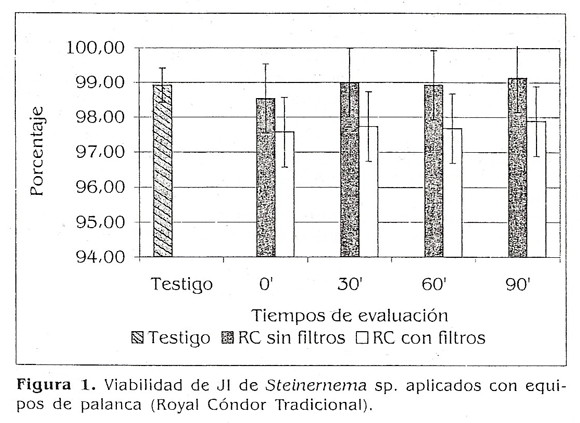
Viabilidad de los juveniles infectivo de Steinernema sp. aplicados con equipos de palanca. Para la Royal Cónde Tradicional, no se encontraron diferencias estadísticas con respecto al testigo utilizando el equipo con y sin filtros (Fig. 1 Los valores de viabilidad para las cuatro evaluaciones estuvieron entre un 97,57 un 99.13%. Es importante resaltar una tendencia a disminuirse la viabilidad cuando se utilizan los filtros, la cual no se refleja estadísticamente (p>0,05).
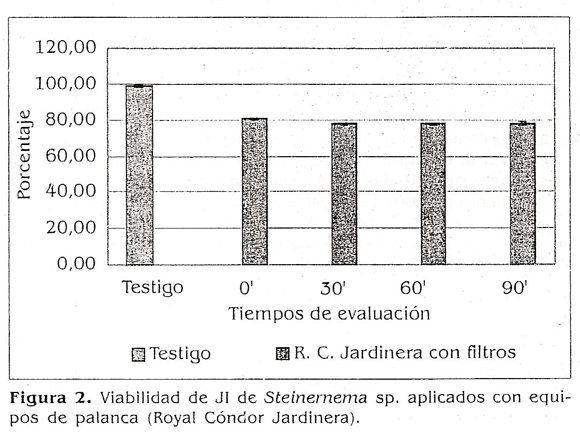
Para el equipo Royal Condor Jardinera se observó, a través de los cuatro tiempos de evaluación, una tendencia a disminuir la viabilidad (Fig. 2), pero estadísticamente no presentó diferencias (p>0,05). Los valores oscilaron entre un 77,80 y un 80% Este equipo se utilizó con el filtro original
que posee, pues se descartó quitarlo ya que tenía 1,5 mm de ancho y según Orewal 1998) nemátodos como Steinernema carpocapsde, que poseen 100 u de diámetro, no se ven afectados por los filtros que tienen normalmente los equipos de aspersión.
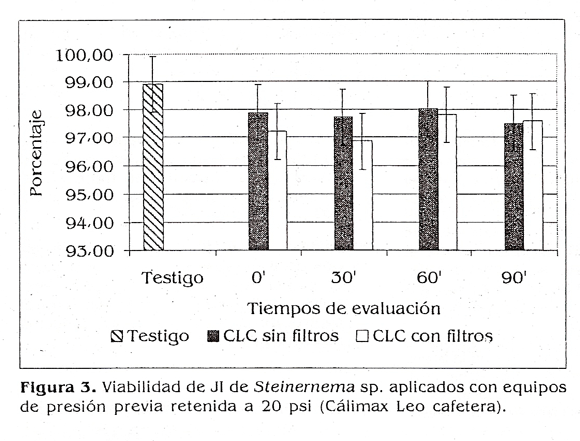
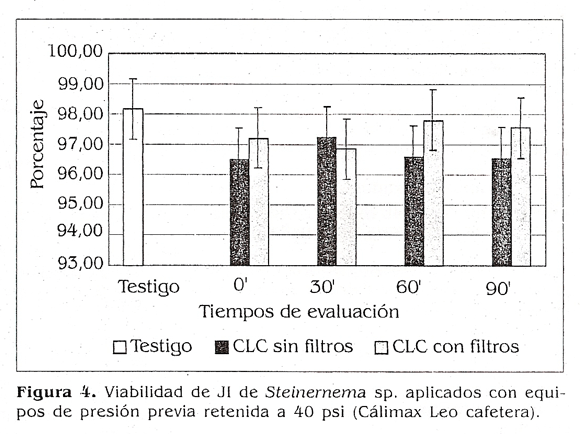
Cuando se utilizó la Calimax Leo cafetera a 20 psi (fig. 3) no se encontraron diferencias estadísticas en cuanto a la viabilidad de los JI con respecto al testigo (p>0,05), pero sí se pudo ver, para los cuatro tiempos de evaluación, una tendencia a disminuir la viabilidad cuando se empleó el equipo con los filtros. Para este caso, los valores estuvieron entre un 96,85 y un 98,01°k para el tratamiento, mientras que en el testigo la viabilidad fue del 98,92%. Para este mismo equipo, pero a 40 psi (fig. 4), tampoco se presentaron diferencias estadísticas con respecto al testigo en cuanto a viabilidad (p>0,05), pero si se observó un comportamiento inverso en cuanto a que la tendencia fue presentar porcentajes mayores de viabilidad cuando se usaron filtros. Los valores para este caso estuvieron entre un 96,51 y un 97,81% para el tratamiento.
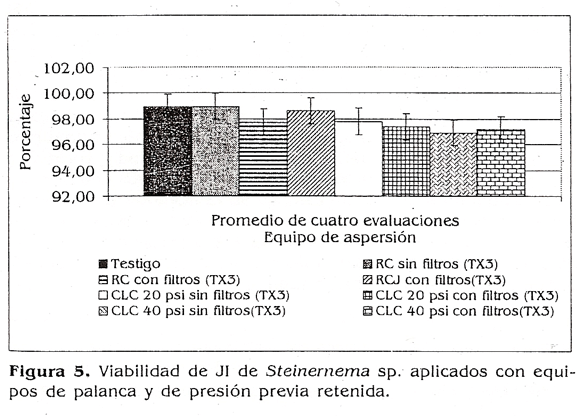
Un la figura 5 se observa un resumen de los porcentajes de viabilidad de los JI obtenidos para cada uno de los equipos evaluados donde no se presentaron diferencias estadísticas con respecto al testigo (p>0,05), pero sí vale la pena resaltar una tendencia a disminuirse la viabilidad cuando se usan los filtros en los equipos y cuando se incrementa la presión en los mismos, lo cual concuerda con lo dicho por Grewal (1998), quien recomienda que los filtros y pantallas de los equipos de aspersión deben ser retirados para disminuir el daño a los juveniles infectivos de los nemátodos.
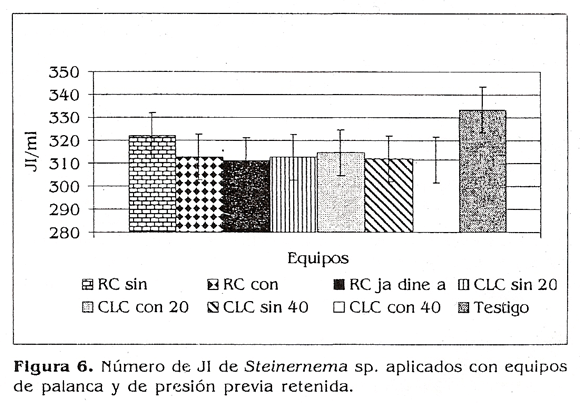
En cuanto al número de JI iniciales que se tenían en los diferentes equipos y el número de JI que estaban saliendo asperjados (fig. 6) vale la pena mencionar que no se presentaron diferencias estadísticas entre los tratamientos y el testigo (p>0,05), encontrándose valores entre 311,31 JI/ml para la Royal Cóndor Jardinera y 322,09 Jh/m para la Royal Cóndor Tradicional sin filtros, mientras que en el testigo fueron 333 JI/ml.
Las condiciones de temperatura y presión generadas por los equipos utilizados no afectaron el parasitismo de los juveniles infectivos de Steinernema sp. que al cabo de 72 h fue del 100% para los diferentes tratamientos evaluados (Tabla 2), lo cual confirma lo dicho por Grewal (1998), en el sentido en que los nemátodos no se deben someter a presiones que excedan las 300 psi en ¡os tanques de los equipos y tampoco a temperaturas superiores de los 30°C para que así no pierdan sus características de viabilidad y virulencia.

Conclusiones
- No se encontraron diferencias estadísticas para la variable viabilidad de los JI con respecto al testigo cuando se utilizaron los equipos con y sin filtros a diferentes presiones, pero si se pudo observar una tendencia a disminuir la viabilidad cuando se utilizaron los filtros y las presiones fueron mayores.
- La concentración inicial de JI fue similar a la final para todos los equipos evaluados.
- Los equipos utilizados no afectaron el parasitismo de los JI de Steinernema sp. sobre larvas de Galleria mellonella.
- Los equipos evaluados son adecuados para la aplicación de los nemátodos entornopatógenos.
Recomendaciones
- Se deben hacer trabajos similares con nemátodos entomopatógenos de otras especies.
- Es importante investigar el efecto de otras boquillas, equipos y presiones.
- Se deben realizar estudios donde se evalúe el efecto que tienen sobre los nemátodos entomopatógenos la calidad del agua, el p y otras características de ésta.
Agradecimientos
Los autores agradecen al Ingeniero Agrónomo Diógenes Villalba por sus aportes técnicos, a los auxiliares Uriel Posada y Carlos Quintero por su valiosa colaboración en las diferentes evaluaciones y a Cenicafé y Colciencias por la cofinanciación del proyecto 2251-07-12173 y su programa de Jóvenes Investigadores.
Literatura citada
ALLAED, G. B.; MOORE, D. 1989. Heterorhabdios sp., nematodes as control agents for coffee berry borer Hypothenemus hampei (Scolitydae). Journal of Invertebrate Pathology 54 (1): 45-48. [ Links ]
BUSTILLO P,, A. E. 1991. Perspectivas de un Manejo Integrado de la Broca del Café, Hypothenernus hampei, en Colombia. Agricultura tropical (Colombia) 28 (1): 83-93. [ Links ]
BUSTILLO P, A. E. 2002. El manejo de cafetales y su relación con el control de la broca del café en Colombia. boletín Técnico No. 24. Centro Nacional de Investigaciones de Café. Cenicafé. Chinchiná, Caldas, Colombia 40 p. [ Links ]
COMMONWEALTH INSTITUTE OF BIOLOGICAL CONTROL - CIBC. LONDRES. INGLATERRA.1990. Control biológico de la broca de la cereza del cafeto. MANUAL de Capacitación de Control biológico. Chinchiná (Colombia), CENICAFE, p. 140-153. [ Links ]
GEORGIS, R.; HOM, A. 1992. Introduction of entomophatogenic Nematode Products into Latin America and the Caribbean. Nematropica 22 (1): 81-98. [ Links ]
GREWAL, E S. 1998. Formulation of entornopathogenic nematodes for storage and application. Japanese Journal of Nematology 28: 68-74. [ Links ]
HOMINICK, W.B.; COLLINS, S. A. 1997. Application of ecological information for practical use of insect pathogenic nematodes. Capítulo 2. Microbial insecticides: Novelty or Necessity?. Farham. british Crop Protection Council. 302 p. [ Links ]
LÓPEZ N., J. C. 1999. Movilidad y búsqueda de hospedero: Ventajas de un entornopatógeno. p. 26-29. En Memorias. Seminario Nemátodos Entomopatógenos. Bogotá D. C.. Universidad Nacional. Septiembre 25. [ Links ]
RIVILLAS O., C. A. 1977. Estudio económico y técnico de aspersiones fitosanitarias en cafetales comerciales. Trabajo de grado de Ingeniero Agrónomo. Universidad de Caldas. facultad de Agronomía. Manizales. 225 p. [ Links ]
RIVILLAS O., C. A.; LEGUIZAMON C., J. E.; GIL V., L. F. 1999. Recomendaciones para el manejo de la roya del cafeto en Colombia. boletín Técnico NO 19. Cenicafé. Chinchiná- Caldas-Colombia. [ Links ]
SMITHIS, E. M. 1997. Insects pathogens: their suitability as biopesticides. Microbial Insecticides: Novelty or Necessity?. Farham british Crop Protection Council.302 p. [ Links ]
VILLALBA O., D. A. 2003. Tecnología y equipos de aspersión para el control de la broca del café. En Memorias Curso Tecnología y Equipos de aspersión para el control de la broca del café. Chinchiná (Colombia), marzo 25-27. [ Links ]
Recibido: Dic. 15/2003 - Aceptado: Ago. 04 / 2004