Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.31 n.1 Bogotá jan./jun. 2005
Pathogenicity of Paeczlomyces lilacinus and Metarhizzim anisopliae on Microcerotermes sp. termites (Isoptera: Termitidae)
ANA ISABEL GUTIERREZ G.1,YAMILLE SALDARRIAGAO.2, SANDRA URIBES. 3, MÓNICA P. ZULUAGA A. 4, FABIO PINEDA O. 5
1 Biologa M Sc Investigadora Asociada al Grupo de Micologia, Instituto de Biologia, Facultad de Ciencias Exactas y Naturales. Corporacion de Patologias Tropicales. Universidad de Antioquia. E-mail anaisaguti@hotmail.com
2 Autor para correspondencia Licenciada en Biologia y Quimica M Sc Profesor de Micologia Instituto de Biologia Facultad de Ciencias exactas y Naturales Corporacion de Patologias Tropicales Universidad de Antioquia A A 1226 Medellin Colombia Fax 2330120 E- mail ysaldar@matematicas.udea.edu.co
3 Ingeniera Agronoma M. Sc. Ph. D. Posgrado de Entomologia Facultad de Ciencias Universidad Nacional Sede Medellin Colombia E mail suribe@unalmed. edu. co
4 Biologa Universidad de Antioquia E- mail aguazul@hotmail.corn
5 Biologo Licenciado en Biologia y Quimica M. Sc. Profesor de Micologia Instituto de Biologia Facultad de Ciencias Exactas y Naturales. Corporacion de Patologias Tropicales Universidad de Antioquia. E- mail fpgutier@matematicas.udea.edu.co
Resumen. Se realizaron ensayos de laboratorio para determinar la patogenicidad de Paectiomyces lilactnus y Metarhizzum anisopliae sobre las termitas Microcerotermes sp Las termitas se colectaron en plantaciones de Eucalipto de la reforestadora San Sebastian de Buenavista Magdalena (Colombia) y se mantuvieron en oscuridad a una temperatura promedio de 25°C y humedad relativa de 59 5% Los bioensayos consistieron en colocar en contacto las termitas obreros con lonas 100% algodon impreg nadas con los hongos a concentraciones de 1x101, 1x103, 3x105, 1x107, 3x108 conidios/ml. Para evaluar el efecto del hongo se utilizo la metodologia del agar arena El analisis estadistico mostro que no hubo diferencias significativas entre los efectos originados por P. lilacinusi y los testigos (X2 = 3 32 P = 0, 51) Pero se presentaron diferencias significativas entre la mortalidad de las termitas con las diferentes con centraciones siendo 3x108 conidios/ml la que causo los porcentajes mas altos de mortalidad (X2 81 3 l’<0 001) Con Pi anisoplcae se observaron diferencias en la mortalidad a las diferentes concentraciones y los testigos excepto entre 1x103 y 3x105 conidios/ml (Z = 0 97 E’ = 0 33) La conidiacion de ambos hongos en las termitas muertas fue mayor a concentraciones de 3x108 conidios/ml (P<0 001) La DL fue de 1 78x108 conidios/ml para P. lilacinusi a los dos citas y de 0, 69x102 conidios/ml para M. anisopliae a los siete dias .
Palabras clave: Control biologico Reforestadora Eucalipto Comejenes Hongo entomopatogeno
Summary. Laboratory bioassays were performed to determine the susceptibility of the termite Microcerotermes sp to the eritomopathogenic fiingus Paecilomyces hlacinus and Metarhizium anzsopliae The termites were collected from Eucalyptus plantations at the locality San Sebastian of Huenavista Magdalena (Colombia) Termites were maintained in darkness at mean temperature 25°C ancl relative humidity, 59,5%. The bioassays consisted in putting worker termites in direct contact with 100% cOtton canvas, impregnated with concentrations of the fungus at concentrations of 1x101, 1x103, 3x105, 1x107, 3x10° conidia/mI The agar sand method was used to evaluate the effect of the fungus Statistical analysis showed that there were no significant differences (X2=3 32 P=0 51) between the effects caused by P hlacrnus and the control ut there was a significant difference in the mortality of the termites with the different concentrations 3xlo8conidia/ml being the dose that caused the highest percentages of mortality (X2=81 3 Pc0 001) With ti anisoptiae significant difíerences were observed in the mortality at the different concentrations and the control (X2 = 320 7 P<0 001) except for 1x103 and 3x105 conidia/ml (Z = 0 97 E’ = 0 33) TIte conicliation of both fungi in the dead termites was higher at the concentration of 3x108 conidiaiml (P<0 001) The DL50 was 1 78x108 conidia/ml for P Iilacrnus at two days and O 69x102 conidia/rnl for ti. anisopliae at seven days.
Key words:Biological control Reforestation Eucalyptus Termites Entomopathogenic fungus
Introduccion
Las termitas son insectos que se alimentan de una gran variedad de sustratos entre ellos los lignoceluliticos el caucho plastico entre otros constituyendose en organismos muy nocivos en los ecosistemas de zonas templadas y tropicales (Garces 1997 Harris 1971).
Las termitas atacan frecuentemente a ucalyptus tereticornis arbol utilizado ampliamente por las reforestadoras como fuente de madera utilizando la parte seca de la corteza como fuente de alimentacion y posteriormente accediendo al interior causando la muerte lenta del arbol (Beron 1983 Madrigal 1989 Garces 1997).
Aunque en Colombia existen algunos registros sobre danos ocasionados por termitas en diversos cultivos y plantaciones de eucalipto son muy pocos los tra bajos realizados en control biologico para las termitas.
Entre las alternativas para el control biologico de estos insectos se han realizado a nivel mundial estudios con virus (Hassan 1990), bacterias (Gavino 1984; Logan et al. 1990), nemátodos (Mix y Beal 1985; Coppel y Llang 1987) y hongos como ,Beauueria bassiana (Bals,)Vuill. y M. anisopliae (Metsch.) Sor. (Zoberi y Grace 1990; Fernandes y Alves 1991; Alves et al.1995; Zoberi 1995; Milner et al. 1998a, 1998b; Shimizu y Yamaji 2002; Wright et al. 2002). Dichos estudios señalan que los hongos nativos son los agentes de control biológico más promisorios debido a que se encuentran en el mismo nicho ecológico y se replican por sí mismos, aumentando la población e infectando la colonia (Delate et al. 1995; Zoberi 1995; Madrigal 1999).
En países como Brasil, diversos grupos de investigadores han utilizado los hongos entomopatógenos contra termitas tanto en laboratorio como en campo, obteniendo porcentajes de mortalidad altos. rio obstante, algunos de los resultados se han controvertido debido a que varían de acuerdo con las condiciones ambientales y con aislamientos fúngicos particulares.
Milner et al. (1998a), en Australia, realizaron pruebas in vitro y en campo con varios aislamientos de M. anisopliae sobre termitas Coptotermes spp. y Nasutitermes exitiosus encontrando que todos los aislamientos fueron patógenos siendo más susceptibles Coptotermes spp.
Los investigadores Csiro (1990), Fernándes y Alves (1991), Alves el al. (1995), Grace (1991), Grace y Zoberi (1992), Delate et al. (1995) y Zoberi (1995) observaron que las termitas Coptotermes spp., Reticulitermes flavipes y Cornitermes cuinulans tratadas con M. anisopliae y B. bassiana en sus sitios de alimentación, sobre la colonia y aplicando suspensiones conidiales tópicas, murieron a causa de la invasión de los hongos. Es importante aclarar que M. anisopliae a concentraciones bajas produjo mayor mortalidad en menor tiempo que B. bassiana, Igualmente, Rosengaus (1997) demostró que la termita Zooterrnopsis angusticollis expuesta en papel de filtro impregnado con varias suspensiones de conidias de M. anisopliae son susceptibles a la infección por éste.
Sajap y Kaur (1990) observaron la histopatología y la ontogenia del hongo M. anisopliae sobre Coptotermes curvignathus encontrando que la mortalidad ocurrió 36- 48 h postinoculación y la colonización completa de la termita no fue evidente hasta 72 h.
Estudios realizados por thader Khan et al. (1990) y Khan el al. (1991) en termitas de cultivos agroforestales (Odontotermes brunneus, O. wallonensis y O. obesos) tratadas con los hongos: 0. bassiana, PI, anisopliae var. anisopllae, PI. flavoviridae var. minos, Paecilomyces lilacinusi y E fumosoroseus señalaron que 13. bassiana fue la más patógena.
El objetivo principal de este estudio fue evaluar la patogenicidad de dos aislarnientos de los hongos entornopatógenos P. lilacinusi (Thom) Samson y M. anisopliae sobre las termitas Plicrocerotermes sp. que atacan las plantaciones de eucalipto en la reforestadora San Sebastián de Buenavista, Magdalena.
Materiales y Métodos
Origen de los aislamientos
El estudio se realizó en el laboratorio de Micología del Instituto de Biología de la Universidad de Antioquia. Las termitas se colectaron en la reforestadora San Sebastián, ubicada en el municipio de San Sebastián de Buenavista en el departamento de Magdalena, con coordenadas latitudinales de 9°17’ norte y longitudinales de 74°32’ oeste, con un total de 7.000 hectáreas. El área se encuentra en la zona de vida Bosque Seco Tropical (bs - T) caracterizada por tener una temperatura promedio de 28,8°C, una precipitación media anual de 1,787 mm y una altitud de 25 m sobre el nivel del mar (Espinal 1990; Hernández 1993; Borreros 1996).
Colección de insectos
Las termitas se colectaron con sus respectivos sustratos (hojas, litera y suelo), fragmentos o termiteros completos. Se trasladaron al laboratorio en recipientes plásticos de 16 x 12 cm de diámetro tapados con muselina, sellados con vinilpel y envueltos en bolsas oscuras dándoles condiciones apropiadas. En el laboratorio, las termitas se mantuvieron en recipientes plásticos dentro de una cámara climatizada (WTBbinder 78532 (Tuttlingen/Oermany) con temperatura controlada de 25°C, humedad relativa de 59.5% y en oscuridad.
Origen de los hongos
El hongo P. lilacinusi se aisló de muestras de suelo de las plantaciones de eucalipto de la reforestadora y se purificó realizando cultivos monospóricos, siguiendo la técnica descrita por Calle (2000). Su determinación taxonómica se realizó según criterios morfológicos y de cultivo, de acuerdo con las claves de nelson et al. (1983), Samson et al. (1984), Domsch et al. (1993), Goettel e lnglis (1997), Papierok y Hajek (1997) y Barnett y Hunter (1998).
MI. anisopliae (Ma 45). aislado de un coleóptero (de una subfamilia de la familia Melolonthidae) fue donado por CORPOICA (Corporación Colombiana de Investigación Agropecuaria Seccional Antioquia). Los hongos se cultivaron a temperatura ambiente en tubos y cajas con Agar Sabouraud Dextrosa (SDA) (Oxoid LTD., Basingstoke. Hampshire, England), durante 10-12 días antes de hacer la dilución. Además, después de las pruebas se multiplicaron en arroz acidificado (ácido láctico) y se conservaron en el laboratorio de Micología del Instituto de Biología de la Universidad de Antioquia.
Pruebas de Patoqenicidad
Preparación de la suspensión de conidios
A partir de los cultivos en SDA se realizaron diluciones para obtener las concentraciones de1x101, 1x103, 3x105, 1x107, 3x108 conidios/ml según la metodología de Goettel e Inglis (1997) y Pérez (1997).
Bioensayo
Se utilizaron las concentraciones 1x101, 1x103, 3x105, 1x107, 3x108 conidios/ml. que fueron vertidas en cajas de vidrio previamente esterilizadas donde se sumergieron las lonas (100% de algodón durante 4 mm. Los ensayos se realizaron con termitas obreros. Estos se introdujeron en frascos oscuros de vidrio de 9 x 8 cm preparados con las lonas y de acuerdo con la metodología de agar-amena de Staples y Milner (2000). Se realizaron cuatro repeticiones, cada una con 30 termitas obreros, por cada una de las concentraciones de los hongos y un lote de testigos (lona tratada con agua destilada estéril).
Las termitas tratadas se mantuvieron en condiciones de oscuridad en una cámara climatizada (WTBbinder 78532 (‘tuttlingen/Germany), a una temperatura de 25°C y una humedad relativa de 59,5%.
La supervivencia de las termitas se verificó durante 10 días contando el número de individuos muertos y calculando el porcentaje de mortalidad diaria y acumulada. Los cadáveres se colocaron en cámara húmeda y se incubaron a temperatura ambiente (22°C) durante 10 días. para favorecer la conidiación del hongo y verificar la muerte por el mismo (mortalidad intrínseca). A todos los insectos muertos y colonizados por el hongo se les realizaron montajes en placa microscópica con azul de lactofenol, KOH y cultivos para observar las diferentes estructuras morfológicas y verificar la presencia e identidad del mismo (Goettel e Inglis 1997).
Análisis estadístico
Para cada concentración de los conidios de P. lilacinusi y M. anisopliae, se analizó la patogenicidad de las termitas tomando como criterio el porcentaje de mortalidad. La mortalidad diaria de las termitas se comparó mediante las curvas de supervivencia de Kaplan-Meier y utilizando la prueba generalizada de Gehan. Mediante estas curvas se estimaron también los TL50 para cada concentración. La CL50 se estimó con el análisis Probit segúr. Wardlaw (1987). Se consideró α=0,05 como el nivel de significancia estadística y se calculó la corrección de Bonferroni en la comparación de las curvas de supervencia. La mortalidad corregida fue determinada según el método de Schneide= Orelli (CYBA GEIGY 1981).
Resultados y Discusión
Patogenicidad del aislamiento de P. lilacinusi y M. anisopliae sobre obreros Microcerotermes sp.
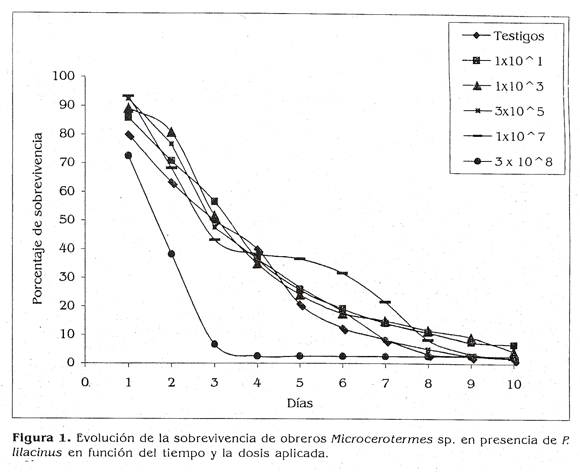
En el aislamiento de P.lilacinusi no se observaron diferencias significativas en la sobrevivencia de las termitas tratadas con dosis entre 1x101 y 1x107 conidios/ml. No obstante, al comparar la sobrevivencia de las termitas tratadas con la concentración de 3x108 conidios con las demás, se encontraron niveles de significancia (X2 = 81,3; P<0,001). Con esta concentración se obtuvieron los valores más bajos de sobrevivencia: 2,5% a los cuatro días. Esto se evidencia en la gráfica de sobrevivencia acumulada (Fig. 1) en la cual los porcentajes similares se obtuvieron entre el 8 y 10 día con las demás dosis.
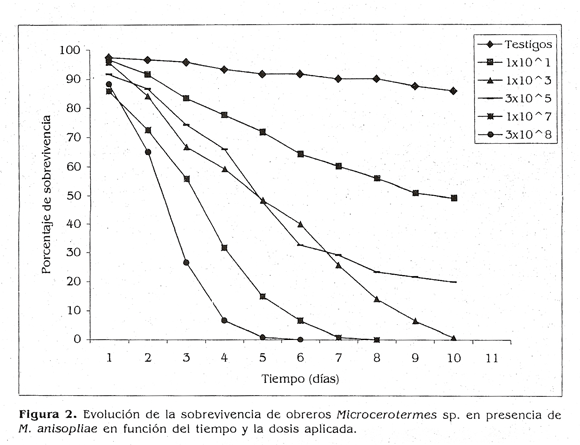
Resultados similares se encontraron para el aislamiento de M. anisopliae, ya que la dosis de 3x108 conidios/ml originó los niveles más bajos de sobrevivencia en las termitas al quinto día después del tratamiento. Valores tan bajos de sobrevivencia sólo se observaron con las demás dosis entre 8 y l0 días después del tratamiento. Sin embargo, para las dosis 3x105 y 1x10 conidios/ml los períodos de sobrevivencia fueron mayores a los 10 días (Fig. 2).
Se observaron diferencias significativas en 4 la sobrevivencia de las termitas tratadas con todas las dosis de M. anisopliae (X2=320,7; P<0,001) excepto entre 1x103 y 3x10 conidios/ml. Con excepción de la dosis 3x105 conidios/ml hubo correspondencia entre la dosis y la mortalidad.
Las diferencias en tiempo de sobrevivencia relacionadas con la dosis de tratamiento son relevantes cuando se realizan bloensayos con entomopatógenos, ya que el tiempo es considerado como un factor real de respuesta al agente (Matthews 1997). Para el presente estudio, con base en la sobrevivericia en función de la dosis y el tiempo, la respuesta de las termitas al agente se observó en menor tiempo para el hongo Paecilomyces que para Metarhizium.
En estudios similares con M. anisopliae sobre Macrotermes subhyalinus los tiempos promedios de sobrevivencia de las termitas variaron entre dos y ocho días
después del tratamiento (Abebe 2002). El tiempo promedio de sobrevivencia varió dependiendo del aislamiento. En la presente investigación los rangos de sobrevivencia variaron entre 4 y 10 días para Paecilomyces. Para M. anisopliae los rangos fueron mayores ya que en el día 10 se observaron altos porcentajes de sobrevivencia para las dosis lx101 (52%) y 3x105 conidios/ml (21%).
Capacidad de conidiación de P. Iilacinus y M. anisopliae sobre cadáveres de Microcerotermes sp.
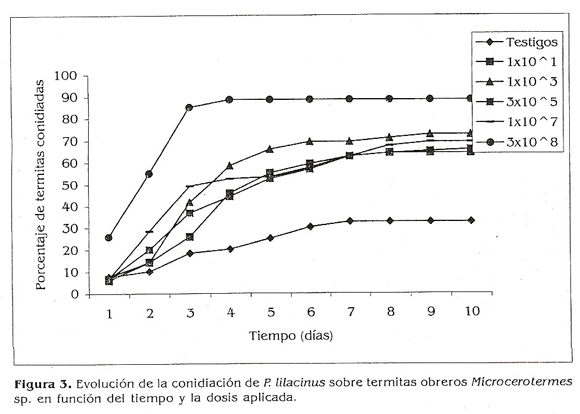
En la figura 3 se observa el porcentaje de termitas conidiadas cuando se trataron con P. lilacinusi. De las 600 termitas tratadas con P.lilacinusi, 433 presentaron invasión por el hongo. En general, la conidiación sobre los cadáveres se observó desde el primer día después de la muerte. Para la dosis 3x108 conidios/ml. que causó los porcentajes más altos de mortalidad en el menor tiempo, se observó el mayor número de termitas colonizadas por el hongo encontrándose diferencias significativas con respecto a las demás dosis (X2= 89,6; P<0,001).
Es de mencionar que el hongo P.lilacinusi esporulo en un 30%de las termitas testigo, lo cual sugiere una probable contaminación mecánica o por manipulación con el hongo (Carvajal 2002). Este valor explica, en parte, los bajos porcentajes de sobrevivencia del testigo que se observaron en el bioensayo.
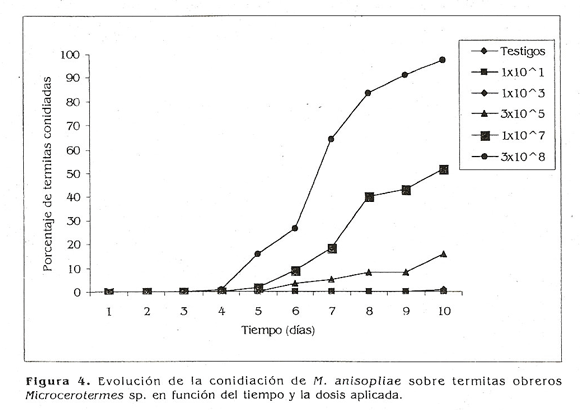
Para el caso de M. anisopliae, de 600 termitas tratadas, 199 fueron colonizadas por el hongo; el mayor porcentaje de termitas conidiadas se obtuvo con la dosis de 3x108 conidios/ml, pero la aparición del micelio sólo se observó a partir del quinto día (Fig. 4) y al segundo día en P. lilacinusi con la misma dosis (Fig. 3). Patcharin (1996) observó que M. anisopliae en termitas Coptotermes sp. y Microcerotermes sp. murieron después de dos días de postinoculación y a los 7 días se desarrolló el micelio blanco y el verde alrededor de los cadáveres. Ambos aislamientos en este estudio causaron micosis a las termitas; sin embargo, P. lilacinusi invadió los cadáveres en menor tiempo.
El hecho de que el hongo invada los cadáveres es de gran importancia, ya que la posibilidad de la transmisión de la micosis a partir de termitas enfermas sería una forma exitosa de acceder a las partes de la colonia y el nido, que no son accesibles por tratamiento directo (Fig.5 ). Adicionalmente, el tiempo de conidiación sobre los cadáveres puede influir sobre la diseminación y contagio de termitas sanas a partir de termitas infectadas (Rosengaus et al. 1998; Rath 2000).
Concentración letal mediana (CL50) del aislamiento de P. litacinus y de M. anisopliae y tiempo letal medio (TL50) de las concentraciones utilizadas
La dosis letal 50 (DL50) para P. lilacirzus fue de 1,78X108 conidios/ml en 2 días con un intervalo de confianza del 95%: (0.44; 3,59) x 108 conidios/ml. El tiempo de TL50 fue de 3 días para todas las concentraciones excepto para 3 x108 conidios/ml (dos días).
Para M. anisopliae la dosis letal 50 (DL50) fue de 0.69x102 conidios/ml pero en un tiempo de 7 días con un intervalo de confianza del 95%: (0,33; 1,44) x 102 conidios! ml. El tiempo letal 50 (TL50) fue de 5 días para las concentraciones 1x102 y 3x105 conidios/ml y de 3 días para la concentración de 3x108 conidios/ml.
De acuerdo con los resultados, las termitas del género Microcerotermes son susceptibles a los aislamientos de P. lilacinusi y M. anisopliae. Tomando como criterios la sobrevivencia, la conidiación del hongo en los cadáveres, el tiempo promedio de invasión y el TL50 y DL50, P lilacirtus aparece como mejor candidato que M. anisopliae como agente potencial de control microbiológico de termitas. Los tiempos de respuesta tanto en la mortalidad, como en la conidiación y en la efectividad para matar el 50% de la población tratada así lo con- firman, Las diferencias podrían explicarse teniendo en cuenta aspectos como la procedencia de los aislamientos. R ¡ilacinus fue aislado directamente de la zona de hojas de eucalipto mientras que M. anisopliae se aisló de un coleóptero de una subfamilia de la familia Melolonthidae donado por CORPOICA. La patogenicidad varía de acuerdo con el sustrato de procedencia, su nicho ecológico y por lo tanto sus condiciones fisiológicas y metabólicas.
Aunque hongos entomopatógenos como Pl. anisopliae han sido utilizados con éxito para el control de termitas en Brasil, es necesario realizar pruebas en campo bajo las condiciones del país y considerar aspectos propios del ecosistema, el aislamiento fúngico y el comportamiento de las termitas, que podrían afectar los resultados (Shimizu y Yamaji 2003; Sun et al. 2003; Abebe 2002; Myles 2002; ‘flaniello et al. 2002).
Conclusiones
- Las termitas obreros Microcerotermes spp. presentaron una susceptibilidad similar para P lilacinus y M. anisopliae, por lo cual podrían ser considerados como agentes potenciales de control biológico.
- La mortalidad en las termitas obreros Microcerotermes spp. fue atribuida a la conidiación causada por ambos aislamientos debido a que éstos fueron recuperados de los cadáveres de los insectos.
Agradecimientos
Los autores agradecen al profesor Abel Díaz Cadavid y a Camilo Quintero por el análisis estadístico y elaboración de tablas y gráficos, respectivamente. A los compañeros del laboratorio de Micología de la Universidad de Antioquia por su aporte técnico y logístico en el desarrollo de esta investigación. Se agradece a la Corporación de Patologías Tropicales, al Instituto de Biología de la Facultad de Ciencias Exactas y Naturales, al CODI de la Universidad de Antioquia y al Posgrado de Entomología de la Universidad Nacional por su ápoyo y financiación, Se agradece de manera muy especial al personal de la Reforestadora San Sebastián de buenavista, Magdalena (Colombia) por su hospitalidad y ayuda en el trabajo de campo.
Literatura citada
ABEBE, H. 2002. Potential of entomopathogenic fungi for the control of Macro termes subhyalinus (Isoptera: Termitidae). Dem Fachbereich Gartenbau der Universitat Hannover zur Erlangung des Akademischen Grades emes. Áthiopien. 161 p. [ Links ]
ALVES, S. I. E.; ALMEIDA, J. E. M.; MOINO. A.; STIMAC, J. L.; PEREIRA, R. M. 1995. Uso de Metarhizium anisopliae e Beauveria bassiana no controle de Cornitermes cumulans em pastagens. Ecossistema Faculadade de Agronomia “Manoel Carlos Goncalves”. Brasil. 20: 50-57. [ Links ]
BARNETT, H. L.; HUNTER, B. B. 1998. Illustrated genera of imperfect fungi. Fourth edition. AFS Fress. The American Phytopathological Society. St. Paul, Minnesota. 218 p. [ Links ]
BERÓN, W. C. 1983. Daños y control de termitas. Seminario. Facultad de Ciencias. Universidad Nacional de Colombia. Medellín. 68 p. [ Links ]
BORREROS, S. 1996. Diccionario geográfico de Colombia. Instituto Geográfico Agustín Codazzi. 3 ed. Tomo 3. Bogotá. Colombia. p. 1404-1405. [ Links ]
CALLE, J. 2000. Vers un contróle Microbiologique des populations Colombiennes de Triatominae, insectes vecteurs de la maladie de Chagas. Tesis presentada para obtener el titulo de Doctor de la Universidad de París V.-René Descartes-Facultad de Medicina Necker. 141 p. [ Links ]
CARVAJAL, L. D. 2002. Estudio del efecto patogénico de algunos microorganismos sobre urhizococus colurnbianus Jakubsi (Homoptera: Margarodidae). Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias. Sede Medellín. 37 p. [ Links ]
CIBA - GEIGY. 1981. Manual para ensayos de campo en protección vegetal. 2a ed. CIBA-GEIGY. 5. A. Basilea. Suiza. Printed in Switzerland. 205 p. [ Links ]
COPPEL, H. C.; LlANO, M. C. 1987. Rhabditoid nematodes associated with subterranean termites. Porestry Research Notes. N° 274. 5 p. [ Links ]
CSIRO. (1990). New termite controls. En: Entomology. Science for survival. Australia. CSIRO. Division of Entomology p. 32. [ Links ]
DELATE, K. M.; GRACE, J. K.; TOME C. H. M. 1995. Potential use of pathogenic fungi in balta to control the Formosan subterranean termite (Isoptera: Rhinotermitidae). Journal of Applied Entomology 119 (6): 429-433. [ Links ]
DOMSCH, K. H.; GAMS, W.; TRAUTE-HEIDI, A. 1993. Compedium of Soil Fungi. Academic Fress. London. 1: 525-535. [ Links ]
ESPINAL, L. S. 1990. Geografía ecológica de Colombia. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias. 1red. Medellín. p. 61-62. [ Links ]
FERNANDES. P. M.; ALVES. S. B. 1991. Control of Cornitermes cumulans Kollar 1832. (Isoptera: Termitidae) with Beauueria bassiana Bals. VuilI. and frletarhizium anisopliae Metsch. Sorok. under field conditions. Anais da Sociedade Entomologica do Brasil 20: 50. [ Links ]
GARCES. J. E. 1997. Generalidades sobre las principales plagas insectiles en plantaciones forestales de Colombia (Guía de campo). Trabajo final de especialización. Universidad Nacional de Colombia. Facultad de Ciencias y Ciencias Agropecuarias. Postgrado en Entomología. Medellín. p. 293-311. [ Links ]
GAVINO, A. A. 1984. Efficacy of Sacillus thurin,qiensis Berliner (Backie, biochem product Ltd.) as biological insecticide against subterranean termites Philippines. Scientiflc Journal 6 (1): 25. [ Links ]
GOETTEL, M.; INGLIS, G. D. 1997. Fungi Hyphomycetes. In: Lawrence Lacey (ed.). Manual of techniques in insect pathology. USDA, ARS. Academic Press, Great Britain. p. 213-249. [ Links ]
GRACE, J. K. 1991. ‘Trmite-fungal associations and nlanipulations for termite control. En: Society for lnvertebrate Pathology, XXIV Annual Meeting. Northern Arizona University. p. 29. [ Links ]
GRACE, J. K.; ZOBERI, M. H. 1992. Experimental evidence for transmission of &auueria bassiana by Reticulitermes flavipes workers (Isoptera: Rhinotermitidae) Sociobiology 20: 23-28. [ Links ]
HARRIS, W. Y. 1971. Termites. Their recognition and control. Longman. Second ed. London, Great Britain. 186 p. [ Links ]
HASSAN, E A. 1990. lmportant insects pests of Casuarina in Egypt. En: Advances in Casuarina research and utilization. Proceeding of the Second International Casuarina Workshop. Cairo. Egypto. p. 102-109. [ Links ]
HERNÁNDEZ, R. J. 1993. Evaluación del efecto de la densidad de crecimiento del ucalyptus tereticorrtis en la Costa Atlántica Colombiana. Trabajo de grado para obtener el título de Ingeniero Forestal. Universidad Nacional de Colombia. Sede Medellín. Facultad de Ciencias Agropecuarias. Medellín. 101 p. [ Links ]
KHADER KHAN, H.; JAYARAJ, S.; GOPALAN, M. 1990. Testing entomopathogenic fungi against the common agro-forestry termites. En: Veeresh, O. R., Malliclç, I, B. and Viraktamath, C. A. (eds.). Social insectsand the environment. p. 636. [ Links ]
KHAN, K.; JAYARAJ, B.; GOPALAN, M. 1991. Mycopathogens for biological control of Odontotermes brunneus Hagen. Journal of Biological Control. India. 5: 32-35. [ Links ]
LOGAN, J. W. M.; COWIE. R, H. WOOD, T. O. 1990. Termite (lsoptera) control in agriculture and forestry by nonchemical methods: a review. Bulletmn of Entomological Research 80 (3): 309-330. [ Links ]
MADRIGAL, A. 1989. Reconocimiento de insectos dañinos en plantaciones forestales de la Costa Atlántica Colombiana. Sociedad Colombiana de Entomología. Miscelánea 12: 1-24. [ Links ]
MADRIGAL, A. 1999. Notas sobre control biológico de plagas. Universidad Nacional de Colombia Facultad de Ciencias Agropecuarias, p. 1-13. [ Links ]
MATTHEWS, G. A. 1997. Techniques lo evaluate insecticide efficacy. En: Methods in ecological & agricultural Entomology. D.R. Dent and M. P. Walton (eds.). CAlI International. Prinled and bound in the UK al the University Fress, Cambridge. p. 243- 269. [ Links ]
MILNER, R. J.: STAPLES, J. A.; LUTTON, G. G. 1998a. The selection of an isolate of the hyphomycete fungus. Metarhizium anisopliae, for control of termites in Australia. Biological control: theory and applications in pest management 11 (3): 240-247. [ Links ]
MILNER. R. J.; STAPLES. J. A.; HARTLEY, T. R.; LUTTON, G. G.; DRIVER, F.; WATSON, J. A. L. 1998b, Occurrence of Metarhizium anisopliae in nests and feeding sites of Australia termites. Mycological Research [Cambridge: Cambridge University Press] 102: 216-220. [ Links ]
MIX, J.; BEAL, R. H. 1985. Can nematodes halt subterranean termites?. Pest Control 53 (2): 22-23. [ Links ]
MYLES, T. G. 2002. Alarm, aggregalion, and defense by Reticulitermes flavipes in response to a naturally occurring isolate of Metarhizium anisopliae. Sociobiology 40 (2): 243-255. [ Links ]
NELSON, P.E.; TOUSSOUN, T. A.; MARASAS, W. 1983. Iusarium species. An illustrated manual for identification. The Pennsylvania State University Press. University Park and London. Printed in the United States of America. 457 p. [ Links ]
PAPIEROK B.; HAJEK, A. E. 1997. Fungi Entomophthorales. In: Lawrence Lacey (ed.). Manual of techniques in insect pathology. USDA. ARS. Academic Press, Great Britain. p. 187-212. [ Links ]
PATCHARIN I, B. 1996. Laboratory studies on green muscardine fungus, Metarhizium anisopliae for control of termites (Isoptera). Bangkok (Thailand). 82 p. [ Links ]
PEREZ, L. E 1997. Desarrollo para evaluar virulencia de Verticillium lecanii sobre Myzus persicae y Trialeurodes vaporariorum. Tesis de investigación presentado como requisito para optar al título de Magister en Entomología. Facultad de Ciencias. Universidad Nacional de Colombia. Sede Medellín. 79 p. [ Links ]
RATH, A. C. 2000. The use of entornopathogenic for control of termites (Review). Biocontrol Science & Technology 10 (5): 563-58 1. [ Links ]
ROSENGAUS, R. B. 1997. Pathobiology and disease transmission in dampwood termites (Zootermopsis angusticollis) (lsoptera: Termopsidae) infected with the fungus Metarhlizium anisopliae (Deuteromicotina, Hyphomycetes). Sociobiology 44 (2):125- 134. [ Links ]
ROSENGAUS, R. B.; MAXMEN, A. B.; COATES, L. E.; TRANIELLO, J. F. A. 1998. Disease resistance: a benefit of sociability in the dampwood termite Zootermopsis anguslicollis (Isoptera: Termopsidae). Hehavioral Ecology & Sociobiology 44 (2): 125-134. [ Links ]
SAJAP A. S.; KAUR, K. 1990. Histopathology of Pletarhizium aoisopliae, on entomopathogenic fungos infection in the termite, Coptotermes curvignathus. Pertanika 13 (3): 33 1-334. [ Links ]
SAMSON, R. A.; HOEKSTRA, E. S.; OORSCHOT, A. N. 1984. lntroduction to food- borne fungi. Second edition. Central bureau voor Schimmelcultures. lnstitute of the Royal Netherlands. Academy of arta and sciences. 247 p. [ Links ]
SHIMIZU, S.; YAMAJI. M. 2002. Pathogenicity of entomopathogenic fungi to the terrnite, Reticulitermes speratus. Japanese Journal of Applied Entomology and Zoology 46 (2): 89-91 [ Links ]
SHIMIZU, S.; YAMAJI, M. 2003. Effect of the termite, Heticulltermes speratus Rolbe (lsoptera: Rhinotermitidae), on the suceptibilities to Metarhizium anisopliae. Applied Entomology and Zoology 38 (1): 125- 130. [ Links ]
STAFLES, J. A.; MILNER, R. J. 2000. A laboratory evaluation of the repellency of Pletarhizium anisopliae conidia lo Coptotermes ladeos
(Isoptera: Rhínotermitidae). Sociobiology 36(1): 133-148. [ Links ]
SUN, J. Z.; PUXA, J. R.; HSNDERSON, O. 2003. Effects of virulence, sporulation, and temperature on Pletarhiziurn anisopliae and eauveria bassiana laboratory transmission in Coptotermes Formosanus. Journal of Invertebrate Pathology 84 (11: 38-46 [ Links ]
TRANIELLO, J. F. A.; ROSENGAUS, R. B.; SAVOLE, K. 2002. The development of inmunity in a social Insect: Evidence for the group facilitation of disease resistance. PNAS 99 (10): 6838-6842. [ Links ]
WARDLAW, A. C. 1987. Practical statistics for experimental biologist. John Wiley & Sons. New York: p. 107-110. [ Links ]
WRIGHT, M. S.; OSBRINK, W. L. A.; LAX, A. R. 2002. Transfer of entomopathogenic fungi among formosan subterranean termites and subsequent mortality. Journal of Applied Entomology-Zeitschrift Sur Angewandte Entomologie. Germany 126 (1): 20-23. [ Links ]
ZOBERI, M. H. 1995. Netarhizium aoisopliae, a fungal pathogen of Reticulitermes flavipes (Isoptera: Rhinotermitidae). Mycologia 87 (3): 354-359. [ Links ]
ZOBERI, M. H.: ORACE, J. K. 1990. Isolation of the pathogen Beauueria bassiana from Reticulitermes flavípes (lsoptera: Rhinotermitidae). Sociobiology 16 (3): 289-296. [ Links ]
Recibido: Dic. 05/2003 - Aceptado: Jun. 11 / 2004