Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.31 no.2 Bogotá July/Dec. 2005
Efecto de la crioconservacion sobre la viabilidad y actividad biocontroladora de Nomuraea rileyi contra Spodoptera frugiperda (Lepidoptera: Noctuidae)
Effect of cryopreservacion on the viability and the biocontrol activity of Nomuraea rileyi against Spodoptera frugiperda (Lepidoptera: Noctuidae)
LISSETTE TORRES1. ALBA MARINA COTES2
1Autor para correspondencia B.Sc. Investigadora Laboratorio de Control Biologico. C.I, Tibaitata. Corpoica. E-mail: lissettetorres@yahoo.es
2Ph.D. Investigador principal. Laboratorio de Control Biologico. C.I, Tibaitata. Corpoica. E-mail: acotes@corpoica.org.co
Resumen. El hongo entomopatogeno omuraea rileyi constituye una de las alternativas mis promisorias para el control de Spodoptera frugiperda, la plaga mas limitante del maiz en Colombia. En un trabajo previo se selecciono un aislamiento nativo de N. rileyi que ocasiono una mortalidad del 100% sobre larvas de la plaga en laboratorio. Sin embargo, la actividad biocontroladora de losmicroorganismos puede verse afectada por aspectos como el metodo de conservacion. En este estudio se determino el efecto de la crioconservacion en glicerol con agua peplonada a -70°C. sobre la viabilidad y actividad biocontroladora del hongo a traves del tiempo. A partir de una suspension de 1 x 107 conidios.ml-1, se determino el porcentaje de germinacion, el numero de unidades formadoras de colonia (UFC) y el porcentaje de eficacia del microorganismo sobre larvas, antes de su crioconservacion (control), a las 24 horas, a los 12 meses y a los 18 meses. Al evaluar su viabilidad expresada como porcentaje de germinacion y como UFC, 24 horas despues de la crioconservacion, no se evidencio reduccion con respecto al control; pero a partir de los doce meses se presento un retardo de 18 horas en alcanzar un porcentaje de germinacion superior al 90% y una perdida de un exponente para UFC. Sin embargo, no se presentaron diferencias significativas en la mortalidad de las polillas en cada uno de los tiempo se valuados, siendo esta superior al 96.4%. Se puede concluir que la crioconservacion durante dieciocho meses no afecta la germinacion ni la actividad biocontroladora del microorganismo pero si su UFC.
Palabras clave: Conservacion. Entomopatogeno. Gusano cogollero del maiz.
Summary.The entomopathogenic fungus Nomuraea rileyi is one of the most promising alternatives for the control of Spodoptera frugiperda, the most important pest of maize in Colombia. In previous work, a native isolate of N. rileyi was selected that caused 100% mortality on larvae of the pest under laboratory condicions. However, biocontrol activity of microorganisms may be affected by different factors such as preservacion method. This study determined the effect of cryopreservation in glycerol and peptone at- 70ºC on its viability and biocontrol activity overtime. From a suspension of 1 x 107conidia.mr-1. germination percentage, number of colony-forming units (CFU) and percent efficacy of the microorganism on larvae were determined before cryopreservation (control), after 24 hours. 12 months and 18 months. An effect on the viability of the microorganism expressed as percent germinacion and as CFU was not evident 24 hours after cryopreservation with respect to the control; but after 12 months there was a delay of 18 hours to reach a percent germination above 90% and a one exponent loss to CFU. However, no significant differences were detected in moth mortality in any of the evaluated times, being higher than 96,4%. It is concluded that ryopreservation over 18 months does not affect the germination or the biocontrol activity but does affect the CFU.
Key words: Conservation. Entomopathogen. Fall army worm.
Introduccion
El cultivo del maiz ocupa un lugar muy importante dentro de los sistemas de produccion agricola de Colombia al ser el segundo cereal mas producido despues del arroz. Dicha produccion para el 2003 fue de 1.173.800 toneladas, que en terminos de rendimiento represento 2.1 toneladas por hectarea (Ministerio de Agricultura y Desarrollo Rural 2004). Sin embargo, el rendimiento de este cultivo se ha visto reducido hasta en un 35% debido al daño ocasionado por el gusano cogollero del maiz Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae) (Fernandez 2003 citado por Castillo 2003), el cual se ha convertido en la plaga mas limitante del cultivo si se tiene en cuenta que, ademas de ser una plaga polifaga, se encuentra ampliamente distribuida en la zonas productoras de maiz afectandolo en las diferentes etapas de su desarrollo. Ante esta problematica e han venido utilizando diferentes metodos de control, como el cultural el cual, no ha sido suficiente para disminuir los daños ocasionados por la plaga, el control quimico ha traido consigo un uso exagerado e inadecuado de plaguicidas que han afectado severamente el ambiente al alterar las poblaciones de enemigos naturales, fauna y flora asociada, asi como tambien ha originado problemas de contaminacion. Es asi como el control biologico. mediante el uso de hongos entomopatogenos, aparece como una alternativa frente a las debilidades de los demas metodos de control, ya que puede representar una solucion duradera y efectiva, amigable con el medio ambiente y altamente especifica hacia su hospedero (Garcia et al. 2002).
En el control biologico de S. frugiperda se ha destacado la actividad del hongo Nomuraea rileyi, el cual se encuentra distribuido en diferentes agroecosistemas y zonas geograficas donde frecuentemente ocasiona epizootias naturales sobre este insecto y otros lepidopteros de importancia economica como Anticarsia gemmatalis (Hubner) (Lepidoptera: Noctuidae), Pseudoplusia includens (Walker) (Lepidoptera: octuidae), Trichoplusia ni (Hubner) (Lepidoptera: Noctuidae) y Helicoverpa virescens (F.) (Lepidoptera: Noctuidae). Es asi como este microorganismo se ha convertido en un excelente agente de control biologico con gran potencial para ser utilizado dentro de estrategias de Manejo Integrado de la Plaga (Leon y Pulido 1991).
Estudios realizados en Venezuela, reportaron una incidencia del 100% sobre larvas de S. frugiperda alimentadas con hojas de maiz provenientes de campo e infectadas con N. rileyi (Garcia y Clavijo 1985). Asi mismo, Lezama-Gutierrez et al. (2000), reportaron a N. rileyi como el entomopatogeno con mayor ocurrencia en larvas de S. frugiperda, en comparacion con B. anisopliae (Balsamo) Vuillemin, Metarhizium anisopliae etschnikov 1879, Hirsutella sp. y Entomophthora sp. Por otra parte, segun estudios realizados por Garcia et al, (2002), aplicaciones de este entomopatogeno en forma de cebo en lotes comerciales de maiz en el Valle del Cauca, ocasionaron porcentajes de eficacia superiores al 90% por un tiempo mayor a 20 dias despues de su aplicacion. A pesar de este potencial como agente biocontrolador, no existe ningun bioplaguicida registrado a base de este microorganismo ni en Colombia ni en el mundo (Villamizar et al. 2004).
En este sentido, el Laboratorio de Control Biologico del Programa de Manejo Integrado de Plagas de Corpoica, con su compromiso de producir insecticidas microbianos seguros, eficaces y confiables, ha destinado gran parte de sus esfuerzos de los ultimos años hacia el aislamiento, evaluacion, produccion y formulacion de N. rileyi. Es asi como actualmente cuenta con el aislamiento nativo Nm006 de este microorganismo obtenido a partir de larvas de S. frugiperda recolectadas en un cultivo de maiz ubicado en el departamento del Meta, que ha ocasionado una mortalidad del 100% sobre estas, bajo condiciones de laboratorio (Bosa et al. 2004).
A pesar que N. rileyi es un microorganismo exigente en cuanto a los requerimientos necesarios para su adecuado crecimiento y esporulacion (Boucias et al. 2000), Villamizar et al. (2004) estandarizaron un medio para su produccion masiva con el que se han alcanzado rendimientos de 3.0 x 109conidios.gramo-1. Asi mismo, se desarrollaron diferentes preformulaciones a base de este microorganismo, seleccionandose un concentrado emulsionable con la cual se han obtenido porcentajes de eficacia del 96.6% (L. Villamizar, com. pers.).
Dada la importancia de garantizar la estabilidad de las caracteristicas necesarias para su produccion y para su actividad biocontroladora, el icroorganismo fue incorporado al Banco de Germoplasma de Microorganismos con Interes en Control Biologico, el cual tiene como proposito preservar las caracteristicas originales de los aislamientos alli presentes. Por lo tanto, el objetivo del presente trabajo fue el de evaluar el efecto de la crioconservacion en el tiempo sobre la viabilidad y actividad biocontroladora de Nomuraea rileyi contra Spodoptera frugiperda.
Materiales y Metodos
Se determino la viabilidad y la actividad biocontroladora del aislamiento Nm006 de N. rileyi antes de su crioconservacion y a las 24 horas, a los 12 meses y a los 18 meses despues de esta. Para la evaluacion de la viabilidad se determino el porcentaje de germinacion y el numero de unidades formadoras de colonia (UFC) y para la evaluacion de la actividad biocontroladora, se determino el porcentaje de eficacia y el tiempo letal noventa (TL90) mediante bioensayos bajo condiciones de laboratorio.
Efecto de la crioconservacion sobre la viabilidad del aislamiento
A partir del microorganismo crecido y esporulado sobre Agar Extracto de Levadura - Extracto de Malta (YM), se preparo una suspension madre en el criopreservante, que consistio en una mezcla de glicerol y agua peptonada. Dicha suspension se ajusto a la concentracion de 1 x 107conidios ml-1'y partir de esta se hicieron diluciones seriadas desde 10-1 hasta 10-5 para determinar el porcentaje de germinacion se utilizo la suspension madre y la dilucion 10-1sembrando 100 mL de cada una de ellas en cajas de Petri con medio YM. Posteriormente, las cajas se incubaron a 25°C y a partir de las 18 horas de incubacion se determino el porcentaje de conidios germinados en el tiempo hasta que este supero el 90%. Para ello se registro el numero de conidios totales presentes en 10 campos opticos seleccionados aleatoriamente de tres cajas de Petri. Los resultados se xpresaron como el porcentaje de conidios germinados.
Para determinar el numero de unidades formadoras de colonia (UFC), se sembraron las diluciones 10-2, 10-3 y 10-5 de la misma manera descrita anteriormente y se hicieron observaciones diarias hasta evidenciar el crecimiento puntual de las colonias.
Por otra parte y con el fin de determinar la viabilidad del microorganismo despues de su crioconservacion, se prepararon los crioviales necesarios para hacer estas evaluaciones en el tiempo, sirviendo 1 mL de la suspension que con tenga 1 x 107 conidios.ml-1 por criovial. Posteriormente, todos los crioviales se mantuvieron en un ultracongelador a -70°C durante 24 horas, 12 meses y 18 meses. Transcurridos cada uno de estos por odos, se tomo al azar un criovial, se descongelò a 37°C y se determinaron el porcentaje de germinacion y el numero de UFC siguiendo la metodologia anteriormente descrita; asi mismo, se determino el efecto de la crioconservacion en el tiempo sobre la actividad biocontroladora del microorganismo contra S. frugiperda.
Para la evaluacion del porcentaje de germinacion y del numero de UFC del microorganismo antes y despues de su crioconservacion, se utilizo un diseno experimental completamente al azar con tres repeticiones por tratamiento, siendo cada repeticion una caja de Petri, y los datos obtenidos se sometieron a un analisis de varianza (ANAVA) y a la prueba de comparacion de medias LSD (a=0.05).
Efecto de la crioconservacion sobre la actividad biocontroladora
Para determinar el efecto de la crioconservacion sobre la actividad biocontroladora de N. rileyi, se rcalizaron cinco bioensayos en el tiempo, en los cuales se evaluo esta actividad antes de la crioconservacion y 24 horas, 6 meses, 12 meses y 18 meses despues de esta. Para tal fin, a partir del microorganismo mantenido en Agar YM antes y despues de su crioconservacion durante cada uno de los tiempos evaluados, se preparo una suspension en el tensoactivo Tween 80 al 0.1% ajustada a una concentracion de 1 x 107 conidios.ml-1. Posteriormente, por medio de un aspersor manual se asperjo sobre 30 hojas de higuerilla (Ricinus communis) a razon de 1.2 mL sobre el haz y el enves de cada hoja, previamente desinfectada en una solucion de hipoclorito de sodio al 0.5%. La unidad experimental consistio en un recipiente plastico de 16 onzas, en cuyo interior sc ubicd un papel humedo, una hoja de higuerilla y una larva de tercer in star de S. frugiperda, provenicnle de una cria establecida en el Laboratorio de Control Biologico. Estos se mantuvieron bajo condiciones de laboratorio a 25°C y 55% de humedad relativa. Se tomaron datos de mortalidad cada tercer dia a partir del quinto dia del montaje del bioensayo hasta alcanzar un porcentaje de mortalidad del 100%. Los resultados se corrigieron calculando el porcentaje de eficacia mediante la formula de Schneider - Orelli (Ciba - Geigy 1973):
Porcentaje = (b - k) / (100 - k) x 100 de eficacia
Donde b equivale al porcentaje de individuos muertos en el tratamiento y k equivale al porcentaje de individuos muertos en el testigo absoluto.
Se utilizo un diseno experimental completamente al azar con 30 repeticiones por tratamiento, en el cual cada larva fue una repeticion. Los tratamientos correspondieron a un testigo absoluto (hojas de higuerilla sin ninguna aplicacion), un testigo tratado en el cual se asperjo Tween 80 al 0.1% sobre hojas de higuerilla y a la aplicacion del entomopatogeno antes y despues de su crioconservacion. Debido a que los resultados no se comportaron como una normal, los datos se sometieron a la prueba no parametrica de Kruskal Wallis (a=0.05). Adicionalmente, se determino el tiempo letal 90 (TL90) del microorganismo antes y despues de su crioconservacion; los datos de mortalidad se sometieron a un analisis de varianza (ANAVA) y a la prueba de comparacion de medias LSD (a=0.05).
Resultados y Discusion
Efecto de la crioconservacion sobre la viabilidad del aislamiento
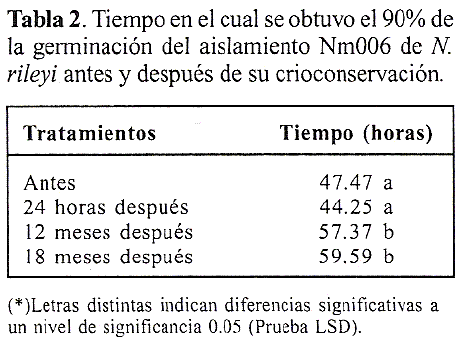
Se encontro que el porcentaje de germinacion fue superior al 90% a las 48 horas de lectura antes de la crioconservacion y 24 horas despues de la crioconservacion. Sin embargo, a partir de los 12 meses despues de la crioconservacion, se evidencio este mismo porcentaje aproximadamente a las 18 horas de lectura (Tabla 1).
Este retraso en la germinacion, que fue mas evidente a partir de los 18 meses, podria estar relacionado con un efecto de latencia inducido por el tiempo de crioconservacion si se tiene en cuenta que se obtuvo un porcentaje de germinacion inferior al 17% al comienzo del periodo de recuperacion del microorganismo que correspondio a 18 horas despues de la descongelacion y cultivo sobre medio agar YM, pero a medida que este periodo de recuperacion aumento, tambien lo hizo su germinacion. Asi mismo, el tiempo requerido por el microorganismo para alcanzar el 90% de germinacion despues de los 12 meses de su crioconservacion, fue significativamente superior (57.37 horas) con respecto a los tiempos requeridos por el microorganismo antes y 24 horas despues, que fueron de 47.47 horas y 44.25 horas, respectivamente (Tabla 2).
Los resultados podrian indicar que la crioconservacion afecto el tiempo de geminacion de los conidios, pero no su capacidad de germinar. Lo anterior concuerda con estudios realizados por Bahamon et al. (2001), quienes atribuyeron el retardo en la germinacion de Beauveria anisopliae despues de su crioconservacion durante seis meses a la latencia inducida del microorganismo por el choque osmotico de los criopreservantes o por cambios en la permeabilidad de la membrana. Sin embargo, los resultados demostraron que el glicerol favorece la geminacion de N. rileyi despues del periodo de recuperacion sobre el medio de cultivo, lo que podria deberse a la capacidad del glicerol de penetrar la pared celular y la membrana citoplasmatica de las celulas, protegiendolas de la desecacion y del daño producido por los cristales intracelulares (Simione 1998). Esta misma capacidad, tambien se ha evidenciado en la conservacion de virus, bacterias, micoplasmas, mixomycetes, otros hongos filamentosos, levaduras, algas y protozoos (Hubalek 2003). Adicionalmente, la peptona usualmente es usada corao diluyente para microorganismos quc van a ser sometidos al proceso de crioconservacion, ofreciendoles proteccion durante la congelacion y la descongelacion. Al utilizar este compuesto en combinacion con el glicerol, se pudo acentuar el efecto protector de este ultimo (Hubalek 2003).
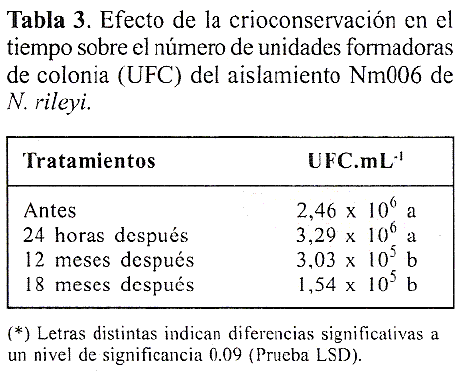
A pesar de que no se observo perdida en la germinacion de los conidios, a partir de los 12 meses de la crioconservacion se presento una reduccion de un exponente en el numero de unidades formadoras de colonia (UFC) (Tabla 3). Esta podria deberse a la alteracion de los mecanismos fisiologicos involucrados en la formacion de micelio. Sin embargo, es necesario desarrollar trabajos de investigacion que generen respuestas a este supuesto, ya que existe una gran cantidad de factores que afectan la eficiencia de la crioconservacion de los microorganismos. Tal es el caso de la especie, el aislamiento, el tamaño y forma de las celulas, la tasa y fase de crecimiento, la temperatura de incubacion, la composicion del medio de cultivo, el pH, la osmolaridad, la aireacion, el contenido de agua celular, la composicion del medio de cultivo, la densidad de congelamiento, la tasa de enfriamiento, la temperatura y duracion del almacenamiento, la tasa de calentamiento y el medio de recuperacion (Hubalek 2003). Sin embargo, uno de los factores mas importantes es la composicion del medio usado para suspender el microorganismo congelado; aunque algunos microorganismos han sido capaces dc sobrevivir a condiciones de congelamiento sin uso de aditivos protectores, la presencia de estos favorece la supervivencia considerablemente (Hubalek 2003).
Smith y Tomas (1997) al observar mediante un microscopio criogenico de luz la viabilidad de siete aislamientos de hongos durante su congelacion y descongelacion, encontraron quc la ausencia de criopreservantes favorecio la formacion de hielo intracelular y el encogimiento de las hifas; caracteristicas quo no fueron letales para el microorganismo, pero que en muchos casos afectaron su tasa y calidad dc crecimiento, en contraste con los rcsultados obtcnidos al utilizar glicerol y dimetil - sulfoxido (DMSO).
Aunque no existen registros que hayan determinado el efecto de la crioconservacion sobre la viabilidad de N. rileyi; se han realizado algunos trabajos con otros microorganismos. Ryan et al. (2001) en su estudio relacionado con los efectos de la crioconservacion y liofilizacion sobre la viabilidad, fisiologia y estabilidad genetica de asilamientos dc Metarhizium anisopliae, Fusarium oxysporum Link ex Gray y Serpula lacrymans (Wulfen) J. Schrot.; encontraron que algunas de sus caracteristicas pueden afectarse por la preservacion. Tal es el caso de los perfiles de metabolitos secundarios y la produccion dc enzimas extracelulares, incluso se detectaron mediante la tecnica de PCR fingerprinting, polimorfismos en dos aislamientos de M. anisopliae despues de su crioconservacion y liofilizacion. Sin embargo, al crioconservar una cepa de Beauveria anisopliae durante seis meses en nitrogeno liquido a -196°C usando glicerol al 10% como criopreservante, se obtuvo un incrcmento en el porcentaje de germinacion siendo este del 70% y del 90.5% al inicio y al final de la evaluacion respectivamenle (Bahamon et al. 2001).
Por otra parte, Mota et al. (2003) evidenciaron un incremento en el crecimiento micelial, en la produccion de biomasa y en la esporulacion de los hongos controladores de nematodos Arthrobotrys robusta Dudd y Monacrosporium thaumasium (Drechsler) de Hoog & van Oorschot al ser crioconservados durante 18 meses en glicerol al 10% y nitrogeno liquido a -196°C, con respecto a su conservacion a 4°C sin ningun preservanle. Asi mismo, al conservar especies de hongos entomopatogenos como Paecilomyces fumosoroseus (Wize) Brown & Smith (Hyphomycete), Smittium culisetae Lichtwardt, 1964 (Trichomycele) y Leptolegnia chapmanii Seymour (Oomycete), bajo diferentes metodos tales como agua desionizada, aceite mineral, silica gel y crioconservacion a -20°C y a -80°C, no presentaron perdida en su viabilidad al ser mantenidas durante 3, 6, 12 y 18 meses bajo este ultimo metodo (Lastra et al. 2002).
Efecto de la crioconservacion sobre la actividad biocontroladora
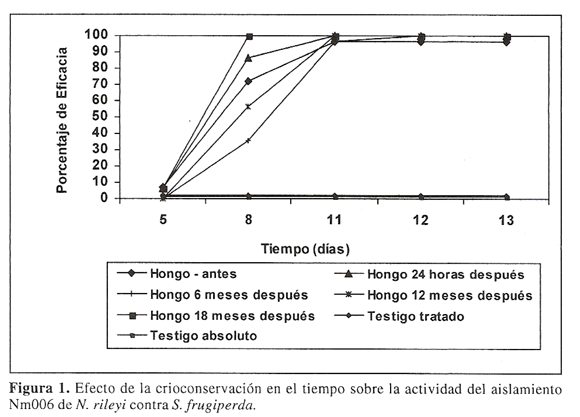
No se presentaron diferencias significativas entre los porcentajes de eficacia (actividad biocontroladora) antes y despues de su crioconservacion; siendo estos superiores al 96% al final de la evaluation (Fig.1).
Estos resultados obtenidos concuerdan con los reportados por Bahamon et al. (2001), quienes al evaluar la actividad biocontroladora de un aislamiento de B. anisopliae contra la broca del cafe Hypothenemus hampei Ferrari (Coleoptera: Scolytidae) despues de seis meses de su conservacion en glicerol, obtuvieron un porcentaje de mortalidad del 91.6%. Segun Clarkson y Charnley (1996), la capacidad patogenica dc un hongo entomopatogeno, como N. rileyi, depende en gran medida de la actividad del complejo enzimatico encargado de degradar la cutcula o exoesqueleto del insecto. Tal es el caso de las proteasas, quitinasas y lipasas, las cuales pueden presentar reduccion en su actividad a temperaturas entre -12°C y -75°C debido a cambios estructurales en su sitio activo (Shikama y Yamasaki 1961 citados por Bahamon et al. 2001). Sin embargo, el uso del glicerol y de la peptona en la conservacion del aislamiento Nm006 de N. rileyi, al actuar como osmoreguladores en la celula pudieron remplazar las moleculas de agua perdidas, manteniendo la hidratacion de las protefnas, especialmente las de bajo peso molecular. Asi mismo, el glicerol al ser excluido del dominio de la protefna, pudo evitar la inestabilidad en su composicion (Crowe et al. 1984; Crowe et al. 1990 y Fink 1986 citados por Bahamon et al. 2001). Esta misma accion estabilizante ha sido observada en la production de enzirnas ligninoliticas por diferentes Basidiomycetes crioconservados en DMSO y en glicerol (Stoychev et al. 1998; Croan et al. 1999).
Lastra et al (2002) no encontraron perdida en la actividad biocontroladora de los hongos entomopatogenos Smittium culisetae y Leptolegnia chapmanii al ser evaluados contra Aedes aegypti Linnaeus, 1762 (Diptera: Culicidae), despues de 18 meses de su crio conservacion a -80°C. Tambien, se ha podido comprobar el efecto protector del glicerol en los hongos fitopatogenos Colletotrichum gloeosporioides Penz, Colletotrichum acutatum J. H. Simmonds, Colletotrichum fragariae Brooks y Phomopsis obscurans Ellis & Everh. [stat. anam.] (1894), ya que no presentaron perdidas en su viabilidad al ser conservados a -85°C, durante 21 meses, ni presentaron cambios en su patogenicidad despues de cuatro años de su conservacion bajo las mismas condiciones (Legard y Chandler 2000).
El TL90 del aislamiento Nm006 de N. rileyi crioconservado durante 18 meses, correspondio a 7.67 dias y fue significativamente inferior con respecto a los TL90 obtenidos para el microorganismo antes de su crioconservacion y 24 horas y 12 meses despues de esta, los cualcs correspondieron a 11.25, 10.79 y 11.45 dias, respectivamente (Tabla 4). Estos resultados podrian indicar un efecto potencializador de la crioconservacion durante 18 meses sobre la actividad biocontroladora del microorganismo. Los polioles, especialmente aquellos de bajo peso molecular como el glicerol, el eritritol y la trehalosa juegan un papel muy importante en el balance osmotico de las celulas, brindando proteccion a la membrana y a las proteinas. De igual manera, estos compuestos se han asociado con la lolerancia a ciertas condiciones ambientales, con la aceleracion de la germinacion e incluso con el incremento en la patogenicidad y en la vida de almacenamiento de los propagulos fungicos, como ha sido demostrado para los hongos B. anisopliae, M. anisopliae y Paecilomyces farinosus (Holm:Fr.) Brown & Smith (Hallsworth y Magas 1996). Es posible que el glicerol utilizado como agente criopreservante en el presente estudio hubiera sido acumulado en la pared celular y en la membrana citoplasmatica de las celulas del microorganismo protegiendolas; ademas los polioles u otros metabolitos producidos por este una vez fue dcscongelado y sembrado sobre medio de cultivo YM, favorecio la germinacion de N. rileyi y su actividad biocontroladora contra S.frugiperda. Debe considerarse que la realizacion de diferentes bioensayos en el tiempo, impidio el uso de larvas de S. frugiperda provenientes dc una misma colonia y de una misma generacion; hecho que podria estar relacionado con una mayor susceptibilidad del insecto frente al ataque del hongo entomopatogeno, especialmente al llevarse a cabo la evaluacion despues de los 18 meses de la crioconservacion, repercutiendo en los resultados del efecto de la crioconservacion; hay que tener en cuenta que los datos de numero de UFC cambiaron a traves del tiempo, y en estas evaluaciones no se tuvieron en cuenta lo insectos, por consiguiente se podria decir que si hay un efecto de la crioconservacion. Sin embargo, es necesario continuar con estas evaluaciones durante un mayor tiempo para poder confirmar la repetibilidad de las observaciones realizadas. De ser asi, esta metodologia podria ser incorporada dentro del desarrollo tecnologico del bioplaguicida ya que permitio el incremento de la actividad biocontroladora de N. rileyi.
Conclusiones
La crioconservacion del aislamiento Nm0()6 de Nomuraea rileyi en glicerol y agua peptonada durante 18 meses, no afecto su germinacion ni su actividad biocontroladora, pcro si su numero de UFC.
Agradecimientos
Los autores expresan su agradecimiento al Sislema de Bancos de Germoplasma financiado mediante el convenio tripartite entre Corpoica, el Ministerio de Agricultura y Desarrollo Rural y el Instituto Colombiano Agropecuario.
Literatura citada
BAHAMON, T.; AYCARDI, E.; OROZCO, J.; MARIN, P.; BUSTILLO, A. 2001. Preservation de la patogenicidad de Beauveria anisopliae (Balsamo) Vuillemin (Moniliales: Moniliaceae) contra la broca del cafe en diferentes sistemas. Revista Colombiana de Biotecnologia 3(1): 80-90. [ Links ]
BOSA, C. F.; CHAVEZ, D.; TORRES. L.; PARIS, A.; VILLAMIZAR, L.; COTES, A. ML 2004. Evaluacion dc aislamicntos natives de Nomuraea rileyi para el control de Spodoptera frugiperda (Lepidoptera: Noctuidae). Revista Colombiana de Entomologia 30 (1): 94-97. [ Links ]
BOUCIAS, D. G.; TIGANO, M. S.; SOSA - GOMEZ, D. R.; GLARE, T. R.; INGLIS, P W. 2000. Genotypic properties of the entomopathogenic fungus Nomuraea rileyi. Biological Control (19): 124-38. [ Links ]
CASTILLO, L. F. 2003. Efecto de la composition del medio de cultivo en la virulencia de Nomuraea rileyi sobre el gusano cogollero del maiz Spodoptera frugiperda (Lepidoptera: Noctuidae). Trabajo de grado de Microbiologa Industrial. Pontificia Universidad Javeriana, Facultad de Microbiologia Industrial. Bogota. 149 p. CIBA - GEIGY. 1973. Como realizar un bioensayo. Manual de ensayos de campo. 215 p. [ Links ] [ Links ]
CLARKSON, J.: CHARNLEY, A. K. 1996. New insights into the mechanisms of fungal pathogenesis in insects. Trends in Microbiology 4 (5) 197-202. [ Links ]
CROAN, S. C; BURDSALL, H. H.; RENTMEESTER, R. M.1999. Preservation of tropical wood-inhabiting basidiomycetes. Mycologia 91 (5): 908-916. [ Links ]
GARCIA, J. L.; CLAVIJO, S. 1985. Incidencia del hongo Nomuraea sp (Deuteromycele: Ascomycotina) en larvas de Spodoptera frugiperda criadas en el laboratorio y alimentadas con plantas provenientes de campos comerciales de maiz. Boletlin de Entomologia Venezolana. N. S. 4(7): 53-59. [ Links ]
GARCIA, R: MOSQUERA, M.; VARGAS, C; ROJAS, L. 2002. Control biologico, microbiologico y fisico de Spodoptera frugiperda (Lepidotera: Noctuidae), plaga del maiz y otros cultivos en Colombia. Revista Colombiana de Entomologia 28 (1): 53-60. [ Links ]
HALLSWORTH, J. E.; MAGAN, N. 1996. Culture age, temperature and pH affect the polyol and trehalose contents of fungal propagules. Applied and Environmental Microbiology 62 (7): 2435-2442. [ Links ]
HUBALEK, Z. 2003. Protectanls used in the cryopreservation of microorganisms. Cryobiology 46 (3): 205-229. [ Links ]
LASTRA, C.C; HAJEK. A. E.; HUMBER, R. A. 2002. Comparing methods of preservation for cultures of entomopathogenic fungi. Canadian Journal of Botany 80(10):1126-1130. [ Links ]
LEGARD, D. E.; CHANDLER, C. K. 2000. Cryopreservation of the strawberry pathogens Colletotrichum gloeosporoides, C. acutatum, C. fragariae and Phomopsis obscurans in a - 95°C mechanical ultra-low temperature freezer. HortScience 35 (7): 1357-1361. [ Links ]
LEÒN, M.; PULIDO, J. L. 1991. Importancia del control natural del gusano cogollero Spodoptera frugiperda J. E. Smith. Memorias. Seminario Spodoptera frugiperda (El Gusano Cogollero) en sorgo, maiz y en otros cultivos. p. 78-82. Cali. [ Links ]
LEZAMA-GUTIERREZ, R.; JAMM, J.; MOLINA-OCHOA, J.; LOPEZ-EDWARDS, M.; PESCADOR-RUBIO, A.; GONZALEZ-RAMIREZ, M.; STYER. E. 2000. Occurence of entomophatogens of Spodoptera frugiperda (Lepidoptera: Noctuidae) in the mexican states of Michoacan, Colima, Jalisco and Tamaulipas. Army worm Symposium. Mexico. 8 p. [ Links ]
MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL, 2004. Colombia:Produccion, superficie y rendimiento de productos agropecuarios web site, http:// www.comunidadandina.org/estadisticas/ comp9099/agro-col.xls. Fecha ultimo acceso: 24 septiembre 2004. [ Links ]
MOTA, M.; CAMPOS, A.K.; ARAUJO. J. V. 2003. Sporulation, radial growth and biomass production of A. robust a and M. thaumasium submitted to different methods of preservation. Brazilian Journal of Microbiology 34 (2): 157-160 [ Links ]
RYAN. M.: JEFFRIES. P.; BRIDGE, P.; SMITH. D. 2001. Developing cryopreservation protocols to secure fungal gene function. CryoLetters (22) 125-134. SIMIONE. F. 1998. Cryopreservation Manual. American Type Culture Collections- Nelge Nunc International Corp. Estados Unidos. 8 p. [ Links ] [ Links ]
SMITH, D.; THOMAS, V. E. 1997. Cryogenic light microscopy and the development of cooling protocols for the cryopreservation of filamentous fungi. World Journal of Microbiology and Biotechnology 14(1): 49-57. [ Links ]
STOYCHEV, I.; HOMOLKA, L.; NERUD, F: LISA. L. 1998. Activities of ligninolytic enzymes in some white-rot basidiomycete strains after recovering from cryopreservation in liquid nitrogen. International Journal of General and Molecular Microbiology 73 (3): 211-214. [ Links ]
VILLAMIZAR,L.;ARRIERO , C.;BOSA ,F.; COTES, A,2004 Desarrollo de preformulados a base de Nomuraea rileyi para el control del Spodoptera frugiperda (Lepidoptera :Noctuidae ).Revista Colombiana de Entomologia 30(1) 99 - 105. [ Links ]