Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.32 no.1 Bogotá Jan./June 2006
Efecto de plantas nectaríferas sobre la reproducción de Diadegma aff insulare Cresson (Hymenoptera: Ichneumonidae), parasitoide de Plutella xylostella L. (Lepidoptera: Plutellidae)
Effect of nectar producing on the reproduction of Diadegma aff insulare Cresson (Hymenoptera: Ichneumonidae), parasitoid of Plutella xylostella L. (Lepidoptera: Plutellidae)
DANIEL CARRILLO1, MIGUEL S. SERRANO2, EDISON TORRADO-LEÓN3
1. Ingeniero Agrónomo, daniel.carrillo@utadeo.edu.co
2. Autor para correspondencia: Entomólogo Ph. D. Compañía Agrícola Colombiana. Calle 100 No. 7-33 piso 19 Bogotá D.C. miguel.serrano@monsanto.com
3. Profesor asociado Universidad Nacional de Colombia etorradol@unal.edu.co
Resumen. Se estudió el efecto de plantas productoras de néctar (Brassica rapa (L.), Calendula officinalis (L.), Ruta graveolens (L.), y Borrago officinalis (L.)), comparadas con solución de miel de abejas sobre la longevidad y fecundidad de Diadegma aff. insulare bajo condiciones de casa de malla. La longevidad y fecundidad de hembras de D. aff. insulare alimentadas en B. rapa fueron iguales a las alimentadas con solución de miel y agua (15,4 ± 1,1 días, 67,0 ± 2,7 progenie/hembra). B. officinalis fue la mejor fuente de alimentación (38,4±4,6 días, 186,8±2,5 progenie/ hembra), seguida por R. graveolens (18,2±10,6 días, 91,4±2,7 progenie). Hembras alimentadas con C. officinalis (4,0±1,7 days, 12.2±2,97 progenie) tuvieron la longevidad y fecundidad más baja respecto al testigo. Longevidad y fecundidad variaron con características morfológicas de las flores. Un incremento en longevidad y fecundidad estuvo relacionado con mayor ancho y longitud de corola. En pruebas de selección libre y de no selección se registró un número significativamente mayor de visitas a las flores de R. graveolens (4,2 ±1,7 y 5,75±1,2 visitas/min) y B. rapa (3,8 ± 0,9 y 5,75 ± 0,9 visitas/min). Se sugiere manipular la presencia plantas nectaríferas, especialmente B. officinalis para aumentar el impacto de D. aff. insulare en el manejo integrado de P. xylostella.
Palabras clave: Palomilla Dorso de Diamante, control biológico, nectarios, arquitectura floral.
Abstract. The effect of nectar-producing plants (Brassica rapa (L.), Calendula officinalis (L.), Ruta graveolens (L.), and Borrago officinalis (L.)), compared to honey solution, on the longevity and fecundity of Diadegma aff. insulare were studied under green house conditions. The longevity and fecundity of D. insulare females fed on B. rapa (L.) were similar to those fed with a solution of honey and water (15,4±1,1 days, 67,0± 2,7 progeny/female). B. officinalis was the best food source (38,4±4,6 days, 186,8±2,5 progeny/female), followed by R. graveolens (18,2±10,6 days, 91,4±2,7 progeny). Females fed with C. officinalis (4,0±1,7 days, 12.2±2,97 progeny) had the lowest fecundity and longevity with respect to the control. The longevity and fecundity of D. insulare varied with morphological characters of flowers. An increase in longevity and fecundity was correlated with a greater width and length of the corolla. In choice and no choice tests, a greater number of flower visits were recorded for R. graveolens (4,2±1,7 y 5,75±1,2 visits/min) and B. rapa (3,8±0,9 y 5,75±0,9 visits/min). It is suggested that the number of nectar producing plants, especially B. officinalis, be manipulated to increase the impact of D. insulare on the integrated management of P. xylostella.
Key words: Diamondback moth, biological control, nectaries, floral architecture.
Introducción
En Colombia el cultivo de brasicas o crucíferas constituye un renglón productivo para la economía campesina y de medianos productores. En el año 2001 se sembraron 4.237 ha principalmente en cultivos de brócoli (Brassica oleracea L. var. italica), repollo (Brassica oleracea L. var. capitata), y coliflor (Brassica oleracea L. var. botrytis) (Anónimo 2004).
Dentro del complejo de plagas que atacan las crucíferas se destacan especies de lepidópteros como Copitarsia sp., Spodoptera spp. y Peridroma sp. (Lepi-doptera: Noctuidae), moluscos como Deroceras reticulatum (Müller) y Va g i -nulus spp. (Pulmonata: Veronicellidae), el áfido Myzus persicae (Sulzer) (Hemip-tera: Aphididae) y Lyriomiza spp. (Dip-tera: Agromyzidae). No obstante, la principal plaga de cultivos de crucíferas en el mundo es la polilla dorso de diamante, Plutella xylostella L. (Lepidop-tera: Plutellidae) (Xu et al. 2001; Idris y Grafius 1993). Sus poblaciones pueden alcanzar frecuentemente el 75% del total de insectos en un cultivo y pueden causar pérdidas de hasta el 90% en la producción (Ivey y Jonson 1997). Las pérdidas causadas varían con las características ambientales de la localidad, el período de crecimiento del cultivo, la extensión de las plantaciones y la frecuencia de aplicación de insecticidas (Idris 1995).
La estrategia de control más utilizada ha sido el uso de insecticidas químicos de síntesis como piretroides, carbamatos, organofosforados y reguladores de crecimiento (Idris y Grafius 1996a). Sin embargo, P. xylostella ha desarrollado resistencia a todos los insecticidas usados en su contra (Liu et al. 2003; Zhao et al. 2001, 2002; Diaz et al. 2000; Tabashnik et al. 1990, 1994; Shelton et al 1993; Leibiee y Savage 1992). Los problemas de resistencia se han combatido con la introducción de nuevas moléculas o principios activos, sin embargo lejos de resolver el problema la situación cada vez se ha tornado más compleja. Varios autores han registrado resistencia cruzada a diferentes grupos de insecticidas (Zhao et al. 2001; Idris 1995; Tabash-nik et al. 1994).
Para el manejo integrado de P. xylostella se enfatiza la reducción de aplicaciones e integrar diferentes métodos de control. Para reducir la frecuencia de las aplicaciones se ha propuesto aplicar sólo durante etapas críticas del desarrollo fenológico del cultivo, como la inducción floral o la formación de cabeza (Carrillo 2004; Barrantes y Rodríguez 1996; Idris 1995; Carballo y Hruska 1989). Al reducir las aplicaciones se favorece la acción del control biológico ejercido por sus enemigos naturales, como ha sido el caso del programa establecido en Malasia donde las poblaciones de parasitoides controlan a P. xylostella y solo ocasionalmente se hacen aplicaciones de insecticidas químicos (Greathead 1995).
Entre los parasitoides que se usan para control de P. xylostella se destacan bracónidos e ichneumónidos de los géneros Cotesia, Microplitis y Diadegma (Talekar y Shelton 1993). Diadegma reviste la mayor importancia debido a que sus especies tienen buena capacidad de búsqueda, alta fecundidad, capacidad de evadir superparasitismo, y pueden regular el desarrollo de su hospedero (Idris y Grafius 1996a).
Diadegma insulare Cresson, es el principal parasitoide de P. xylostella en varios países del mundo (Xu et al. 2001; Johanowicz y Mitchell 2000). En algunos casos, el parasitismo en campo supera el 90% sin embargo, en muchos otros el éxito del control biológico ha sido reducido por no tener en cuenta los requerimientos alimenticios del parasitoide (Wratten et al. 2003; Muckenfuss et al. 1990). Entender la importancia relativa de las flores como fuente de alimento para D. insulare es muy importante para aumentar su eficiencia como controlador biológico de P. xylostella.
La alimentación con azúcares es determinante para la supervivencia, fecundidad, y eficiencia de los parasitoides adultos (Godfray 1993). Un adecuado abastecimiento de azúcares en la dieta puede producir un efecto positivo en la tasa de maduración de huevos y aumentar el periodo reproductivo de las hembras (Idris 1995). La escasez de fuentes de azúcar puede reducir la actividad de búsqueda ya sea por una reducción general de la actividad del insecto o por un incremento en el tiempo utilizado en la búsqueda de alimento (Wackers 1994). Lewis et al. (1998) encontraron que las hembras en ayuno son menos eficientes buscando y parasitando hospederos que las hembras bien alimentadas. Adicio-nalmente, Takasu y Lewis (1995) encontraron que hembras de Microplitis croceipens (Cresson) presentaron mayor superparasitismo cuando estaban hambrientas que las hembras bien alimentadas. Estos resultados y los de Wackers (2004) sugieren que proporcionar alimento a parasitoides adultos en el campo (como glucosa y proteínas) puede aumentar su eficiencia como controladores biológicos.
Para estudiar el efecto de las flores como fuente de azúcares para los parasitoides es necesario tener en cuenta varios factores. La disponibilidad (abundancia y distribución) calidad (valor nutricional) el grado de atracción y la accesibilidad del néctar, como parámetros más relevantes (Wackers 2004). La accesibilidad al néctar está determinada por la interacción entre la arquitectura floral y la morfología del insecto; por otra parte, las flores son naturalmente atractivas o emiten señales para que el parasitoide las acepte como fuente de alimento (Lewis et al. 1998). Estos factores se deben tener en cuenta si se pretende adicionar recursos florales a los sistemas de cultivos con el propósito de incrementar o mantener las poblaciones de enemigos naturales.
Idris y Grafius (1996b) y Johanowicz y Mitchell (2000) estudiaron el efecto de varias arvenses sobre la fecundidad y longevidad de D. insulare en Michigan (EE.UU.). En Colombia no se han realizado trabajos sobre la respuesta de D. insulare a la presencia de arvenses como fuentes de azúcares. Por esta razón este trabajo evaluó el efecto de varias plantas nectaríferas que normalmente se presentan en cultivos de crucíferas de la sabana de Bogotá, sobre la capacidad reproductiva de D. aff. insulare, así como el grado de aceptación y acceso a las estructuras florales donde se encuentra el alimento.
Materiales y métodos
Material vegetal
Se realizó un inventario florístico en 13 fincas productoras de hortalizas en varios municipios de la sabana de Bogotá (Gachancipá, Subachoque, Tausa, Cogua, Sopó, Tenjo, Madrid y Mosquera) con el fin de establecer las plantas mas frecuentemente asociadas a cultivos de crucíferas en la zona. Para la selección de las plantas se tomaron en cuenta los parámetros propuestos por Idris y Grafius (1996a) como el color, ancho y largo de la corola y ser hospederas de P. xylostella. Adicio-nalmente, se hicieron consultas con los agricultores y se realizaron observaciones directas en el campo para verificar que D. aff. insulare visitara estas flores bajo condiciones normales de cultivo. Se seleccionaron cuatro plantas, nabo Brassica rapa L. (Readales: Brassica-ceae), caléndula Calendula officinalis L. (Asterales: Asteraceae), ruda Ruta gra-veolens L. (Terebinthales: Rutaceae) y borraja Borrago officinalis (Tubifloras: Boraginaceae), como fuentes de néctar para D. aff. insulare.
Se coleccionaron semillas y esquejes para establecer una siembra escalonada de las plantas y asegurar un abastecimiento permanente de flores durante la ejecución de los experimentos. Las plantas se sembraron en materas de 30 x 20 cm (5 kg de suelo) en una casa de malla, en la finca Potosí en el municipio de Subachoque, Cundinamarca (2.610 msnm, T= 13º).
Material Entomológico
Los experimentos se realizaron con la F3 de D. aff. insulare y la F6 de P. xylostella de crías establecidas en la Facultad de Agronomía de la Universidad Nacional de Colombia, sede Bogotá (20 ± 2º C; HR 80%) y fotoperíodo 12:12 h L:O.
Efecto de cuatro plantas nectaríferas sobre la longevidad y fecundidad de D. aff. insulare. Se colocaron jaulas cilíndricas de acrílico (10 cm. de diámetro por 20 cm. de alto) sobre ramas de cada especie vegetal, asegurándose que cada jaula alojara por lo menos una flor o inflorescencia. Para adherir las jaulas a las ramas, los tallos con inflorescencias se insertaron en espumas ubicadas en la base y tapa de la jaula. Cada jaula contó con cuatro orificios (cubiertos con muselina) para ventilación, y un pequeño orificio para introducir los insectos. En cada jaula se colocó una pareja de D. aff. insulare de la misma cohorte y 24 h de emergida. Cada especie vegetal se consideró un tratamiento y una solución de miel de abejas al 10% se utilizó como testigo en un diseño completamente al azar con cinco repeticiones. Para el testigo se utilizaron algodones humedecidos con la solución y se reemplazaron cada dos días.
Diariamente se registró la supervivencia de D. aff. insulare y la longevidad se calculó como el número total de días de vida de la pareja de parasitoides. Para medir la fecundidad, las hembras fueron retiradas de las jaulas y liberadas en una cámara de parasitismo (recipiente plástico con una hoja de repollo y 10 larvas P. xylostella de II o III instar) durante su periodo de mayor actividad (11:00-13:00 h. Idris [1995]). Después del periodo de exposición de 2 horas, las hembras de D. aff. insulare fueron regresadas a las jaulas con flores y las larvas de P. xylostella fueron alimentadas y observadas hasta la emergencia de adultos. Se registraron los adultos emergidos de P . xylostella y las larvas muertas, así como el sexo de los adultos de D. aff. insulare que emergieron diariamente. Este procedimiento se repitió diariamente durante toda la vida libre de los parasitoides. La fecundidad se calculó a partir de la progenie producida por cada hembra durante su periodo de vida libre al ofrecerle diariamente 10 larvas de P. xylostella.
Los datos se analizaron por ANAVA y la prueba de diferencias honestamente significativas de Tukey (α= 0,05) con el programa estadístico SAS v. 8.0 (SAS 2000). Los datos de longevidad y fecundidad se relacionaron entre sí mediante regresión con el mismo programa estadístico.
Relación entre estructuras florales, longevidad y fecundidad de D. aff. insulare (Accesibilidad). Para estudiar el grado de accesibilidad al néctar, se midió el diámetro de apertura y la longitud de la corola de una muestra de 10 flores escogidas al azar para cada una de las cuatro especies. Las mediciones se realizaron entre las 11:00 y las 13:00 horas cuando las corolas se encuentran completamente abiertas.
Los datos se analizaron por ANAVA y una prueba de diferencias honestamente significativas de Tukey (α=0,05) con el programa estadístico SAS v. 8.0 (SAS 2000). Las medias del largo y la apertura de la corola fueron relacionadas con la longevidad y fecundidad del parasitoide mediante regresión utilizando el mismo programa estadístico.
Selección de las flores de cuatro especies vegetales por hembras de D. aff. insulare. El experimento se realizó en jaulas de 60x60x60 cm con paredes de muselina y techo de vidrio, bajo condiciones de laboratorio en Subachoque (Cundinamarca) (T= 20 ± 2ºC; HR =70%, Fotoperíodo = 12:12 h L:O).
Se colocaron treinta hembras de D. aff. insulare (entre 0 y 24 horas de emergidas) en jaulas vacías (descritas antes) durante 24 h. Al finalizar este período de ayuno se introdujo a cada jaula un recipiente plástico de 300 ml con 4 ramas florecidas de cada especie vegetal. Las ramas se escogieron uniformizando el tamaño, color y el número de flores por rama de cada especie. Treinta minutos después de la introducción de las flores se anotó el número de hembras que visitaron cada flor durante un periodo de un minuto. Durante el mismo tiempo se contaron las hembras posadas sobre las paredes o techo de la jaula. Después de la evaluación se retiraron los recipientes con las flores y se redistribuyeron aleatoriamente en las jaulas para repetir el proceso de adaptación (30 min.) y conteo (1 min.).
La misma prueba se repitió en la modalidad de no-elección. Para estas pruebas se ofrecieron recipientes con cuatro ramas florecidas de la misma especie con 30 min. de adaptación y uno de observación. Al finalizar los 31 minutos se retiraron los recipientes con flores y se colocaron nuevamente al azar en las jaulas.
Cada prueba se distribuyó en un diseño de bloques completos al azar, con cuatro tratamientos (flores de cada especie vegetal) y doce repeticiones en el tiempo. Los datos del número de visitas a cada flor se analizaron por medio de ANAVA y la prueba de diferencias honestamente significativas de Tukey (a=0,05) con el programa estadístico SAS v. 8.0 (SAS 2000). Las dos pruebas se relacionaron mediante regresión utilizando el mismo programa estadístico.
Resultados y Discusión
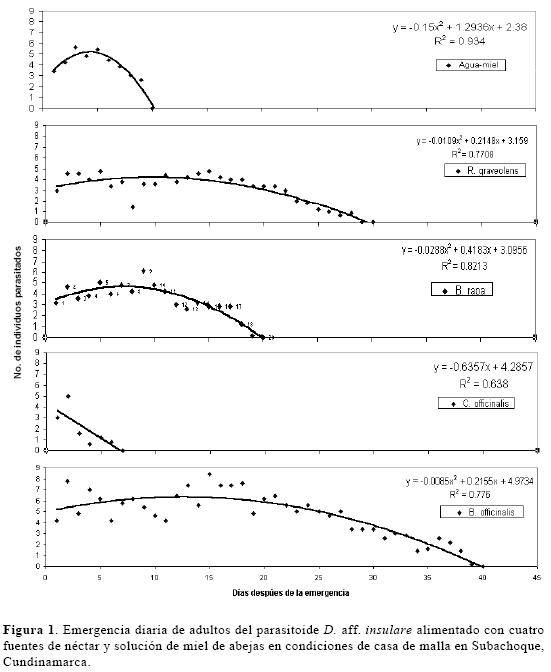
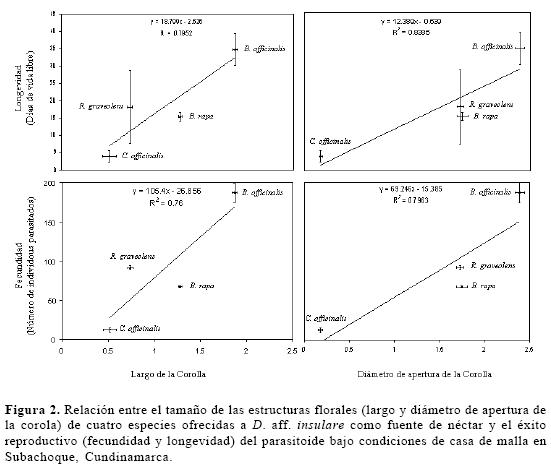
Efecto de cuatro plantas nectaríferas sobre la longevidad y fecundidad de D. aff. insulare. La longevidad de D. aff. insulare fue significativamente mayor cuando se alimentó con néctar de B. officinalis (F = 22,17; gl =4, 24; P < 0,01) comparada con la alimentación con el néctar de las otras plantas y el testigo (Tabla 1). R. graveolens y B. rapa no fueron diferentes del testigo (solución de miel de abejas al 10%) y produjeron adultos con una longevidad entre 20.2 y 23.0 días (40 y 47%) menor a los producidos sobre B. officinalis. El néctar de C. officinalis produjo la menor longevidad, con una diferencia de 34 días (90%) con respecto a B. officinalis. La fecundidad de D. aff. insulare fue significativamente mayor cuando se alimentó con néctar de B. officinalis (F = 21,96; gl =2, 24; P < 0,01) comparado con la alimentación con el néctar de las otras plantas (Tabla 1). El efecto sobre la fecundidad del parasitoide fue similar al ser alimentado con R. graveolens, B. rapa y solución de miel de abejas. La fecundidad de las hembras alimentadas con flores de R. graveolens fue 2.5 veces mayor que con solución de miel de abejas. El éxito reproductivo fue menor en hembras alimentadas con néctar de C. officinalis y se presentó una reducción del 93% en la longevidad respecto a la de adultos alimentados con B. officinalis. La longevidad y fecundidad analizadas en conjunto mediante regresión lineal (Fig. 1) presentan una relación significativa (r2 = 0,99; F = 778,2; gl =1, 4; P < 0,01). El éxito reproductivo de D. aff. insulare puede incrementarse linealmente al aumentar los días de vida libre y el número de individuos parasitados por las hembras (Fig. 1).
En estudios similares solo se había logrado demostrar un aumento en la longevidad y fecundidad igual al generado por la solución de miel de abejas al 10%. Idris y Grafius (1996a) registraron a Brassica kaber (D. C.) (Readales : Brassicaceae) como la mejor fuente de néctar natural para D. insulare. Su efecto sobre la longevidad fué igual al producido por la solución de miel de abejas. Igualmente, Johanowicz y Mitchell (2000) estudiaron el efecto de la alimentación con flores de Lobularia marítima L. (Readales: Brassicaceae) y obtuvieron resultados similares. Idris y Grafius (1996b), proponen a las arvenses Daucus carota L. (Apiales: Umbelliferae) B. kaber y Barbarea vulgaris R. Br. (Readales: Brassicaceae) como fuentes de alimento apropiadas para D. insulare pues mejoran su eficiencia en campo en Michigan, E.E. U.U. En este trabajo se propone a B. officinalis como la mejor fuente de alimento en términos de reproducción de D. aff. insulare para cultivos de crucíferas en la sabana de Bogotá. Su efecto sobre la longevidad y fecundidad supera ampliamente al testigo y a las otras plantas evaluadas. Adicionalmente es una planta de fácil propagación y con un periodo prolongado de floración. R. graveolens presentó resultados similares a los de B. rapa y solución de miel de abejas en las dos pruebas, no obstante su efecto sobre la longevidad y fecundidad del para-sitoide fue mayor a la de los otros tratamientos excluyendo a B. officinalis. Su buen desempeño en las pruebas de longevidad y fecundidad, así como su floración casi permanente, hacen de esta especie otra buena opción como alimento para D. aff. insulare dentro de un programa de control biológico de P. xylostella. B. rapa es una arvense abundante en los periodos lluviosos del año y es hospedera de P. xylostella. Probablemente D. aff. insulare reconozca fácilmente esta planta y juegue un papel importante en el ambiente natural del parasitoide. Finalmente, las hembras alimentadas con flores de C. officinalis presentaron los peores resultados en las pruebas de longevidad y fecundidad, lo que nos hace presumir su incapacidad de proveer alimento de buena calidad a D. aff. insulare.
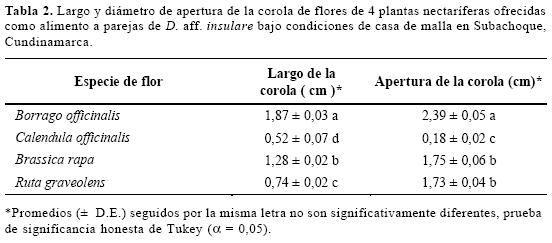
Relación de las estructuras florales con la longevidad y fecundidad (Accesibilidad). El diámetro de apertura de la corola de B. officinalis fue significativamente mayor que el de las demás especies de flores (F = 4,2; gl =3, 39; P < 0,01; Tabla 2). B. rapa y R. graveolens presentaron un diámetro muy similar entre ellas y C. officinalis es la especie con menor longitud de corola. El largo de la corola fue mayor en B. officinalis (F = 1999,7; gl =3, 39; P< 0,01) seguido por B. rapa, R. graveolens, y C. officinalis respectivamente (Tabla 2).
El análisis de regresión indicó que el 83% (F = 10,4; gl =1 , 3; P < 0,01) y el 79% (F =7.8 gl =1 , 3; P < 0,01) de la variación en la longevidad y fecundidad de D. aff. insulare, puede ser explicado por el diámetro de apertura de la corola de la flor visitada como fuente de alimento (Fig. 2). El mismo análisis indicó que el 79% (F = 7,8; gl =1,3; P < 0.01) y el 76% (F = 6,3; gl =1, 3; P < 0.01) de la variación en la longevidad y fecundidad de D. aff. insulare, puede ser explicado por el largo de la corola de la flor visitada como fuente de alimento. Este análisis también indica una relación positiva entre los datos de longevidad y fecundidad de D. aff. insulare, y el largo y apertura de la corola de las flores evaluadas (Fig. 2).
B. officinalis es la especie con mayor apertura y largo de la corola y también la que mejor influenció los atributos de longevidad y fecundidad del parasitoide. Posiblemente su arquitectura floral hace más accesible el néctar lo que podría estar asociado al tamaño del parasitoide. Para todas las especies, entre mayor fue la apertura y largo de la corola de la flor visitada, mayor fue la longevidad y fecundidad del parasitoide. Los resultados concuerdan con los de Idris (1995) quien propone al diámetro de apertura y el largo de la corola como indicadores de las flores potencialmente buenas como fuente de alimento.
Existen otros factores que afectan la accesibilidad al néctar. La separación entre los sépalos y pétalos determina el grado de exposición de la parte basal de las flores donde se encuentra localizado el néctar en la mayoría de los casos (Idris y Graifus 1996a). Las flores de B. rapa proveen fácil acceso del parasitoide a los nectarinos por tener los pétalos y sépalos separados, a pesar de su corta longitud y menor apertura de corola.
Selección de las flores de cuatro especies vegetales por hembras de D. aff. insulare. En la prueba de libre elección las flores más visitadas por hembras de D. aff. insulare (F = 9,6; gl =15, 191; P < 0,01) fueron R. graveolens y B. rapa (Tabla 3). En esta prueba B. officinalis tuvo 50% menos visitas que R. graveolens. C. officinalis recibió 69% menos visitas de hembras de D. aff. insulare que R. graveolens. En la prueba de no-elección las flores más visitadas fueron las de las especies R. graveolens, B. rapa y. C. officinalis (F = 6,6; gl = 3, 47; P < 0,01; Tabla 3). R. graveolens y B. rapa tienen flores de color amarillo, el color de flor más abundante en la naturaleza (Lewis et al. 1998) lo que podría ayudar a explicar el mayor número de visitas a estas flores. El número y tamaño de las flores pueden ser factores adicionales para explicar la respuesta de los parasitoides. Las flores de R. graveolens y B. rapa tienen un menor tamaño que las de B. officinalis. El número de flores por inflorescencia de estas dos especies es mayor al compararlas con las demás. La calidad del alimento puede influir en el número de visitas necesarias para que el parasitoide satisfaga sus necesidades de néctar. Las pruebas de longevidad y fecundidad mostraron a B. officinalis como una fuente de néctar de alta calidad debido a su mayor efecto sobre la reproducción de D. aff insulare, entonces es probable que D. aff. insulare necesite un menor número de visitas a esta flor para satisfacer sus necesidades alimenticias.
Habitualmente las arvenses que florecen dentro o en los bordes del cultivo son las únicas fuentes de alimento disponibles para insectos benéficos. El establecimiento de una arvense en asocio con un cultivo a una densidad determinada no es fácil y los productores consideran las malezas como problemas por su alta compe-titividad y porque pueden propiciar otros problemas fitosanitarios para el cultivo. Los efectos positivos que tienen ciertas arvenses sobre la efectividad de D. aff insulare nos llevan a proponer la incorporación de plantas nectaríferas de fácil manejo (distribución, propagación, adaptación y ubicación) períodos largos de floración y buena calidad de néctar dentro de programas de manejo integrado de los cultivos de crucíferas donde P. xylostella sea plaga limitante.
Conclusiones
Los resultados de este estudio indican que el éxito reproductivo de D. aff. insulare, medido en términos de su longevidad y fecundidad, está influenciado por el tipo de recursos florales con los que cuente para alimentarse. La arquitectura de las flores y las características morfológicas del insecto influyen en el grado de accesibilidad a las fuentes de néctar. De las plantas que se evaluaron, las que tuvieron mayor ancho y longitud de corola prolongaron la longevidad y aumentaron la fecundidad del parasitoide. B. officinalis (Borraja) fue la mejor fuente de alimento ya que incrementó cuatro veces la longevidad y cinco veces la fecundidad de D. aff. insulare respecto a una solución de miel de abejas. Se sugiere manipular la presencia plantas nectaríferas para aumentar el efecto de D. aff. insulare sobre el manejo de P. xylostella dentro de un programa de manejo integrado de los cultivos de crucíferas en la sabana de Bogotá.
Agradecimientos
A la Facultad de Agronomía de la Universidad Nacional de Colombia por su apoyo financiero y logístico. Especialmente a los laboratorios y al UNAB. De forma muy especial a Luisa Fernanda Bermúdez por su apoyo en las actividades de campo, a Diego Campos y Edgard Palacios por la identificación de las especies y a los productores de la Cooperativa de trabajo Asociado HUERTOS por prestar los escenarios donde se realizó la investigación.
Literatura Citada
ANONIMO 2004. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. Secretaría de Agricultura Departamental. Oficina de información y estadística. [ Links ]
BARRANTES, J. A.; RODRÍGUEZ, C. L.1996.Abundancia estacional y daño de Plutella xylostella (L.) (Lepidoptera: Plutellidae) y el cultivo de repollo, durante la época seca en Alfaro Ruiz, Alajuela, Costa Rica. Manejo Integrado de Plagas Costa Rica (CATIE) No. 39 p. 17-24. [ Links ]
CARBALLO, M.; HRUSKA, A. 1989. Periodos críticos de protección y efecto de la infestación de Plutella xylostella (L.) (Lepi-doptera: Plutellidae) sobre el rendimiento del repollo. Manejo Integrado de Plagas Costa Rica (CATIE) No. 14 p. 46-60. [ Links ]
CARRILLO, D. 2004. Caracterización de Diadegma aff. insulare (Cresson) (HY-MENOPTERA: ICHNEUMONIDAE) y su potencial como agente de control biológico de Plutella xylostella L. (Lepidoptera: Plutellidae). Trabajo de Grado para el título de Ingeniero Agrónomo. Universidad Nacional de Colombia, Facultad de Agronomía, Bogotá. 65 p. [ Links ]
DIAZ, O.; RODRIGUEZ, J. C.; SHELTON, A. M.;LAGUNES, A.; BUJANOS, M. 2000. Susceptibility of Plutella xylostella (L.) (Lepidoptera: Plutellidae) populations in Mexico to commercial formulations of Bacillus thuringiensis. Journal of Econo-mic Entomology 93(3): 963-970. [ Links ]
GODFRAY, H. C. J. 1993. Parasitoids, Behavioral and Evolutionary Ecology. Princeton University Press. Princeton, New Jersey, EE.UU. 473 p. [ Links ]
GREATHEAD, D. J. 1995. Natural enemies in combination with pesticides for integra-ted pest management. En: REUVENI, R. Novel approaches to integrated pest management. Lewis Publishers, Boca Raton, Florida. 369 p. [ Links ]
IDRIS, A. B. 1995. Ecology and behavior of Diadegma insulare (Cresson), a biological control agent of Diamondback moth, Plutella xylostella (L.). Ph.D. Dissertation, Michigan State University, East Lansing, MI. [ Links ]
IDRIS, A. B.; GRAFIUS, E. 1993a. Differential toxicity of pesticides to Diadegma insulare (Hymenoptera: Ichneu-monidae) and its host, the Diamondback moth (Lepidoptera: Plutellidae). Journal of Economic Entomology. 86 (2): 529-536. [ Links ]
IDRIS, A.B.; GRAFIUS, E. 1993b. Field studies on the impact of pesticides on the diamondback moth, Plutella xylostella (L.)(Lepidoptera: Plutellidae) and parasitism by Diadegma insulare (Cresson) (Hymenoptera: Ichneumonidae). Journal of Economic Entomology. 86: 1196-1202. [ Links ]
IDRIS, A.B.; GRAFIUS, E. 1996a. Effects of nectar-producing plants on Diadegma insulare (Cresson), a biological control agent of diamondback moth, Plutella xylostella (L.). The Management of diamondback moth and other crucifer pests, Proceedings of the Third Interna-tional Workshop, Kuala Lumpur, Malaysia. Pgs. 90-96. [ Links ]
IDRIS, A.B.; GRAFIUS, E. 1996b. Effects of wild and cultivated host plants on ovipo-sition, Survival, and development of Diamondback moth (Lepidoptera: Plute-llidae) and its parasitoid Diadegma insulare (Hymenoptera: Ichneumonidae). Environ-mental Entomology. 25(4): 825-833. [ Links ]
IVEY, P. W.; JOHNSON, S. J. 1997. Efficacy of Bacillus thuringiensis and cabbage cultivar resistance to Diamondback moth (Lepidoptera: Yponomeutidae). Florida Entomologist. 80 (3): 396-401. [ Links ]
JOHANOWICZ, D. L.; MITCHELL, E. R. 2000. Effects of Sweet Alyssum flowers on the Longevity of the parasitoid wasps Cotesia marginiventris (Hymenoptera: Braconidae) y Diadegma insulare (Hyme-noptera: Ichneumonidae). Florida Ento-mologist 83(1): 41-47. [ Links ]
LEIBIEE, G. L.; SAVAGE, K. E. 1992. Evaluation of selected insecticides for control of diamondback moth and cabbage looper in cabbage in Central Florida with observations on insecticide resistance in the Diamondback moth. Florida Ento-mologist. 75(4): 585-591. [ Links ]
LEWIS, W. J.; STAPEL J. O.; CORTESERO, A. M.; TAKASU, K. 1998. Understanding how parasitoids balance food and host needs: importance to biological control. Biological Control. 11(1): 175-183. [ Links ]
LUI, T. X.; HUTCHISON, W. D.; CHEN, W.; BURKNESS, E. C. 2003. Com-parative Susceptibilities of diamondback moth (Lepidoptera: Plutellidae) and cabbage looper (Lepidoptera: Noctuidae) from Minnesota and South Texas to Cyhalothrin and Indoxicarb. Journal of Economic Entomology. 94(4): 1230-1236. [ Links ]
MUCKENFUSS, A. E.; SHEPPARD, B. M.; FERRER, E. R. 1990. Natural mortality of diamondback moth in coastal South Carolina. Diamondback moth and other crucifer pests, Proceedings of the Second Interna-tional Workshop. Tainan, Taiwan. AVRDC publication No.92-368. 603 p. [ Links ]
SAS Institute, 2000. SAS statistical software. Versión 8. SAS Institute, Cary, NC, USA. [ Links ]
SHELTON, A. M.; ROBERTSON, J. L.; TANG, J. D.; PEREZ, C.; EINGEN-BRODE, S. D.; PREISLER, H. K.; WISLEY, W. T.; COOLEY, R. J. 1993. Resistance of diamondback moth (Lepi-doptera: Plutellidae) to Bacillus thurin-giensis subspecies in the field. Journal of Economic Entomology. 86: 697-705. [ Links ]
TABASHNIK, B. E.; CUSHING, N. L.; FINSON, N.; JOHNSON, M. W. 1990. Field development of resistance to Bacillus thuringiensis in diamondback moth (Lepi-doptera: Plutellidae). Journal of Economic Entomology. 83: 1671-76. [ Links ]
TABASHNIK, B. E.; FINSON, N.; GROE-TERS, F. R.; MOAR,W. J.;JOHNSON, M. W.; LOU,.K.; ADANG,M. J. 1994. Reversal of resistance to Bacillus thurin-giensis in Plutella xylostella. Agricultural Science. 91: 4120-4124. [ Links ]
TAKASU, K.; LEWIS, W.J. 1995. Importance of Adult Food Sources to Host Searching of the Larval Parasitoid Microplitis croceipes. Biological Control 5 (1): 25-30. [ Links ]
TALEKAR, N. S.; SHELTON, A. M. 1993. Biology, ecology, and management of the Diamondback moth. Annual Review of Entomology. 38: 275 – 301. [ Links ]
WÄCKERS, F. L. 1994. The effect of food deprivation on the innate visual and olfactory preferences in the parasitoid Cotesia rubecula. Journal of Insect Physiology. 40: 641–649. [ Links ]
WÄCKERS, F. L. 2004. Assessing the suitability of flowering herbs as parasitoid food sources: flower attractiveness and nectar accessibility. Biological Control. 29: 307-314. [ Links ]
WRATTEN, S.; BERNDT, L.; GURR, G.; TYLIANAKIS, J.; FERNANDO, P.; DIDHAM, R. 2003. Adding floral diver-sity to enhance parasitoid fitness and efficacy. 1st International Symposium on Biological Control of Arthropods. 211-214 pp. [ Links ]
XU, J.; SHELTON A. M.; CHENG, X. 2001. Comparison of Diadegma insulare (Hymenoptera: Ichneumonidae) and Microplitis plutellae (Hymenoptera: Braconidae) as biological control Agents of Plutella xylostella (Lepidoptera: Plute-llidae): field parasitism, insecticide susceptibility, and host-searching. Journal of Economic Entomology. 94(1): 14-20. [ Links ]
XU, J.; SHELTON A. M.; CHENG, X. 2001. Variation in susceptibility of Diadegma insulare (Hymenoptera: Ichneumonidae) to permethrin. Journal of Economic Entomology. 94(2): 541-546. [ Links ]
ZHAO, J.; Li, Y.; COLLINS, H. L.; CAO, J.; EARLE, E. D.; SHELTON, A. M. 2001. Different cross-resistance patterns in the Diamondback moth (Lepidoptera: Plute-llidae) resistant to Bacillus thuringiensis Toxin Cry1C. Journal of Economic Entomology. 94 (6): 1547-1552. [ Links ]
ZHAO, J.; LI, Y.; COLLINS, H. L.; SHEL-TON, A. M. 2002. Examination of the F2 screen for rare resistance alleles to Bacillus thuringiensis toxins in the Diamondback moth (Lepidoptera: Plutellidae). Journal of Economic Entomology. 95(1): 14-21. [ Links ]
ZHAO, J.; LI, Y.; COLLINS, H. L.; GUSU-KUMA-MINUTO, J.; MAU, R. F.; THOMPSON, G. D.; SHELTON, A. M. 2002. Monitoring and characterization of Diamondback moth (Lepidoptera: Plute-llidae) resistance to Spinosad. Journal of Economic Entomology. 95 (2): 430-436. [ Links ]
Recibido: 01-mar-05 Aceptado: 07-dic-05