Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.32 no.1 Bogotá Jan./June 2006
Evaluación de dos cepas comerciales de entomonematodos como agentes de control de Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae)
Evaluation of two commercial strains of entomonematodes as control agents of Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae)
ELSA LILIANA MELO M.1, CARLOS ALBERTO ORTEGA-OJEDA2, ANDREAS GAIGL2, RALF-UDO EHLERS3, ANTHONY C. BELLOTTI2
1 Centro Internacional de Agricultura Tropical (CIAT), Colombia. A.A. 6713, tel: 445 00 00, fax: 445 00 73, e-mail: meloelsa@gmail.com
2 Centro Internacional de Agricultura Tropical (CIAT), Colombia. E-mail: a.gaigl@cgiar.org
3 Instituto de Fitopatología, Departamento de Biotecnología y Control Biológico, Universidad de Kiel, Klausdorfer Straße 28-26, 24223 Raisdorf, Alemania.
Resumen. Cyrtomenus bergi Froeschner es un fitófago subterráneo importante en cultivos tropicales. Se evaluaron dos cepas comerciales de nemátodos entomopatógenos (nep) (Steinernema feltiae (Filipjev) y Heterorhabditis bacteriophora Poinar) como antagonistas biológicas bajo invernadero (18-28°C y 55-85% humedad relativa). Se utilizaron las concentraciones comerciales recomendadas por la casa commercial E-nema: 1000 y 500 nep/ml de S. feltiae y H. bacteriophora, respectivamente. Estas soluciones se aplicaron en potes de 1,5 dm3 con suelo agrícola y arena (1:1) con 20 individuos de C. bergi (adultos o inmaduros del quinto instar) confinados por pote. Los insectos fueron alimentados con plantas de maní (Arachis hypogaea L.). La tasa de infestación en el chinche y la mortalidad fueron medidas por medio de evaluaciones destructivas a los 15 y 30 días después de infectados (ddi), tres potes por época. Solo los adultos resultaron infectados (P£0,05). Considerando ambas evaluaciones y todas las cepas, se observó la mayor tasa de penetración en S. feltiae (93,9%) comparado con H. bacteriophora (72,1%). En términos de mortalidad, a 15 ddi H. bacteriophora (42,2%) mató a más insectos que S. feltiae (8,6%); sin embargo, a los 30 ddi no se encontraron diferencias entre las dos cepas de nep (ca. 54,3%). Adicionalmente, se observaron nemátodos melanizados, probablemente como respuesta inmunológica de C. bergi al entomopatógeno, donde S. feltiae (37,5%) fue más susceptible que H. bacteriophora (13,1%) a los 30 ddi. Se concluye que solo los chinches adultos son significativamente susceptibles a los entomonemátodos; H. bacteriophora es la cepa más promisoria al obtener las mayores mortalidades en menos tiempo y presentar el menor porcentaje de melanización bajo estas condiciones.
Palabras clave: Steinernema feltiae. Heterorhabditis bacteriophora. Control Biológico. Melanización.
Abstract. Cyrtomenus bergi Froeschner is a subterranean phytophage important in tropical crops. We tested two commercial entomopathogenic nematode (epn) strains (Steinernema feltiae (Filipjev) and Heterorhabditis bacteriophora Poinar) as biological antagonists in the greenhouse (18-28°C and 55-85% relative humidity). We used the concentrations recommended by the supplier E-nema: 1000 and 500 epn/ ml of S. feltiae and H. bacteriophora, respectively. These solutions were applied to pots of 1,5 dm3 filled with agricultural soil and sand (1:1) with 20 burrower bugs (adults or 5th instar immatures) confined to each pot. The insects were fed on groundnuts (Arachis hypogaea L.). Infestation rate of the burrower bug and mortality were measured through destructive evaluations 15 and 30 days after application (daa), three pots per time period. Only adults were infested (P£0,05). Considering both evaluations and all strains, we observed the greatest penetration rate for S. feltiae (93,9%) compared to H. bacteriophora (72,1%). In terms of mortality, H. bacteriophora killed more bugs after 15 days (42,2%) than S. feltiae (8,6%); however, after 30 days no differences were found between the two epn strains (54,3%). Moreover, we observed melanized nematodes, probably as an immune response of C. bergi against nematodes, where S. feltiae (37,5%) was more susceptible than H. bacteriophora (13,1%) at 30 daa. We conclude that only adults of C. bergi are susceptible to entomonematodes; H. bacteriophora is the most promising strain for producing greater mortality in less time and presenting a lower percent of melanization under these conditions.
Key words: Steinernema feltiae. Heterorhabditis bacteriophora. Biological Control. Melanization.
Introducción
Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae), chinche subterráneo de la viruela, es considerada una importante plaga rizófaga cuyos registros en Colombia se han realizado sobre maíz (ICA 1980), yuca (CIAT 1980; García y Bellotti 1980) y maní (Riis 1997); reportándose como un problema serio en diversas regiones a través del Neotrópico (Bellotti et al. 1988). Su distribución geográfica aún no está bien determinada, habiéndosele encontrado únicamente en países como Cuba, Surinam, Ecuador, Panamá, Colombia, Brasil y Costa Rica (Clavijo 1981; Lacerda 1983; Carballo y Saunders 1990a; Riis 1990; Aguilar et al. 1991). En Colombia el rango geográfico es amplio y se ha encontrado en 15 departamentos: Cauca, Valle del Cauca, Tolima, Huila, Quindío, Risaralda, Caldas, Antioquia, Córdoba, Magdalena, Sucre, Bolívar, Atlántico y los dos Santanderes (Sánchez 1996).
El daño del chinche es causado tanto por ninfas como por adultos al introducir su estilete en la epidermis y corteza de la raíz, permitiendo indirectamente la entrada de microorganismos del suelo de géneros como Fusarium, Aspergillus, Genicularia, Pythium, Phythopthora y Diplodia (CIAT 1980). El insecto posee tres estados de desarrollo, huevo, ninfa (cinco ínstares) y adulto, este último es volador, todos se desarrollan en el suelo, incluyendo la cópula y oviposición. Los vuelos nocturnos de estos adultos, y su repentina aparición en nuevas localidades sugiere que es altamente móvil (Gold et al. 1988, Bellotti et al. 1999). Arias y Bellotti (1985) sugieren que las malezas aledañas a los cultivos pueden servir de hábitat permanente desde donde C. bergi puede migrar a los cultivos; de hecho, Lacerda (1983) capturó más adultos en trampas de luz que estaban próximas a la vegetación nativa que en trampas dentro del cultivo.
En estudios de laboratorio cuando se alimenta al insecto con raíces de yuca con bajo contenido de cianuro (HCN) el periodo de incubación promedio de huevo es de 13,5 días, los estados ninfales ocurren en 111,3 días y el promedio de vida del adulto es de 293,4 días. Esto indica que C. bergi puede vivir más de un año alimentándose de estas raíces (García y Bellotti 1980). En efecto, la plaga se alimenta de muchos cultivos como: yuca (Manihot esculenta Crantz), maíz (Zea mays L.), maní (Arachis hypogaea L.), papa (Solanum tuberosum L.), sorgo (Sorghum bicolor L.), cebolla (Allium fistulosum L. y Allium cepa L.), palma africana (Elaeis guinensis Jacq.), café (Coffea arabica L.), caña de azúcar (Saccharum officinarum), fríjol (Pha-seolus vulgaris L.), arveja (Pisum sativum L.), espárragos (Asparagus oficinalis L.), cilantro (Coriandrum sativum L.), pastos y malezas (Bellotti y García 1983; Lacerda 1983; Riis 1990).
Por su amplia distribución, presenta daños que implican hasta el 100% de la producción de muchos cultivos, no siendo siempre identificado como el causante de estos males por encontrarse camuflado en el suelo (Vargas 1996; Bellotti et al. 1988). En el cultivo de la yuca no afecta el vigor de la planta, y el daño en raíces no se detecta hasta el momento del pelado de éstas, lo cual toma de sorpresa a los agricultores que ya no pueden hacer nada en este momento; se ha reportado más del 85% de raíces afectadas y un 51% de reducción en la producción de almidón (CIAT 1983; CIAT 1985; Riis 1997). En maíz se le atribuye el 50% en la reducción de la emergencia de plantas y en ataques severos en esta edad puede causar marchitamiento del cultivo; observándose igualmente manchas rojas circulares en las raíces donde ocurre la inserción del estilete y clorosis de las hojas de plantas atacadas (Shenk y Saunders 1984; King y Saunders 1984). En maní tanto ninfas como adultos pueden penetrar la vaina y alimentarse de los granos; en ataques poco severos se observan manchas de pudrición secas delimitadas que van de amarillo a café (Riis 1997).
Su control en zonas endémicas mediante insecticidas sintéticos, aunque puede reducir la población del insecto, no es muy efectivo ni recomendable, no solo por los costos, sino también por la destrucción de los enemigos naturales que controlan otras plagas asociadas a cultivos, el deterioro ambiental que causa su uso frecuente y el perjuicio a la salud humana (Bellotti et al. 1988; Carballo y Saunders 1990b). Por este motivo la alternativa es el manejo integrado de la plaga y, dentro de éste, el componente biológico de control.
Dentro de la búsqueda de enemigos naturales, que comparten los hábitats crípticos de la plaga se pueden destacar los entomopatógenos, siendo uno de los más importantes, los nemátodos. En los últimos 50 años, diferentes tipos de nemátodos que atacan insectos han sido examinados como un potencial para el control biológico de plagas. Los grupos más estudiados son los de hábito obligado como los mermítidos, los de hábito facultativo como los neotilénquidos; y, los más importantes, los steinernemátidos y heterorabdítidos de hábito críptico (Federici 1999).
Los nemátodos entomopatógenos (neps) (Rhabditida), se aplican inundativamente y usualmente no es necesario que se multipliquen en el hábitat, por lo que un amplio espectro de competencias ecológicas que son esenciales para los neps silvestres podrían sacrificarse en la producción de cepas comerciales, dedicando los recursos de investigación hacia características de importancia comercial como formulación, viabilidad o, introducción de combinaciones de genes originales que no se hayan favorecido en la selección natural o que no estuvieron disponibles en las poblaciones ancestrales. Las cepas que expresan combinaciones de genes originales transmitirán sus capacidades con menor probabilidad, de modo que no persistan indefinidamente como las cepas naturales que sufrieron selección por competencia bajo condiciones naturales. Acorde con esta línea de pensamiento, aunque pareciera favorecer a los productores, desde el punto de vista del cuidado ambiental y, donde hayan estrictas medidas de seguridad, los industriales deberían desarrollar cepas de neps que sean estrictamente hechas para sus propósitos y, a la vez, sean incapaces de persistir indefinidamente en el campo. Respecto al uso de cepas transformadas, se podría llegar al uso de cepas incapaces de cruzarse, por ejemplo, Heterorhabditis, que puede producirse comercialmente sin la necesidad de fertilización cruzada; las líneas incapaces de aparearse tendrían reducida posibilidad de establecerse, liberar o de transferir genes a cepas silvestres, lo que evitaría alteraciones en los ecosistemas, favoreciendo que las especies introducidas no desplacen a las nativas (Downes y Griffin 1996).
La liberación de cepas exóticas para el control biológico de plagas, se está realizando hace más de un siglo en todo el globo. Estas en muchos casos no han sido efectivas, pero no se conoce que causen problemas a la salud humana. Aunque no se espera que las cepas introducidas perduren en el ambiente, debido a la incapacidad de reproducción, inducida en algunos casos, o al problema de adaptación de especies foráneas, la capacidad de sobrevivir de las cepas nativas debería sacrificarse en las introducidas, factor que no presentaría riesgos en la seguridad ecológica en aplicaciones inun-dativas (Downes y Griffin 1996).
Al respecto, como lo anota Ehlers (1996), las reglas para el control de los riesgos en el uso de neps exóticos deberían estandarizarse internacionalmente y relacionarse específicamente a la biología y ecología de estos neps. El volumen de los actuales mercados no justificaría para los nemátodos los costos de los procedimientos de registros actualmente requeridos para químicos, insecticidas microbiales u organismos genéticamente modificados. Adicionalmente, las políticas reguladoras deberían alcanzar a abarcar la introducción de neps como agentes de biocontrol.
En Colombia cepas nativas e introducidas han sido evaluadas como agentes de control mostrando posibilidades para el manejo de C. bergi bajo condiciones de laboratorio e invernadero.
En los últimos años se ha observado un gran interés en el uso de estos microorganismos para el control de plagas pero, considerando lo antes expuesto y el hecho de que una especie nativa tendría menos problemas de adaptabilidad que una introducida, se ha incrementado la necesidad de hacer reconocimientos de especies nativas, partiendo de exploraciones de suelos y previendo también el intercambio de cepas entre instituciones, lo que puede devenir en la introducción de neps exóticos de un área a otra. Por lo anterior se deben identificar y manejar los riesgos y las desventajas que pueden traer estos eventos.
Por otro lado, dentro de los factores que pueden limitar la introducción exitosa de estos neps, Jansson (1993), destaca a los siguientes: la biología, comportamiento del hospedero blanco y su hábitat, virulencia e infectividad, tiempo de almacenamiento de los productos, factores abióticos y bióticos del lugar donde se liberarán, estrategias de aplicación, etc. Dentro de los riesgos de introducir estos patógenos se tiene en cuenta: el potencial para diseminarse, el rango de hospederos, el impacto sobre los organismos no blancos, la permanencia en el sitio de introducción, el desplazamiento de las cepas nativas y la relación con las bacterias simbiontes.
El efecto nocivo que C. bergi está causando en variedad de cultivos ha motivado algunos experimentos buscando estudiar su control y su comportamiento frente a diferentes controladores principalmente neps y hongos ento-mopatógenos; de éstos, los estudios específicamente con nemátodos entomo-patógenos realizados en el país para el manejo de esta plaga son pocos (CIAT 2003; CIAT 2004; Struck et al. 2004; Jaramillo et al. 2005)
Se ha evaluado por ejemplo Steinernema carpocapsae Weiser especie que parasita exitosamente todos los estados del chinche en laboratorio, siendo el adulto el estado más susceptible, con 58,6% de infección después de 10 días de inoculado; mientras que los menos susceptibles fueron el primer y segundo instar con 17 y 31%, respectivamente (Caicedo y Bellotti 1994).
Otras investigaciones hechas en laboratorio con dos cepas nativas de Heteror-habditis bacteriophora Poinar (LFR92 y SQC92), mostraron que las dos razas parasitaron todos los estados del chinche; donde el parasitismo más bajo (65%) se presenta en ninfas de primer instar con ambas razas, mientras que el quinto instar resultó más susceptible, con un 90 y 100%, para SQC92 y LFR92 respectivamente 10 días después de inoculado (Barberena y Bellotti 1998). Experimentos realizados con cepas nativas e introducidas de Steinernema spp. y Heterorhabditis spp. muestran infecciones hasta del 100%, pero presentándose mortalidades muy bajas (22%); esto debido posiblemente a un efecto de inmunidad del chinche frente a estos neps, observándose incluso un fenómeno de melanización (CIAT 2003).
Luego de algunos experimentos realizados en condiciones de laboratorio, el Proyecto de Manejo Integrado de Plagas Subterráneas del Centro Internacional de Agricultura Tropical (CIAT), se ha planteado esta investigación con el objetivo de determinar la eficiencia de dos entomopatógenos Steinernema feltiae (Filipjev) y H. bacteriophora, cepas comerciales de E-NEMA®, sobre los dos últimos estados de desarrollo de la plaga C. bergi en condiciones de invernadero.
Materiales y Métodos
Ubicación. Este ensayo se llevó a cabo en invernadero, bajo condiciones de temperatura entre 18 a 28°C y humedad relativa entre 55 a 85%; en el campo experimental del Centro Internacional de Agricultura Tropical CIAT, Palmira, Departamento del Valle del Cauca, a 965 msnm.
Cría del insecto blanco. Se seleccionaron para este experimento los estados adulto y quinto instar de C. bergi, por ser los más susceptibles a los neps (Caicedo y Bellotti 1994; Barberena y Bellotti 1998); la cría se mantuvo en un cuarto de crecimiento a 22°C y 70 ± 5% de humedad relativa, en total oscuridad, en recipientes de acrílico rectangulares, con suelo a capacidad de campo, esterilizado previamente por ebullición en muflas u hornos de suelos por 24 horas a 105oC. Se alimentaron con maní, dieta que es reemplazada cada ocho días; tiempo en el cual los chinches succionan la semilla o las raíces que estas produzcan al germinar. Este insecto se seleccionó por instares de primero a quinto y adultos: manteniendo alrededor de 500 individuos por caja. Después de establecida la colonia los adultos se cambiaron de suelo cada ocho días para separar los huevos.
Insecto trampa. Como control, se incluyeron larvas de Galleria mellonella L. (Lepidoptera: Pyralidae), a fin de ser un indicador de infección de la suspensión de nemátodos, debido a su alta susceptibilidad a éstos. Las larvas, de último instar se obtuvieron, al igual que los chinches, de la cría que se mantiene en el Laboratorio de Manejo Integrado de Plagas del Centro Internacional de Agricultura Tropical. La cría se mantiene en un cuarto a 29ºC y humedad relativa de 67%, con una dieta consistente en 500 g de salvado de trigo, 145 g de levadura de cerveza, 72 g de cera de abejas, 150 cm3 de glicerina, 270 cm3 de miel de abejas y formaldehído, aplicada como 1% del total de los líquidos viscosos (la mezcla glicerina + miel). Además se utilizó estreptomicina una vez al mes en una dosis de 0,25 g por 500 g de salvado, con el objetivo de disminuir la contaminación por bacterios y hongos.
Se utilizaron frascos de vidrio grandes y de boca ancha para la oviposición de los adultos y recipientes de acrílico rectangulares (24 x 32 x 11 cm) para los huevos y larvas. Las bandejas se esterilizaron previamente con agua caliente e hipo-clorito, con posterior exposición a luz ultravioleta (12 h).
Nematodos. Provinieron de dos cepas híbridas importadas de Alemania como productos comerciales de la empresa ENEMA®: NEMAPLUS (S. feltiae) y NEMATOP (H. bacteriophora), que se adquirieron una vez cumplidas las regulaciones del Instituto Colombiano Agropecuario ICA. Estos productos se obtienen en bolsas plásticas estériles, en un sustrato arcilloso de fácil dilución en agua. El material es inocuo para vertebrados e invertebrados. La inoculación con nemátodos se realizó dos semanas después de la infestación con el chinche, a fin de que este último se adapte previamente a las condiciones de cría bajo invernadero. Para el efecto, se aplicó una suspensión de 500 000 nemátodos por m², es decir, 7 697 nemátodos en la superficie del pote (153,94 cm²) así:
Nemaplus: Bajo la recomendación de la casa comercial de 50 millones de nematodos S. feltiae sobre una superficie de 100 m2 en 20 a 50 litros de agua (1000 nep/ml de agua), se calcularon: 7,7 ml para la superficie de la matera, con 7 697 nematodos (ca. 1000 nep/ ml).
Nematop: Bajo la recomendación comercial de 50 millones de nematodos de H. bacteriophora para 100 m2 con 120 litros de agua (417 nematodos/ml de agua), se calcularon: 18,47 ml para la superficie de la matera, con 7 697 nep (ca. 500 nep/ ml).
Se agitó la suspensión con nemátodos previo a cada aplicación (inoculación) en los tratamientos propuestos para homogenizar el producto. La movilización de estos preparados se hizo siguiendo las recomendaciones técnicas para evitar muerte o debilitamiento de los neps, por efecto de los rayos U V, altas temperaturas, desecamiento, etc.
Los nemátodos se aplicaron en las horas de la tarde sobre un suelo ligeramente húmedo (a capacidad de campo). Posteriormente a la aplicación se regaron 40 ml de agua por matera para facilitar la dispersión de los nemátodos dentro del sustrato.
Ensayo en invernadero. Se utilizó como hospedero (alimento) para los chinches, plántulas de maní sembradas 15 días antes de la infestación. Se utilizaron materas de 15 x 15 x 10 cm para almacenar aproximadamente 1 500 cm3 de suelo (50% arena + 50% suelo agrícola), con una superficie efectiva de 153,94 cm² (14 cm de diámetro superficial). Cada unidad experimental contó con seis potes, en los que se sembraron cinco plantas que luego se ralearon para dejar solo tres por pote; en cada pote se colocaron 20 chinches de cada estado. En todos los tratamientos se colocó una cabina de acetato para evitar que escapen los insectos. Todos los potes fueron colocados en jaulas con tul para individualizar los tratamientos.
En el caso del control de viabilidad de las cepas de nemátodos se colocaron larvas de último ínstar de G. mellonella en minijaulas de malla metálica para evitar que escapen; estas se introducen en los potes, en la zona cercana a la superficie (bajo el suelo) y a la zona radicular, a los días 1, 15 y 30 desde la inoculación con nep (ddi).
Diseño experimental. Se utilizó un diseño experimental de bloques completos aleatorios DBCA, con arreglo factorial de 2 x 2 + 3, con tres repeticiones. Se evaluaron dos factores en estudio: chinches de dos edades (quinto ínstar y adultos) criados en laboratorio, y dos cepas comerciales de nemátodos (E-NEMA®), S. feltiae y H. bacteriophora. A éstos se sumaron testigos con agua destilada tanto para adultos como para quinto ínstar. De la combinación de los factores en estudio y un control con G. mellonella se desglosaron seis tratamientos. Estos ensayos se evaluaron en dos épocas, a los 15 y 30 días después de aplicar los nemátodos (ddi).
Ensayo complementario en laboratorio. Para esto se dispuso un experimento en bloques completos aleatorios en arreglo factorial de 2 x 2 + 2, con dos factores en estudio comprendidos por dos edades de chinches (adulto y quinto ínstar) y dos cepas de nemátodos ento-mopatógenos (S. feltiae y H. bacte-riophora), con 11 repeticiones y seis tratamientos, esto se evaluó a los 30 ddi. Para el efecto se utilizaron multipozos, donde las unidades experimentales se componían por diez pozos cada una, con un chinche por multipozo. Los análisis se realizaron con similar metodología a la utilizada para el experimento en invernadero. Para ambos casos se desglosan los siguientes tratamientos: Chinches adultos con Steinernema feltiae, Chinches adultos con Heterorhabditis bacte-riophora, Chinches adultos con ADE (testigo), Chinches de quinto ínstar con S. feltiae, Chinches de quinto ínstar con H. bacteriophora, Chinches de quinto ínstar con ADE (testigo).
Análisis estadístico. Se realizó un Análisis de Varianza ANAVA para evaluar estadísticamente cada variable del estudio, utilizando para el efecto el paquete estadístico Infostat (2004). Como los datos contenían valores de cero (0), debieron transformarse previamente para este análisis utilizando la fórmula 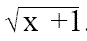 . Los controles no presentaron infección ni mortalidad por lo cual no se incluyeron en el análisis; sin embargo, para la presentación de tablas y gráficas se utilizaron los datos originales en porcentaje. Finalmente se realizaron pruebas de Tukey (P≤0,05) para determinar los rangos de significación de las variables que presentaron diferencias estadísticas con los factores y con la interacción entre ellos.
. Los controles no presentaron infección ni mortalidad por lo cual no se incluyeron en el análisis; sin embargo, para la presentación de tablas y gráficas se utilizaron los datos originales en porcentaje. Finalmente se realizaron pruebas de Tukey (P≤0,05) para determinar los rangos de significación de las variables que presentaron diferencias estadísticas con los factores y con la interacción entre ellos.
Variables evaluadas
Porcentaje de infección. Este se evaluó para adultos e inmaduros de quinto ínstar, a los 15 y 30 días de la inoculación de nemátodos. Luego de disectar los chinches vivos (se dejaron seis días después de la evaluación en cámara húmeda, tiempo prudente para verificar la capacidad de matar de los nemátodos) y muertos, se contabilizaron aquellos que presentaron nemátodos, en cada fecha de evaluación. El índice se expresó en porcentaje. Siendo esta evaluación destructiva, se tomaron tres potes en cada oportunidad.
Porcentaje de mortalidad. A fin de determinar si la muerte se debió a la infección con nemátodos o por causas diferentes, tales como hongos, parásitos u otros, se disectaron todos los individuos muertos, tanto adultos como inmaduros, para establecer la presencia de nemátodos en su interior. Al igual que la variable anterior el índice se expresó en porcentaje.
Porcentaje de nematodos melanizados.
En el experimento de invernadero, al tiempo que se hacían las evaluaciones anteriores, se contabilizaron los nemátodos melanizados encontrados tras la disección, estos estaban muertos, rígidos y tenían una coloración entre amarilla anaranjada a rojiza (Fig. 1). Este fenómeno se presenta en los insectos como un mecanismo de acción dado por una respuesta inmune de tipo celular, asociada a la producción o absorción de fenol oxidasas, estas también están relacionadas con la melanización de la cutícula y de los huevos, además con la cicatrización de heridas (Uribe 1997).
Viabilidad de nematodos. Para esta evaluación se colocaron larvas de G. mello-nella en potes, dentro del invernadero, en las mismas condiciones que el experimento principal. Se analizaron las larvas muertas encontradas en los potes expresando el valor en porcentaje; y, se evaluó en tres oportunidades: a los 6, 20 y 35 ddi, después de la inoculación.
La infección de nematodos en G. mello-nella se determinó por presencia del nematodo en trampa White modificada (Kaya y Stock 1997), a partir de larvas muertas dispuestas en las mismas, sobre papel filtro con agua destilada, de donde los nemátodos migran al líquido externo de la trampa.
En el laboratorio se llevaron dos controles de la viabilidad de los dos productos uno con G. mellonella y otro con los dos estados de la plaga, todos sobre arena y usando la concentración de neps recomendada comercialmente, el tiempo de evaluación fue de 5 ddi para el primero y 30 ddi para el segundo. Estos como verificación de la viabilidad del producto comercial de las dos cepas de nemátodos al momento de su utilización.
Características externas de las larvas de G. mellonella. Para esta evaluación se revisaron los individuos muertos de los controles con G. mellonella a los cinco días después de colocadas en las materas en el invernadero y también para los controles en el laboratorio a las 72 horas.
Resultados y Discusión
Porcentaje de infección. Para las dos fechas de evaluación el análisis de varianza mostró alta significación estadística para cada factor y para su interacción. El coeficiente de variación fue de 12,4%. Efectuada la separación de las respectivas medias, se establecieron rangos de significación para cada variable así: en la interacción edad por cepas las dos cepas evaluadas son igualmente infectivas, pero solo para adultos, pues el quinto ínstar no mostró susceptibilidad significativa a ninguna de las cepas (F= 728,14; df= 1; P ≤ 0,0001). La interacción edad por tiempo presenta tres rangos; en el tercero se aprecia que H. bacteriophora es más infectiva que S. feltiae (segundo rango). El quinto estado muestra muy baja infección con ambas cepas (primer rango) (F= 2,27; df= 1; P ≤0,154). Esto último discrepa con lo hallado por Barberena (1998), quien encontró un promedio de 80% de infección en los estados adulto y quinto, mientras que los primeros ínstares mostraron valores menores. En otros trabajos en condiciones de laboratorio, se encontró hasta un 100 % de infección con la especie Steinernema sp. sobre adultos, comparado con Heterorhabditis sp. (45%), evaluada a los 10 ddi (CIAT 2003).
Los porcentajes de infección para los adultos (interacción cepas por tiempo) mostraron diferencias sólo para S. feltiae en los dos tiempos (F = 5,93; df = 1; P≤0,0289), presentando un menor porcentaje en la primera evaluación (15 ddi) con respecto a la segunda (30 ddi) (Tabla 1), igual resultado se encontró cuando se evaluaron diferentes estadios de este insecto con la cepa introducida S. carpo-capsae en condiciones de laboratorio 10 ddi, donde la infección promedio para adultos fue de 58,6%, Caicedo y Bellotti (1994) determinando dosis letales encontraron que193 nep/ml y 641 nep/ml produjeron 50% y 90% de infección, frente a la dosis recomendada comercialmente y usada en este experimento, para la cepa de Steinernema feltiae (1.000 nep/ml). Por otro lado, en invernadero, al usar esta misma concentración con dos cepas nativas (Steinernema sp. y Heterorhabditis sp.) se obtuvieron bajas infecciones (18 y 10%, respectivamente); estas infecciones se incrementaron cuando se aumentaron las dosis (25 000 nep/ml) hasta 55% y 45%, cantidad de neps imposible de considerar comercialmente (CIAT 2003), según Bedding et al. (1983), la asociación prolongada de un nematodo con un insecto lleva a que la población benéfica busque hacer el menor daño a su hospedero, por lo cual una población introducida podría ejercer un mejor control.
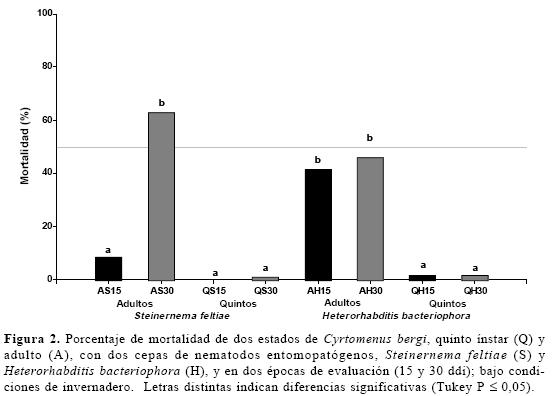
Porcentaje de mortalidad. El análisis de varianza mostró alta significación estadística para los factores edad, tiempo y sus interacciones, pero no para cepas. Efectuada la prueba de Tukey (P ≤0,05), se determinaron dos niveles de significación en el factor edad de chinches, donde el estado adulto se mostró más susceptible (39,6%) frente al quinto estado (1,1%) (F= 148,6; df= 1; P ≤0,0001). En el factor tiempo, sin ser el ideal, la mayor mortalidad la presenta el tiempo dos (30 ddi), con 27,8%, frente a 12,9% a los 15 ddi (F= 6,77; df= 1; P ≤0,0209). En la interacción cepas por tiempo solo S. feltiae presenta diferencias entre los tiempos de evaluación, con apenas 4,3% de mortalidad a los 15 ddi frente a 31,9% a los 30 ddi; no habiendo diferencias para H. bacteriophora, cuyo promedio de mortalidad en los mismos tiempos es de 22,6%. Ambas cepas comparten el mismo rango de mortalidad a los 30 ddi, lo que permite inferir que H. bacteriophora sería más eficiente, en términos de celeridad (F= 4,82; df= 1; P ≤0,0455). Por otro lado, en la interacción edad por cepas y por tiempo, se confirman los resultados parciales, mostrando al estado adulto como el más susceptible sin importar la cepa; H. bacteriophora y S. feltiae a los 30 ddi son estadísticamente iguales pero, como no hay diferencias en el porcentaje de mortalidad de H. bacteriophora entre las dos fechas de evaluación, lo que si ocurre con S. feltiae, la primera sería más eficiente que la segunda por su rápida acción sobre el rizófago (F= 4,41; df= 1; P ≤0,0544) (Fig.2). El promisorio éxito de H. bacteriophora podría explicarse gracias a su menor tamaño, lo que le permitiría acceder más rápida y fácilmente al chinche, el que por no tener un sistema bucal mandibular como en las larvas de coleópteros o lepidópteros, sino un estilete, tiene menores posibilidades de acceso para los organismos entomo-patógenos. Los resultados en esta variable concuerdan con los estudios de Bedding (1981), quien encontró que cepas de Heterorhabditis son más virulentas que las de Steinernema. En cuanto al estado más susceptible Barberena y Bellotti (1998) encontraron, por el contrario, que la cepa nativa H. bacteriophora mata más eficientemente a los chinches de quinto instar (en promedio 83,8%) que a los adultos (32,5%), con 8 000 nep/ml. Cabe resaltar que la mortalidad resultante en el presente estudio supera a la encontrada en un experimento realizado en invernadero que, usando dosis altas de neps (100 000 nep/ml) sobre adultos de esta plaga, solo presentó una mortalidad promedio de 29% usando la cepa introducida Steinernema riobravis y las nativas Steinernema sp. y Heterorhabditis sp. (CIAT 2003).
Porcentaje de nemátodos melanizados
La mayoría de nemátodos presentaron morfología normal y se encontraron vivos dentro de los insectos, llegando incluso a obtenerse nuevas generaciones de neps; sin embargo, algunos chinches luego de la disección presentaron nemátodos melanizados, seguramente como una reacción del insecto al microorganismo invasor, al parecer desencadenando una cascada de enzimas (Profenil oxidasas) presentes en la hemolinfa de este insecto, las que actúan sobre los neps, evitando que maten a C. bergi (Soderhall y Aspan 1993).
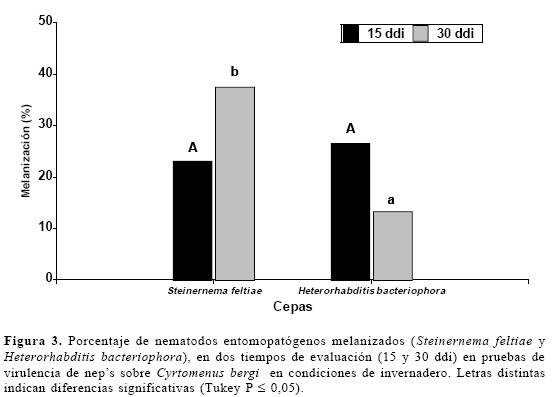
Debido a que no existieron nemátodos melanizados en el quinto ínstar de C. bergi, se hizo un análisis solo para los adultos frente a las dos cepas de neps, tras lo cual se encontraron diferencias estadísticas para nemátodos melanizados solo en la segunda evaluación. Determinados los rangos de significación, S. feltiae presenta mayor melanización que H. bacteriophora a los 30 días de evaluación (ANAVA F= 33,38; df= 1; P≤0,0287).
Adicionalmente, al comparar las dos fechas de evaluación no hubo influencia del tiempo de exposición de los chinches a los nemátodos frente a la melanización; observándose un promedio de 25% de melanización en las 293 muestras positivas para nemátodos con las dos cepas (Fig. 3). Este efecto ya fue observado en experimentos preliminares donde se inyectaron dos cepas nativas de neps vivos y muertos en el chinche (Steinernema sp. y Heterorhabditis sp.); en ambos casos se observaron liberación de profel-noloxidasas (10 ddi) (CIAT 2003). Además en experimentos con S. feltiae, cepa comercial reproducida in vivo, se encontró que al aumentar las concentraciones, aumentaba el porcentaje de melanización llegando a ser aproximadamente del 80% con 10 000 nep/ml, mientras que H. bacteriophora no superó el 20% a la misma concentración, lo que mostró nuevamente la mayor susceptibilidad de la primera cepa a este fenómeno (CIAT 2004).
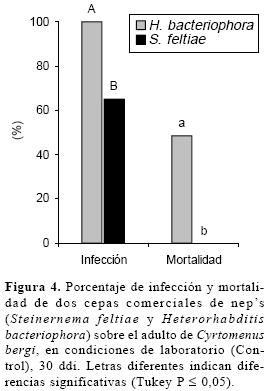
Viabilidad de los neps inoculados al sustrato. Se destaca que los neps inoculados (S. feltiae y H. bacteriophora) mantuvieron su virulencia en el sustrato durante todo el experimento, pues se verificó una mortalidad del 100% en G. mellonella, cuyas larvas mostraron signos y síntomas característicos a cada cepa de nep (color rojizo para las infectadas con H. bacteriophora y café para las de S. feltiae).(Fig. 4)
Conclusiones
Comparando los dos estados del chinche, el estado adulto es el más susceptible a la infectividad y mortalidad, indistintamente de la cepa de nematodo evaluada bajo estas condiciones. Al evaluar el efecto de la inoculación de nemátodos sobre C. bergi (infección) Heterorhabditis bacte-riophora mostró una acción más rápida frente a Steinernema feltiae la cual necesita más tiempo para penetrar y matar al insecto.
Observando el efecto de las cepas sobre la mortalidad del chinche, en la evaluación a los 15 días desde la inoculación (ddi) presenta el mejor efecto H. bacteriophora; y, solo a la segunda época de evaluación (30 ddi) se le iguala S. feltiae, compartiendo el mismo rango estadístico; lo que permite inferir que H. bacteriophora es más eficiente al actuar más rápido que S. feltiae. Respecto a la respuesta inmune del insecto a los neps, la cepa S. feltiae presenta mayor melanización, lo que puede afectar su efectividad entomopatógena hacia C. bergi. Estos resultados evidencian que H. bacteriophora es la cepa más promisoria por actuar en un tiempo más corto (15 ddi) bajo las condiciones de invernadero, respuesta que en campo favorecería un control más rápido de la plaga.
En condiciones de laboratorio esta misma cepa presenta también la mayor infección; aunque, no supera el 50% en mortalidad, como se observó en invernadero. Mientras tanto S. feltiae no produjo mortalidad, seguramente debido a la melanización, que si bien no se evaluó en este experimento, en el ensayo de invernadero mostró la mayor frecuencia con esta cepa.
Por lo anterior, se puede indicar que el efecto de los nemátodos entomopatógenos sobre esta plaga se ve influenciado tanto por la especie como por la cepa del nematodo, las condiciones ambientales, el estado de desarrollo de la plaga, el fenómeno de melanización, que impide que estos microorganismos causen la muerte del insecto, entre otros: Estos factores se deberían tener en cuenta al diseñar un programa de control biológico con la especie más promisoria, para las condiciones ambientales en las cuales se liberen estos entomopatógenos.
Agradecimientos
Este trabajo fue financiado por el Ministerio de Cooperación Económica (BMZ) de Alemania; además, los autores agradecen a Rodrigo Zúñiga, Catalina Ramírez y Rómulo Riascos, por brindar el material insectil necesario para el desarrollo del mismo.
Literatura citada
AGUILAR, J. A.; GONZÁLES, A.; LÓPEZ, J.; CONCEPCIÓN, J.; GORDÓN, R. 1991. Evaluación y Control de daño ocasionado por el chinche subterráneo Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae) en el cultivo de la yuca var. Brasileña. Instituto de Investigación Agropecuaria de Panamá (IDIAP). 127 p. [ Links ]
ARIAS, V. B.; BELLOTTI; A. C. 1985. Aspectos ecológicos y de manejo de Cyrtomenus bergi Froeschner, chinche de la viruela en el cultivo de la yuca Manihot esculenta Crantz. Revista Colombiana de Entomología 11 (2): 42-46. [ Links ]
BARBERENA, M. F.; BELLOTTI, A. C. 1998. Parasitismo de dos razas del nematodo Heterorhabditis bacteríophora sobre la chinche Cyrtomenus bergi (Hemiptera: Cydnidae) en laboratorio. Revista Colombiana de Entomología 24 (1-2): 7-11. [ Links ]
BEDDING, R. A. 1981. Low cost in vitro mass production of Neoplectana and Heterorhabditis species (Nematoda) for field control of insects pests. Nematology. 27: 109-114. [ Links ]
BEDDING, R. A.; MOLYNEUX, A. S.; ARFIURST, R. J. 1983. Heterorhabditis spp., Neoplectana spp., and Steinernema kraussei: interespecific and intraespecific differences in infectivity for insects. Experimental Pathology 55: 249-257. [ Links ]
BELLOTTI, A. C; GARCÍA, C. A. 1983. The subterranean Chinch Bug, a new pest of cassava. Cassava Newsletter 7: 10-11. [ Links ]
BELLOTTI, A. C; VARGAS, O.; ARIAS, B.; CASTAÑO, O.; GARCÍA, C. 1988. Cyrtomenus bergi Froeschner. A new pest of cassava: Biology, Ecology and Control. VII Symposium of the International Society for Tropical Root Crops, Gosier (Guadalupe) Ed. INRA, Paris. p: 551-560. [ Links ]
BELLOTTI, A. C; SMITH, L.; LAPOINTE, S. L. 1999. Recent advances in cassava pest management. Annual Review of Entomology 44: 343-70 [ Links ]
CAICEDO, A. M.; BELLOTTI, A. C. 1994. Evaluación del potencial del nematodo entomógeno Steinernema carpocapsae Weiser (Rhabditida: Steinernematidae) para el control de Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae) en condiciones de laboratorio. Revista Colombiana de Entomología 20 (4): 241-246. [ Links ]
CARBALLO, M.; SAUNDERS, J. L. 1990a. Labranza del suelo e insecticidas: efecto sobre la incidencia de Cyrtomenus bergi Froeschner en maíz. Turrialba 40: 165-168. [ Links ]
CARBALLO, M.; SAUNDERS, J. L. 1990b. Manejo del suelo, rastrojo y las plagas: interacciones y efecto sobre el maíz. Turrialba 40: 183-189. [ Links ]
CIAT 1980. Cassava Program Report. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia. p: 11-17. [ Links ]
CIAT 1983. Cassava Program Report. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia. p: 325-370. [ Links ]
CIAT 1985. Cassava Program Report. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia. p: 223-264. [ Links ]
CIAT 2003. Cassava Entomology. p. 1-42. En: Centro Internacional de Agricultura Tropical (CIAT). Annual Report. Inte-grated Pest and Disease Management in Major Agroecosystems. Cali, Colombia. 258 p. [ Links ]
CIAT 2004. Soil pests-Cassava and other crops. p. 116-165. En: Centro Internacional de Agricultura Tropical (CIAT). Annual Report. Integrated Pest and Disease Management in Major Agroecosystems. Cali, Colombia. 417 p. [ Links ]
CLAVIJO, S. 1981. Variaciones estacionales de poblaciones de adultos de Spodoptera frugiperda y Cyrtomenus bergi en cinco localidades de los alrededores del lago de Valencia, medidas mediante trampas de luz. Revista Facultad de Agronomía, Maracay 12: 63-79. [ Links ]
DOWNES, M. J.; GRIFFIN, C. T, 1996. Dispersal behaviour and transmission strategies of the entomopathogenic nema-todes Heterorhabditis and Steinernema. Biocontrol Science and Technology 6: 347-356. [ Links ]
EHLERS, R. U. 1996. Current and future use of nematodes in biocontrol: practice and commercial aspects with regard to regu-latory policy issues. Biocontrol Science and Technology 6: 303-316. [ Links ]
FEDERICI, B. A. 1999. A perspective on pathogens as biological control agents for insect pests. p. 517-547. En: Bellows, T. S.; Fisher, T. W. (eds.). Handbook of Biological Control: Principles and Appli-cations. Academic Press, San Diego, New York. 1046 p. [ Links ]
GARCIA, C. A.; BELLOTTI, A. C. 1980. Estudio preliminar de la biología y morfología de Cyrtomenus bergi, Froeschner, nueva plaga de la yuca. Revista Colombiana de Entomología 6 (3): 55-61. [ Links ]
GOLD, C. S.; VARGAS, O.; WIGNIMAN, J. 1988. Intercropping effects on insect pest of cassava in Colombia and of groundnut in India. CP479. International Crop Research Institute for the Semi-Arid Tropics (ICRISAT), Patancheru, Andhra Pradesh, India. p: 1–18. [ Links ]
ICA. 1980. Notas y Noticias Entomológicas (Sep. – Oct.). Instituto Colombiano Agropecuario, Bogotá. p. 68. [ Links ]
INFOSTAT. 2004. Manual del usuario. Grupo INFOSTAT, FCA., Universidad Nacional de Córdoba. 1 ed. Editorial Brujas Argentina. 318 p. [ Links ]
JANSSON, R. K. 1993. Introduction of exotic entomopathogenic nematodes (Rhabditida: Heterorhabditidae and Steinernematidae) for biological control of insects: potential and problems. Florida Entomologist 76 (1): 83-96. [ Links ]
JARAMILLO, J.; BORGEMEISTER, C.; EBSSA, L.; GAIGL, A.; TOBÓN, R.; ZIMMERMANN, G. 2005. Effect of combined applications of Metarhizium anisopliae (Metsch.) Sorokin (Deu-teromycotina: Hyphomycetes) strain CIAT 224 and different dosages of imidacloprid on the subterranean burrower bug Cyrto-menus bergi Froeschner (Hemiptera: Cydnidae). Biological Control 34: 12–20 [ Links ]
KAYA, H. K.; STOCK, S. P. 1997. Techniques of insect nematology. p. 281-324. En: Lacey, L. (eds.) Manual of techniques in insect pathology. Biological Techniques Series. Capítulo VI. Academic Press, San Diego, California. 409 p. [ Links ]
LACERDA, J. I. 1983. Dano causados au dendê (Elais guineensis) por ação do Cyrtomenus bergi (Froeschner, 1960) (Hemiptera: Cydnidae). Revista Floresta (Brazil) 14: 59-60. [ Links ]
KING, A. B. S.; SAUNDERS, J. L. 1984. The invertebrate pests of annual food crops in Central America. Overseas Development administration, London, UK. p. 117-118. [ Links ]
RIIS, L. 1990. The Subterranean Burrowing Bug Cyrtomenus bergi Froeschner, an increasing Pest in Tropical Latin America: Behavioral studies, Population Fluc-tuations, Botanical Control, with Special Reference to Cassava. M.Sc. Thesis, Department of Ecological and Molecular Biology, Section of Zoology, The Royal Veterinary and Agricultural University, Copenhagen. 85 p. [ Links ]
RIIS, L. 1997. Behavior and Population growth of the Burrower Bug, Cyrtomenus bergi Froeschner: Effects of host plants and abiotic factors. Ph.D. Thesis, Department of Ecological and Molecular Biology, Section of Zoology, The Royal Veterinary and Agricultural University, Copenhagen. 167 p. [ Links ]
SANCHEZ, D. 1996. Patogenicidad de hongos hyphomycetes sobre Cyrtomenus bergi F. (Hemiptera: Cydnidae) chinche subterráneo de la yuca en condiciones de laboratorio. Trabajo de Grado de Ingeniero Agrónomo, Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Palmira. 93 p. [ Links ]
SHENK, M.; SAUNDERS, J. L. 1984. Vegetation management systems and insect responses in the humid tropics of Costa Rica. Tropical Pest Management. 30: 186-193 [ Links ]
SODERHALL, K; ASPAN, A. 1993. Prophe-noloxidase Activating System and its role in cellular communication. En: J.P.N. Pathak editor. Insect Immunity. New Delhi. Oxford and IBH Publishing Co. p. 113-129. [ Links ]
STRUCK, E.; EBSSA, L.; EHLERS, R-U.; POEHLING, H-M.; GAIGL, A.; BOR-GEMEISTER, C. 2004. Interactions between host plants, the subterranean burrower bug, Cyrtomenus bergi, and the entomopathogenic nematode Heteror-habditis megidis. Nematology 6 (5): 633-639. [ Links ]
URIBE, S. 1997. Mecanismos de respuesta inmune en insectos. Revista Colombiana de Entomología. 23 (3-4): 177-185. [ Links ]
VARGAS, H. L. 1996. Resistencia de variedades de yuca a Cyrtomenus bergi. Revista Nataima 1: 27-30. [ Links ]
Recibido: 01-feb-05 Aceptado: 24-nov-05