Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.32 no.2 Bogotá July/Dec. 2006
Sección Medica
Detección y Cuantificación de Propoxur en la Sucesión de Insectos de Importancia Médico-Legal
Detection and Quantification of Proporxur in a Succession of Insects of Medico-Legal Importance
Marta Wolff1 , Yovanny Zapata2 , Gladis Morales3, Mark Benecke4.
1Autor para correspondencia: Profesor, Dr. Laboratorio de Colecciones Entomológicas-GIEM. Universidad de Antioquia. A.A 1226 Medellín, Colombia. E-mail: mwolff@matematicas.udea.edu.co
2Biólogo. Laboratorio de Colecciones Entomológicas-GIEM. Universidad de Antioquia. A.A 1226 Medellín, Colombia.
3MSc química. GIEM. Universidad de Antioquia. A.A 1226 Medellín, Colombia.
4Dr. Mark Benecke. Internacional Forensic Research and Consulting. Cologne-Germany.
Resumen. Con miras a la detección y cuantificación del propoxur en insectos de importancia forense y a la búsqueda de indicadores entomotoxicológicos, se utilizó la técnica de HPLC (Cromatografia Líquida de Alta Eficiencia) con ejemplares colectados durante la sucesión ecológica asociada a los cadáveres de tres conejos, los cuales fueron sacrificados con una sobredosis de propoxur y contando con un cuarto conejo control que fue sacrificado por dislocamiento cervical. Los conejos fueron monitoreados durante 28 días, tres veces al día (7, 13 y 18 horas). Durante este periodo se colectaron insectos inmaduros y adultos, se midió la temperatura ambiental, la temperatura corporal y la pérdida de peso. Del material colectado, se seleccionaron 73 individuos entre inmaduros (larva I, II, III, pupas) y adultos de los órdenes Diptera y Coleoptera, en los que se evaluó el analito de interés por la técnica de Cromatografía Líquida de Alta Eficiencia (HPLC), con un resultado positivo en el 56% de las muestras desde larva I hasta adulto y en todos los estados sucesionales de la descomposición. Esta técnica permitió una alta sensibilidad a partir de 0,1g o menos por cada muestra, para la cuantificación de residuos de propoxur en larvas y adultos. En Diptera se cuantificó a partir de muestras con un peso de 0,0029 g y para Coleoptera en muestras con un peso de 0,002 g. La concentración mínima detectada (0,671 ppm) se encontró en larvas en estadio II de dípteros Calliphoridae y Muscidae y la concentración máxima cuantificada (229,7121 ppm) se encontró en larvas en estadio III de Lucilia eximia (Diptera: Calliphoridae), con porcentajes de 0,04 y 0,34 respectivamente.
Palabras clave: Entomotoxicología, Entomología Forense, Cromatografía Líquida de Alta Eficiencia.
Abstract. To detect and quantify the amount of propoxur in insects of forensic importance and over the chance of finding entomotoxicologic indicators, the HPLC (High Performance Liquid Chromatography) technique was used in individuals collected during the ecological succession associated to the corpses of three rabbits, which were sacrificed by means of a 10 ml propoxur overdose, and with a control fourth rabbit which was sacrificed by cervical breakup. The rabbits were checked during 28 days three times a day (07:00, 13:00 and 18:00 hours). During this period immature and adult insects were collected; the environmental temperature, corporal temperature and lost of weight were taken. From the collected material, 73 individuals between immature (larvae I, II, III, pupas) and adults of orders Diptera and Coleoptera were selected and evaluated by the High Performance Liquid Chromatography (HPLC) technique. A positive result in 56% of the samples from first instars to adult stage, as well as in all the states of decomposition, was obtained. This technique allowed high sensitivity (from 0.1 g or less for each sample) in the quantification of remains of propoxur in larvae and adult insects. Samples with a weight of 0.0029 g for Diptera and 0.029 g for Coleoptera were quantified. The minimum detected concentration (0,671 ppm) was found in dipters Calliphoridae and Muscidae stadium II larvae and the maximum quantified concentration (229,721 ppm) was found in Lucilia eximia (Diptera: Calliphoridae) stadium III larvae, percentages of 0,04 and 0,34 respectively.
Key words: Enthomotoxicology, Forensic Enthomology, High Performance Liquid Chromatography (HPLC).
Introduccion
La entomotoxicología es una herramienta que aplica análisis toxicológicos a insectos que se alimentan de carroña, con el fin de identificar drogas y toxinas tales como insecticidas, antidepresivos tricíclicos y estimulantes (barbitúricos, cocaína y anfetaminas) presentes en tejidos. También investiga los efectos causados por dichas sustancias en el desarrollo de los artrópodos para determinar el intervalo postmortem (IPM) (Introna et al. 2001) ya que la confiabilidad de la evidencia entomológica para la estimación de IPM puede depender de la presencia de productos en los tejidos de las larvas pues algunas toxinas pueden afectar la rata de crecimiento de las especies presentes en los cadáveres (Goff et al. 1989; 1991; 1993; Introna et al. 1990; Goff and Lord 2001; Gagliano-Candela and Aventaggiato 2001; Introna et al. 2001).
Por los métodos tradicionales de la toxicología, los productos de envenenamiento se recuperan mediante muestras de órganos internos, orina y sangre; sin embargo, en estados avanzados de descomposición esta técnica no es posible (Introna et al. 2001). De ahí que los insectos puedan ser una alternativa en la determinación de la presencia de sustancias en un cuerpo, dado que el análisis cualitativo en las larvas es una evidencia de la presencia de un compuesto determinado (Goff et al. 1993; 1997; ,Bourel et al.1999; Bourel et al. 2001; Introna et al, 2001 Hédouin, et al. 2001, Wolff et al. 2004). La entomotoxicología utiliza técnicas tales como Análisis Radio Inmunológico (RIA), Cromatografía de Gases (GC), Cromatografía de Capa Fina (TLC), Cromatografía Gaseosa Acoplada a Masas (GC-MS) y Cromatografía Líquida de Alta Resolución (HPLC) (Introna et al. 2001).
El propoxur es un producto ampliamente comercializado que no tiene prescripción ni restricciones para su compra y es de bajo costo. Es un carbamato muy persistente, cuyo ingrediente activo presenta un DL 50 de 100 mg/kg de peso. Es un insecticida de ingestión y contacto (FAO 1985).
Por lo anterior, el objetivo de este trabajo fue detectar cuantitativa y cualitativamente propoxur en insectos asociados al proceso de descomposición cadavérica, como una metodología de apoyo a la investigación médica y judicial.
Materiales y Métodos
El trabajo se realizó en la ciudad de Medellín, Colombia, situada a una altitud de 1450 msnm, en un área designada según Holdridge como bosque húmedo premontano (bh-P), con temperatura ambiental entre 18–24 ° C y pluviosidad media anual de 1409mm (IGAC, 1997; Espinal, 1985).
Para el estudio se utilizaron cuatro conejos (Sylvilagus brasiliensis) de 3,1-3,2 Kg. Uno de ellos, que se utilizó como control, fue sacrificado por dislocamiento cervical. A los otros tres se les inyectó con una dosis letal de 10 ml de propoxur vía intra-cardíaca y se les suministró 1 ml vía oral. Previo al sacrificio todos los conejos fueron anestesiados con 0,7 ml de Ketalar, siguiendo el protocolo aprobado por el Comité de Bioética de la Universidad de Antioquia. Después del sacrificio se extrajeron 10 g de hígado de cada uno de los conejos para un posterior análisis toxicológico. Los conejos fueron colocados individualmente en jaulas metálicas de 60 x 50 x 40 cm separadas entre si a una distancia de 5 m.
Los insectos que se encontraban sobre los cadáveres fueron colectados diariamente durante 28 días entre los meses de junio y julio, tres veces al día: a las 7, 13 y 18 horas, y una vez al día se midió la temperatura ambiente, la temperatura corporal (rectal) y la pérdida de peso. Se recogieron tanto insectos inmaduros en todos los estadios (LI, LII, LIII, pupa), como adultos en orificios naturales (ojos, orejas, boca y ano); sobrevolando el cuerpo, bajo éste y en el suelo hasta una profundidad de 10 cm en un área de 40 x 60 cm. Una parte de los insectos colectados se fijó y almacenó en alcohol al 70% para la identificación taxonómica y otra parte, consistente en una muestra de individuos de todos los estadios provenientes de todos los sitios, se almacenó de forma individual en viales secos y se llevó a –20º C, al igual que una porción de 20 g de hígado proveniente de cada uno de los cuatro conejos a evaluar para la detección y cuantificación del propoxur por HPLC.
Procesamiento de insectos en laboratorio.
Previo al procesamiento para detección en el HPLC, las muestras entomológicas guardadas en frío se separaron por estadio de desarrollo, previa determinación taxonómica e identificación del estado sucesional correspondiente a la fase de descomposición de cada conejo (Castillo 2001; Shalaby et al, 2000; Schoenly et al. 1996; Timms 1994). De igual forma se procedió con los insectos fijados en alcohol.
Separación y cuantificación del propoxur por Cromatografía Liquida de Alta Resolución (HPLC). El análisis se llevó a cabo en un cromatógrafo líquido (Gilson) con detector de arreglo de diodos (DAD) a una longitud de onda de 263 nm. Columna: Water BondapackC18: 3,9x300mm, Guarda columna: WAT044480, W10861. Fase móvil: Acetonitrilo: Agua (50:50). Gradiente isocrático: temperatura ambiente y flujo de 1,2 ml/min (Fig. 1). El tiempo de elución del propoxur fue de 4,4 minutos.
Un máximo de 0,2 g de muestra de insecto o hígado fue sometido a la técnica cromatográfica luego de maceración y tres extracciones; mezcla Agua: ACN (50:50) con 0,5 ml de solución por extracción para un volumen total de 1,5 ml. Cada extracción se acompañó con el sonicador durante 10 minutos. Se centrifugó para separar el sobrenadante en tubos Eppendorf, y se le agregó 0,1 ml de etanol con el fin de precipitar las proteínas para volver a centrifugar. La solución sobrenadante se inyectó directamente en el cromatógrafo líquido.
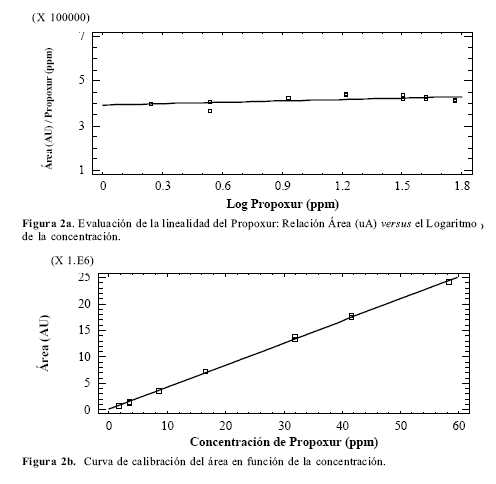
La cuantificación se realizó por curva de calibración, para ello se prepararon diferentes diluciones del estándar de propoxur y se inyectaron en el cromatógrafo (Tabla 1). Como estándar interno se empleó el Carbofurano lote 234-101B a un 99% de pureza de CHEM SERVICE, con esos datos se buscó la linealidad del método, graficando la relación área (uA)/concentración (ppm) en función del logaritmo de la concentración (Fig. 2a), empleando el programa estadístico Statgraphics Plus 5.0. El factor de respuesta se encontró en el rango de 400 357,42 y 442 500,30, a un 95% de nivel de confianza. A partir de esos resultados, se determinaron los límites de cuantificación, siendo la concentración de 1,8 ppm el límite de donde se estimó que el propoxur es cuantificable en un rango de linealidad de 1,8 a 58 ppm. Así mismo, se graficó el área en función de la concentración (Fig. 2b) y se obtuvo una relación lineal entre las variables, con un coeficiente de correlación = 0,99951 y R2 = 99,902%.
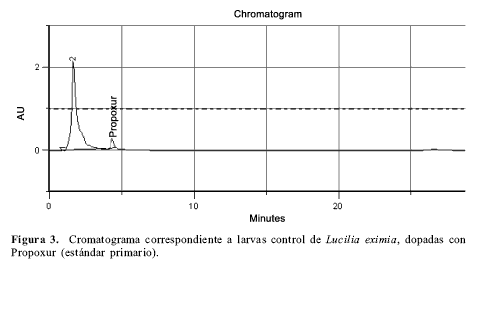
Para validar el método de extracción y separación del propoxur, se tomaron larvas limpias del conejo control y se doparon con una concentración conocida de propoxur (estándar primario); luego se procedió al proceso de extracción descrito anteriormente, con un porcentaje de recuperación del 82 % (Fig. 3).
Resultados y Discusión
En la sucesión de artrópodos observada durante el proceso de la descomposición, se registraron cinco fases de descomposición: fresco, hinchado, descomposición activa, descomposición avanzada y momificado, no observándose la fase de restos. Se colectaron organismos pertenecientes a 17 ordenes (Diptera, Coleoptera, Hymenoptera, Lepidoptera, Blattaria, Orthoptera, Dermaptera, Hemiptera, Thysanura, Thysanoptera, Collembola, Acari, Araneae, Geophilomorpha, Isopoda, Oligochaeta) y a 36 familias distribuidos en todas las categorías ecológicas (Smith 1986): necrófagos (Calliphoridae, Muscidae -en parte-, Sarcophagidae, Phoridae, Sepsidae -en parte-, Cleridae, Trogidae, Acari); depredadores (Calliphoridae -en parte-; Muscidae -en parte-, Carabidae, Histeridae, Staphylinidae, Reduviidae -en parte-, Aranae, Geophilomorpha); omnívoros (Blattidae, Vespidae, Formicidae, Labiidae, Labiduriidae, Isopoda) e incidentales (Apidae, Braconidae, Cydnidae, Gelastocoridae, Miridae, Reduviidae -en parte-, Chloropidae, Sphaeroceridae, Syrphidae, Tabanidae, Cicadellidae, Membracidae, Elateridae, Gryllidae, Lepismatidae, Thysanoptera, Hypogastruridae, Onychuiridae).
Del total de individuos colectados, se utilizó una muestra (N=73) para el análisis, obteniéndose un resultado positivo (detección y/o cuantificación del propoxur) en 41 ejemplares entre larvas, pupas y adultos de Diptera y Coleoptera (Tabla 2), pertenecientes a los conejos uno y dos (Figs. 4a-c). En el conejo tres no hubo detección del producto, ni en el control. Las concentraciones de propoxur que se pudieron cuantificar estuvieron entre 0,6771ppm en larva II de Muscidae y Calliphoridae y 229,712 ppm en larva III de Lucilia eximia , y con una área promedio de 284 104,25 y 96 391 120 respectivamente (Tabla 2).
En lo que respecta a las muestras de los hígados, no se encontró propoxur en ninguno de los conejos sometidos al producto, ni en el control, lo que podría explicarse por el mecanismo de dispersión del propoxur. Los carbamatos no se acumulan en el organismo; su biotransformación se realiza por hidrólisis, oxidación y conjugación y se eliminan rápidamente por vía urinaria.(Anonimo 2006)
En la sucesión se observó como grupos mayoritarios en estadio de larva individuos de Diptera y Coleoptera; del primer grupo se encontraron las familias Calliphoridae, Sarcophagidae, Muscidae y Phoridae y del segundo, Trogidae, Staphylinidae, Dermestidae y Cleridae. La familia Calliphoridae fue la primera en llegar y depositar sus huevecillos en todos los conejos, Lucilia eximia , se recolectó en todas las fases de descomposición, disminuyendo en el periodo momificado. Cochliomya macellaria estuvo presente en mayor cantidad en el periodo de hinchado al igual que la Chrysomya albiceps, la cual fue encontrada hasta momificado. Chrysomya megacephala estuvo presente sólo en el conejo dos desde activo a momificado. Larvas de Sarcophagidae fueron colectadas en todos los modelos desde el periodo hinchado hasta el momificado.
La familia Muscidae (Polietes sp) predominó en todas las fases de descomposición. La familia Phoridae (Trophodeinus sp) se colectó en el suelo a partir del periodo hinchado hasta el final del muestreo. En el segundo grupo, los coleópteros adultos de Trogidae (Trox sp.) predominaron desde hinchado hasta momificado. En este grupo se cuantificaron los mayores residuos del veneno; igualmente se obtuvo Staphylinidae (Alecharinae), Dermestidae (Dermestes sp.) y Cleridae (Necrobia rufipes); estos últimos de gran importancia en la entomología forense ya que predominan desde la fase de activo hasta la de momificado.
Los himenópteros, presentes en todas las fases de descomposición y que forman parte de la fauna local con carácter de oportunistas, fueron observados devorando larvas, en especial de Diptera. Los demás grupos, que fueron minoritarios (Hemiptera -Gelastocoridae-, Lepidoptera, Anthicidae, Collembola, algunos Formicidae y otros artrópodos -Isópodos y otros-) fueron considerados como incidentales ya que hacen parte de la fauna local.
En cuanto a la detección del propoxur (Tabla 2), los resultados fueron positivos a partir del periodo en fresco para larvas I de Calliphoridae colectadas directamente del cuerpo, pero no fue posible la cuantificación. Para la fase de hinchado, se detectaron nueve larvas III de Lucilia eximia , provenientes del suelo y del cuerpo. La detección en pupas se efectuó en ejemplares hallados enterrados a partir de la fase de descomposición avanzada, pertenecientes a Calliphoridae (una de C. albiceps y cuatro indeterminadas).
Para el caso de los Dermestes sp y Trox sp., se detectó el propoxur tanto en larvas como adultos y en N. rufipes, en adultos; estas especies fueron colectadas al interior del cuerpo de los conejos y aunque aparecen en periodos de descomposición desde hinchado hasta momificado (Trox sp) o desde activo a momificado (Dermestes sp y N. rufipes), son consideradas propias de las últimas fases de descomposición o, como ocurrió en este trabajo, de partes del cuerpo que sufren un proceso de esqueletización mucho antes que el resto del cuerpo como las patas o miembros inferiores al tener menor cantidad de tejido blando.
Con respecto al consumo de los cadáveres, la presencia del veneno no alteró las etapas sucesionales en los insectos, pero sí las fases de descomposición. Esto fue debido quizás al mecanismo de dispersión del veneno.
La técnica del HPLC mostró ser una herramienta muy eficaz para la Entomotoxicología a partir de muestras con un peso desde 0,0029 g. Se detectó y cuantificó el propoxur en larvas LI, II, III, pupa y adultos de Diptera; larvas y adultos de Coleoptera; en las etapas de sucesión de fresco, hinchado, avanzado y momificado. La concentración más alta detectada (0,5584 %) se presentó para los coleópteros (Trox sp.) en momificación.
Los estudios en entomotoxicologia con fines forenses aunque han sido numerosos son muy escasos en lo que respecta a pesticidas; tan solo se tienen reportes de detección en el organofosforado malation, en el cual se realizaron extracciones por cromatografía gaseosa (GC) en larvas de Diptera (Gunatilake y Goff, 1989) y por cromatografía líquida de alta resolución (HPLC), en donde se obtuvieron resultados positivos larvas de Diptera y adultos de Coleoptera (Wolff et al. 2004).
Este es el primer estudio que se efectúa con propoxur, con el cual, se pudo estandarizar un protocolo para cuantificar y detectar el carbamato en insectos de importancia médico-legal. Este trabajo demuestra la importancia de considerar la Entomotoxicología en Colombia como una herramienta eficaz de apoyo a las ciencias forenses.
Literatura citada
ANÓNIMO 2006. Manejo ecológico de plagas:Los plaguicidas y la salud. Sitio web:http://es.geocities.com/ pirineosjuan/plaguicidasalud.html. Fecha último acceso:21 febrero 2006. [ Links ]
BOUREL, B.; HÉDOUVER, L.M.; BÉCART, A.; TOURNEL, G.; DEVEAUX, M.; GOSSET, D. 1999. Effects of morphine in decomposing bodies on the development of Lucilia sericata (Diptera: Calliphoridae). Journal Forensic Science 44(2): 354-358. [ Links ]
BOUREL, B.; TOURNEL, G.; HÉDOUIN, V.; DEVEAUX, M.; BÉCART, A.; DEVEAUX, M.; GOFF, M.L.; GOSSET, D. 2001. Morphine extraction in necrophagous insects remains for determining ante-mortem opiate intoxication”. Forensic Sciences International 120 (1-2): 127-131. [ Links ]
CASTILLO MIRALBES, M. 2001. Artrópodos presentes en carroña de cerdos en la comarca de La Litera (Huesca). Boletín S.E.A 28: 133-140. [ Links ]
ESPINAL, L.S. 1985. Geografía ecológica del Departamento de Antioquia: zonas de vida, formaciones vegetales. Revista Facultad Nacional de Agronomía Medellín, Universidad Nacional de Colombia Volumen 38, 104p. [ Links ]
GAGLIANO-CANDELA, R; AVENTAGGIATO, L. 2001. The detection of toxic substances in entomological specimens. International Journal of Legal Medicine 114: 197-203.
GOFF, M.L.; OMORI, A.I, GOODBROD J.R. 1989. Effect of cocaine in tissues on the rate of development of Boettcherisca peregrina (Diptera: Sarcophagidae). Journal of Medical Entomology 26: 91-93. [ Links ] [ Links ]
GOFF, M.L.; BROWN, W.A; HEWADIKARAM K.A; AMORI, A.I.. 1991. Effects of heroin in decomposing tissues on the development rate of Boettcherisca peregrina (Diptera: Sarcophagidae) and implications of this effect on estimations of postmortem intervals using arthropod development patterns. Journal of Forensic Science 36: 537-542. [ Links ]
GOFF, M.L.; BROWN, W.A.; AMORI, A.I.; LA POINTE, D.A. 1993. Preliminary observations of the effects of amitriptyline in decomposing tissues on the development of Parasarcophaga ruficornis (Diptera: Sarcophagidae) and implications of this effect to estimation of postmortem interval. Journal of Forensic Science 38: 316-322. [ Links ]
GOFF, M.L.; MILLER, M.L.; PAULSON, J.D.; LORD, W.D.; OMARI, A.I. 1997. Effects of 3,4-methylenedioxymethamphetamine in decomposing tissues on the development of Parasarcophaga ruficornis (Diptera: Sarcophagidae) and detection of the drug in postmortem blood, liver, and puparia. Journal of Forensic Science 42(2): 276-280. [ Links ]
GOFF, M.L.; LORD, W.L. 2001. Entomotoxicology: insects as toxicological indicators and impact of drugs and toxins on insect development. In: Byrd J.H; Castner, J.H (eds) Forensic entomology. CRC Press, Boca Raton 331-340. [ Links ]
HÉDOUIN, V.; BOUREL, B.; BÉCART, A.; TOURNEL, G.; DEVEAUX, M.; PHARM, D.; GOFF, M.L; GOSSET, D. 2001. Determination of drug levels in larvae of Protophormia terranovae and Calliphora vicina (Diptera: Calliphoridae) reared on rabbit carcasses containing morphine. Journal of Forensic Science 46(1): 12-14. [ Links ]
INSTITUTO GEOGRÁFICO AGUSTIN CODAZZI. 1997. Zonas de vida o formación vegetal de Colombia, explicativo sobre el mapa ecológico, Bogotá. 235p. [ Links ]
INTRONA, F.; LODICO, C; CAPLAN, Y.H; SMIALEK, J.E. 1990. Opiate análisis in cadaveric blowfly larvae as an indicador of narcotic intoxication. Journal of Forensic Science 35: 118-122. [ Links ]
INTRONA, F.; CAMPOBASSO, C.P.; GOFF, M.L. 2001. Entomotoxicology. Forensic Sciences International 120 (1-2): 42-47. [ Links ]
SCHOENLY, K.; GOFF, M.L.; WELL, J.D.; LORD, W.D. 1996. Quantifying Statistical Uncertainty in Succesion - Based Entomological Estimates of the Postmortem Interval in Death Scene Investigation: A Simulation Study. American Entomologist 106-112. [ Links ]
SHALABY, O.A.; CARVALHO D. L, M.; GOFF, M.L. 2000. Comparison of Patterns of Descomposition in a Hangin Carcass and a Carcass in Contact with Soil in a Xerophytic Habitat on the Island of Oauhu, Hawaii. Journal of Forensic Science 45(6): 1267-1273. [ Links ]
SMITH, K.G. 1986. A Manual of Forensic Entomology. Department of Entomology, British Museum. London. 205 p. Statgraphic Plus 5.0, PRISMA CONSULTORES, S.A. DE C.V. [ Links ]
TIMMS, R.F. 1994. Determinación del Tiempo de Muerte en Cadáveres Putrefactos, Momificados y Saponificados. Medicina Legal de Costa Rica. 10(2): 17 - 21. [ Links ]
WOLFF, M.; BUILES, A.; ZAPATA, G; MORALES, G; BENECKE, M. 2004. Detection of Parathion (0,0-diethyl 0 (4-nitrophenyl) phosphorothioate) by HPLC in insects of forensic importante in Medellín, Colombia. Aggrawal`s Internet Journal of Forensic Medicine and Toxicology 5(1): 6-11.
[ Links ]
Recibido: 28-feb-06 • Aceptado: 23-octubre