Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.32 no.2 Bogotá July/Dec. 2006
Seccion morfologica, Comportamiento, Evolucion, y Sistematica
Eumaeini (Lepidoptera: Lycaenidae) del cerro San Antonio: Dinámica de la riqueza y comportamiento de “Hilltopping”
Eumaeini butterflies (Lepidoptera: Lycaenidae) from San Antonio hill: Richness dynamic and hilltopping behaviour
Carlos Prieto1, Hans W. Dahners2
1Centro Iberoamericano de la Biodiversidad (CIBIO). Universidad de Alicante, España. cprieto@ucauca.edu.co
2Departamento de Ciencia fisiológicas. Universidad del Valle. Cali, Colombia. hdahners@gmx.de
Resumen. Se analizan los cambios temporales en la riqueza de Eumaeini en la cima del cerro San Antonio al oeste de Cali sobre recolectas efectuadas en 2003. Los especímenes se capturaron con redes entomológicas de 5m y 1.80m de longitud en 92 muestreos. Se realizaron curvas de acumulación de especies y análisis de similitud (Jaccard) para comparar 11 meses del año y curvas de rarefacción. La riqueza de Eumaeini registrada en el cerro asciende a 72 especies distribuidas en 35 géneros. Los estimadores indican que se colectó cerca del 88% de las especies que vuelan en la zona. 20 especies se distribuyen durante todo el año, tienen poblaciones constantes en San Antonio y utilizan el cerro como lugar de encuentro de pareja. Se asume que al menos 26 especies no presentan el comportamiento de “hilltopping” o sus poblaciones son relativamente bajas en los alrededores del cerro. Los meses de julio y agosto muestran un gran número de especies aunque los análisis de rarefacción indican que no existen diferencias en la riqueza entre los 11 meses del 2003. La similitud entre los meses es menor del 56% según el análisis de similitud de Jaccard. Los cambios en la riqueza de la comunidad son debidos principalmente al régimen de lluvias y a la influencia del sol sobre la zona. La gran cantidad de especies únicas puede ser debida a individuos que no presentan el comportamiento de “hilltopping” o que provienen de cerros aledaños.
Palabras clave: Cordillera occidental. Colombia. Biodiversidad. Theclinae. Eumaeini.
Abstract. Eumaeini richness dynamics was analyzed on San Antonio hill (Cali). Collects were made with entomological nets of 5m and 1.80m through 92 samplings. Species accumulation curves and Jaccard similarity analysis were carried out to compare species richness among 11 months in 2003. Rarefaction curves were made to compare differential sampling months. Eumaeini richness found reached 72 species and 32 genera. Estimators show 88% of sampling efficiency. Twenty species displayed hilltopping behaviour and have abundant populations around the area. Twenty six species do not display hilltopping behaviour and their populations were comparatively low. July and August had the most abundant species number although the rarefaction analysis does not show significant differences on richness among the 11 months. According to Jaccard similarity index, less than 56% of the species were shared through months. The changes on richness were due to changes of sun light intensity and average rainfall on the hill. Most of unique species probably arriving from other hills near San Antonio or it is species do not display hilltopping behaviour.
Key words: Western cordillera. Colombia, Biodiversity. Theclinae. Eumaeini.
Introducción
Los bosques en zonas tropicales son destruidos rápidamente y los organismos dentro de ellos siguen siendo en gran parte, desconocidos. Por esto los estudios modernos sobre la diversidad de especies son cruciales para entender las comunidades tropicales restantes y su conservación (Heywood 1995; Gaston 1996; DeVries et al. 1999). El conocimiento de la variación de abundancia de las especies en espacio y tiempo puede ayudar a identificar características ecológicas de la diversidad tropical, sin embargo se han hecho muy pocos estudios de este tipo (DeVries et al. 1999).
Muchas mariposas y otros insectos vuelan hacia las cimas de cerros y montañas como respuesta a la necesidad de encontrar pareja. A este comportamiento se le denomina en inglés como “hilltopping” (Shields 1967; Alcock 1987; Pe´er et al. 2004). En muchos aspectos este comportamiento es similar al que presentan algunas aves que forman “leks” incrementando la eficiencia de los encuentros sexuales al reducir el área en la cual pueden ocurrir. Las cimas de cerros y montañas actúan como un foco para el apareamiento pues estos sitios generalmente no proveen de fuentes alimenticias o plantas hospederas las especies que los visitan (Alcock 1987). Estas cimas pueden tener un área muy pequeña en relación a la cantidad de especies que las utilizan lo que sugiere patrones de actividad diaria o estacional en la ocurrencia y abundancia de estos taxones. De esta manera la coexistencia por repartición del tiempo puede ser posible en grupos de especies relacionadas (Gilbert y Singer 1975; Gilbert 1984; Prieto en prep.).
En el Neotrópico el conocimiento de la composición de comunidades de ropalóceros de cima de montaña es muy escaso. En Colombia algunos trabajos describen hábitos territoriales de especies aisladas (Ackery 1975; Shapiro y Torres 1978; Callaghan 1983; Salazar 1996) o describen la riqueza de especies que frecuentan estos sitios (Salazar 1996; Prieto 2003). Se han registrado especies con comportamiento de “hilltopping” en varias familias de lepidoptera como: Lycaenidae, Nymphalidae, Papilionidae, Pieridae y Hesperidae. Probablemente Lycaenidae es la familia con mayor riqueza de especies en las cimas de cerros y montañas neotropicales.
Los Eumaeini son un grupo cuyo arreglo taxonómico ha estado estancado durante casi 80 años debido principalmente a que la mayoría de las especies son extraordinariamente raras en colecciones. Algunas especies descritas dos siglos atrás permanecen conocidas con menos de cinco individuos (Robbins 2004). Aunque la tribu Eumaeini es Holártica y Neotropical (Eliot 1973; Robbins 2004) el grupo está principalmente representado en el Neotrópico donde se han descrito 1058 de las 1130 especies conocidas. Solo en Suramérica se encuentran 910 especies de Eumaeini (Robbins 2004). Colombia, Ecuador, Perú y Brasil presentan la mayor riqueza de esta tribu con más de 500 especies y muchas más por describir en cada país (Robbins 2004). Aunque los Eumaeine se encuentran en un amplio rango de hábitat, presentan un patrón alar muy similar. Como anota Robbins (2004) ésta pudo ser una de las razones por las cuales muchas especies fueron ubicadas en el género “Thecla” Fabricius (Draudt 1919-20), genero cuya acepción actual nunca estuvo representada en el Neotrópico y que técnicamente se refiere a un pequeño género Paléartico de Theclini (Eliot 1973). El presente trabajo pretende mostrar la riqueza de Eumaeine en el cerro San Antonio, y analizar la dinámica temporal en la cima de esta montaña.
Materiales y Métodos
Área de estudio
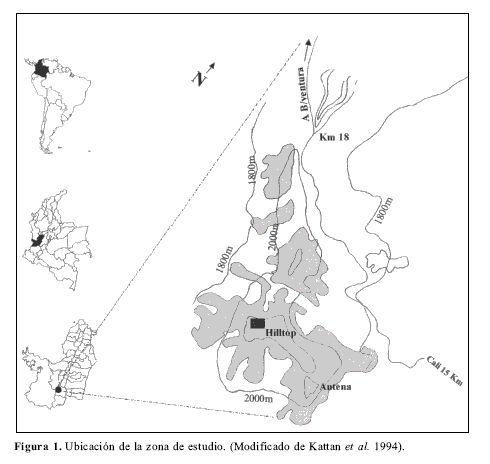
El cerro San Antonio o de La Horqueta se encuentra en la cordillera Occidental, departamento del Valle a 15 kilómetros al occidente de Cali sobre la carretera a Buenaventura y en la divisoria de aguas de las cuencas del rió Aguacatal y Dagua (76º 38´ O y 3º 30´ N) (Fig. 1). San Antonio forma parte de un sistema de parches de bosques relictuales con un área total de 700 ha, a elevaciones entre 1800 y 2200m. En la actualidad esta región está representada por un archipiélago de fragmentos boscosos sobre una matriz de pequeñas granjas y casas de campo. Sin embargo, en la zona los procesos de fragmentación no han sufrido muchos cambios desde la década de los sesenta (Kattan et al. 1984; Kattan et al. 1994). De acuerdo con Holdridge (1967) el bosque de San Antonio está clasificado como bosque húmedo montano bajo con una media de temperatura anual entre 15 ºC y un promedio anual de lluvia de 3000mm. Este sistema ha sido estudiado con relativa intensidad durante muchos años, principalmente en aves, donde se ha demostrado que el 31% de especies del bosque original en 1911 han desaparecido (Kattan et al. 1994). Sin embargo no se conocen trabajos intensivos que registren la diversidad real de mariposas en la zona.
Muestreo e identificación de especímenes
El lugar específico de muestreo es una colina que constituye la parte más alta de San Antonio a 2200msnm. Esta pequeña prominencia geográfica tiene aproximadamente 70m de altura y 300m de base (Fig. 2). La cima tiene un área aproximada de 200m2 (17m x 12m) y la altura máxima de la vegetación es de 7.50m. Una descripción detallada de la zona de muestreo y de los bosques aledaños puede encontrarse en Bálint et al. (2003). Se realizaron 92 salidas de campo entre las 9:00 y las 14:00 horas para un total de cinco horas/hombre de recolecta en días con un porcentaje de cobertura de nubes inferior al 40% a lo largo del año 2003. Al no realizar ninguna salida de campo en febrero, este mes no se tuvo en cuenta en los análisis (Tabla 1).
Puesto que los licénidos no son atraídos profusamente por trampas cebadas de ningún tipo, se recolectaron todos los individuos con dos redes entomológicas de 5mt de longitud y dos redes de 1.80mt observados perchados en las hojas de los árboles. De la misma forma se efectuaron recolectas esporádicas en el año 2004 para completar la lista de especies. Los especímenes se identificaron con la ayuda de Zsolt Bálint (Museo de Historia Natural, Budapest. Hungría), basados en D´Abrera (1995) y Beccaloni et al. (2003). Se utiliza principalmente el arreglo genérico propuesto por Robbins (2004) aunque en algunos casos se mantienen los géneros propuestos por Kurt Johnson y colaboradores (Johnson 1992; Johnson et al. 1997a; Johnson et al., 1997b; Salazar et al. 1997; Salazar y Johnson 1997). Las fotografías fueron tomadas con una cámara digital Nikon Coolpix 4500 y modificadas en Adobe Photoshop7.0 para mostrar las dos caras de cada espécimen en una misma imagen.
Análisis de la riqueza
Se realizaron curvas de acumulación de especies para determinar la amplitud del muestreo utilizando los estimadores no paramétricos que analizan la riqueza específica, estos fueron: Chao2, el cual requiere solo datos de presencia y ausencia y es el que presenta menor sesgo cuando las muestras son pequeñas (Colwell y Coddington 1994); Jackniffe 1, que al tener en cuenta las especies únicas tiende a reducir el sesgo de los valores estimados; Jackniffe 2, se basa en el número de especies que ocurren solamente en una muestra y en el número de especies que ocurren exactamente en dos muestras, además del método de Booststrap (Colwell y Coddington 1994).
Se realizó un análisis de similitud (Jaccard) entre los meses con el programa BiodiversityPro. Esta información es representada como un “cluster” creado con el método de Ward (1963) en el programa STATISTICA. Se llevó a cabo un análisis de rarefacción para comparar la diversidad de los meses con muestreos desiguales con el programa EcoSim700 (Gotelli y Entsminger 2001). Para facilitar el análisis de los datos se hizo una analogía con los términos de alfa, beta y gama diversidad propuestas por (Schluter y Ricklefs 1993). En el presente trabajo se tratan como diversidades alfat las riquezas puntuales en cada mes, la diversidad betat como el recambio de especies entre los diferentes meses y la diversidad gamat como el total de especies observadas en los 11 meses muestreados. Esta analogía se utiliza como una herramienta metodológica y no refleja el concepto espacial para los que fueron creados los términos alfa (diversidad local), beta (recambio de especies entre localidades) y gama (diversidad regional), por tratarse de un solo punto de muestreo.
Se determinó el grupo de meses que proporciona un mayor número de especies utilizando el algoritmo de complementariedad de especies propuesto por Vane-Wright et al. (1991). La complementariedad se entiende como el conjunto mínimo de tratamientos (meses) que aseguran la inclusión de todas las especies, independientemente de su frecuencia y permite identificar que tratamientos son los que aportan más especies al total. Este método se utiliza generalmente para determinar áreas prioritarias en conservación debido a su particular riqueza específica. En este estudio se utilizó para determinar cuales meses del año pondrían ser más utilizados por las especies para realizar sus actividades de búsqueda de pareja y para centrar el inventario de biodiversidad en meses con alta riqueza específica.
Resultados
En el año 2003 se recolectaron 573 especímenes que representaron 60 especies de Eumaeini distribuidas en 35 géneros (Tablas 1 y 2 ; Figs. 8 y 9). La Table 1 muestra la lista total de especies, incluyendo las encontradas en los muestreos esporádicos del 2004.
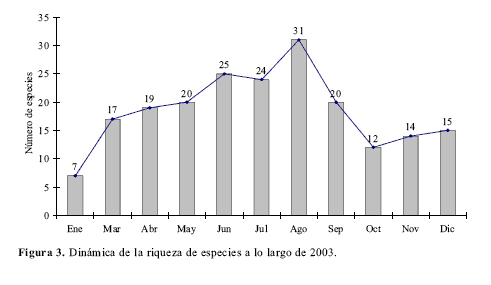
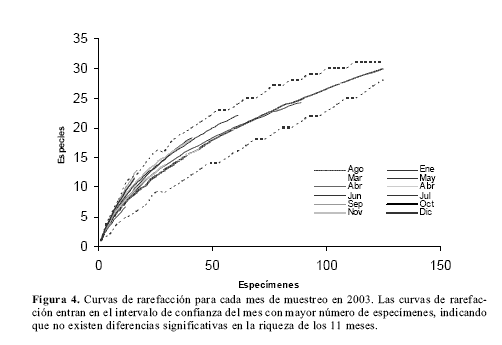
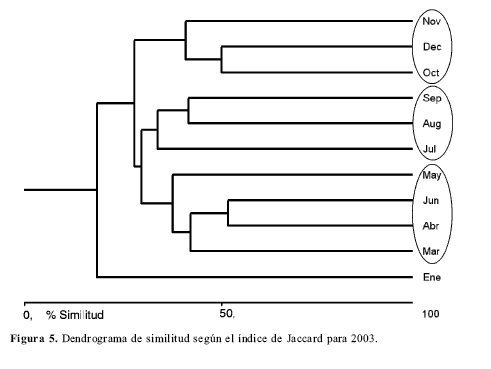
Diversidad alfat: El mayor número de especies se registra en los meses de agosto y junio seguidos de julio, mayo y abril (Tabla1, Fig.3). Sin embargo las curvas de rarefacción indican que la riqueza es muy similar en los 11 meses y que todas las riquezas entran en el intervalo de confianza del mes con mayor número de especimenes (Fig. 4). Los meses con menor riqueza de especies son enero y octubre.Diversidad betat: La diversidad betat se halló utilizando la fórmula B= 1/n promedio de muestras ocupadas por una especie (Schluter y Ricklefs 1993), y mostró un valor de Bt= 0.29. El análisis de similitud de Jaccard (Fig. 5) muestra un porcentaje de similitud en todo caso menor al 56% y tres grupos de meses, relacionados por su composición de especies, que concuerdan con los meses de lluvia, disminución de lluvias y verano en la zona.
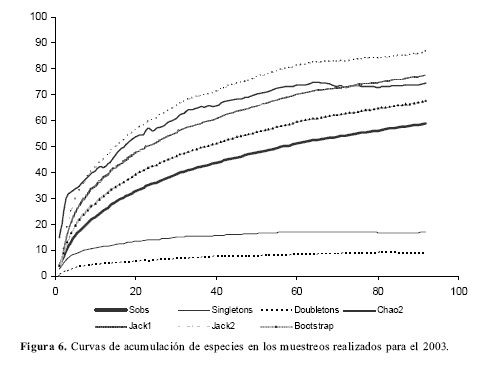
Diversidad gamat: La diversidad gamma se halló como: Υt= α promedio x ßt x Dimensión de la muestra (número de meses en este caso), según Schluter y Ricklefs (1993). La cifra hallada Υt = 59,16 es muy similar al número total de especies observadas durante todo el año S = 60. Los estimadores muestran que se ha recolectado cerca de 88% de las especies que se predicen para la zona. Las curvas de acumulación de especies para el periodo de recolecta durante todo el año se muestran en la figura 6.
El algoritmo de complementariedad de especies muestra que los cuatro meses que más especies aportan son agosto, abril, julio y mayo (Tabla 3).
Discusión
Las curvas de acumulación de especies indican que para el año 2003 se habían recolectado entre el 77% y el 88% de las especies en la zona, es decir 60 de las 77 que predice Jackniffe2 o 60 de las 68 que predice Bootstrap. Los muestreos realizados en 2004 añadieron 12 especies más al inventario para un total de 72 especies. Lo que demuestra la increíble riqueza de Eumaeini que puede reunir una cima de montaña en zonas tropicales. Aunque la riqueza de Eumaeini en San Antonio es alta, es muy probable que cerros a altitudes similares y con bosques bien preservados, presenten riquezas similares. Especialmente “El Faro” (muestreado intensamente por el segundo autor) y el cerro “Brisas”, ambos en la cordillera Occidental en el municipio de Cali, han mostrado riquezas de más de 90 y 40 especies de Eumaeini respectivamente.
Además la coexistencia y utilización de este recurso (la cima), en un área tan pequeña para el encuentro de parejas sexuales por un gran número de especies, puede ser reforzada por segregaciones espacio-temporales; especialmente a una distribución vertical y horizontal de las mariposas perchadas sobre la vegetación (Prieto en prep.).
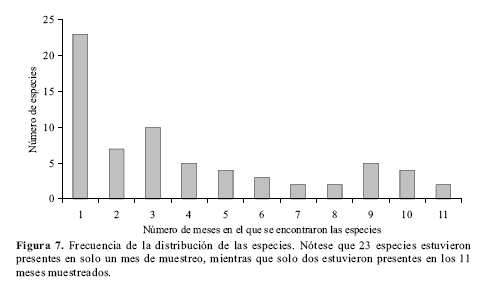
La gran cantidad de especies que se recolectaron en un solo mes del año (Fig. 7) puede ser debida, en gran medida, a la visita esporádica y aleatoria de individuos únicos que no presentan el comportamiento de “hilltopping” o que no poseen poblaciones estables y abundantes en los bosques de San Antonio. Establecer un periodo fijo de estudio para determinar la diversidad es muy importante en una zona como ésta, porque un periodo indeterminado podría ampliar la diversidad a escala regional, máxime cuando a solo 10 kilómetros de San Antonio existe el Parque Natural Farallones de Cali, con más de 150000 hectáreas de bosque en muy buen estado. Un periodo de un año es suficiente para acercarse a la diversidad de especies que utilizan la cima o que vuelan en los bosques aledaños.
Existe una gran dificultad en deducir la preferencia por un recurso (la cima de montaña) del uso de un recurso (Singer et al. 1989; Singer y Thomas 1992). Una gran cantidad de especies pueden utilizar el recurso sin preferirlo por varias razones como depredación, densidad poblacional o por simple casualidad. Cualquier factor puede estar afectando la distribución espacial de los individuos y puede, de esta manera, afectar el uso de los recursos independientemente de la preferencia (Singer y Thomas 1992). Por esta razón es muy posible que no todas las especies que se encuentren regular o esporádicamente en las cimas presenten el comportamiento de “Hilltopping” como fue descrito por Shield (1967) “un fenómeno en el cual los machos y hembras instintivamente buscan una cumbre geográfica para el encuentro”. La fauna de Eumaeini que utiliza la cima del cerro San Antonio y mantiene poblaciones estables en sus bosques oscila entre 20 y 30 especies. Estas especies particularmente presentan comportamientos territoriales tenaces a la vez que se posan o patrullan constantemente en un área pequeña sobre la cima, además su presencia es mensual y constante.
Es muy probable que durante los meses más calurosos y soleados de junio a septiembre aparezcan esporádicamente algunos individuos de especies que son abundantes en cerros de zonas más bajas (muestreados intensivamente por los autores en la actualidad) como Brangas coccineifrons, Atlides polybe y Ocaria aholiba. Las especies Atlides browni, Atlides dahnersi, Aveexcrenota anna, Aubergina hesychia, Brangas caranus, Cyanophrys pseudolongula, Brevianta tolmides, Erora n. sp, Lamprospilus nicetus, Theritas paupera, Ministrymon azia, y Rhamma bilix, entre otras tienen una distribución a lo largo de todo el año, presentan poblaciones abundantes y comportamientos territoriales y de oteo por lo que utilizan el cerro de manera regular como lugar de encuentro de pareja. Especies como Ocaria aholiba, Brangas coccineifrons, Brevianta undulata, Marachina maraches, Hypostrymon asa, Panthiades paphlagon, Strymon bubastus, Timaeta eronos, Timaeta trochus, estuvieron representadas por un solo individuo lo cual indica que son especies regularmente ajenas a la cima o que no hacen “Hilltopping”.
Entre junio y agosto se presenta una riqueza superior mientras que enero y octubre muestran las riquezas más bajas (Fig. 3). Sin embargo las curvas de rarefacción indican que no existirían diferencias en las riquezas de los 11 meses si se hubiese muestreado con la misma intensidad. Estas diferencias en la riqueza pueden deberse a factores en el muestreo como un mayor número de especimenes recolectados y a la gran cantidad de muestreos que coinciden con la disminución de lluvias en la zona, lo que proporcionó más y mejores días de colecta en los meses de junio, julio y agosto. De esta manera, aunque podría existir una fluctuación mensual en la riqueza sobre la cima, debido a factores biológicos, asumimos que la dinámica observada (Fig. 3) se debe principalmente a las condiciones del clima; especialmente a la gran cantidad de horas de sol durante los días de julio y agosto que determina la afluencia de individuos en este lugar. En cerros de naturaleza rocosa como el estudiado por Salazar (1996) los veranos intensos y los meses secos pueden disminuir la diversidad de especies que visitan la cima, sin embargo en montañas con abundante cobertura vegetal como San Antonio, la diversidad aumenta a medida que el verano transcurre.
El dendrograma de similitud (Fig. 5) permite diferenciar tres grupos, de acuerdo a la composición de especies, que concuerdan con las épocas de lluvias (octubre a diciembre), disminución de lluvias (marzo a junio) y verano (julio a septiembre). Puesto que la temperatura corporal en mariposas de pequeño tamaño puede cambiar drásticamente entre 30 a 60 segundos después de un cambio en la temperatura ambiental (Kingsolver 1985) la incapacidad para volar por causa del clima puede ser un importante componente de la mortalidad y la fecundidad de los individuos. Por esta razón el clima está estrechamente relacionado con la dinámica de las poblaciones de mariposas (Dempster 1983; Kingsolver 1985). De esta manera algunas especies pueden tener mecanismos de termorregulación más efectivos que otras y ser más frecuentes en épocas lluviosas y nubladas (Prieto en revisión). Además la disminución del tamaño poblacional, debido a factores climáticos, afecta la probabilidad de encontrar individuos de determinada especie en un muestreo y esto se traduce en diferencias en la composición de la comunidad a través del tiempo. Al utilizar el algoritmo de complementariedad de Vane- Wright et al. (1991), se aprecia que los meses que mayor número de especies aportan al muestreo son agosto, abril, julio y mayo. Estos cuatro meses de nuevo concuerdan con las épocas de verano y poca pluviosidad en la zona de estudio. Los meses más lluviosos como octubre, noviembre y diciembre aportaron solo una especie al inventario (Tabla 3).
Los factores temporales son importantes componentes de la diversidad biológica, desafortunadamente sus efectos sobre la diversidad en comunidades de mariposas tropicales se han tratado directamente muy pocas veces (DeVries et al. 1999). Por esta razón el índice de diversidad betat utilizado en este estudio (B = 0.29) y deducido de la fórmula de Schluter y Ricklefs (1993) para análisis de diversidad en la dimensión espacial puede ser de mucha utilidad para comparar la dinámica de riquezas a través del tiempo en diferentes sitios de muestreo. De esta manera se obtienen cifras precisas de recambio de especies en dimensiones temporales que luego pueden ser comparadas con las cifras de otras localidades. De la misma manera pueden ser tratadas las diversidades alfa y gama en la dimensión temporal.
Implicaciones para la conservación
En Colombia más del 85% del área en bosques premontanos y montanos ha sido modificada con alguna extensión, con el resultado de que en muchas regiones los remanentes de vegetación natural están aislados en parches que quedan situados hacia las cumbres de los cerros afectados (Orejuela 1985; Kattan et al. 1984; Kattan et al. 1994). Este retroceso de la vegetación hacia las partes altas, que generalmente se encuentran menos intervenidas, como es el caso de San Antonio, acentúa la importancia de sitios de encuentro únicos en las cumbres de estos bosques.
Los hábitats de cima de montaña son principalmente deteriorados por la construcción de complejos de transmisión o antenas de comunicación y sus edificios asociados. Esto se traduce en la pérdida de puntos claves para el encuentro de pareja en mariposas y eventualmente puede llevar a la extinción de especies a escala local.
La importancia de estos sitios de encuentro no es proporcional a su tamaño, de modo que un área pequeña puede ser vital para la supervivencia de una o varias especies. Además, los cambios pequeños en el aspecto de un sitio pueden dar lugar a que los machos no lo reconozcan como lugar conveniente (Baugman y Murphy 1988). De esta manera es posible que en ausencia de cimas de montaña adecuadas, algunas mariposas puedan desaparecer de una región. El conocimiento de la distribución, riqueza y abundancia de las comunidades que utilizan las cimas es de vital importancia en el momento de emprender estrategias de conservación en cualquier región. Además, este conocimiento puede ayudar a disminuir el impacto de la construcción de complejos de comunicación dando pautas sobre ubicaciones geográficas con mayor o menor importancia en la conservación de estas comunidades. Figs.8 Figs. 9.
Conclusiones
Aunque existe un mayor número de especies entre junio y agosto, la rarefacción indica que no hay diferencias en la riqueza de los 11 meses muestreados en 2003 y las fluctuaciones son debidas principalmente a un mayor o menor número de horas de sol que permiten una gran afluencia de mariposas en la cima y mejores días de captura.
Existen tres grupos de meses que son muy similares en cuanto a su composición de especies, estos grupos concuerdan con las temporadas de lluvias, disminución de lluvias y verano en la zona respectivamente. Por esta razón la composición de la comunidad a lo largo del año varía principalmente de acuerdo con el régimen de lluvias.
Las curvas de acumulación de especies predicen entre 68 y 77 especies para la zona en los muestreos realizados para el año 2003. A octubre de 2004, 72 especies han sido registradas para la zona. La gran cantidad de taxones con un solo individuo pueden ser especies ocasionales provenientes de otros cerros o que no utilizan la cima regularmente. Por lo menos 20 de las 72 especies se distribuyen durante todo el año, tienen poblaciones constantes en San Antonio y utilizan el cerro como lugar de encuentro de pareja.
Agradecimientos
Los autores expresan sinceros agradecimientos a Zsolt Bálint (Museo de Historia Natural, Budapest, Hungría) por la ayuda en la identificación de especimenes, Julián Salazar (Museo de Historia Natural, Universidad de Caldas, Manizales) y Luís Miguel Constantino (Cali, Colombia) por la corroboración en la identificación de algunas especies, a Gonzalo Halffter (Xalapa, México), Catherine Numa y José Ramón Verdú (CIBIO, Alicante, España) por sus comentarios en el análisis de diversidad. IDEA WILD aportó parte del equipo de campo utilizado en este estudio.
Literatura citada
ACKERY, P. R. 1975. A new Pierine genus and species with notes on the genus Tatochila (Lepidoptera: Pieridae). Bulletin of the Allyn Museum 30: 1-9. [ Links ]
ALCOCK, J. 1987. Leks and hilltopping in insects. Journal of Natural History 21, 319-328. [ Links ]
BÁLINT, Zs.; CONSTANTINO, L. M.; JOHNSON, K. 2003. Atlides dahnersi sp. n. from Colombia, (Lepidoptera: Lycaenidae). Folia Entomologica Hungarica 64: 251-266. [ Links ]
BAUGHMAN, J. F.; MURPHY, D. D. 1988. What constitutes a hill to a hilltopping butterfly? American Midland Naturalist 120: 441 - 443. [ Links ]
BECCALONI, G. W., SCOBLE, M. J., ROBINSON, G. S.; PITKIN, B. (Editores). 2003. The Global Lepidoptera Names Index (LepIndex). World Wide Web electronic publication. http://www.nhm.ac.uk/entomology/lepindex Fecha ultima revisión: 12 Octubre 2004. Fecha ultimo acceso: 16 Noviembre 2004. [ Links ]
CALLAGHAN, C. J. 1983. A study of isolation mechanism among neotropical butterflies of the subfamily Riodininae. Journal of Research on the Lepidoptera. 21 (3): 159-176. [ Links ]
COLWELL, R.; CODDINGTON, J. A. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London. 345:101-118 [ Links ]
D’ABRERA, B. 1995. Butterflies of the neotropical Region. Part VII. Lycaenidae. Victoria, Black Rock, Hill House. 1098-1270 p. [ Links ]
DRAUDT, M. 1919-20. I. Gruppe: Theclini, pp 744-812. In: Seitz, A. (ed.), Die Gross- Schmetterlinge der Erde. Stuttgart, Alfred Kernen 5: 1140 p. [ Links ]
DEMPSTER, J. P. 1983. The natural control of populations of butterflies and moths. Biological Reviews 58: 461-481. [ Links ]
DEVRIES P. J.; WALLA T. R.; GREENEY H. F. 1999. Species diversity in spatial and temporal dimensions of fruit-feeding butterflies from two Ecuadorian rainforests. Biological Journal of the Linnean Society 68: 333-353. [ Links ]
ELIOT, J. N. 1973. The higher classification of the Lycaenidae (Lepidoptera): a tentative arrangement. Bulletin of the British Museum of Natural History (Entomology) 28 (6) : 373-506. [ Links ]
GASTON, K. J. 1996. Biodiversity. Oxford: Blackwell Science. 396 p. [ Links ]
GILBERT, L. E.; SINGER M. C. 1975. Butterfly ecology. Annual Review of Ecology and Systematics 6:365-397. [ Links ]
GILBERT, L. E. 1984. The biology of butterfly communities p.26-40. En R. I. VANE.WRIGHT & P. R. ACKERY. The biology of Butterflies. Academic Press, London. 429 p. [ Links ]
GOTELLI, N. J.; ENTSMINGER, G. L. 2001. EcoSim: Null models software for ecology. Version 7.0. Acquired Intelligence Inc. & Kesey-Bear. http://homepages.together.net/~gentsmin/ecosim.htm. Fecha último acceso: 15 abril 2005. [ Links ]
HEYWOOD, V. H. 1995. Global biodiversity assessment. Cambridge: Cambridge University Press. 1140 p. [ Links ]
HOLDRIDGE, L. R. 1967. Life zone ecology. Tropical Science Center. San Jose, Costa Rica. 215 p. [ Links ]
JOHNSON, K. 1992. Genera and species of the neotropical “Elfin” like Hairstreak Butterflies (Lepidoptera: Lycaenidae, Theclinae) Reports of the Museum of Natural History, University of Winsconsin 22 (1): 135pp., 22(2): 279 p. [ Links ]
JHONSON, K.; KRUSE, J. J.; KROENLEIN, K. R. 1997. The Macusiina, a new infratribe of the Eumaeini with description of ten new genera (Lycaenidae). Revista de Theclinae Colombianos 2 (13): 1-30 p. [ Links ]
JHONSON, K.; SALAZAR, J. A.; VELEZ, J. H. 1997. New species of Micandra Staudinger from colombia whit distinction of Trochusinus, a new genus of the Eumaeini. Revista de Theclinae Colombianos 2 (15): 1-15 p. [ Links ]
KATTAN, G.; RESTREPO, C.; GIRALDO, M. 1984. Estructura de un bosque de niebla en la cordillera occidental, Valle del Cauca, Colombia. Cespedesia 13: 23-43. [ Links ]
KATTAN, G.; ALVARES, H.; GIRALDO, M. 1994. Forest fragmentation and bird extinctions: San Antonio eighty years later. Conservation Biology 8 (1): 138-146. [ Links ]
KINGSOLVER, J. G. 1985. Butterfly thermoregulation: organismic mechanisms and population consequences. Journal of Research on the Lepidoptera 24 (1): 1-20. [ Links ]
OREJUELA, J. E. 1985. Tropical forest birds of Colombia: A survey of problems and a plan for their conservation p 95.115. En A. W. Diamond and T. E. Lovejoy eds. Conservation of tropical forest birds. Paston press, Norwich, Connecticut. [ Links ]
PE’ER, G.; SALTZ, D.; THULKE, H. H.; MOTRO, U. 2004. Response to topography in a hilltopping butterfly and implications for modelling nonrandom dispersal. Animal Behaviour 68, 825–839 [ Links ]
PRIETO, C. 2003. Satirinos (Lepidoptera: Nymphalidae, Satyrinae) del Parque Nacional Natural Munchique. Diversidad de especies y distribución altitudinal. Revista Colombiana de Entomología 29 (2): 203-210. [ Links ]
PRIETO, C. 2006. Diversidad de segregacion de nicho en comunidades del Eumaeini (Lepidoptera: Lycaenidae: Theclinae) del Valle del Cauca. Colombia. Trabajo para obtener el Diploma de Estudios Avazados, Univesidad de Alicante. España. 70 p. [ Links ]
PRIETO, C. (en revisión) Resource utilization, environmental and spatio-temporal overlap of a hilltopping Lycaenid community. A Null model analysis. Ecological Entomology. [ Links ]
ROBBINS, R. K. 2004. Checklist of Eumaeini. 98. Lycaenidae Theclinae, Eumaeini. 118-137pp. Checklist of neotropical lepidoptera. Part 4A. Hesperoidea- Papilionoidea. Gerardo Lamas (editor). In Atlas of Neotropical Lepidoptera. John B. Heppner. (Serie Ed.). Scientific Publishers, Gainesville. 439 p. [ Links ]
SALAZAR, J. A. 1996. Sobre la concentración de lepidópteros ropalóceros en la cumbre de un cerro del noroccidente de Caldas, Colombia. SHILAP 24 (94): 183-195. [ Links ]
SALAZAR, J. A.; JOHNSON, K. 1997. A new genus of Neotropical hairstreaks utilizing bird excrement as their protective color substrate (Eumaeni: Macusiina). Revista de Theclinae Colombianos 2 (14): 1-10. [ Links ]
SALAZAR, J. A.; JOHNSON, K.; CONSTANTINO, L. M. 1997. Additional new species and records of “elfin”- like Eumaeini from Colombia (Lycaenidae). Revista de Theclinae Colombianos 2 (17): 1-13. [ Links ]
SCHLUTER, D.; RICKLEFS, R.E. 1993. Convergence and the regional component of species diversity p 230–240. In: Species diversity: historical and geographical perspectives (ed. by R.E. Ricklefs and D. Schluter), University of Chicago Press, Chicago. [ Links ]
SHAPIRO, A. M.; TORRES, R. 1978. Notas sobre la biología de dos mariposas Pieridae de grandes aturas de Colombia (Lepidoptera: Pieridae). Cespedesia 7 (25-26): 7-23. [ Links ]
SHIELDS, O. 1967. Hilltopping. An ecological study of summit congregation behavior of butterflies on a southern California hill. Journal of Research on the Lepidoptera. 6: 69-178. [ Links ]
SINGER, M. C.; THOMAS, C. D.; PARMESAN C.; BILLINGTON, H. L. 1989. Variation among conspecific insect populations in the mechanistic basis of diet breadth. Animal Behaviour. 37: 751-759. [ Links ]
SINGER, M. C.; THOMAS, D. 1992. The difficulty of deducing behavior from resource use: an example from hilltopping in checkerspot butterflies. American Naturalist 140 (4): 654-664. [ Links ]
VANE-WRIGHT, R. I.; HUMPHRIES, C. J.; WILLIAMS, P. H. 1991. What to protect? Systematics and the agony of choice. Biological Conservation. 55: 235-254. [ Links ]
WARD, J. H. (1963). Hierarchical grouping to optimize an objective function. Journal of the American Statistical Association, 58, 236. [ Links ]
Recibido: 22-sep-05 • Aceptado: 26-may-06