Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.33 no.1 Bogotá Jan./June 2007
Sección Morfología, Comportamiento, Ecología, Evolución y Sistemática
Cambios en edafofauna asociada a descomposición de hojarasca en un bosque nublado
Changes in soil fauna associated with litterfall decomposition in a cloud forest
Amanda Varela1, Camilo Cortés2, Catalina Cotes3
1 Ph.D., Pontificia Universidad Javeriana, Cra. 7 No. 43-82, Edificio 53, Oficina 406B, avarela@javeriana.edu.co
2 B.Sc., Pontificia Universidad Javeriana, Cra. 7 No. 43-82, Edificio 53, Oficina 406B, avarela@javeriana.edu.co
3 Estudiante Biología, Pontificia Universidad Javeriana, Cra. 7 No. 43-82, Edificio 53, Oficina 406B, mcotes@javeriana.edu.co
Resumen. Se estudió la diversidad funcional y el papel de la edafofauna sobre la descomposición de hojarasca en bosque nublado al suroccidente de la Sabana de Bogotá. Se montó un experimento de descomposición, confinando 10 g de hojarasca en bolsas de malla. Se colocaron 24 bolsas en total, la mitad de las cuales contenían naftalina para evitar el ingreso de la edafofauna. A los dos, cuatro y 12 meses se recogieron cuatro bolsas del tratamiento y cuatro del control. Cada bolsa se colocó en un embudo Tullgreen para extraer la edafofauna asociada. Ésta se identificó hasta el menor nivel taxonómico posible y se clasificó en grupos funcionales. Se calculó la riqueza y la diversidad con el índice de Shannon y el de Simpson. La hojarasca se secó y se pesó para determinar el porcentaje de descomposición. En la hojarasca tratamiento se encontró una reducción en la abundancia o ausencia de edafofauna por efecto de la naftalina durante los primeros 60 días, pero no hubo diferencia en el porcentaje de descomposición entre el tratamiento y el control. Hubo una mayor abundancia de detritívoros, seguidos de los transformadores de hojarasca y fitófagos en los tres períodos muestreados. La riqueza de los grupos funcionales, la dominancia y la equidad no fueron distintas entre la hojarasca tratamiento y el control. Esto sugiere que el papel de la edafofauna en la descomposición de hojarasca en este bosque es menos relevante que en bosques de tierras bajas.
Palabras clave. Artrópodos. Diversidad funcional. Función. Proceso ecosistémico. Bosque montano.
Abstract. The functional diversity and role of soil fauna on litterfall decomposition were studied in a cloud forest located southwest of the Sabana de Bogota. A decomposition experiment was set up, confining 10 g of litterfall in mesh bags. A total of 24 bags was set out, half of which contained naphthalene to avoid the entry of soil fauna. At two, four and 12 months, four bags of the treated litterfall and four of the control were collected. Each bag was placed in a Tullgren funnel to extract the associated soil fauna. This was identified to the lowest taxonomic level possible and classified into functional groups. Richness and diversity were calculated using Shannon and Simpson indices. Litterfall was dried and weighed in order to calculate percent decomposition. In the litterfall treatment there was a reduction in the abundance or absence of soil fauna during the first 60 days due to naphthalene, but there was no difference in percent decomposition between the treatment and control. There was a greater abundance of detritivores, followed by litter transformers and phytophages over the three sampling periods. Richness, dominance and equitability of functional groups were not different between the litterfall treatment and the control. This suggests that the role of soil fauna in the decomposition of litterfall is less relevant in this forest than lowland forests.
Key words. Arthropods. Functional diversity. Function. Ecosystem process. Montane forest.
Introducción
En Colombia los bosques altoandinos han sido los más afectados por la fragmentación, definida ésta como un proceso en el que se cambia la configuración del hábitat que lleva a la formación de fragmentos más o menos aislados, como consecuencia de actividades antrópicas que interrumpen la continuidad del hábitat original (Hamilton et al. 1995; Fahrig 2003). A escala mundial, el bosque altoandino es uno de los ecosistemas más amenazados, e incluso en la Cordillera de los Andes se estima que el 90% de los bosques de este tipo ha desaparecido (Hamilton et al. 1995). El bosque altoandino es el ecosistema que forma una franja entre los 2.500 y 3.500 m de altitud en las montañas tropicales, donde mejor se desarrolla el bosque nublado (Cuatrecasas 1958; Carrizoza 1990; Webster 1995).
Este tipo de bosque juega un papel importante dentro del ciclo hidrológico, al capturar agua tanto de la neblina como de la lluvia horizontal, que de otra manera se perdería. Esto hace que este tipo de bosque tenga un alto valor en términos de mantenimiento de agua y protección de las cuencas altas de la Región Andina; papel muy diferente al de otros bosques o de suelos con diferente uso (Cavelier et al. 2001). Por otra parte, los estudios sobre este tipo de bosque se han centrado en aspectos descriptivos y poco se conoce acerca de su funcionamiento como ecosistemas. Uno de los aspectos funcionales es la descomposición de la materia orgánica, proceso vital en los ecosistemas boscosos, ya que determina la biomasa y productividad (Melillo et al. 1982; Liu et al. 2000). La descomposición y el ciclaje de nutrientes están regulados por factores fisicoquímicos ambientales, la calidad del sustrato y la comunidad de organismos descomponedores (Lavelle et al. 1993; Joffre y Ǻgren 2001). Estos organismos están principalmente representados por la microbiota (hongos y bacterias) y la fauna edáfica (artrópodos). Pese a que en los últimos años varios estudios se han enfocado en las relaciones entre la estructura de las comunidades y el funcionamiento de los ecosistemas (Hector et al. 1999; Huston et al. 2000), pocos se han centrado en la estructura de la comunidad de fauna del suelo y el funcionamiento del mismo (Cortet et al. 2003).
La relación entre la diversidad de especies y la función de los ecosistemas es un tópico central en ecología hoy en día (Johnson et al. 1996). Las relaciones establecidas han generado interés y controversia y con pocas excepciones los estudios empíricos se han restringido a los pastizales y sistemas acuáticos de laboratorio (Duffy 2002) y se ha dado poca atención a cómo cambios en la diversidad de la fauna pueden influenciar procesos ecosistémicos. La realización de investigaciones en esta dirección es necesaria para esclarecer en qué medida estos mecanismos se ven afectados por la reducción o pérdida de especies. Aunque las especies son el resultado de la interacción entre el genoma y el ambiente, se reconoce que hay una redundancia entre especies en términos de su contribución a los procesos ecosistémicos (Brussaard 1998). Adicionalmente, los datos disponibles sugieren que no solamente la riqueza de especies sino el mantenimiento de estos procesos y la diversidad funcional son importantes para mantener la integridad de los ecosistemas (Wall 1999). Entre los bienes que la biodiversidad ofrece está el de sostener los ciclos de nutrientes y de energía (Wall et al. 2004). Por este motivo una aproximación es la reunión de dichas especies en grupos funcionales, debido a que el suelo es un hábitat altamente complejo y a la gran riqueza de los taxa que lo habitan (Brussard et al. 1997; Wall y Virginia 1999). Aunque en los ecosistemas terrestres, la diversidad biológica de los suelos se conoce muy poco (Wall y Virginia 2000) se ha establecido que los grupos funcionales de la biota del suelo contribuyen a la regulación de procesos vitales para el funcionamiento de los ecosistemas, tales como la descomposición, el secuestro de carbono y el ciclaje de nutrientes (Groffman y Bohlen 1999; Liiri et al. 2002). Sin embargo, no se conoce en ecosistemas de alta montaña cuál es realmente la importancia y el papel que cumple la fauna edáfica como reguladora del proceso de descomposición, ni tampoco la variedad de grupos taxonómicos que la componen (diversidad). Existe entonces el reto de determinar la importancia de la diversidad biótica de los suelos en relación con el funcionamiento de los ecosistemas, los bienes y servicios ecológicos que presta en estos ecosistemas en particular (Adams y Wall 2000).
Por esto, el presente estudio determinó la importancia de la fauna del suelo sobre la tasa de descomposición de la hojarasca de una especie de planta, y cómo cambia su diversidad al nivel de grupos funcionales, en distintas etapas del proceso en un bosque altoandino. Las hipótesis del estudio fueron: 1) la velocidad de descomposición está determinada por la fauna presente en el suelo, 2) la fauna del suelo acelera la descomposición de la hojarasca durante la primera etapa del proceso, y, 3) la diversidad de los grupos funcionales es mayor al principio de la descomposición. De esta manera se realiza una aproximación al funcionamiento de los bosques altoandinos, contribuyendo así a apoyar esfuerzos para su conservación, y a esclarecer la relación entre la diversidad a nivel funcional y el funcionamiento ecosistémico, que probablemente no se puede generalizar para todos los ecosistemas. Vale la pena mencionar que este estudio se encuentra enmarcado dentro del Global Litter International Decomposition Experiment Project, una investigación comparada a nivel mundial que se realizó con el objetivo de definir el papel funcional de la fauna edáfica dentro del proceso de descomposición en distintos ecosistemas.
Materiales y Métodos
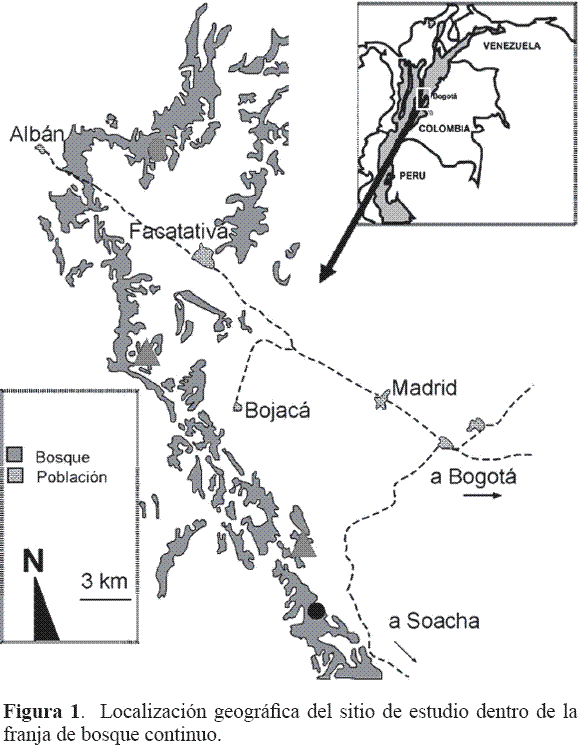
Se seleccionó un área de bosque nublado altoandino en la vertiente occidental de la Cordillera Oriental, conocida como falla de Bogotá, localizada al occidente de la Sabana de Bogotá (Fig. 1). Es una franja entre 2.600 y 2.800 msnm y comprende bosque continuo de más o menos 80 km de longitud. La escogencia se realizó con base en estudios previos en el área (Caro 2002; Varela 2004) que permitieron conocer algunos aspectos de su diversidad y funcionamiento. En general, el área de estudio se caracteriza por presentar un clima frío semihúmedo, con temperatura anual que varía entre 6-15°C, humedad relativa promedio de 90%, precipitación mensual promedio en el rango de los 1.000-2.000 mm, con patrón bimodal, siendo los meses lluviosos abril-mayo y octubrenoviembre (Instituto de Hidrología, Meteorología y Estudios Ambientales 2004). Predominan allí los suelos del orden de los Andisoles e Inceptisoles, de tipo Andic Humitropept y Typic Distrandept (Instituto Geográfico Agustín Codazzi 1985). El bosque es alto semi-abierto con abundancia de epífitas (criptógamas, bromelias y orquídeas) y el sotobosque es medianamente denso; está dominado por Weinmannia L., Chusquea scandens Kunth, Palicourea angustifolia Kunth, Hedyosmum bonplandianum Kunth, Miconia spp., Fucsia boliviana Carr. (Mendoza 1999; Caro 2002).
El área del bosque tiene una inclinación entre 10° y 15°. El estudio se hizo entre diciembre de 2001 y diciembre de 2002, mediante el montaje de un experimento de descomposición, usando el método de confinamiento del material a descomponer en bolsas de malla de fibra de vidrio, de 20x20 cm con un tamaño de poro de 1,5 mm. Cada bolsa contenía 10 g de hojarasca de una gramínea (Agropyron cristatum (L.) Garent.) previamente secados al aire durante una semana y esterilizados con radiación gama durante 1 h, con el fin de eliminar los microorganismos propios del material vegetal. Se utilizó esta especie de planta, como material estándar para poder realizar posteriormente comparaciones con los experimentos de descomposición montados simultáneamente en otros bosques alrededor del mundo.
En el área de estudio se colocaron 24 bolsas, ubicadas mediante la selección al azar de un par de coordenadas, con un mínimo de 100 m de distancia del borde del bosque, 12 bolsas para la hojarasca tratamiento (hojarasca con 10 g de naftalina) y, 12 para control (hojarasca solamente). La naftalina ha sido usada en otros trabajos para disuadir la entrada de artrópodos a las bolsas de descomposición (Seastedt y Crossley 1983; Heneghan et al. 1999b). La distancia entre las bolsas estuvo entre 15 y 20 m. Se recogieron al azar cuatro bolsas del tratamiento y cuatro del control en los períodos definidos previamente: 60, 120 y 365 días después de colocadas. Las bolsas se limpiaron de las partículas de suelo adheridas, raíces y cualquier otro material extraño y se empacaron en bolsas plásticas selladas, para ser llevadas al laboratorio.
El contenido de cada bolsa se colocó en un embudo Tullgreen para extraer la edafofauna asociada (Bater 1996), dejando las muestras durante cinco días. Se determinó la abundancia de la fauna extraída y esta se conservó en alcohol al 95% en recipientes de vidrio. Posteriormente se identificaron al menor nivel taxonómico posible y se clasificaron en los grupos funcionales microdetritívoros, depredadores, transformadores de hojarasca, fitófagos e ingenieros del ecosistema, de acuerdo con Faber (1991), Coleman y Crossley (1996), Lavelle (1997) y Brussaard (1998). La diversidad de los grupos funcionales para cada período de muestreo se calculó con base en la dominancia usando el índice de Simpson y la equidad, utilizando el índice de Shannon. Adicionalmente se determinó la riqueza usando el índice alfa de Fisher (Magurran 2004).
Posteriormente a la extracción, la hojarasca de cada bolsa se secó a 80°C por 48 h y fue pesada para calcular el porcentaje de descomposición por diferencia entre el peso seco inicial y el peso seco final de la hojarasca (Ilangovan y Paliwal 1996). Para el peso inicial y final se utilizó una balanza con 0,0001 g de precisión. La calidad de la hojarasca inicial y final se determinó por la relación C:N. Los análisis se realizaron en el Laboratorio de Suelos del Instituto Geográfico Agustín Codazzi (Bogotá), donde se determinó la cantidad de carbono por espectrofotometría de absorción infrarroja y de nitrógeno mediante espectrofotometría por conductividad térmica (Skoog y West 1983). Se tomaron los datos de precipitación y temperatura ambiental durante el experimento de descomposición registrados en la estación climática Acapulco, la más cercana al área de estudio (Instituto de Hidrología, Meteorología y Estudios Ambientales 2004).
La comparación de los porcentajes de descomposición entre el tratamiento y el control, y entre períodos de muestreo, se realizó mediante un análisis de varianza de doble vía (Sokal y Rohlf 2001) con el programa Statistica 5.5 (Statsoft, Inc. 2000). Las relaciones entre la abundancia de la fauna edáfica y la precipitación y la temperatura ambiental se determinaron con un análisis de correlación por rangos de Spearman (Siegel y Castellan 1995) con el programa Statistica 5.5 (Statsoft Inc. 2000). La diversidad entre las tres etapas de muestreo se comparó con base en la técnica de remuestreo de Bootstrap, con el fin de establecer los intervalos de confianza del 95% (Magurran 2004).
Resultados y Discusión
Los registros de las condiciones climáticas durante la época de muestreo mostraron que la temperatura estuvo alrededor de los 13ºC, con pocas variaciones a lo largo del año. La precipitación exhibió dos períodos altos (enero-abril y octubrediciembre) y un período bajo o más seco (mayo-agosto). Este es el comportamiento típico de ambos factores climáticos en la región de estudio.
Se extrajeron 511 artrópodos de los cuales el 61% provinieron de la hojarasca control y el 38% de la hojarasca tratamiento. Los ejemplares fueron identificados hasta el nivel de orden y fueron clasificados en los diferentes grupos funcionales definidos (Tabla 1). El número de individuos extraídos de la hojarasca disminuyó con el tiempo: 225 individuos a los 60 días (225 en el control y 0 en el tratamiento), 179 a los 120 días (110 en el control y 69 en el tratamiento) y 83 a los 365 días (51 en el control y 32 en el tratamiento) (Tabla 1). De acuerdo con Lavelle et al. (1995) los artrópodos del suelo tienden a disminuir en número cuando los suelos son ácidos, como en este caso en donde el pH del suelo es cercano a 5,0 (González et al. 1999), pero su disminución es más marcada debido a la presencia de material vegetal de baja calidad. Esto puede explicar por qué se encontraron pocos individuos de fauna edáfica en los diferentes muestreos. Además es posible considerar que la naftalina colocada en las bolsas tratamiento pudo tener un efecto disuasivo sobre la fauna edáfica también en las bolsas control, debido al fuerte olor que despide. Respecto a estos resultados igualmente hay que tener en cuenta que la naftalina no logró evitar por completo el ingreso de la fauna edáfica a las bolsas, sino sólo al comienzo del experimento. A los 120 y 365 días sólo se logró disuadir su ingreso en un 38%. Esto hace suponer que los resultados no permiten definir con seguridad el efecto de la fauna edáfica en el proceso de descomposición, que se requiere un cambio más frecuente de la naftalina, por ejemplo cada mes, para mantener su efecto y que se tendría una mejor aproximación con un sustrato nativo del bosque.
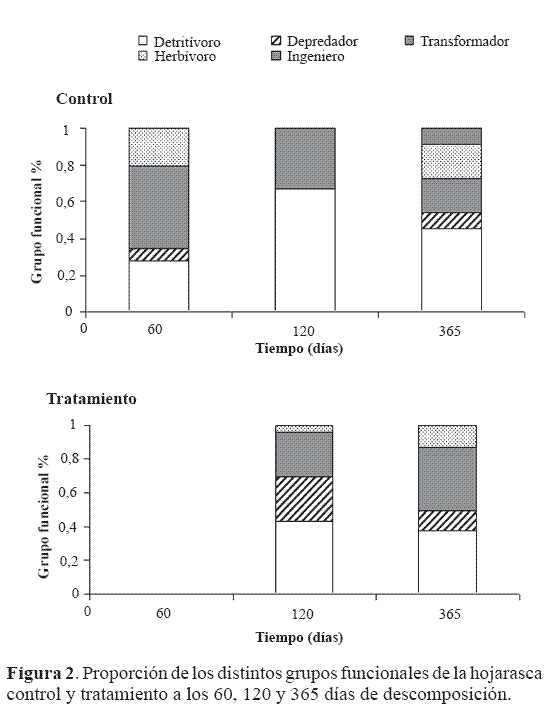
Haciendo ya referencia a la clasificación en grupos funcionales, los grupos con mayor abundancia tanto en la hojarasca control como en la de tratamiento, fueron los detritívoros y los transformadores de hojarasca. Dicho resultado podría variar si se utiliza hojarasca propia del bosque y sería importante evaluarlo posteriormente. Sin embargo, hay que resaltar que este es uno de los pocos trabajos que hay en Colombia con el enfoque de grupos funcionales. Los pocos estudios que han abordado el componente de la edafofauna desde el punto de vista funcional, han mostrado que la mayoría de ésta corresponden a los omnívoros y, en menor medida, a los depredadores y saprófagos (Amat y Soto 1988) o a los fitófagos (Quijano et al. 2000). El grupo de los omnívoros fue el más abundante en la cobertura bajo bosque en el Caquetá, según los autores, debido a que son los que más contribuyen en los procesos de circulación de nutrientes (Quijano et al. 2000) y, de acuerdo con esta descripción, en el presente caso este grupo sería equiparable al de los detritívoros. Esto sugiere que a mayor altitud, la proporción de los diferentes grupos puede cambiar y por tanto también su participación en el proceso de descomposición, entre otros procesos edáficos. Sin embargo hacen falta más estudios a nivel de grupos funcionales, incluso en gradientes altitudinales, para establecer estos cambios, pues en términos globales se sabe que la abundancia de la edafofauna disminuye con la altitud (Leaky y Proctor 1987).
La proporción de cada uno de los grupos cambió con el transcurso de la descomposición tanto para la hojarasca tratamiento como para la de control (Fig. 2). A los 120 días en la hojarasca control se redujo el número de grupos funcionales a dos, los detritívoros y los transformadores de hojarasca, mientras que el máximo de grupos funcionales correspondiente a todos los grupos establecidos para el estudio se encontró al final del experimento. El cambio temporal de la abundancia de artrópodos encontrado no coincide con el planteamiento inicial, según el cual se suponía un mayor número de grupos funcionales al comienzo del proceso de descomposición. Este planteamiento se hizo con base en los patrones de sucesión encontrados en otros estudios (Santos y Whitford 1981; Vreeken-Buijs y Brussaard 1996), en los cambios en la riqueza de especies de artrópodos que suceden con el tiempo (Osler et al. 2004) y en las modificaciones en la calidad del sustrato durante el proceso de descomposición de la hojarasca (Lagerlöf y Andrén 1985; Siepel 1990). La disminución de los grupos funcionales a los 120 días es difícil de explicar a la luz de los resultados encontrados. Podría deberse a características climáticas y edáficas del área de estudio como pH ácido, bajas temperaturas durante el año y alta humedad ambiental, factores que pueden reducir la abundancia, riqueza y actividad de la fauna edáfica en general. De esta manera, sólo cuando la calidad del sustrato mejora por acción de los microorganismos,estos y el sustrato en el que se encuentran ofrecen mejores fuentes de alimento que favorecen la aparición de otros grupos de artrópodos. Sin embargo, también es necesario considerar el efecto que pudo tener la hojarasca no nativa utilizada, por lo cual es necesario realizar experimentos de descomposición con mezclas de esta, con el objeto de establecer con certeza el patrón de cambio temporal en la abundancia de artropofauna encontrada.
La contribución del grupo ingenieros del ecosistema al proceso de descomposición fue baja ya que sólo se encontraron, y en baja cantidad en el último muestreo (Fig. 2). La abundancia de las lombrices dentro de este grupo funcional en particular puede ser baja debido a la altitud del sitio de estudio, como lo sugieren Leaky y Proctor (1987) o podría responder a las características de la hojarasca de la gramínea no nativa usada. Por otra parte, ya que la artropofauna ingresó a las bolsas de descomposición después del segundo muestreo, es posible que mientras más tiempo dure el experimento de descomposición sea necesario adicionar con mayor frecuencia naftalina, para mantener los niveles del compuesto que permiten disuadir a la fauna de ingresar a las bolsas con hojarasca. Sin embargo, en algunos trabajos como el de Heneghan et al. (1999b) se ha sugerido que este método es más eficiente que el uso de malla con un tamaño de poro reducido para impedir la participación de la fauna edáfica en la descomposición. Por tanto, para posteriores evaluaciones se sugiere utilizar una combinación de métodos físicos y químicos de exclusión, sobre todo teniendo en cuenta que en el presente estudio se observaron pequeñas perforaciones en algunas de las bolsas de malla usadas en el experimento.
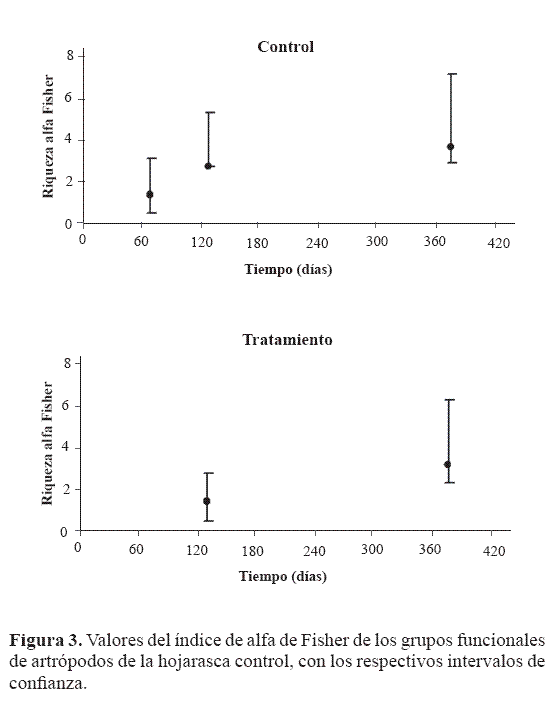
Con base en la comparación de los intervalos de confianza, la riqueza de los grupos funcionales (índice alfa de Fisher), ladominancia y la equidad no fueron distintas entre la hojarasca tratamiento y la control (Fig. 3). Aunque el anterior resultado pudiera ser lógico debido a la ausencia de una exclusión efectiva de los artrópodos del experimento de descomposición, que no permitió establecer una clara diferencia de las abundancias de los artrópodos entre la hojarasca tratamiento y control, el resultado no necesariamente debería ser el mismo para otros atributos como la riqueza y diversidad de los artrópodos. No obstante, como se muestra en la Tabla 1, se encontraron prácticamente los mismos órdenes de artrópodos en los dos tipos de hojarasca, lo que soporta los resultados de diversidad y riqueza. Los resultados sugieren que para este bosque altoandino, con el método usado, la fauna edáfica no juega un papel tan relevante en la determinación del porcentaje de descomposición, como se había supuesto, al menos en la primera etapa del proceso. Esto se basa en que la artropofauna se vio reducida en un 100% a los 60 días de montado el experimento en la hojarasca tratamiento, mientras que el porcentaje de descomposición en este mismo período fue de 46,67 ± 1,17, muy similar a la control (46,45 ± 1,29), etapa en la que se presenta la pérdida de peso más importante del material. Estos resultados no eran los esperados por cuanto se suponía que la fauna edáfica cumple una función importante en procesos que se dan al nivel del suelo, como la descomposición de la material orgánico (Liiri et al. 2002), existiendo evidencia de que en su ausencia la descomposición se ve reducida (Santos y Whitford 1983b). Sin embargo, esta suposición se basa en al generalización de su papel, con base en estudios de ecosistemas de zona templada (Heneghan et al. 1999b) o en ambientes extremos o perturbados (Santos y Whitford 1983b; Blair y Crossley 1988). Hasta hace pocas décadas se comenzaron a explorar otros ecosistemas como los tropicales, pero los estudios se han centrado en ecosistemas de tierras bajas, cercanos al nivel del mar (Heneghan et al. 1999a) o en experimentos de microcosmos (Liiri et al. 2002; Cortet et al. 2003; Heemsbergen et al. 2004). Uno de los primeros planteamientos de que los artópodos y los microorganismos tenían mayores implicaciones en la determinación de las tasas de descomposición de la materia orgánica que los factores climáticos, en los ecosistemas tropicales, fue propuesta por Lavelle et al. (1993). De todos modos, hasta el momento prácticamente no se conocen estudios que hayan tratado de probar este planteamiento. En los ecosistemas de alta montaña el proceso de descomposición es lento y puede no responder como se espera, por las condiciones particulares del suelo (acidez) y de la hojarasca (de baja calidad), baja temperatura constante y humedad alta debida a la presencia casi constante de neblina. En este sentido el porcentaje de descomposición encontrado fue bajo, como se esperaba.
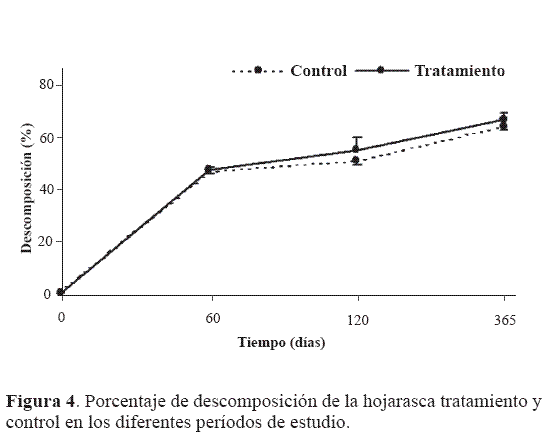
Los porcentajes de descomposición se aprecian en la Figura 4 y no fueron diferentes entre la hojarasca control y la tratamiento respecto a la descomposición, siendo los tres períodos distintos períodos muestreados entre la hojarasca tratamiento y control indicaría un efecto de la fauna edáfica sobre el proceso; pero la 0,27) y por lo tanto no habría una etapa del proceso en el que la fauna tuviera una mayor incidencia en la determinación de la velocidad de descomposición.
En general, el porcentaje de descomposición al final del experimento (365 días) fue alrededor del 60%. Este porcentaje es relativamente alto si se tiene en cuenta que la hojarasca utilizada no es nativa del sitio de estudio y que en un experimento de descomposición en este mismo sitio fue, en promedio, del 55% después de 365 días (Varela 2004). En este último experimento se utilizó una mezcla de hojarasca nativa del bosque y no una gramínea no nativa, lo que puede hacer diferir los porcentajes de descomposición, ya que esta última puede contener una menor concentración de polifenoles y otros compuestos complejos que la hojarasca nativa, las cuales normalmente retardan las tasas de descomposición como lo han mencionado algunos autores (Kuiters 1990). A pesar de esto se utilizó hojarasca no nativa, ya que al ser este un estudio comparativo permite explorar el papel de la edafofauna en el proceso de descomposición, y se plantea la necesidad de realizar un experimento similar con hojarasca nativa.
La relación C:N inicial de la hojarasca fue de 31,70 en promedio, la cual es similar a la de la hojarasca nativa (C:N = 37 en promedio), usada en experimentos de descomposición previos realizados en este mismo sitio (Varela 2004). Esta relación fue un poco más baja que al final del experimento, lo que sugiere la predominancia de procesos de inmovilización sobre los de mineralización por parte de la microbiota edáfica (Swift et al. 1979; Lambers et al. 1998). Dicha predominancia normalmente ocurre cuando la calidad del recurso a descomponer es muy baja para los microorganismos, siendo la calidad inicial más adecuada entre 15 y 25 (Anderson y Swift 1983). De esta manera, un sustrato con bajas cantidades de nitrógeno se descompone lentamente, como se encontró en este estudio, debido en parte a que el nitrógeno es un nutriente clave para el metabolismo microbiano, a menos que haya una adición de nitrógeno que satisfaga las necesidades microbianas de los microorganismos libres y en asociación mutualista con la fauna edáfica.
La calidad del sustrato al final del proceso de descomposición, medida en términos químicos como la relación C:N, fue en promedio 27,6 para la hojarasca control y 24,6 para la hojarasca tratamiento. Aunque esta diferencia a que la hojarasca control sea de mayor calidad, debido a una menor utilización del nitrógeno, lo que podría sugerir una reducción en la actividad microbiana por efecto de la naftalina. No obstante, la ausencia de diferencias en la calidad final de la hojarasca en descomposición está acorde con los resultados encontrados en cuanto a los porcentajes de descomposición de la hojarasca, que tampoco fueron significativamente distintos entre la hojarasca tratamiento y la control e indica que no habría efectos sobre la mineralización del C y N de la hojarasca. Esto también concuerda con resultados experimentales de dos bosques tropicales y uno templado, en los que una reducción de la comunidad de microartrópodos con naftalina no tuvo efectos drásticos en la mineralización del C y N de la hojarasca (Heneghan et al. 1999a).
Los cambios en la temperatura no se relacionaron con la abundancia de los grupos funcionales de fauna edáfica (r2 = primeros fueron poco marcados (estuvieron entre 12,3-12,6°C), mientras que la abundancia varió entre cero y 13 individuos. A pesar de las diferencias en la cantidad de precipitación entre distintas épocas (141 a 401 mm mensuales), ésta tampoco se relacionó con la abundancia de los grupos funcionales de 2 alta humedad prevaleciente durante todo el año por la entrada de agua en forma de neblina en este tipo de bosque. Cambios en la precipitación como los observados, no generan efectos en la abundancia de los artrópodos como sí se ha reflejado en estudios en ecosistemas con periodos estacionales de lluvias muy marcados tales como los bosques secos subtropicales y deciduo tropical (Levings y Windsor 1985; Castellanos et al. 2003) o en bosques templados que involucran muestreos entre estaciones (Santos y Whitford 1981; Santos y Whitford 1983a, b; Cepeda 2006). Adicionalmente, es posible que a otro nivel, las condiciones microclimáticas del suelo y de la hojarasca sí tuvieran alguna relación con la abundancia de la fauna que participa en el proceso.
Los resultados aquí encontrados permiten proponer que en el proceso de descomposición de la hojarasca, en este tipo de ecosistema, la fauna edáfica tiene un papel menos relevante del que se había considerado en principio (Seastedt 1984; Verhoef y Brussard 1990); advirtiendo, eso si, que el uso de hojarasca no nativa pudo reducir la participación de la edafofauna en el proceso. Esto no significa que la edafofauna pueda ser reducida o eliminada sin consecuencias para éste y otros aspectos funcionales del ecosistema, sino que por el contrario, se debe seguir investigando en éste y otros ecosistemas tropicales, particularmente los de montaña, sobre todo con hojarasca propia del bosque. Este trabajo es uno de los primeros para bosques nublados que abordan la diversidad funcional de la fauna edáfica y su relación con procesos ecosistémicos como la descomposición de materia orgánica, por lo cual sirve de base a estudios encaminados a ratificar o refutar los resultados aquí encontrados. Además, el trabajo sirve para definir el papel de la fauna edáfica en diferentes ecosistemas usando gradientes altitudinales. De esta manera, se pueden proponer nuevos enfoques de investigación acerca del papel de los artrópodos en este tipo de procesos ecosistémicos y establecer la importancia de las implicaciones que podría tener la reducción de la diversidad a este nivel en ecosistemas no intervenidos y en los agrosistemas adyacentes, en términos de la regulación de poblaciones de artrópodos y de microorganismos y de los ciclos de nutrientes (particularmente de nitrógeno) en el suelo.
Conclusiones
En este bosque nublado la descomposición, a los 60 días, de la hojarasca utilizada, no se vio afectada como proceso en sí cuando se redujo la participación de la fauna edáfica. Sin embargo, queda por explorar la posibilidad de establecer los efectos de la ausencia de edafofauna en etapas posteriores del proceso, dado que el uso de la naftalina la excluyó por completo sólo en los primeros meses y, el efecto de dicha exclusión sobre la descomposición utilizando hojarasca nativa del bosque no ha sido estudiada. Con respecto a los factores ambientales, la temperatura y precipitación no parecen afectar la abundancia de la fauna edáfica, por lo que sería necesario explorar estas mismas pero a nivel de microclima de la hojarasca y suelo u otras variables como la calidad de la hojarasca.
Asimismo, la diversidad de grupos funcionales de la fauna edáfica que participa en el proceso no cambió sustancialmente a lo largo del proceso de descomposición, posiblemente debido al método usado para la exclusión de la fauna. De esta manera, se aporta evidencia preliminar acerca de la implicación que tiene la diversidad funcional de la fauna edáfica en el proceso de descomposición de hojarasca en el bosque nublado estudiado.
El papel de dicha diversidad sería menor que el propuesto en otros estudios, en el sentido de no encontrarse porcentajes de descomposición significativamente diferentes cuando se excluye del proceso con respecto a cuando no (primera etapa de descomposición). Además, deja entrever una reducción de parte de la macrofauna edáfica (particularmente lombrices) a estas altitudes, por lo cual se plantea el interrogante de cómo es la variación con la altitud, de los diferentes grupos funcionales de fauna edáfica y su relación con ciertos procesos claves en el funcionamiento de los ecosistemas. Por tanto, desde el punto de vista de la funcionalidad de los ecosistemas, es importante seguir explorando los mecanismos que mantienen los distintos procesos y el efecto que la pérdida de diversidad podría tener sobre estos, mediante experimentos controlados y mediante la modelación de dichos procesos usando datos empíricos.
Agradecimientos
Agradecemos a la National Science Foundation por la financiación parcial de este estudio y en particular a Diana Wall por permitirnos participar en el proyecto Global Litter Invertebrate Decomposition Experiment (GLI DE). A la Pontificia Universidad Javeriana y en particular al Laboratorio de Ecología Funcional del Departamento de Biología por el apoyo logístico. Finalmente a los dos revisores, quienes realizaron sugerencias y comentarios que permitieron mejorar el escrito.
Literatura Citada ADAMS, G. A.; WALL , D. 2000. Biodiversity above and below surface of soils and sediments: linkages and implications for global change. BioScience 50 (12): 1043-1048. [ Links ] AMAT, G.; SOTO, L. 1988. Efectos del uso actual del suelo sobre la macrofauna edáfica en la región del Guëjar (Reserva Natural Integral La Macarena, Meta). Pérez-Arbelaezia 2 (6- 7): 44-67. [ Links ] ANDERSON, J. M.; SWIFT, M. J. 1983. Decomposition in tropical forest, pp. 547-569. En: Sutton, S. L.; Whitmore, T. C.; Chadwick, A. C. (eds.). Tropical rain forest: ecology and management. Elsevier. New York, U.S.A. 714 p. [ Links ] BATER, J. E. 1996. Micro- and Macro-arthropods, pp. 163- 174. En: Hall, G. S. (ed.). Methods for the examination of organismal diversity in soils and sediments. Cab International. United Kingdom. 307 p. [ Links ] BLAIR , J. M.; CROSSLEY, D. A., Jr. 1988. Litter decomposition, nitrogen dynamics and litter microarthropods in a southern Appalachian hardwood forest 8 years following clearcutting. Journal of Applied Ecology 25: 683-698. [ Links ] BRUSSAARD, L. 1998. Soil fauna, guilds, functional groups and ecosystem processes. 1998. Applied Soil Ecology 9: 123-135. [ Links ] BRUSSAARD, L.; BEHAN-PELL ETI ER, V. M.; BIGNELL , D. E.; BROWN, V. K.; DIDDEN, W. A. M.; FOLGARAIT , P. I.; FRAGOSO, C.; FRECKMAN, D. W.; GUPTA, V. V. S. R; HATT ORI , T.; HAWKSWORT H, D.; KLOPATEK, C.; LAVELL E, P.; MALL OCH, D.; RUSEK, J.; SÖDERSTR ÖM, B.; TI EDJE, J. M.; VIR GINIA, R. A. 1997. Biodiversity and ecosystem functioning in soil. Ambio 26: 563-570. [ Links ] CARO, O. 2002. Análisis comparativo de la estructura y composición de la vegetación entre áreas de bosque andino fragmentado y no fragmentado en el borde suroccidental de la Sabana de Bogotá (Cundinamarca-Colombia). Trabajo para obtener el título de Ecóloga. Facultad de Estudios Ambientales y Rurales, Pontificia Universidad Javeriana. Bogotá, D. C. 91 p. [ Links ] CARRIZOZA, U. J. 1990. La selva Andina, pp. 151-184. En: Carrizoza, U. J.; Hernández, C. (eds.). Selva y Futuro. El Sello Editores. Bogotá, Colombia. [ Links ] CASTELLANOS, M. L.; PARDO, L. C.; CARABALÍ, A.; DORI A, C. 2003. Algunas características de la macrofauna del suelo en la Serranía de la Macuira, Guajira, Colombia. Suelos Ecuatoriales 33 (2): 157-161. [ Links ] CAVELIER, J.; LI ZCAÍNO, D.; PULI DO, M.T. 2001. Colombia, pp. 443-496. En: Kapelle, M.; Brown, A. D. (eds.). Bosques nublados del Neotrópico. INBio, FUA, NC-UICN, UvA, LI EY. San José. Costa Rica. 698 p. [ Links ] CEPEDA, J. 2006. Distribución altitudinal de microartópodos edáficos, pp. 123-147. En: Cepeda, J. (ed.). Geoecología de los Andes desérticos. La Alta Montaña del Valle del Elqui. Ediciones Universidad de La Serena. Santiago de Chile, Chile. 351 p. [ Links ] COLEMAN, D.; CROSSLEY, D. A., Jr. 1996. Fundamentals of soil ecology. Academic Press. San Diego, U.S.A. 205 p. [ Links ] CORTET, J.; JOFFRE, R.; ELM HOLT , S.; KROGH, H. P. 2003. Increasing species and trophic diversity of mesofauna affects fungal biomass, mesofauna community structure and organic matter decomposition. Biology and Fertility of Soils 37 (5): 302-312. [ Links ] CUATR ECASAS, J. 1958. Aspectos de la vegetación natural de Colombia. Revista de la Academia Colombiana de Ciencias Exactas Fisicoquímicas y Naturales 10 (2): 221-264. [ Links ] DUFFY, J. E. 2002. Biodiversity and ecosystem function: the consumer connection. Oikos 99: 201-219. [ Links ] FABER, J. H. 1991. Functional classification of soil fauna: a new approach. Oikos 62 (1): 110-117. [ Links ] FAHRI G, L. 2003. Effects of habitat fragmentation on biodiversity. Annual Review of Ecology and Systematics 34: 487-515. [ Links ] GONZÁLEZ, X.; GONZÁLEZ, L.; VARELA, A. 1999. Incidencia de la cobertura vegetal sobre poblaciones de bacterias nitrificantes autótrofas en un fragmento de bosque andino. Suelos Ecuatoriales 29 (1): 83-88. [ Links ] GROFFMAN, P. M.; BOHLEN, P. J. 1999. Soil and sediment biodiversity: cross-system comparisons and large-scale effects. BioScience 49: 139-148. [ Links ] HAMILT ON, L. S.; JUVIK, J. O.; SCATENA, F. N. 1995. The Puerto Rico Tropical Cloud Forest Symposium: Introduction and Workshop Synthesis, pp. 1-37. En: Tropical Montane Cloud Forest. Hamilton, L.S., J.O. Juvik; Scatena, F. N. (eds.). Springer-Verlag New York, Inc. HECTOR , A . ;SCHMI D , B . ; BEIERKUHNLEIN, C . ; CALDEIR A , M. C .; DIEMER , M .; DIMITR AKOPOULOS , P. G .; FINN , J. A .; FREIT AS , H .; GIL ER , P. S .; GOOD , J .; HARRI S , R .; HOGBERG , P.; HUSS-DANELL , K . ; JOSHI , J .; JUMPPONEN , A . ; KÖRNER , C .; LEADLEY , P. W .; LOREAU , M .; MI NNS, A .; MULDER, C. P. H .; O'DONNOVAN.; OTWAY , S. J .; PEREIR A , J. S. ; PRI NZ , A .; READ , D. J . ;SCHERER-LORENZEN , M ; SCHULZE , E. D .; SIAMANTZIOURAS , A. S. D .; SPEHN , E. M .; TERR Y , A. C .; TR OUMBIS , A. Y .; WOODWARD , F. I .; YAHCI , S .; LAWTON , J. H . 1999 . Plant diversity and productivity experiments in European grasslands . Science 286 : 1123-1127 . [ Links ] [ Links ] HEEMSBERGEN, D. A.; BERG, M. P.; LOREAU, M.; VAN HAL, J. R.; FABER, J. H.; VERHOEF, H. A. 2004. Biodiversity effects on soil processes explained by interspecific functional diversity. Science 306: 1019-1020. [ Links ] HENEGHAN, L., COLEMAN, D. C., CROSSLEY, D. A.; ZOU, N. 1999a. Nitrogen dynamics in decomposing chesnut oak (Quercus prinus L.) in mesic temperate and tropical forest. Applied Soil Ecology 13: 169-175.
HENEGHAN, L., COLEMAN, D. C., ZOU, X., CROSSLEY, D. A., HAINES, B. L. 1999b. Soil microarthropod contributions to decomposition dynamics: Tropical-temperate comparisons of a single substrate. Ecology 80: 1873-1882. [ Links ]
HUSTON , M. A .; AARSSEN , L. W . ; AUSTI N, M. P . ;CADE, B. S . ; FRI DLEY, J. D. ; GARNIER , E .; GRIM E , J. P . ; HODGSON, J . ; LAUENROTH , W. K .; THOMPSON , K .; VANDEMEER , J. H .; WARDLE , D. A. 2000 . No consistent effect of plant diversity on productivity . Science 289 : 1255. [ Links ] ILANGOVAN, M.; PALI WAL, K. 1996. Changes in mass and nutrient during decomposition of Leucaena leucocephala and Cymbopogon citrates and the effect of substrate quality, weather variables on mass loss during decomposition in a semi-arid ecosystem, Madurai, India. Journal of Tropical Forest Science 8 (3): 317-332. [ Links ] Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM). 2004. Datos de precipitación y temperatura estación Acapulco (No. 2120828). Bogotá, D.C. Colombia. [ Links ] Instituto Geográfico Agustín Codazzi (IGAC). 1985. Estudio general de suelos de los sectores sur y suroeste del Departamento de Cundinamarca. Subdirección Agrológica. Bogotá, D. E. [ Links ] JOFFRE, R.; ǺGREN, G. 2001. From plant to soil: litter production and decomposition, pp. 83-99. En: Roy, J.; Saugier, B.; Mooney, H. A. (eds.). Global terrestrial productivity: past, present , future. Academic Press. San Diego. California. 237 p. [ Links ] JOHNSON, K. H.; VOGT, K. A.; CLARK, H. J.; SCHMIT Z, O. J.; VOGT, D. J. 1996. Biodiversity and the productivity and stability of ecosystems. Trends in Ecology and Evolution 11: 372-377. [ Links ] KUITERS, A. T. 1990. Role of phenolic substances from decomposing forest litter in plant soil interactions. Acta Botany Neerlandica 39: 329-348. [ Links ] LAGERLÖF, J.; ANDRÉ N, O. 1985. Succession and activity of microarthropods and enchytraeids during barley straw decomposition. Pedobiologia 28: 343-357. [ Links ] LAMBERS, H.; CHAPIN II , F. S.; PONS, T. L. 1998. Plant physiological ecology. Second edition. Springer-Verlag. New York, U.S.A. 540 p. [ Links ] LAVELLE, P. 1997. Faunal activities and soil processes: adaptative strategies that determine ecosystem function. Advances in Ecological Research 27: 93-102. [ Links ] LAVELLE, P.; BLANCHART , E.; MARTI N, A.; MARTI N, S. 1993. A hierarchical model for decomposition in terrestrial ecosystems: application to soils of the humid tropics. Biotropica 25 (2): 130-150. [ Links ] LAVELLE, P.; CAHUVEL, A.; FRAGOSO, C. 1995. Faunal activity in acid soils, pp. 201-211. En: Date, R. A.; Grundon, N. J.; Rayment, G. E.; Probert, M. E. (eds.). Plantsoil interactions at low pH: principles and management (developments in plant and soil sciences). Kluwer Academic Publishers. Netherlands. 415 p. [ Links ] LEAKY, R. J. G.; PROCTOR, J. 1987. Invertebrates in the litter and soil at a range of altitudes in Gunung Silam, a small ultrabasic mountain in Sabah. Journal of Tropical Ecology 3: 119-129. [ Links ] LEVINGS, S. C.; WINDSOR, D. M. 1985. Seasonal and annual variation in litter arthorpod populations, pp. 355-387. En: Leigh, E. G.; Rand, A. S.; Windsor, D. M. The Ecology of a Tropical Forest: seasonal rythms and long-term changes. Smithsonian Institution Press. Washington, U.S.A. 432 p. [ Links ] LIRI , M.; SETÄLÄ, H.; PENNANEN, T.; FRIT ZE, H. 2002. Relationship between soil microarthropod species diversity and plant growth does not change when the system is disturbed. Oikos 96: 137-149. [ Links ] LIU, W.; FOX, J.E.; XU, Z. 2000. Leaf litter decomposition of canopy trees, bamboo and moss in a montane moist evergreen broad-leaved forest on Ailao Mountain, Yunnan, south-west China. Ecological Research 15: 435-447. [ Links ] MAGURR AN, A. E. 2004. Measuring biological diversity. Blackwell Publishing. Malden, U.S.A. 256 p. [ Links ] MELILO, J. M., ABER, J. D.; MURATORE, J. F. 1982. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics. Ecology 63: 621-626. [ Links ] MENDOZA, J. E. 1999. Análisis multitemporal (1940-1996) del cambio de la cobertura vegetal en dos áreas del bosque suroccidental de la Sabana de Bogotá, Cundinamarca, Colombia. Trabajo de grado como requisito parcial para optar por el título de Biólogo. Facultad de Ciencias, Pontificia Universidad Javeriana. Bogotá, D.C. 128 p. [ Links ] OSLER, G. H. R.; GAUCE, C. S.; ABBOTT , L. K. 2004. Limited evidence for short-term succession of microarthropods during early phases of surface litter decomposition. Pedobiologia 48: 37-49. [ Links ] QUIJANO, S. A.; ALZATE, C. P.; CIPAGAUTA, M.; GÓMEZ, J. E. 2000. Comparación de la fauna edáfica asociada a diferentes coberturas vegetales en algunos ultisoles del Caquetá, Colombia. Suelos Ecuatoriales 30 (1): 93-98. [ Links ] SANTOS, P. F.; WHIT FORD, W. G. 1981. The effects of microarthropods on litter decomposition in a Chiauhuan desert ecosystem. Ecology 62: 654-663. [ Links ] SANTOS, P. F.; WHIT FORD, W. G. 1983a. Seasonal and spatial variation in the soil microarthropod fauna of the White Sands National Monument. The Southwestern Naturalist 28 (4): 417-421. [ Links ] SANTOS, P. F.; WHIT FORD, W. G. 1983b. The influence of soil biota on decomposition of plant material in a gypsum sand dune habitat. The Southwestern Naturalist 28 (4): 423-427. [ Links ] SEASTEDT, T. R. 1984. The role of microarthropods in decomposition and mineralization processes. Annual Review of Entomology 29: 25-46. [ Links ] SEASTEDT, T. R.; CROSSLEY, D. A., Jr. 1983. Nutrients in forest litter treated with naphthalene and simulated throughfall: a field microcosm study. Soil Biology and Biochemistry 15: 159-165. [ Links ] SIEGEL, S.; CASTELL AN, N. J. 1995. Estadística no paramétrica aplicada a las ciencias de la conducta. Cuarta edición. Editorial Trillas. México, D. F., México. 437 p. [ Links ] SIEPEL, H. 1990. Decomposition of leaves of Avenella flexuosa and microarthropod succession in grazed and ungrazed grasslands. Pedobiologia 34: 19-30. [ Links ] SKOOG, D.A.; WEST, D. M. 1983. Análisis instrumental. Nueva Editorial Interamericana. México, D.F., México. 718 p. [ Links ] SOKAL, R. R., ROHLF, F. J. 2001. Biometry. The principles and practice of statistics in biological research. Third edition, W.H. Freeman and Company. New York, U.S.A. 887 p. [ Links ] STATSOFT, Inc. 2000. STATI STI CA for Windows [computer program manual]. Tulsa, OK: Statsoft, Inc., 2300 East 14th Street, Tulsa, OK 74104. [ Links ] SWIFT, M. J.; MEAL, O. W.; ANDERSON, J. M. 1979. Decomposition in terrestrial ecosystems. Blackwell Scientific Publications. Oxford, U.S.A. 371 p. [ Links ] VARELA, A. 2004. Efecto de la fragmentación sobre la producción y descomposición de hojarasca en bosque altoandino nublado: patrones, mecanismos y modelos. Tesis para optar al título de Doctora en Ciencias Biológicas. Facultad de Ciencias. Pontificia Universidad Javeriana. 330 p. [ Links ] VERHOEF, H. A.; BRUSSARD, L. 1990. Decomposition and nitrogen mineralization in natural and agroecosystems: the contribution of soil animals. Biogeochemistry 11: 175-211. [ Links ] VREEKEN-BRUIJS, M. J.; BRUSSAARD, L. 1996. Soil mesofauna dynamics, wheat residue decomposition and nitrogen mineralization in buried litter bags. Biology and Fertility of Soils 23: 374-381. [ Links ] WALL , D. H. 1999. Biodiversity and ecosystem functioning. BioScience 49: 107-108. [ Links ] WALL , D. H.; VIR GINIA, R. A. 1999. Controls on soil biodiversity: insights from extreme environments. Applied Soil Ecology 13: 137-150. [ Links ] WALL , D. H.; VIR GINIA, R. A. 2000. The world beneath our feet: soil biodiversity and ecosystem functioning, pp. 225- 241. En: Raven, P. R.; Williams T. (eds.). Nature and human society: the quest for a sustainable world. National Academy of Sciences and National Research Council, Washington, D.C., U.S.A. 450 p. [ Links ] WALL , D. H., BARDGETT , R. D., COVICH, A. P., SNELGROVE, P. V. R. 2004. The need for understanding how biodiversity and ecosystem functioning affect ecosystem services in soils and sediments, pp. 1-12. En: Wall, D. H. (ed.). Sustaining biodiversity and ecosystem services in soils and sediments. Island Press. Washington, D.C., U.S.A. 275 p. [ Links ] WEBSTER, G. L. 1995. The panorama of neotropical cloud forests, pp. 53-78. En: Churchill, S. P.; Balslev, H.; Forero, E.; Luteyn, J. L. (eds.). Biodiversity and conservation of neotropical montane forests. The New York Botanical Garden. New York, U.S.A. 702 p. [ Links ] Recibido: 24-ene-2006 - Aceptado: 07-mar-2007