Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.33 no.1 Bogotá Jan./June 2007
Sección Morfología, Comportamiento, Ecología, Evolución y Sistemática
Observaciones sobre los coleópteros saproxilófilos (Insecta: Coleoptera)
en Sotuta, Yucatán, México
Observations on the sapro-xylophagous beetles (Insecta: Coleoptera) in Sotuta, Yucatan, Mexico
Jesús V. Míss D.1,2 y Cuauhtémoc Deloya1
1 A utor para correspondencia. Instituto de Ecología, A. C. Km 2.5 carretera antigua a Coatepec 351, Congregación El Haya, 91070 Xalapa, Veracruz, MÉXICO. cuauhtemoc.deloya@inecol.edu.mx
2 Instituto Tecnológico Agropecuario No. 2 “Ing. José Alberto Navarrete Ruiz”, Apartado Postal 53 “D” Col. Itzimna, CP 97100, Mérida, Yucatán, MÉXICO. Dirección actual: Centro de Investigaciones Regionales “Dr. Hideyo Noguchi”, Universidad Autónoma de Yucatán, Avenida Itzaes 490, CP 97000 Mérida, Yucatán, MEXICO. missdjv@hotmail.com
Resumen. Entre agosto de 2003 y julio de 2004, se recolectaron los coleópteros en vegetación secundaria de ocho a 15 años de recuperación con remanentes de selva mediana subcaducifolia, en el Rancho “X’kitam”, en Sotuta, Yucatán, a 21 m de altitud. Se revisaron 47 troncos y tocones al azar. En 4,2 m3 de madera de 24 troncos revisados se obtuvieron 69 larvas, tres pupas y 65 adultos que representan 137 especimenes incluidos en las familias Cerambycidae, Curculionidae, Tenebrionidae, Melolonthidae, Passalidae, Carabidae y Elateridae. Las familias con mayor abundancia relativa fueron Passalidae (36,49%), Tenebrionidae (21,16%) y Cerambycidae (23,35%). El 71% de las familias se encuentran en el gremio de los degradadores. Se observó que conforme la descomposición avanza se diversifica considerablemente el número de familias en las etapa II y III, decreciendo en la Etapa IV. El 88% de los coleópteros xilófilos prefirieron el hábitat alboduramícola y el 12% el hábitat subcortícola. La presencia o ausencia de larvas, pupas y adultos, no estuvo relacionada con el volumen de cada tronco (r = coleópterofauna saproxilófila de Sotuta, resulta ser más similar a la de Acahuizotla, Guerrero (191 especimenes en 6,5 m3), debido a que el número de ejemplares obtenidos en ambas comunidades representan menos del 10% en comparación con su equivalente del Soconusco.
Palabras clave. Xilofagia. Descomposición troncos. Bosque tropical. Sucesión.
Abstract. From August 2003 to July 2004, beetles were collected from secondary forest aged eight to 15 years with remnants of semideciduous forest in the “X’kitam” Ranch, in Sotuta, Yucatan, at 21 m elevation. Forty-seven trunks and stumps were examined randomly. From 4.2 m3 of wood of the 24 trunks examined, 69 larvae, three pupae and 65 adults were collected, representing 137 specimens belonging to the families Cerambycidae, Curculionidae, Tenebrionidae, Melolonthidae, Passalidae, Carabidae, and Elateridae. The families with the highest abundance were Passalidae (36.49%), Tenebrionidae (21.16%), and Cerambycidae (23.35%). Seventy-one percent of the families belong to the decomposer guild. As decomposition advances the number of families was observed to diversify considerably in stages II and III, and then decreased in stage IV. Eightyeight percent of the xylophagous beetles preferred the sapwood and heartwood habitat, and 12% the subcorticular habitat. 0.01), but rather to the degree of decomposition of the trunk and resource availability. The sapro-xylophagous guild of Sotuta is more similar to that of Acahuizotla, Guerrero (191 specimens in 6.5 m3), given that the number of specimens collected in both communities represents less than 10% in comparison with the equivalent from Soconusco.
Key words. Xylophagy. Semideciduous Tropical forest. Trunk decomposition. Succession.
Introducción
Los ecosistemas tropicales albergan una rica diversidad de especies ecológica y económicamente invaluables (Sánchez y Rebollar 1999), por lo que el estudio de la entomofauna es un aspecto determinante debido al alto grado de deterioro al que están siendo sometidos estos ecosistemas. Los coleópteros y la madera muerta son dos componentes que cumplen funciones vitales en las selvas y bosques, ya que contribuyen al flujo energético a través de las diferentes cadenas tróficas (Camero 1999). De las 166 familias en que se divide el Orden Coleoptera, 90 presentan especies que se encuentran asociadas a la madera muerta, y la mayoría se alimentan o satisfacen su diferentes requerimientos en este sustrato en descomposición (Delgado y Pedraza 2002).
La madera muerta es un término común que se utiliza para referirse a las ramas derribadas, árboles muertos en pie, troncos, tocones y en general a cualquier resto xiloso que se encuentra en todo tipo de selvas. Este recurso se incorpora al ciclo de nutrientes del ecosistema a través del proceso de descomposición, en el cual la materia orgánica es transformada en sus compuestos elementales (Álvarez-Sánchez 2001). Consecuentemente, la madera muerta representa un hábitat que provee refugio, alimento y lugares de cría para una extensa variedad de especies de coleópteros. Por su parte, entre este grupo de insectos, los macro-coleópteros pueden llegar a procesar entre un tercio a una cuarta parte de los troncos podridos donde viven, como sucede con los Passalidae (Castillo y Reyes-Castillo 1997).
El objetivo de este trabajo fue identificar la fauna de macrocoleópteros que se encuentra asociada a las distintas etapas sucesionales de troncos y tocones, en la vegetación secundaria y remanentes de selva mediana subcaducifolia en una localidad del estado de Yucatán, México.
Material y Métodos
El trabajo de campo se realizó en el Rancho “X’kitam” (20º 35’ 45” N y 89º 00’ 22” W) ubicado en la carretera Sotuta- Cantamayec Km 8, aproximadamente a 4 km de distancia de la carretera, en el municipio de Sotuta, Yucatán. Presenta una altitud de 21 m y un clima cálido sub-húmedo, con temperatura media anual de 27,5°C y precipitación anual de 1000,6 mm (INEGI 2000). La vegetación es secundaria, de ocho a 15 años de recuperación, con remanentes de selva mediana subcaducifolia. Las especies características son: Acacia pennatula (Schlech & Benth), Spondias mombin L., Annona reticulata L., Bursera simaruba (L.), Gymnopodium floribundum Rolfe, entre otras (Flores y Espejel 1994). Los suelos presentes en la zona son del tipo cambisol, litosol y parte de rendzina, que en la clasificación maya corresponden al K’ankab, K’ankab akalche’ y tsek’el (op. cit.), respectivamente.
En el periodo agosto 2003-julio 2004, se revisaron 47 troncos y tocones en la selva y franjas de vegetación alrededor de milpas y caminos, escogiendo las áreas de manera no sistematizada, considerando como unidad de muestra una persona/2 horas. Se tomaron datos de la longitud, diámetro, género, especie o nombre común del árbol y número de coleópteros encontrados en sus diferentes estados de desarrollo (Morón y Terrón 1988).
La identificación de los ejemplares se realizó con literatura especializada de Aalbu et al. (2002), Delgado et al. (2000), Morón et al. (1997), Lawrence y Newton (1995), Doyen (1972, 1988, 1989) y Watt (1974). El material colectado fue depositado en la colección entomológica del Instituto de Ecología (IEXA). Se utilizó la clasificación propuesta por Castillo y Reyes- Castillo (2003) para caracterizar las etapas de descomposición del arbolado muerto.
Los estados inmaduros colectados se colocaron en frascos de plástico, adicionándoles parte del sustrato donde fueron encontrados, para llevarlos al laboratorio y seguir su desarrollo en cautiverio. Los adultos colectados se pasaron a la cámara letal con acetato de etilo y se preservaron en alcohol etílico al 70%. Las larvas que murieron o no alcanzaron a desarrollarse hasta el estado adulto se sumergieron en líquido de Pampel durante tres horas y posteriormente se conservaron en alcohol etílico al 70%. En el laboratorio, los estados inmaduros se revisaron y asperjaron semanalmente con agua destilada.
Para determinar el volumen individual de cada tronco o tocón, se utilizó la fórmula para calcular el volumen de un cilindro: Vc = B r2 x h, con r2 = radio al cuadrado, h = altura o longitud del tronco. Los 47 troncos y tocones se revisaron en su totalidad (TT) y solo 24 presentaron coleópteros (TC).
Del total de troncos con algún estado de desarrollo (TT) se analizó la abundancia de las familias colectadas así como porcentaje por cada etapa seral y por el total de troncos revisados (TC) se evaluaron las etapas serales. Para obtener la relación entre el volumen del tronco (alboduramen y corteza) y el número de ejemplares colectados se utilizó el Coeficiente de Correlación de Pearson a través del programa STAT S TM V.2 (Brigthman 2003).
Resultados
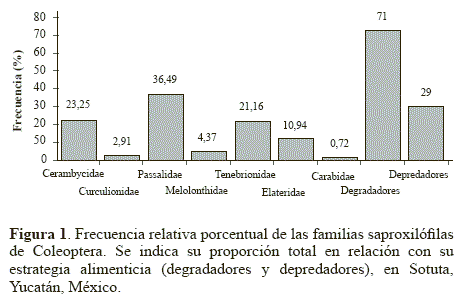
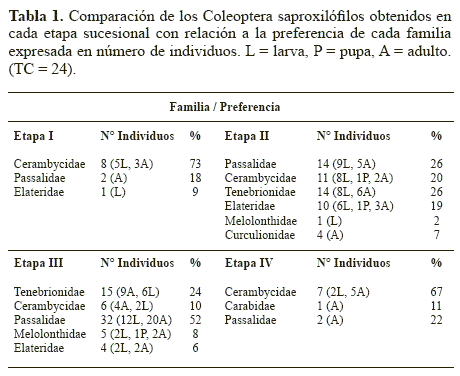
Familias obtenidas. En 4,2 m3 de madera (TC) se obtuvieron 69 larvas, tres pupas y 65 adultos que contabilizan 137 ejemplares incluidos en siete familias de Coleoptera (Fig. 1). Las familias más abundantes fueron Passalidae (36,49%), Tenebrionidae (21,16%) y Cerambycidae (23,35%). Las especies de Passalidae identificadas fueron Passalus (Passalus) interstitialis Eschscholtz, 1829, P. (Passalus) punctiger Lepeletier y Serville, 1825, Odontotaenius striatopunctatus (Percheron, 1835) y Ptichopus angulatus (Percheron, 1835). Algunos géneros y especies identificados para Tenebrionidae fueron Platydema spp., Zophobas spp., Isicerdes spp., Lobopoda spp., Uloma retusa (Fabricius, 1801) y Strongylium impressicolle Maklin, 1864. Del total de familias, el 71% se determinaron dentro del gremio de los degradadores (Fig 1) Relación grupo-sucesión. Las abundancias a nivel familiar con relación al grado de descomposición de la madera son: Etapa I con 13%, II con 37%, III con 31% y IV con 19%. La preferencia por familia en relación a las etapas de descomposición se analizan en el Tabla 1, considerando la abundancia porcentual para cada etapa, se puede observar que conforme la descomposición avanza, el número inicial de familias en la Etapa I (3) se diversifica considerablemente, aumentan las familias en la Etapa II (6) y III (5), decreciendo en la Etapa IV (3). Es importante mencionar que posterior a esto, la microfauna se diversifica y aumenta, como se ha observado en el bosque mesófilo de montaña al centro de Veracruz (Palacios- Vargas y Castillo 1992).
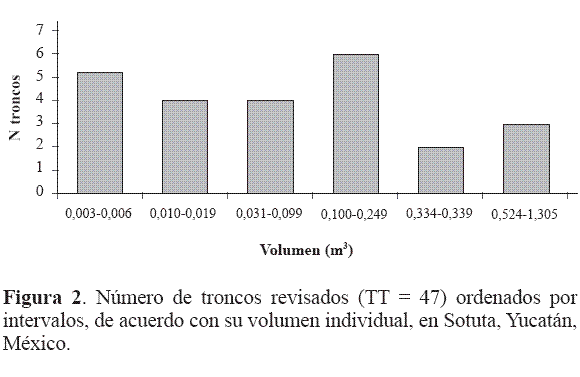
La mayoría de los coleópteros xilófilos presentaron un 88% de preferencia por el hábitat alboduramícola (Melolonthidae, Passalidae, Tenebrionidae, Cerambycidae, Curculionidae), mientras que tan solo un 12% presentó hábitos subcortícolas (Carabidae, Elateridae, Passalidae). Considerando los volúmenes individuales obtenidos de cada tronco (TT = 47), el mayor número de troncos se ubica en el intervalo comprendido entre 0,100-0,249 m3 y en TC = 24 entre los 0,010-0,016 m3 (Fig 2) , (Fig 3). Del total de troncos y tocones revisados (TT), solo un 21% presentó corteza, 52% parte de la corteza y 27% sin corteza. En relación con las etapas sucesionales de descomposición, de los 5,3 m3 de madera revisados (TT) la mayor parte de las muestras vegetales se caracterizaron por presentar las etapas de descomposición II, III y IV, siendo la III la más frecuente (34%) y la etapa I la menos frecuente (6%) Tabla 1. Los resultados sugieren que la presencia o ausencia de larvas, pupas y adultos, no está relacionada con el volumen de cada tronco (r = 0,10981, gl = 20, p < 0,01) sino con la etapa de descomposición en la que se encuentra y con la disponibilidad del recurso. Composición florística. En la Tabla 2 se anotan las familias florísticas encontradas con el número de especies correspondientes. La familia mejor representada fue Leguminosae. Las especies dominantes por su biomasa fueron Bursera simaruba, Acacia pennatula y Cassia racemosa Tabla 2. Todas las especies identificadas fueron angiospermas. Caracterización de la madera. Con base en las propiedades físicas observadas que presentó el arbolado muerto (TC) y la clasificación de Castillo y Reyes-Castillo (2003), se obtienen los siguientes resultados: a) Etapa I: corteza presente, la madera es dura y consistente, presenta cierta humedad, con escasa presencia de epífitas. b) Etapa II: la corteza se desprende con cierta facilidad, la madera conserva su consistencia, no se observa un claro aumento en la cantidad de humedad, las epifitas aumentan considerablemente. c) Etapa III: corteza presente pero adherida ó ausencia de ella, la madera es blanda, se observa un claro aumento en la cantidad de agua, varias comunidades de epifitas se presentan. d) Etapa IV: el tronco generalmente sin corteza, la madera es muy blanda, de consistencia fibrosa o esponjosa y degradada, por lo que es muy fácil de desprender, generalmente se encuentra saturada de agua y con cantidades considerables de humus o detritos, se presenta alguna epífita. Del total de troncos y tocones revisados (TT), solo un 21% presentó corteza, 52% parte de la corteza y 27% sin corteza. En relación con las etapas sucesionales de descomposición, de los 5,3 m3 de madera revisados (TT) la mayor parte de las muestras vegetales se caracterizaron por presentar las etapas de descomposición II, III y IV, siendo la III la más frecuente (34%) y la etapa I la menos frecuente (6%) (Tab 3). Considerando los volúmenes individuales obtenidos de cada tronco (TT), el volumen más frecuente se ubicó en los intervalos 0,010-0,016 m3 (Fig 2) y en TC entre los intervalos 0,100-0,249 m3 (Fig 3). Discusión Considerando que en el Soconusco, Chiapas se obtuvieron 2.551 ejemplares en 22,3 m3 de madera muerta (Morón et al. 1988), 1.678 en Manantlán, Jalisco y 191 ejemplares en Acahuizotla, Guerrero en 6,5 m3 de madera muerta (Delgado- Castillo y Deloya 1990) la abundancia de la coleopterofauna saproxilófila de Sotuta (136 ejemplares en 4,2 m3), resulta ser similar a la de Acahuizotla, debido a que el número de ejemplares obtenidos en ambas comunidades, representan menos del 10% en comparación con su equivalente del Soconusco. Sin duda, considerando el tipo de comunidad vegetal, la altitud, el clima, los suelos, el grado de perturbación del ecosistema, la disponibilidad de troncos en el área, los períodos de sequía, la extracción anual del recurso (repartido en 64 troncos en la milpa, 29 del solar y 30 troncos de la selva) y la pérdida periódica de follaje, son factores que condicionan que la composición de la entomofauna saproxilófila cambie en forma considerable, como sucede en las selvas tropicales caducifolia y subcaducifolia de Acahuizotla y Sotuta. En relación con la perturbación del ecosistema Grove (2002), menciona que la mayoría de las alteraciones que se ocasionan a las selvas tropicales, se reflejan en la disminución o modificación de selvas maduras. Por ejemplo en la actualidad, la mayoría de las selvas en Yucatán han sido sustituidas por paisajes de tipo secundario debido a las actividades agrícolas, forestales y asentamientos humanos principalmente (Mariscal 1999; Sánchez y Rebollar 1999). Por lo tanto, la pérdida de árboles con un diámetro grande puede causar diferencias en la composición de la fauna de escarabajos saproxílicos (Grove 2002), como sucede en las selvas tropicales caducifolia y subcaducifolia de Acahuizotla y Sotuta. A lo anterior hay que agregar que también se observaron en los troncos hormigas (Hymenoptera: Formicidae). Se ha observado que en los bosques tropicales y subtropicales ubicados por debajo de los 1.000 m de altitud existe una fuerte competencia por el sustrato xiloso, por la presencia de numerosas especies de termitas y hormigas, que al parecer llegan a desplazar a los macro coleópteros de las familias Passalidae, Cerambycidae, Melolonthidae y Tenebrionidae (Morón 1985a). Dajoz (1967) y Morón (1985b) mencionan que los principales coleópteros que se presentan en los troncos son los miembros de las familias Cerambycidae, Melolonthidae, Passalidae y Tenebrionidae, cuyas especies pueden ocupar dicho sustrato en distintos estadios de la sucesión y que ocasionalmente se sobreponen en el tiempo, mientras que los depredadores como Elateridae y posiblemente Carabidae invaden la madera en la últimas fases, como se comprobó en Sotuta, tal vez debido a las galerías hechas por las larvas de los coleópteros xilófagos, que permiten el ingreso de estas familias con hábitos depredadores. Ptichopus angulatus es la única especie de Passalidae que no se alimenta de madera y es un habitante estricto de los detritos externos de la hormiga cortadora de hojas Atta mexicana (Fr. Smith), en donde vive y se reproduce (Castillo y Reyes-Castillo 2003). En la parte alta de la Cuenca del Balsas, esta especie presenta sus mayores abundancias en la época de lluvias (Deloya 1988). En el presente estudio el único ejemplar colectado se encontró bajo la corteza de un tronco durante Octubre, cuando la precipitación fue de 125 mm. Por último, considerando las características físicas de la madera muerta (dureza, humedad, corteza) y la preferencia por un hábitat, se puede afirmar que conforme hay un mayor desgaste de la corteza, el tronco se presenta como un hábitat poco accesible o efímero para algunas familias de Coleoptera; por lo tanto las condiciones internas, la pérdida de consistencia de la madera y la disminución de su dureza mantienen un hábitat más estable y durable para cumplir y satisfacer las diferentes necesidades biológicas de la fauna establecida, como ha sido observado en microartrópodos (Palacios-Vargas y Castillo 1992). Agradecimientos Los autores agradecen a Pedro Reyes Castillo la corroboración de los Passalidae, así como sus valiosas sugerencias y comentarios al documento. Literatura Citada AALBU, R. L.; TRIPLEHORN, C. A.; CAMPBELL, J. M.; BROWN, K. W.; SOMERY, R. E.; THOMAS, D. B. 2002. Family 106. Tenebrionidae, pp. 463-509. En: Arnett, Jr., R. H.; Thomas, M. C.; Skelley, P. E.; Frank, J. H. (eds.). American Beetles, Vol. 2: Polyphaga: Scarabaeoidea through Curculionoidea. CRC Press, Boca Raton. 861 p. [ Links ] ÁLVAREZ-SÁNCHEZ, J. 2001. Descomposición y Ciclo de Nutrientes en Ecosistemas Terrestres de México. Acta Zoológica Mexicana. México. Número especial (1): 11-19. [ Links ] BRIGHTMAN, J. F. 2003. STATS TM Versión 2. Decisión Analyst, Inc. Statistics Software. Guía de usuario y aplicación. [ Links ] CAMERO, E. 1999. Estudio Comparativo de la Fauna de Coleópteros (Insecta: Coleoptera) en dos ambientes de Bosque Húmedo Tropical Colombiano. Revista Colombiana de Entomología 25 (3): 131. [ Links ] CASTILLO, M. L.; REYES-CASTILLO, P. 1997. Passalidae, pp. 245-249. En: Gonzáles Soriano, E; Dirzo, R.; Vogt, R. C. (eds.). Historia natural de Los Tuxtlas. UNAM, México. 406 p. [ Links ] CASTILLO, M. L.; REYES-CASTILLO, P. 2003. Los Passalidae: coleópteros tropicales degradadores de troncos de árboles muertos, pp. 237-262. En: Álvarez-Sánchez, J.; Naranjo-García, E. (eds.). Ecología del suelo en la Selva Tropical Húmeda de México. UNAM, México. 302 p. [ Links ] DAJOZ, R. 1967. Ecologie et biologie des coleopteres xylophages de la hetraie. Vie et Milie, 17, series C: 523-763. [ Links ] DELGADO-CASTILLO, L.; DELOYA, C. 1990. Observaciones sobre los macro-coleópteros saproxilófilos de los bosques tropicales subcaducifolios de Acahuizotla, Guerrero, México.Folia Entomológica Mexicana 80: 281-282. [ Links ] DELGADO, L.; PEREZ, A.; BLACKALLER, J. 2000. Claves Genéricas y Supragenéricas de Scarabaeoidea. Folia Entomológica Mexicana. México. 110: 33-87. DELGADO, L.; PEDRAZA, R. A. 2002. La Madera Muerta de los Ecosistemas Forestales. Foresta Veracruzana 4 (2): 59- 66. [ Links ] [ Links ] DELOYA, C. 1988. Coleópteros lamelicornios asociados a depósitos de detritos de Atta mexicana (Smith) (Hymenoptera: Formicidae) en el sur del Estado de Morelos, México. Folia Entomológica Mexicana 75: 77-91. [ Links ] DOYEN, J. T. 1972. Familial and subfamilial classification of the tenebrionoidea (Coleoptera) and a revised generic classification of the Coniontini (Tentyriidae). Quaestions Entomologicae 8: 357-376. [ Links ] DOYEN, J. T. 1988. Tenebrionidae and Zopheridae of the Chamela Biological Station and Vicinity, Jalisco, México (Coleoptera). México. Folia Entomológica Mexicana 77: 212-277. [ Links ] DOYEN, J. T. 1989. reconstitution of Coelometopini, Tenebrionini and related tribes of America North of Colombia (Coleoptera: Tenebrionidae). Journal of the New York Entomological Society 97 (3): 277-304. [ Links ] FLORES, S. J.; ESPEJEL, I. 1994. Tipos de vegetación de la Península de Yucatán. Etnoflora Yucatanense 3: 136. [ Links ] GROVE, S. J. 2002. Saproxilic Insect Ecology and the Sustainable Management of Forests. Annual Review of Ecology and Systematics 33: 1-23. [ Links ] INEGI. 2000. Carta de uso del suelo y vegetación del estado de Yucatán. Esc. 1:250.000. [ Links ] LAWRENCE, J. F.; NEWTON, Jr., A. F. 1995. Families and Subfamilies of Coleoptera (With selected genera, notes, references and data on family-group names). Reprint from Biology, Phylogeny and Classification of Coleoptera, pp. 779-789. En: Pakaluk, J.; Slipinski, S. A. (eds.). Papers Celebrating the 80th Birthday of Roy A. Crowson. Australia. [ Links ] MARISCAL, B. 1999. Adios a la Selva de Yucatan. http://www.quercus.es. Fecha última revisión: 19 septiembre 2003. Fecha último acceso: [20 septiembre 2003]. [ Links ] MORÓN, M. A. 1985a. Observaciones sobre la biología de dos especies de rutelinos saproxilófagos en la Sierra de Hidalgo, México (Coleoptera: Melolonthidae: Rutelinae). Folia Entomológica Mexicana 64: 41-53. [ Links ] MORÓN, M. A. 1985b. Los insectos degradadores, un factor poco estudiado en los bosques de México. Folia Entomológica Mexicana 65: 131-137. [ Links ] MORÓN, M.A.; TERRÓN, R. A. 1988. Entomología Práctica. Instituto de Ecología, A.C. México. 502 p. [ Links ] MORÓN, M. A.; VALENZUELA, J.; TERRÓN, R. 1988. La Macro-coleóptero fauna saproxilófila del Soconusco, Chiapas, México. Folia Entomológica Mexicana 74: 145- 158. [ Links ] MORÓN, M. A.; RAT CLIFFE, B.; DELOYA, C. 1997. Atlas de los escarabajos de México, Coleoptera: Lamellicornia, Vol. I Familia Melolonthidae, pp. 9-28, 53-93, 205-229. CONABIO-SME. México. 280 p. [ Links ] PALACIOS-VARGAS, J. G.; CASTILLO, M. L. 1992. Sucesión ecológica de microartrópodos dentro de troncos en descomposición. Boletín de la Sociedad Mexicana de Entomología 11: 23-30. [ Links ] SÁNCHEZ, R. L.; REBOLLAR, S. 1999. Deforestación en la Península de Yucatán, los retos que enfrentar. Madera y Bosques 5 (2): 4-5. [ Links ] WATT, J. C. 1974. A Revised subfamily classification of Tenebrionidae (Coleoptera). New Zealand Journal of Zoology 1 (4): 381-452. [ Links ] Recibido: 10-feb-2006 - Aceptado: 17-abr-2007