Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.33 no.2 Bogotá June/Dec. 2007
Sección Agrícola
Efecto de un bioplaguicida sobre algunos parámetros poblacionales del depredador Delphastus pusillus (Coleoptera: Coccinellidae)
Effect of a biopesticide on some population parameters of the predator Delphastus pusillus (Coleoptera: Coccinellidae)
RICARDO PÉREZ1 , JAVIER GARCÍA-GONZÁLEZ2 , ALBA MARINA COTES3
1 Biólogo, Universidad Nacional de Colombia. ricardo_perez_alvarez@yahoo.com
2 Autor para correspondencia: M. Sc. Entomología. Investigador Master Asistente, Área de Entomología, Programa de Investigación en Manejo Integrado de Plagas MIP. C. I., Tibaitatá. Corpoica. javiggonzalez@yahoo.com
3 Ph. D. Investigador principal. Laboratorio de Control biológico. C. I., Tibaitatá. Corpoica. acotes@corpoica.org.co
Resumen: En el diseño de programas de manejo integrado de plagas, un aspecto importante es determinar la compatibilidad entre los diferentes agentes de control, por ejemplo entre los hongos entomopatógenos y los insectos benéficos que se utilicen para el control de un mismo insecto plaga. Por tal motivo, el objetivo del presente trabajo fue determinar el efecto de un bioplaguicida con base en el hongo Lecanicillium lecanii, entomopatógeno de la mosca blanca Trialeurodes vaporariorum, sobre algunos parámetros de la población del depredador Delphastus pusillus. Mediante ensayos en laboratorio, se evaluó el efecto de la aplicación directa del bioplaguicida en la supervivencia del estado adulto del depredador. En un segundo experimento, se construyó la tabla del vida del depredador para dos tratamientos: 1. Control, una cohorte de individuos alimentados con presas sanas 2. Seguimiento de una cohorte alimentada con presas donde previamente se aplicó el bioplaguicida. En la prueba de aplicación directa, se determinó que el bioplaguicida a la concentración recomendada para el control de moscas blanca, ocasionó una mortalidad del 9,8% sobre los depredadores. En el experimento de la tabla de vida, los resultados mostraron que la cohorte de D. pusillus tratada con el bioplaguicida presentó una reducción significativa en la longevidad (49,0%) y en la fecundidad (91,4%), con respecto al control. Los resultados obtenidos sugieren que la aplicación del bioplaguicida podría tener un efecto moderado a través de su acción directa y efectos indirectos negativos de importancia sobre las poblaciones de D. pusillus.
Palabras clave: Compatibilidad. Entomopatógeno. Lecanicillium lecanii. Tabla de vida. Trialeurodes vaporariorum.
Abstract: In the design of pest management programs, an important aspect is to determine the compatibility between different control agents, for instance, between entomopathogenic fungi and the beneficial insects used for control of the same insect pest. Therefore the aim of this study was to establish the effect of a biopesticide based on the fungus Lecanicillium lecanii, an entomopathogen of the whitefly Trialeurodes vaporariorum, on some population parameters of the predator Delphastus pusillus. Through laboratory assays, we evaluated the effect of direct application of the biopesticide on survival of the adult stage of the predator. In a second experiment, life tables were constructed for the predator under two treatments: 1.Control, cohort of individuals fed healthy prey. 2. Cohort fed prey previously exposed to the biopesticide. In the direct application assay, it was determined that the biopesticide at the concentration recommended for whitefly control caused a mortality of 9.8% on the predators. In the life table experiment, results showed that the cohort of D. pusillus treated with the bioinsecticide had a significant reduction in longevity (49.0%) and fecundity (91.4%), with respect to the control. The results obtained suggest that application of the biopesticide could have moderate direct effects and important indirect effects on populations of D. pusillus.
Key words: Compatibility. Entomopathogen. Lecanicillium lecanii. Life table. Trialeurodes vaporariorum.
Introducción
La mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood, 1856) (Hemiptera: Aleyrodidae), es una plaga de importancia económica debido a su amplia distribución geográfica, al daño que ocasiona y al gran número de cultivos que afecta. En Colombia, cultivos como el tomate, habichuela, fríjol y flores son gravemente afectados por esta plaga, fundamentalmente debido al daño mecánico y a la excreción de melazas (Byrne et al. 1990; Rodríguez et al. 1996).
Durante años, se ha empleado una amplia variedad de insecticidas para el control de T. vaporariorum, muchos de los cuales producen una marcada influencia negativa sobre los organismos benéficos que coexisten con la plaga. La gran capacidad para desarrollar resistencia a los plaguicidas empleados para su control, así como problemas de contaminación ambiental, de seguridad y salud pública inherentes al uso inadecuado e indiscriminado de los agroquímicos, han conducido a la búsqueda y desarrollo de alternativas para el manejo de la plaga (Rodríguez y Cardona 2001; Torres et al. 2003).
En este contexto, el desarrollo y aplicación de agentes de control biológico, adquiere importancia relevante como alternativa ambiental segura para el manejo de la plaga, ya que son componentes naturales del ambiente y usualmente son más selectivos que los plaguicidas químicos. De los tres principales grupos de enemigos naturales de la mosca blanca, parasitoides, depredadores y hongos entomopatógenos, es en estos últimos donde quizá existen las mejores perspectivas para su uso con éxito en planes de manejo integrado. Esto debido a características específicas y a la tecnología desarrollada en métodos de producción masiva del inóculo, facilidad de la formulación y forma de aplicación similar a la de los insecticidas químicos, lo cual le da ventajas a la adopción por parte de los agricultores (López-Ávila 1994). En consecuencia, el desarrollo de bioplaguicidas con base en hongos entomopatógenos ha tenido una gran aceptación en los últimos años, con lo cual, ha habido un gran auge en su comercialización (Zambrano et al. 2002).
No obstante, la introducción de cualquier organismo en el ambiente es a menudo un paso irreversible por lo que debe hacerse con cautela, para evitar que se convierta en una plaga por sí misma, interfiera con el funcionamiento natural de otros agentes de control de plagas o cause problemas en las especies no blanco, incluyendo al hombre y otros organismos. De ahí que, el uso seguro de los hongos en el control biológico debe ser considerada a todos los niveles, ya sean efectos directos e indirectos (Hajek y Goettel 2000; García et al. 2004).
Por otra parte, ha sido ampliamente reconocido que el empleo de un solo agente de control biológico no puede proveer una regulación suficiente o satisfactoria sobre las poblaciones plaga (Roselyne 2005; Liu y Stansly 1999). Pero cuando dos o más especies con propiedades reconocidas en el control biológico son seleccionadas para interactuar juntas, las deficiencias o limitaciones de las especies individuales podrían ser compensadas por otros miembros del gremio de enemigos naturales.Sin embargo, el desarrollo de una estrategia de control biológico efectiva, en la cual varios agentes sean integrados, requiere de un profundo conocimiento de sus interacciones.
En tal sentido, en el programa de manejo integrado de plagas de Corpoica se desarrolló un bioplaguicida con base en el hongo Lecanicillium (= Verticillium) lecanii (Zimm.) (Zare y Gams 2001), para el control de T. vaporariorum. Dicho producto ha demostrado ser promisorio en la regulación de las poblaciones de mosca blanca, alcanzando niveles superiores al 70% en el control de la plaga (Jiménez 2002).
Así mismo, se han adelantado estudios con el depredador de moscas blancas Delphastus pusillus (Le Conte, 1852) (Coleoptera: Coccinellidae), con miras a su utilización dentro de una estrategia de manejo integrado de la plaga. Este enemigo natural se encuentra distribuido en la mayoría de las regiones agrícolas del país, consumiendo estados inmaduros de la mosca blanca (López-Ávila et al. 2001). Ciertas características de D. pusillus soportan su potencial como agente de control de T. vaporariorum: a) Altas tasas de consumo de presas (García- González 2003; Heinz y Parrella 1994; Hoelmer et al. 1993); b) Hembras altamente fecundas (Heinz et al. 1994; García-González et al. 2005); c) Compatibilidad con parasitoides y cultivares de plantas resistentes (Heinz y Parrela 1994; Heinz y Zalom 1996; Hoelmer et al. 1994) y, d) Alta adaptabilidad ecológica, frecuencia y abundancia en campo (López-Ávila et al. 2001).
A la fecha, se tiene conocimiento de la interacción que hay entre el bioplaguicida y la plaga y además se ha explorado la interacción entre T. vaporariorum y el depredador D. pusillus. Sin embargo, se desconoce la interacción entre el entomopatógeno y el depredador. Por lo tanto, el objetivo del presente trabajo fue evaluar los efectos directos e indirectos producidos por el bioplaguicida sobre los parámetros biológicos y demográficos de D. pusillus. Con este trabajo se intenta generar información que permita conducir a la utilización óptima y eficiente de estos enemigos naturales en el control de T. vaporariorum.
Materiales y Métodos
El trabajo se llevó a cabo en el centro de investigación “Tibaitatá” de la Corporación Colombiana de Investigación Agropecuaria –Corpoica–, localizado en el municipio de Mosquera (Cundinamarca). El mantenimiento de las colonias de los insectos T. vaporariorum y D. pusillus y la fase experimental se realizaron en los laboratorios e invernaderos del Programa de Manejo Integrado de Plagas de dicho centro.
Colonias de insectos. Una colonia de T. vaporariorum se mantuvo en condiciones de invernadero sobre plantas de fríjol (Phaseolus vulgaris L., 1753) variedad ICA- Pijao sembradas en materas. En estas plantas se obtuvieron los diferentes estados de la mosca blanca, los cuales sirvieron de alimento al insecto depredador en el proceso de cría y en los experimentos propuestos.
La colonia de D. pusillus se inició con adultos colectados en cultivos de algodón (Gossypium hirsutum L., 1763) del municipio de Espinal (Tolima). Estos adultos se ubicaron por parejas en cajas de Petri que contenían papel-toalla humedecido y trozos de hojas de fríjol infestadas con estados inmaduros de la mosca blanca. Las hojas se renovaron periódicamente, con el fin de retirar las posibles posturas así como para proporcionarle alimento fresco a las parejas de adultos. Una vez emergidas las larvas del depredador, se separaron y se ubicaron en nuevas cajas de Petri hasta que alcanzaron el estado adulto. Con los adultos se continuó el ciclo de vida del depredador. La cría de D. pusillus se mantuvo a 21 ± 4°C, 50- 70% H. R. y un fotoperíodo de 14:10 h (luz: oscuridad).
Bioplaguicida. La producción del bioplaguicida se realizó en el laboratorio de control biológico de Corpoica según metodología estandarizada por Villamizar y Cotes (2006). El bioplaguicida consiste en un polvo mojable diseñado para reconstituirse en la emulsión resultante de la mezcla de una base autoemulsificable y agua. Dentro del polvo se encuentran los conidios del hongo entomopatógeno, que se aplica para el control de T. vaporariorum a una concentración de 1x107 conidios/ml. Por su parte, la base autoemulsificable contiene una mezcla de aceite vegetal (80%), un agente emulgente (10%) y una mezcla de tensioactivos (10%), todos ellos comúnmente empleados en la industria cosmética y de alimentos. Para garantizar la estabilidad de la emulsión, la base autoemulsificable y el agua se combinan en relación 1:200 (v/v) respectivamente, independiente de la concentración del entomopatógeno. En su composición el bioplaguicida también incluye un protector solar que absorbe la luz UV y adherentes que le proporcionan protección en el momento de su aplicación en campo.
Bioensayos
Efecto del bioplaguicida en la supervivencia de adultos de D. pusillus. Los insectos depredadores provenían de la colonia establecida en laboratorio, donde se seleccionaron individuos activos, sanos y de la misma edad para garantizar la homogeneidad del material biológico. Inicialmente se tomaron foliolos de fríjol que se dispusieron individualmente en cajas de Petri de 10 cm de diámetro y sobre cada uno de éstos se ubicaron diez adultos de D. pusillus. Posteriormente, en cada caja de Petri se realizó la aplicación del bioplaguicida con un microaspersor, a razón de 1 ml de producto por foliolo y a una presión de 4,22 kg/cm2. Una hora después de la aplicación, los insectos se transfirieron a una nueva caja de Petri donde se les suministraron foliolos infestados con ninfas de mosca blanca. Los insectos permanecieron bajo condiciones controladas (20 ± 5°C; 50- 60% H. R., y 12 horas luz) donde se renovó periódicamente el alimento. Durante 12 días se registró diariamente la mortalidad de los insectos y los individuos muertos se ubicaron en cámaras húmedas con el propósito de hacer evidente la posible infección por el entomopatógeno.
Mediante un diseño completamente aleatorio se evaluaron cuatro tratamientos que consistieron en la aplicación del bioplaguicida a las concentraciones de 1x107 y 1x108 conidios/ ml (una y diez veces la concentración aplicada en campo, respectivamente), la aplicación de la base autoemulsificable sin el ingrediente activo y un testigo donde se aplicó agua destilada. Cada tratamiento se realizó por triplicado empleando diez insectos por réplica.
Efecto del bioplaguicida sobre los parámetros biológicos y demográficos de D. pusillus. Se construyeron tablas de vida para dos cohortes del depredador, cada una de ellas de 30 adultos (15 hembras y 15 machos) provenientes de una tercera generación de la colonia establecida en laboratorio. Las parejas de depredadores se ubicaron en cajas de Petri de 10 cm de diámetro, que en su interior contenían una capa de agar-agua al 5% y sobre ella foliolos de fríjol infestados con ninfas de mosca blanca. Los foliolos se renovaron cada tres días con el fin de retirar las nuevas posturas y proporcionarle nuevo alimento al depredador. Cuando se observó la emergencia de las larvas, éstas se ubicaron en nuevas unidades de cría donde se les suministraron presas hasta que completaron su desarrollo. En los casos donde el macho murió antes que la hembra, éste fue sustituido por otro macho.
Se consideraron dos tratamientos: 1. Seguimiento de una cohorte de individuos alimentados con ninfas sanas, empleado como control y 2. Seguimiento de una cohorte alimentada con ninfas a las que previamente (24 h) se les aplicó el bioplaguicida a la concentración de 1x107 conidios/ml.
En cada uno de los tratamientos se realizó el seguimiento periódico de los adultos sometidos a experimentación, al igual que a la cohorte de huevos que resultaron de las posturas de las parejas de depredadores. En cada tratamiento se registraron las siguientes variables: tiempo de preoviposición (intervalo entre la emergencia del adulto y la colocación de la primera postura), período de oviposición (número de días entre la primera y la última postura), longevidad de la hembra y fecundidad. A partir de estos registros se estimaron los parámetros de la población: tasa neta reproductiva (Ro), tasa intrínseca de crecimiento natural (r), tasa finita de crecimiento (ë), tiempo generacional (Tg) y tiempo de duplicación de la población inicial (Dt).
Análisis de la información. En la prueba de aplicación directa, los porcentajes de mortalidad luego de 12 días de evaluación se corrigieron por medio de la fórmula de Abott (Villamizar y Cotes 2003) y los datos generados se sometieron a un análisis de varianza y a la prueba de diferencia mínima significativa (LSD).
En el experimento de la tabla de vida, se realizó la prueba de Shapiro-Wilk para cada una de las variables, con el fin de comprobar la normalidad de los datos. Los promedios de los períodos de preoviposición, oviposición y la longevidad se transformaron con Log10 (x) para posteriormente analizarlos con un análisis de varianza de una vía. Debido a que los datos de fecundidad (huevos/hembra/día y huevos /hembra) no se comportaron como una normal, la comparación se realizó mediante la prueba no paramétrica de Kruskal-Wallis. Estos análisis estadísticos se realizaron empleando el Software SAS versión 8 (SAS Institute 1999). Por su parte, los parámetros Ro, r, λ, Tg y Dt se estimaron siguiendo los procedimientos propuestos por Rossing (2004).
Resultados
Aplicación directa del bioplaguicida sobre adultos de D. pusillus. El análisis de varianza para la variable mortalidad determinó diferencias significativas entre los tratamientos (F = 6,12; g. l. = 3, 8; P = 0,0038). Los resultados mostraron que la aplicación del bioplaguicida a las concentraciones de 1x107 y 1x108 conidios/ml ocasionó mortalidades del 9,8 y del 24,3% respectivamente, que fueron significativamente diferentes a la registrada en el control, el cual mostró una mortalidad del 3,3%. En el tratamiento donde se aplicó la base autoemulsificable sin ingrediente activo se registró una mortalidad del 17,2%, valor que no presentó diferencias significativas con los tratamientos donde se aplicó el bioplaguicida, pero sí con el control (Fig. 1). En todos los casos, los individuos muertos no presentaron signos del entomopatógeno. Al ser ubicados en cámaras húmedas, en los cadáveres de los insectos no se observó desarrollo micelial.
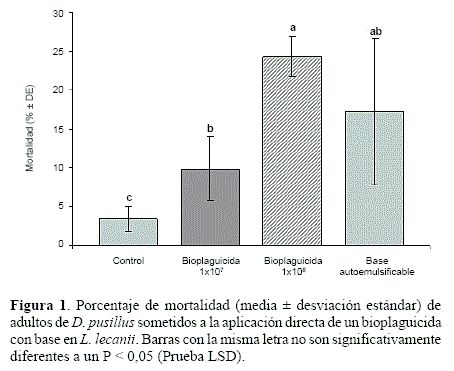
Efecto del bioplaguicida sobre parámetros biológicos de D. pusillus. Los valores de los períodos de preoviposición y oviposición para las hembras de la cohorte control fueron significativamente diferentes a los registrados en la cohorte tratada con el bioplaguicida (preoviposición: F = 22,86; g. l. =1, 15; P = 0,0002; oviposición: F = 13,49; g. l. = 1, 15; P = 0,0023). La cohorte control presentó un período de preoviposición y oviposición de 13,2 ± 5,0 y 55,2 ± 39,4 días respectivamente, mientras que en la cohorte tratada se estimaron valores de 36,7 ± 8,8 y 33,5 ± 13,9 días para los períodos de preoviposición y oviposición respectivamente (Tabla 1).
Del mismo modo, la longevidad de las hembras de D. pusillus en la cohorte control, se registró como significativamente diferente de la longevidad de las hembras de la cohorte tratada con el bioplaguicida (F = 6,13; g. l. = 1, 28; P = 0,0190). Las hembras del tratamiento control presentaron una longevidad promedio de 64,7 ± 44,0 días, frente a un promedio de 33,0 ± 30,5 días para las hembras de la cohorte tratada (Tabla 1).
En lo referente a la supervivencia se encontraron diferencias marcadas entre las cohortes evaluadas. En el tratamiento donde se aplicó el bioplaguicida, se observó una fuerte disminución de la supervivencia durante los primeros 22 días de vida de las hembras, donde la proporción de individuos vivos pasó de 1,0 a 0,22. Después del día 22, la probabilidad de hembras vivas presentó disminuciones progresivas con 0,17 hembras vivas el día 63, 0,11 hembras vivas en el día 95, hasta ser cero el día 98 de vida de las hembras (Fig. 2A).
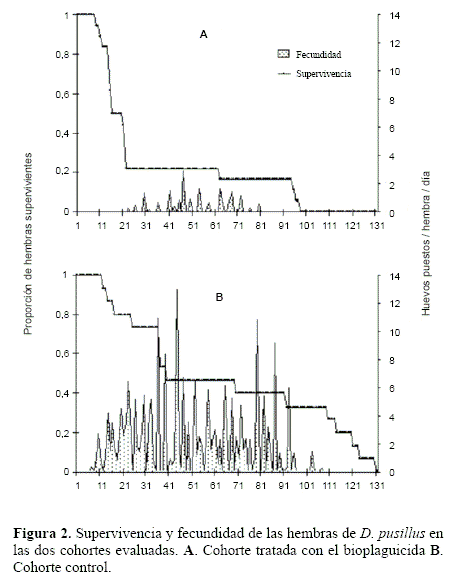
En el tratamiento control, la reducción en la supervivencia fue más moderada en comparación a las hembras de la cohorte tratada. En los primeros 36 días, la probabilidad de vida de la cohorte control se redujo de 1,0 a 0,73. Posteriormente, se observó otra disminución en la supervivencia de la cohorte al pasar a una probabilidad de vida de 0,47 en el día 40 de emergencia de las hembras. A partir de esta fecha, la probabilidad de vida siguió reduciéndose a 0,33 hembras vivas en el día 92, 0,20 hembras vivas en el día 114, hasta el día 131 donde todas las hembras de la cohorte murieron (Fig. 2B).
Con respecto a la fecundidad, la cohorte tratada presentó una producción total de huevos significativamente menor que el control (P = 0,0001), con un promedio de 18,5 ± 38,0 huevos/ hembra, frente a un promedio de 216,2 ± 246,6 huevos/hembra en la cohorte control. De la misma forma, la cantidad de huevos puestos/hembra/día presentó diferencias significativas siendo su valor más alto en el control con respecto al tratamiento bioplaguicida (P = 0,0003). La cohorte tratada presentó un promedio de 0,62 ± 1,4 huevos puestos/hembra/día, mientras que el tratamiento control presentó un promedio de 3,95 ± 2,7 huevos puestos/hembra/día (Tabla 1).
La oviposición hembra/día para la cohorte tratada mostró un pico de oviposición al día 47, con un promedio de 2,9 huevos/hembra/día (Fig. 2A). Para la cohorte control se registraron cuatro picos importantes de oviposición. Los dos primeros se presentaron en los días 36 y 44, con promedios de 10,9 y 12,9 huevos/hembra/día respectivamente. Los otros dos picos se observaron en los días 79 y 87, con promedios de 10,8 y de 9,2 huevos/hembra/día respectivamente (Fig. 2B).
Efecto del bioplaguicida sobre parámetros demográficos de D. pusillus. Los parámetros de la tabla de vida estimados para las dos poblaciones presentaron diferencias para las dos cohortes evaluadas. La tasa de reproducción neta (Ro) para el grupo control se estimó en 13,97 hembras hija/hembra y 3,34 hembras hija/hembra para la cohorte tratada. Estos valores indican que bajo condiciones normales, una hembra de D. pusillus es reemplazada aproximadamente por 14 hembras al cabo de una generación, pero cuando se aplica el bioplaguicida este valor se puede reducir aproximadamente a tres hembras.
De otro lado, la tasa intrínseca de crecimiento natural (rm) para la población control se estimó en 0,0788 hembras/hembra/ día y 0,0261 hembras/hembra/día para la cohorte tratada. Estos valores muestran que las dos poblaciones crecen, aunque la cohorte control lo hace con mayor celeridad. La tasa finita de multiplicación (ë) presentó valores similares en las dos poblaciones. La población control de D. pusillus se incrementó en 1,082 individuos por día, mientras que en la cohorte tratada correspondió a 1,026 individuos por día.
En cuanto al tiempo generacional (Tg) y el tiempo de duplicación (Dt), estos parámetros fueron mayores para la población expuesta a las ninfas infectadas por el bioplaguicida. El tiempo generacional en la cohorte control correspondió a 33,5 días, lo cual determina que desde que un huevo de D. pusillus es puesto, se requiere de 33,5 días para que una hembra proveniente del mismo inicie su reproducción. Este valor es inferior al registrado para la cohorte tratada, donde se estimó un valor de 51,4 días. Por su parte, en el tratamiento control, D. pusillus requirió 8,8 días para duplicar su población, tiempo menor al estimado para el tratamiento donde se aplicó el bioplaguicida, que necesitó de 26,6 días para duplicar su población.
Discusión y Conclusiones
Los resultados indican que la aplicación directa del bioplaguicida sobre el depredador D. pusillus produce un efecto moderado en su supervivencia. Sin embargo, en los insectos muertos no se evidenció la presencia del micelio típico o esporulación de L. lecanii cuando los individuos se ubicaron en cámaras húmedas.
No se puede desconocer que la mortalidad causada por L. lecanii sobre el huésped, lleva un componente bioquímico consistente en las toxinas (Claydon y Grove 1982). Éstas pueden producir la muerte del hospedero sin que se presenten síntomas evidentes de la acción del entomopatógeno (Kershaw et al. 1999). No obstante, la aplicación de toxinas de L. lecanii a la concentración efectiva contra mosca blanca, parecen ser completamente inofensivas para los adultos depredadores del género Delphastus. Así lo sugiere un estudio efectuado por Wang et al. (2005) quienes probaron el efecto de toxinas aisladas de L. lecanii sobre el depredador Delphastus catalinae (Horn, 1895) (Coleoptera: Coccinellidae). Dichos autores encontraron que las toxinas de L. lecanii aplicadas directamente sobre el integumento de los adultos depredadores, no afectan su supervivencia.
Una posible explicación a la mortalidad registrada, es que el efecto adverso sea originado por algunos de los excipientes de la formulación del bioplaguicida. El bioplaguicida está diseñado para reconstituirse en una base autoemulsificable que contiene una mezcla de aceites vegetales. En general, los aceites son preferidos para la formulación de los hongos empleados en el control de insectos (Moore y Caudwell 1997) debido a que facilitan la adhesión y dispersión de los conidios en el área blanco (Inglis et al. 2000; Wraight et al. 2001) mejorando la eficacia y rapidez del producto (Prior et al. 1988; Langewald et al. 1999). En virtud de estas propiedades, los aceites por sí mismos, se han registrado produciendo mortalidad sobre insectos, fundamentalmente a través de una acción física al bloquear el sistema respiratorio (espiráculos) y causando la asfixia de los individuos (Tavainer 2002). De acuerdo con ello, es posible que la aplicación del bioplaguicida genere taponamiento de los espiráculos de los adultos de D. pusillus, lo que se facilita por el tamaño del insecto (< 1,5mm de longitud).
Aunque dentro del análisis planteado se esperaba que la concentración del hongo entomopatógeno no tuviera un efecto en la supervivencia del depredador, se encontró que la aplicación del bioplaguicida a una mayor concentración del hongo (i.e. 1x108 conidios/ml) sí ocasionó una mayor mortalidad. Este resultado no se podría explicar de forma certera, pero se plantea la posibilidad de que otros factores ajenos a la acción del bioplaguicida pudieran afectar al depredador, tales como diferencias en la presión de aplicación o en la densidad de cobertura (gotas / cm2) del bioplaguicida debido a una falla humana, o relacionado con la calibración del equipo empleado en la aplicación. Esto sugiere la necesidad de realizar otras pruebas en laboratorio y campo para evaluar que otros factores pueden aumentar o disminuir la respuesta de los agentes involucrados en este estudio. Sin embargo, cabe resaltar que en todos los casos la muerte de los depredadores se presentó durante las primeras 24 h después de la aplicación y evidenciando una película formada por el bioplaguicida adherida al exoesqueleto de los individuos muertos. Estas observaciones también podrían ser un indicativo de que la muerte del depredador se produjo por una acción física del bioplagicida, ya que se ha observado que L. lecanii requiere de un tiempo de entre tres a siete días para ejercer su acción (Wang et al. 2004).
Estos resultados podrían señalar que la aplicación directa del componente activo del bioplaguicida, es decir del hongo L. lecanii, no produce efectos adversos sobre el depredador. Lo anterior concuerda con estudios realizados por Osborne y Landa (1992), Steimberg y Prag (1994) y Wraight et al. (1998), quienes encontraron que los hongos entomopatógenos Paecilomyces fumosoroseus (Wize) Brown y Smith 1957, Beauveria bassiana (Balsamo) Vuillemin 1912 y Aschersonia aleyrodis Webber 1897, no ocasionaron efectos negativos sobre D. pusillus.
Adicionalmente y en correspondencia con el planteamiento mencionado, Pachón y Cotes (1997) en el estudio realizado para evaluar el efecto de la cepa no formulada del bioplaguicida sobre el parasitoide de moscas blancas Amitus fuscipennis MacGown y Nebeker, 1978 (Hymenoptera: Platygastridae), encontraron que el insecto benéfico no se vio afectado por la acción directa de L. lecanii.
Con respecto a los efectos del bioplaguicida sobre los parámetros biológicos y demográficos del depredador, los resultados de este estudio indican que la aplicación del bioplaguicida reduce la longevidad y el período de oviposición, incrementa el período de preoviposición, reduce drásticamente la fecundidad y en consecuencia afecta la tasa de crecimiento de la población de D. pusillus. Se plantean tres posibles hipótesis para explicar el efecto del bioplaguicida sobre los parámetros biológicos del depredador: (i) infección subletal del depredador a través del consumo de presas infectadas; (ii) disminución de la calidad y cantidad de presas consumidas; y (iii) percepción del depredador por la “calidad” del hábitat, la cual es determinada por la presencia de ninfas sanas.
El consumo de presas infectadas con L. lecanii podría haber ocasionado una infección subletal del depredador. En este sentido, se conoce que los hongos entomopatógenos normalmente invaden al insecto a través de la cutícula y no necesitan ser ingeridos para iniciar el proceso infectivo (Ferron 1978); sin embargo, existe evidencia que algunas especies de hongos entomopatógenos pueden infectar sus hospederos por el tracto alimenticio (Gabriel 1959; Proprawsky et al.1998). Una vez adentro, el hongo entomopatógeno afecta a sus hospederos a través de una combinación de eventos que incluyen daño mecánico por el crecimiento de sus hifas, disminución de nutrientes y producción de toxinas. Alguno de estos procesos a un nivel subletal podría afectar negativamente el sistema reproductivo y supervivencia del hospedero. Así por ejemplo, el período de preoviposición para D. pusillus fue calculado en 13,2 días para la cohorte control. Durante este período, el primer grupo de huevos se está madurando dentro de las ovariolas de la hembra. Una infección fúngica iniciada en este momento y el resultante estrés fisiológico podrían interferir con el desarrollo de los huevos. A este respecto, algunos estudios han registrado hongos entomopatógenos de las especies B. bassiana, Aspergillus ochraceus Wilhelm, 1877 y Metharhizium anisopliae (Metsch.) Sorokin, 1883, como causantes de alteraciones en la fecundidad, y en los períodos de preoviposición y oviposición de sus hospederos (Hornbostel et al. 2004). Del mismo modo, Proprawsky et al. (1998) encontraron que el consumo de moscas blancas infectadas con B. bassiana tuvo un impacto negativo en la supervivencia del coccinélido depredador Serangium parcesetosum Sicard, 1929.
Los parámetros biológicos y demográficos del depredador también podrían ser alterados por la disminución en la cantidad y en la calidad de presas consumidas. El hongo entomopatógeno L. lecanii produce modificaciones físicas y fisiológicas sobre las ninfas de mosca blanca las cuales pueden interferir en el reconocimiento y detección de la presa por parte del depredador. Estudios preliminares mostraron que los adultos de D. pusillus presentaron una reducción en el consumo de presas entre el 38,2 y el 93,2% cuando se le suministraron presas infectadas con L. lecanii, respecto al consumo de presas sanas (R. Pérez, datos no publ.). De esta forma, una disminución en el consumo de presas por las hembras de D. pusillus se podría manifestar en la reducción de la fecundidad, puesto que una hembra grávida debe consumir más presas que ningún otro estado de desarrollo para sostener los niveles de oviposición (Sabelis 1985). Adicionalmente, las presas infectadas pueden ser nutricionalmente deficientes para el depredador o contener ciertos metabolitos secundarios producidos por el patógeno con propiedades tóxicas sobre el insecto benéfico. Así por ejemplo, Wang et al. (2005) demostraron que una concentración de 400 ppm de toxinas aisladas de cepas de L. lecanii redujo significativamente la capacidad de consumo, reproducción y longevidad de adultos de D. catalinae.
En cuanto a la percepción del depredador por la “calidad” del hábitat, García-González y López-Ávila (1998) observaron que la hembra de D. pusillus presenta diversos hábitos de oviposición que dependen de la cantidad y del estado de los individuos de la presa. Este comportamiento está relacionado con la disponibilidad de alimento para las larvas del depredador recién emergidas, las cuales salen en busca de presas. Si en el transcurso de 20 a 30 minutos no encuentran alimento, mueren. De esta forma, la hembra invertirá mayor esfuerzo reproductivo en áreas donde tiene una mayor probabilidad de que su descendencia sobreviva (García-González 2003). Es probable que las hembras de D. pusillus disminuyan la oviposición sobre los foliolos con ninfas infectadas, debido a la ausencia de reconocimiento de éstas como presas, ó al rechazo de las mismas. Evidencias similares son registradas por Meyling y Pell (2006), quienes encontraron que las hembras del depredador Anthocoris nemorum (L., 1761) (Heteroptera: Anthocoridae), diminuyen la oviposición en áreas tratadas con el entomopatógeno B. bassiana.
En función de los resultados, se podría decir que el bioplaguicida es un agente que potencialmente produce efectos perjudícales sobre las poblaciones del depredador. No obstante, en condiciones de campo es de esperarse un menor impacto sobre el benéfico, lo cual puede ser explicado por varias razones. Primero, la mayor movilidad de los adultos del depredador en condiciones de campo podría reducir el riesgo derivado de la exposición directa al bioplaguicida, como ha sido demostrado para otros depredadores (Smith y Krischik 2000). Segundo, D. pusillus se alimenta principalmente del estado de huevo de la mosca blanca, mientras que el bioplaguicida infecta los estados ninfales de la plaga, por lo que se podría plantear liberaciones del insecto y aplicaciones del hongo intercaladas en el tiempo (Fransen 1990; Liu y Stansly 1999; García-González 2003; Hoelmer et al. 1993). Tercero, estudios preliminares demostraron que D. pusillus presenta la habilidad de discriminar entre presas sanas e infectadas con L. lecanii (R. Pérez, datos no publ.), este comportamiento podría permitir la distribución de los coccinélidos en áreas no tratadas del cultivo, donde lograría encontrar mayor cantidad de presas sanas. Finalmente, las moscas blancas típicamente infestan cultivos de rápido crecimiento y prefieren las hojas jóvenes para ovipositar (Lenteren y Noldus 1990). La rápida aparición de nuevo follaje y de presas no tratadas podría facilitar la utilización del bioplaguida junto con D. pusillus, en un programa para el control de la mosca blanca donde se involucren estos dos agentes biológicos.
Agradecimientos
A la Sociedad Colombiana de Entomología (SOCOLEN) por el apoyo otorgado al primer autor como ganador de la “Beca de incentivo a la investigación entomológica en las universidades colombianas”, versión 2005. Este trabajo hace parte de los resultados del proyecto “Incorporación de un Bioplaguicida en el manejo integrado de la mosca blanca” financiado por COLCIENCIAS. Los autores del trabajo agradecen a esta entidad el apoyo financiero. A Jimena Sánchez, profesora de la Universidad Nacional de Colombia, por su invaluable apoyo científico.
Literatura Citada
BYRNE, D. N.; BELLOWS, T. S.; PARRELA, M. P. 1990. Whiteflies in agricultural systems, pp. 227-251. En: Gerling, D. (ed.). Whiteflies: Their bionomics, pest status and Management. Intercept, Ltd., Andover, Hants., UK. 348 p. [ Links ]
CLAYDON, N.; GROVE, J. F. 1982. Insecticidal secondary metabolic products from the entomopatogenous fungus Verticillium lecanii. Journal of Invertebrate Pathology 40: 413-418. [ Links ]
FERRON, P. 1978. Biological control of insect pest by entomopathogenous fungi. Annual Review of Entomology 23: 409-442. [ Links ]
FRANSEN, J. 1990.Natural enemies of Whiteflies: Fungi, p. 187- 211. En: Gerling, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept, Ltd., Andover, Hants., UK. 348 p. [ Links ]
GABRIEL, B. P. 1959. Fungus infection via alimentary tract. Journal of Insect Pathology 1: 319-330. [ Links ]
GARCÍA, L.; GLEIBY, M.; MONTES DE OCA, N.; HIDALGO, L. 2004. Estudio de la irritación ocular y dérmica de Polchonia chlamydosporia var. Catanulata. Revista de Toxicología 12: 103- 107. [ Links ]
GARCÍA-GONZÁLEZ, J. 2003. Estudio de los componentes de depredación para el sistema Delphastus pusillus (Le Conte) (Coleoptera: Coccinellidae) y su presa la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae). Tesis de grado en M. Sc. en entomología Posgrado Ciencias Agrarias. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá. Colombia. 108 p. [ Links ]
GARCÍA-GONZÁLEZ, J.; BENÍTEZ, E. R.; LÓPEZ-ÁVILA, A. 2005. Tabla de vida de Delphastus pusillus (Coleoptera: Coccinellidae) en la mosca blanca Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Revista Colombiana de Entomología 31 (2): 155-160. [ Links ]
GARCÍA-GONZÁLEZ, J.; LÓPEZ-ÁVILA, A. 1998. Biología y hábitos alimenticios de Delphastus pusillus (Coleoptera: Coccinellidae) depredador de moscas blancas. Revista Colombiana de Entomología 24 (3-4): 95-102. [ Links ]
HAJEK, A. E.; GOETTEL, M. S. 2000. Guidelines for evaluating effects of entomopathogens on non-target organisms, p. 847-868. En: Lacey, L. A.; Kaya, H. K. (eds.). Manual of Field Techniques in Insect Pathology. Kluwer Academic Publishers, Dordrecht Netherland. 492 p. [ Links ]
HEINZ, K. M.; PARRELA, M. P. 1994. Biological control of Bemisia argentifolii (Gennadius) (Homoptera: Aleyrodidae) infesting Euphorbia pulcherrima: evaluations of releases of Encarsia luteola (Hymenoptera: Aphelinidae) and Delphastus pusillus (Coleoptera: Coccinellidae). Environmental Entomology 88: 1494-1502. [ Links ]
HEINZ, K. M.; BRAZZLE, J. R.; PICKETT, C. H.; NATWICK, E. T.; NELSON, J. M. ; PARRELA, M. P. 1994. Predatory beetle may suppress silverleaf whitefly. California Agriculture 48 (2): 35-40. [ Links ]
HEINZ, K. M.; ZALOM, F. G. 1996. Performance of the predator Delphastus pusillus on Bemisia resistant and susceptible tomato lines. Entomologia Experimentalis et Applicatta 81: 345-352. [ Links ]
HOELMER, K. A.; OSBORNE, L.; YOKOMI, R. 1993. Reproduction and feeding behavior of Delphastus pusillus (Coleoptera: Coccinellidae), a predator of Bemisia tabaci (Homoptera: Aleyrodidae). Journal of Economic Entomology 86 (2): 322-329. [ Links ]
HOELMER, K. A.; OSBORNE, L. S.; YOKOMI, R. K. 1994. Interactions of the whithefly predator Delphastus pusillus (Coleoptera: Coccinellidae) with parasitized sweetpotato whithefly (Homoptera: Aleyrodidae). Environmental Entomology 23 (1): 136-139. [ Links ]
HORNBOSTEL, V. L.; OSTFELD, R. S.; ZHIOVA, E.; BENJAMIN, M. A. 2004. Sublethal effects of Metarhizium anisopliae (Deuteromycetes) on Engorged larval, Nymphal, and adult Ixodes scapularis (Acari: Ixodidae). Journal of Medical Entomology 41 (5): 922-929. [ Links ]
INGLIS, G. D.; IVIE, T. J.; DUKE, G. M.; GOETTEL, M. S. 2000. Influence of rain and conidial formulation on persistence of Beauveria bassiana on potato leaves and Colorado potato beetle larvae. Biological Control 18: 55-64. [ Links ]
JIMÉNEZ, L. G. 2002. Evaluación de técnicas de aplicación de un bioplaguicida a base de Verticillium lecanii, para el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum en un cultivo de fríjol. Trabajo de grado Ingeniería Agronómica. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá. Colombia. 72 p. [ Links ]
KERSHAW, M. J.; MOORHOUSE, E. R.; BATEMAN, R.; REYNOLDS, S. E.; CHARNLEY, A. K. 1999. The role of dextruxins in the pathogenicity of Metarhizium anisopliae for three species of insects. Journal of Invertebrate Pathology 74: 213-233. [ Links ]
LANGEWALD, J.; OUAMBAMA, Z.; MAMADOU, A.; PEVELING, R.; STOL, I.; BATEMAN, R.; ATTIGNON, S.; BLANDFORD, S.; ARTHURS, S.; LOWER, C.J. 1999. Comparison of an organophosphate insecticide with a mycoinsecticide for the control of Oedaleus senegalensis (Orthoptera: Acrididae) and other sahelian grasshopper at an operational scale. Biocontrol Science and Technology 9 (2): 199- 214. [ Links ]
LENTEREN, J. C.; NOLDUS, P. J. J. 1990. Whitefly-Plant Relationships: Behavioural and Ecological Aspects, pp. 47-88. En: Gerling, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept, Ltd., Andover, Hants., UK. 348 p. [ Links ]
LIU, T.-X.; STANSLY, P. A. 1999. Searching and feeding behaviour of Nephaspis oculatus and Delphastus catalinae (Coleoptera: Coccinellidae), predator of Bemisia argentifolii (Homoptera: Aleyrodidae). Environmental Entomology 28 (5): 901-906. [ Links ]
LÓPEZ-ÁVILA, A. 1994. Avance y perspectivas del control biológico de las moscas blancas. p. 43-53. En: Manejo integrado de mosca blanca y técnicas de aplicación de pesticidas. Socolen, mayo 18. Bogotá. Colombia. 108 p. [ Links ]
LÓPEZ-ÁVILA, A.; CARDONA, C.; GARCÍA, J.; RENDÓN, F.; HERNÁNDEZ, P. 2001. Reconocimiento e identificación de enemigos naturales de moscas blancas (Homoptera: Aleyrodidae) en Colombia y Ecuador. Revista Colombiana de Entomología 27 (3-4): 137-141. [ Links ]
MEYLING, N.; PELL, J. K. 2006. Detection and avoidance of an entomopathogenic fungus by a generalist insect predator. Ecological Entomology 31: 162-171. [ Links ]
MOORE, D.; CAUDWELL, R. W. 1997. Formulations of entomopathogens for the control of grasshoppers and locust. Memoirs of Entomological Society of Canada 171: 49-67. [ Links ]
OSBORNE, L. S.; LANDA, Z. 1992. Biological control of whiteflies with entomopathogenic fungi. Florida Entomologist 75 (4): 456- 471. [ Links ]
PACHÓN, M. P.; COTES, A. M. 1997. Efecto de Verticillium lecanii entomopatógeno de la mosca blanca Trialeurodes vaporariorum sobre la actividad parasítica de Amitus fuscipennis en un cultivo de fríjol. Revista Colombiana de Entomología 23 (3-4): 171-175. [ Links ]
PRIOR, C.; JOLLANDS, P.; Le PATOUREL, G. 1988. Infectivity of oil and water formulations of Beauveria bassiana (Deuteromycotina: Hyphomicetes) to the cocoa weevil pest Pantorhytes (Coleoptera: Curculionidae). Journal of Invertebrate Pathology 52: 66-72. [ Links ]
PROPRAWSKY, T.; LEGASPI, J.C.; PARKER, P. 1998. Influence of entomopathogenic fungi on Serangium parcesetosum (Coleoptera: Coccinellidae), an important predator of whiteflies (Homoptera: Aleyrodidae). Environmental Entomology 27 (3): 785-795. [ Links ]
RODRÍGUEZ, I.; CARDONA, C. 2001. Problemática de Trialeurodes vaporariorum y Bemisia tabaci (Homoptera: Aleyrodidae) como plagas de cultivos semestrales en el valle del cauca. Revista Colombiana de Entomología 27 (1-2): 21-26. [ Links ]
RODRÍGUEZ, A.; HILLER, M.; WILLIAMS, E. 1996. Umbrales de acción para la mosca blanca de los invernaderos, Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae), en tomate. Revista Colombiana de Entomología 22 (1): 87-92. [ Links ]
ROSELYNE, L. 2005. Intraguild interactions of the greenhouse whithefly natural enemies, predator Dicyphus hesperus, pathogen Beauveria bassiana and parasitoid Encarsia formosa. Maîtrise en biologie végétale (M.Sc.). Faculté des sciences DE L' agriculture et DE L' alimentation. Université Laval.Québec. Canada. 99 p. [ Links ]
ROSSING, W. H. A. 2004. IPM Technology: Crop growth and epidemiology, pp. 32-35. En: Memoirs training course "'Integrated pest management and food safety", modulo IPM tools and Implementation. Wageningen. Netherlands. 65 p. [ Links ]
SABELIS, M. W. 1985. Development, pp. 73-82. En: Helle, W.; Sabelis W. (eds.). Spider mites: Their biology, natural enemies and control. Vol. 1B. Elsevier, Amsterdam, Netherlands. 458 p. [ Links ]
SAS INSTITUTE. 1999. SAS Language. Reference. Version 8. Sas Institute. Cary NC. [ Links ]
SMITH, S. F.; KRISCHIK, V. A. 2000. Effects of biorational pesticides on four coccinellid species (Coleoptera: Coccinellidae) having potential as biological control agents in interiorscapes. Journal of Economic Entomology 93 (3): 732-736. [ Links ]
STEIMBERG, S.; PRAG, H. 1994. Efficacy of the fungus Aschersonia aleyrodis and the coccinellid predator Delphastus pusillus, used to control Bemisia tabaci in greenhouse cucumber. Bemisia Newsletter (special issue) 8: 3. [ Links ]
TAVAINER, P. 2002. Drowning or just waving?: A perspective on the ways petroleum-derived oils kill arthropod pest of plants, pp.78-87. En: Beattie, G. A. C.; Watson, P. M.; Stevens, M. L.; RAE, D. J.; Spooner-Hard, R. N. (eds.). Spray oils beyond 2000, 25-29 October 1999. Sydney, NSW, Australia. University of Western Sydney, Australia. [ Links ]
TORRES, J. S.; SILVA-TORRES, C. S. A.; VARGAS, J. 2003. Toxicity of pymetrozine and thiamethoxam to Aphelinus gossypii and Delphastus pusillus. Pesquisa Agropecuária. Brasileira, Brasilia 38 (4): 459-466. [ Links ]
VILLAMIZAR, L. F.; COTES, A. M. 2003. Efecto de las condiciones de cultivo sobre parámetros del modo de acción de Metarhizium anisopliae. Revista Colombiana de Entomología 29 (2): 121-126. [ Links ]
VILLAMIZAR, L. F.; COTES, A. M. 2006. Desarrollo de un bioplaguicida a base de Lecanicillium lecanii para el control de la mosca blanca Trialeurodes vaporariorum, pp. 12-13. En: Díaz, A. (ed.). Resumen de investigaciones en el control biológico de las moscas blancas. Publicación Corpoica-Colciencias. Produmedios. Bogotá D.C. Colombia. 20 p. [ Links ]
WANG, L.; HUANG, J.; YOU, M; LIU, B. 2004. Time-dose mortality modelling and virulence indices for six strains of Verticillium lecanii against sweetpotato whitefly Bemisia tabaci (Gennadius). Journal of Applied Entomology 128 (7): 494-500. [ Links ]
WANG, L.; HUANG, J.; YOU, M.; GUAN, X.; LIU, B. 2005. Effects of toxins from two strains of Verticillium lecanii (Hyphomicetes) on bioattributes of a predatory ladybeetle, Delphastus catalinae (Col.,Coccinellidae). Journal of Applied Entomology 129 (1): 32-38. [ Links ]
WRAIGHT, S. P.; CARRUTHERS, R. I.; BRADLEY, C. A.; JARONSKY, S. T.; LACEY, L. A.; WOOD, P.; GALAINIWRAIGHT, S. 1998. Pathogenicity of the entomopathogenic fungi Paceilomyces spp. and Beauveria bassiana against the silver whitefly Bemisia argentifolii. Journal of Invertebrate Pathology 71: 217-226. [ Links ]
WRAIGHT, S. P.; JACKSON, M. A.; KOCK, S. L. 2001. Production, stabilization and formulation of fungal biocontrol agents, p. 253- 288. En: Butt, T. M.; Jackson, C.; Magan, N. Fungal as biocontrol agents: Progress, problems and potential. CABI publishing. New York. USA. 416 p. [ Links ]
ZAMBRANO, K.; DÁVILA, M.; CASTILLO, M. A. 2002. Detección de fragmentos de ADN de hongos y su posible relación con sistemas de proteínas de actividad entomopatógena. Revista Facultad de Agronomía (Luz) 19: 185-193. [ Links ]
ZARE, R.; GAMS W. 2001. A revision of Verticillium section Prostrata. IV. The genera Lecanicillium and Simplicillium gen. nov. Nova Hedwigia 73: 1-50. [ Links ]
Recibido: 15-jun-2006 - Aceptado: 7-sep-2007














