Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.33 n.2 Bogotá jun./dez. 2007
Sección Agrícola
Determinación de las principales plagas de la espinaca (Spinacia oleracea) en Cota, Colombia
Determination of the major spinach (Spinacia oleracea) pests in Cota, Colombia
RODRIGO GIL C.1, DANIEL CARRILLO Q.2, JAIME JIMÉNEZ G.1
1 Autor para correspondencia: Universidad de Bogotá Jorge Tadeo Lozano. Centro de Investigaciones y Asesorías Agroindustriales, Carretera Central de Norte 3 km adelante del puente de La Caro, Chía, Colombia. rodrigo.gil@utadeo.edu.co
2 Universidad de la Florida. Tropical Research and Education Center. 18905 S.W 280th Street. Homested, FL 33031. U.S.A. dancar@ufl.edu
Resumen: En el municipio de Cota (Cundinamarca) se siembran en promedio 90 ha de espinaca al año. Actualmente no existe información sobre los artrópodos plaga que atacan este cultivo. Sin embargo, los productores aplican frecuentemente insecticidas para su control entre los cuales se destacan: organofosforados, piretroides, carbamatos, organosulfurados y extractos vegetales. En el presente trabajo se identificaron los principales artrópodos plaga y se describe su daño en el cultivo de la espinaca en Cota. Se determinó la distribución espacial de algunos artrópodos y se propone un tamaño de muestra basado en las observaciones realizadas. Los principales artrópodos encontrados en cultivos de espinaca son: Tyrophagus putrescentiae (Schrank) (Acari: Acaridae), Delia sp. (Diptera: Anthomyiidae), Myzus persicae (Sulzer) (Hemiptera: Aphididae), Clavipalpus ursinus (Blanchard) (Coleoptera: Melolonthidae), trips (Thysanoptera: Tripidae) y trozadores (Lepidoptera: Noctuidae). Dentro de este grupo los principales daños estuvieron relacionados con la presencia del ácaro T. putrescentiae y larvas de Delia sp. El principal daño observado fue la deformación de las hojas; se encontró una alta correlación (r = 0,80) entre el síntoma y la presencia de colonias de T. putrescentiae. Las larvas de Delia sp., barrenan las raíces de la espinaca durante el establecimiento de la planta y se alimentan de las hojas tiernas del cogollo durante el desarrollo de follaje. T. putrescentiae y Delia sp. se distribuyen de forma agregada.
Palabras clave: Delia sp. Clavipalpus ursinus. Ley de poder de Taylor. Myzus persicae. Tyrophagus putrescentiae. Hortalizas. Insectos plaga.
Abstract: In the municipality of Cota (Cundinamarca) an average of 90 ha of spinach is planted annually. There is currently no information on the arthropod pests that attack this crop. Growers, however, frequently apply insecticides for their control, including: organophosphates, pyrethroids, carbamates, organosulfides and plant extracts. In this study, the major arthropod pests were identified and the damage caused to spinach was described in Cota. The spatial distribution of some arthropods was determined and a sampling size is proposed based on the observations made. The major arthropod pests found in spinach crops were: Tyrophagus putrescentiae (Schrank) (Acari: Acaridae), Delia sp. (Diptera: Anthomyiidae), Myzus persicae (Sulzer) (Hemiptera: Aphididae), Clavipalpus ursinus (Blanchard) (Coleoptera: Melolonthidae), thrips (Thysanoptera: Thripidae) and cutworms (Lepidoptera: Noctuidae). Within this group the major damage was related to the presence of the mite T. putrescentiae and larvae of Delia sp. The major damage observed was leaf curling; there was a high correlation (r = 0.80) between this symptom and the presence of T. putrescentiae colonies. Larvae of Delia sp. bore into spinach roots during establishment of the plant and feed on the young leaves during development of the foliage. T. putrescentiae and Delia sp. have an aggregated distribution.
Key words: Delia sp. Clavipalpus ursinus. Myzus persicae. Taylor’s power law. Tyrophagus putrescentiae. Vegetables. Pest insects.
Introducción
El cultivo de espinaca Spinacia oleracea L., 1753 se inició en Cota (Cundinamarca) hace 30 años y actualmente es su principal actividad agrícola. El área promedio de espinaca sembrada en los últimos años ha sido de 90 ha, convirtiéndose en el mayor productor de esta hortaliza en el país. La espinaca generalmente se siembra al voleo en camas de 1,7 m de ancho; con este sistema se alcanza una densidad promedio de 34 plantas/m2. La fertilización del cultivo generalmente se realiza mediante la incorporación al suelo de estiércol fresco de gallina (gallinaza). Los materiales genéticos sembrados en el municipio se caracterizan por tener las hojas lisas y el más común es el hibrido select 424. Bajo este esquema de producción el rendimiento promedio fue de 19 ton/ha para el año 2000 (DANE 2002).
En los cultivos se observan una serie de daños, de los cuales se desconoce el artrópodo plaga responsable. Los principales daños están relacionados con flacidez de las plantas durante los primeros estados de desarrollo y la deformación de las hojas verdaderas, siendo este último el síntoma más observado. Como respuesta a estos daños y por la falta de información acerca de los artrópodos plagas, los productores pueden realizan hasta seis aplicaciones de mezclas de pesticidas en un ciclo de cultivo de solo 60 días. Las moléculas aplicadas con mayor frecuencia son: organofosforados (Clorpirifos, Profenofos y Metamidofos), piretroides (Deltametrina), carbamatos (Carbofuran), organosulfurados (Tetradifon) y extractos vegetales (ajo-ají). El uso inapropiado y frecuente de estos productos genera riesgos a la salud de productores y consumidores, además de tener efectos negativos sobre el ambiente y la rentabilidad del cultivo.
Actualmente en Colombia, la información sobre los insectos plaga del cultivo de espinaca es escasa. Sin embargo, en California (EE.UU), Chaney et al. (2001) mencionan que los principales grupos entomológicos relacionados con este cultivo son: los áfidos Myzus persicae (Sulzer, 1776) y Macrosiphum euphorbiae (Thomas, 1878) (Hemiptera: Aphididae), los minadores Liriomyza huidobrensis Blanchard, 1926. L. sativae Blanchard, 1938 y L. trifolii Burgess, 1880 (Diptera: Agromyzidae), el ácaro Rhizoglyphus sp. (Acari: Acaridae), y larvas de lepidópteros tales como, Spodoptera exigua (Hübner, 1808), Trichoplusia ni (Hübner, 1803), Helicoverpa zea (Boddie, 1850), Agrotis ipsilon (Hufnagel, 1766), Peridroma saucia (Hübner, 1808), Agrotis subterranea (Fabricius, 1794) y Spodoptera praefica (Grote, 1875), (Lepidoptera: Noctuidae), así como larvas de Limonius spp. (Coleoptera: Elateridae). Guerrero et al. (2001), mencionan que en la región de Murcia (España), las plagas que afectan la espinaca son polífagas y comunes a otros cultivos hortícolas estacionales. Entre éstas destacan algunos áfidos como, M. persicae, Aphis fabae Scopoli, 1763 y Aphis gossypii Glover, 1877, lepidópteros defoliadores como, S. exigua y Spodoptera littoralis (Boisduval, 1833) y los ácaros Tetranychus urticae (Koch, 1836) y Tyrophagus similis Volgin, 1949. En Japón, Kasuga y Amano (2003) afirman que ácaros del género Tyrophagus, presentes en los suelos de los invernaderos, se alimentan de las hojas jóvenes de la espinaca.
Además de desconocerse las plagas presentes en los cultivos de espinaca, tampoco se conoce la disposición de ellos dentro de las áreas cultivadas. La distribución de los organismos en el espacio, es una característica biológica importante. De forma general se aceptan tres formas de distribución: al azar, uniforme o agregada (Pedigo y Rice 2006; Duque-Echeverri 2002). Existen diferentes métodos que se emplean para describir la distribución de los insectos en el espacio (Southwood 1978). Dentro de los métodos mas empleados se encuentran la ley de poder de Taylor y la distribución binomial negativa (Trichilo et al. 1993; Osorio y Cardona 2003; Tello et al. 2001; Bueno et al. 2005). En la ley de poder de Taylor, el valor de la pendiente b: regresión entre el logaritmo de la media y el logaritmo de la varianza de una población, puede considerarse como una medida de agregación. En consecuencia, si se estima una pendiente menor a 1, se interpreta que el insecto está distribuido uniformemente; si es igual a 1, indica distribución al azar y si la pendiente es mayor que 1, indica agregación (Duque-Echeverri 2002; Bueno et al. 2005). La distribución binomial negativa es la distribución usada generalmente para modelar poblaciones agregadas. Esta distribución está determinada por dos parámetros k y p, los cuales se relacionan con la media (m = k*p). El parámetro k es interpretado como una medida de agregación y se considera que mientras menor sea su valor (k < 8), mayor será la agregación de la población (Southwood 1978; Gómez 1997).
El propósito del presente trabajo es identificar los principales artrópodos plaga en el cultivo de espinaca en Cota, describir el daño que ocasionan y brindar información básica para su manejo.
Se presenta una aproximación a la distribución espacial de algunos de los artrópodos plaga encontrados y se propone un tamaño de muestra mínimo.
Materiales y Métodos
El estudio se llevó a cabo en el municipio de Cota, Cundinamarca, a 2.547 m de altitud (4°49’05”N, 74°07’20”W), con una temperatura media de 13,7°C y un régimen de precipitación bimodal, con un promedio anual de 700 mm.
Dos cultivos se monitorearon semanalmente, desde la siembra hasta la cosecha. Un cultivo se situó en una finca manejada bajo un sistema de producción convencional (lote A) y el otro bajo un sistema ecológico u orgánico (lote B). La fertilización y el manejo de enfermedades y arvenses, se realizó según el criterio del productor. En el lote A se usaron fertilizantes y otros insumos de síntesis química, y el lote B no recibió ninguno de estos tratamientos; sin embargo, en ninguno de los lotes se aplicó insecticidas. El número de plantas para el seguimiento de las poblaciones de insectos, se determinó mediante un muestreo piloto que permitió establecer los parámetros necesarios para desarrollar la fórmula (1) propuesta por Southwood (1978).
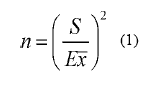
Donde: n = Tamaño de muestra, S = desviación estándar de los datos del muestreo piloto, E = Error Estándar predeterminado y 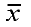 = la media de los datos del muestreo piloto.
= la media de los datos del muestreo piloto.
Para el muestreo de artrópodos, se realizó una revisión manual en cada planta, en las hojas jóvenes en expansión localizadas en el “cogollo” y en las hojas totalmente desplegadas (haz y envés); se registró el tipo y número de artrópodos presentes .Se recolectaron algunos especímenes de cada una y se llevaron al laboratorio de entomología del Centro de Investigaciones y Asesorías Agroindustriales (CIAA), para su preparación. Los especímenes recolectados se preservaron, montaron y etiquetaron siguiendo métodos estándar, tanto para hexápodos como para ácaros (Krantz 1977; Triplehorn y Johnson 2005). Posteriormente se enviaron para su identificación a especialistas del Museo de Zoología de la Universidad de Michigan (EE.UU.), la Facultad de Agronomía de la Universidad de Zulia (Venezuela) y la Facultad de Agronomía de Universidad Nacional de Colombia. En campo como en laboratorio, se tomaron fotografías de los daños atribuibles a cada organismo con el fin de caracterizarlos. Se usó la correlación de Pearson para establecer el nivel de asociación entre el síntoma de deformación de las hojas y la presencia de artrópodos que pudieran estar relacionados con este síntoma.
El ciclo de desarrollo de la espinaca se dividió en tres etapas, siguiendo el código uniforme de estados de crecimiento conocido como “escalas BBCH”. En este código, el ciclo completo de las plantas se subdivide en diez fases principales claramente distinguibles. Estos estados son descritos usando números del cero al nueve en orden ascendente. Los estados secundarios son usados para describir fases cortas de desarrollo. Contrario a los estados principales de crecimiento, los estados secundarios son pasos cortos de desarrollo, que ocurren durante un determinado estado principal y también son codificados usando números de cero a nueve. La combinación de los números de un estado principal y uno secundario de crecimiento conduce a un código digital de dos cifras (Meier 2001). La primera etapa comprende desde la siembra de la semilla hasta cuando la plántula expande completamente las hojas cotiledonales (00 a 10, de la escala BBCH) y se denominó germinación. La segunda comprendió desde la aparición de las primeras hojas verdaderas hasta cuando la roseta foliar alcanzó el 70% del diámetro esperado (11 a 37), esta etapa se denominó desarrollo de hojas. La última etapa abarcó desde cuando la roseta foliar alcanzó el 70% del diámetro esperado hasta cuando está se desarrolló completamente (38 y 39), esta etapa se denominó cosecha. Durante cada una de estas tres etapas se determinó la proporción de las plagas más relevantes encontradas en el cultivo. La distribución en campo de estos organismos se determinó mediante la ley de poder de Taylor (2) (Southwood 1978).
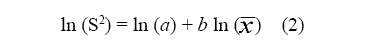
Donde: ln (S2) = Logaritmo natural de la varianza de los datos poblacionales, ln (a) = Logaritmo natural del intercepto de la regresión lineal, b = es la pendiente de la regresión y ln (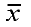 ) = Logaritmo natural de la media de la población. Además se determinó el ajuste de las frecuencias observada a la distribución binomial negativa (Gómez 1997; Southwood 1978).
) = Logaritmo natural de la media de la población. Además se determinó el ajuste de las frecuencias observada a la distribución binomial negativa (Gómez 1997; Southwood 1978).
El tamaño de muestra sólo se calculó para los artrópodos más relevantes encontrados sobre las plantas, utilizando tres márgenes de error: 10, 15 y 20%. La fórmula empleada (3) para calcular el tamaño de muestra, utiliza los valores de a y bde la ley de poder de Taylor y el valor de la distribución t.
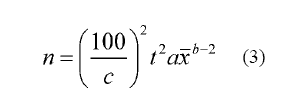
Donde: n = número de muestras a tomar, c = margen de error admitido (error estándar de la media), t = valor aproximado de la distribución t, 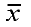 = media de la población y a y b = son los valores estimados con la ley de poder de Taylor (Bueno et al. 2005).
= media de la población y a y b = son los valores estimados con la ley de poder de Taylor (Bueno et al. 2005).
Resultados y Discusión
Con base en el muestreo piloto, se determinó un tamaño de muestra de 180 plantas para cada lote, las cuales fueron seleccionadas aleatoriamente. Los principales artrópodos encontrados en cultivos de espinaca fueron: Delia sp. (Diptera: Anthomyiidae), Tyrophagus putrescentiae (Schrank, 1781) (Acari: Acaridae), M. persicae (Hemiptera: Aphididae), Clavipalpus ursinus (Blanchard, 1850) (Coleoptera: Melolonthidae), trips (Thysanoptera: Tripidae) y trozadores (Lepidoptera: Noctuidae). Dentro de este grupo los principales daños están relacionados con la presencia de larvas de Deliasp. y del ácaro T. putrescentiae.
Descripción del daño. El daño ocasionado por la larva de Delia sp., consiste en la destrucción del tallo y de la raíz de la plántula y del punto de crecimiento de la planta (Fig. 1A), cuando está próxima a la cosecha. La especie que se encuentra en los cultivos de espinaca en Cota, aún no ha sido determinada. Sin embargo, a nivel mundial las especies predominantes de este género son Delia antiqua (Meigen, 1826) y D. platura (Meigen, 1826). La primera de ellas, se asocia a especies cultivadas como cebolla (Allium cepa L. 1753), ajo (Allium sativum L. 1753) y otras pertenecientes a este mismo género, mientras que la segunda, posee un rango más amplio de hospederos (Hill 1983). Según Hough-Goldstein y Bassler (1988), la oviposición de D. platura y de otras especies de este género, está influenciada por la acción de microorganismos del suelo involucrados en procesos de descomposición. En Cota, es común la aplicación e incorporación al suelo de altas cantidades de gallinaza, generalmente de ocho a 15 días antes de la siembra. Esta práctica, al favorecer procesos de descomposición probablemente también ayude al desarrollo de altas poblaciones de Delia sp.

El ácaro encontrado sobre las hojas jóvenes en expansión de la espinaca se identificó como T. putrescentiae. Se determinó que hay una alta asociación entre la presencia de T. putrescentiae y la deformación de las hojas (r = 0,80, P = <0,0001). Se infiere, que la presencia de este ácaro sobre las plantas de espinaca está relacionada con la deformación de sus hojas (Fig. 1B). El ácaro se encontró, en el 100% de los casos, sobre hojas jóvenes en expansión (cogollo) y por su ubicación en la planta, a este artrópodo se le conoce como el ácaro de la corona de la espinaca (Chaney et al. 2001).
Se registraron colonias del áfido M. persicae, tanto ápteros como alados, generalmente en el envés de las hojas maduras de la espinaca. M. persicae transmite eficientemente cerca de 100 tipos de virus de plantas, por lo cual se le considera como la especie más importante en la transmisión de enfermedades virales (Blackman y Eastop 2000). En la espinaca el virus del mosaico de las cucurbitáceas (CBV) es transmitido principalmente por M. persicae y produce moteado sobre las hojas jóvenes y en casos severos destrucción del punto de crecimiento (Correll et al. 1994). Debido a que la deformación de las hojas puede ser atribuida a un síntoma viral (Martínez et al. 1999) y que M. persicae es reportado como un transmisor de virus en espinaca, se realizó la correlación de Pearson entre la presencia del áfido y del síntoma pero se obtuvo una baja asociación (r = 0,21, P = < 0,0001) por lo que se puede inferir preliminarmente, que es poco probable que la deformación de las hojas sea un síntoma de un virus transmitido por M. persicae.
Las larvas del coleóptero C. ursinus, causan daños graves durante la germinación del cultivo, debido a que se alimenta del sistema radicular de la planta. En Cota, este insecto es comúnmente llamado “chisa” durante sus estados larvales y “mayito” o “viejita” en su estado adulto. Según Zuluaga (2003), C. ursinus es una plaga subterránea de hábito fitófago y se alimenta de las raíces de muchas plantas incluyendo la mayoría de las hortalizas; su ataque puede ocasionar la pérdida completa de la cosecha, especialmente cuando el ataque ocurre sobre plantas en estados iniciales de crecimiento. Esta especie parece ser la más limitante en la sabana de Bogotá, por los daños que causa y por su abundancia. (Londoño 2000). Parra et al. (2006), determinaron que los adultos solo se presentan durante los periodos lluviosos y sugieren que es probable que se presente predominio de un determinado instar larval dependiendo de la época del año.
También se observó un complejo de larvas de lepidópteros, los cuales se agrupan en dos categorías. La primera correspondea larvas que actúan como cogolleros y atacan a la espinaca en estado de plántula. La segunda corresponde a larvas defoliadoras, las cuales se observan cuando la planta ya ha desplegado las hojas verdaderas. En otras zonas productoras de espinaca se menciona la presencia de larvas de lepidópteros solo como defoliadores (Chaney et al. 2001; Guerrero et al. 2001). Según Venette y Gould (2006), la espinaca es hospedera de Copitarsia spp., esta plaga es de importancia cuarentenaria en EE.UU y ha sido reportada en la Sabana de Bogotá (LópezÁvila 1996). Es necesario realizar la identificación taxonómica de este complejo de larvas, como un primer paso para plantear estrategias de manejo integrado.
También se encontraron algunos estados inmaduros y adultos de trips. La correlación entre la presencia de estos insectos y la deformación de las hojas fue de r = 0,14 (P = < 0,0001), lo que indica una baja asociación entre estas dos variables. Sin embargo, según Dreistadt y Phillips (2001) la alimentación de muchas especies de trips consideradas como plaga ocasiona la aparición de cicatrices sobre el órgano de la planta afectado, lo que corresponde a una deformación; Dreistadt y Phillips (2001) mencionan que muchas especies de trips se alimentan en los brotes, donde las hojas se encuentran iniciando el proceso de expansión. Por lo tanto es posible que la presencia de trips en el punto de crecimiento de las plantas de espinaca, ocasione también un daño que se manifieste como una deformación de las hojas. Es necesario caracterizar el daño ocasionado por los trips para poder diferenciarlo del que probablemente causa T. putrescentiae.
Distribución espacial de Delia sp. y T. putrescentiae. Debido a que son las principales plagas que atacan al cultivo de la espinaca en el municipio de Cota. Preliminarmente, con base en el índice b se determinó que la distribución espacial de Delia sp., en el lote A (agregada) no coincide con la del lote B (uniforme). Las frecuencias se ajustan a la distribución binomial negativa, por lo cual se confirma la distribución agregada de las larvas en el lote A (Tabla 1). Sin embargo, es probable que la distribución sea agregada y el índice b de la ley de Taylor este influenciada por factores como: el método de muestreo, la población de la plaga (Lote A, 97 larvas; Lote B, < 30 larvas) y el estimulo para la oviposición. Con respecto a este último factor Gouinguené y Städler (2006) mencionan que materiales orgánicos en descomposición, incluyendo fertilizantes orgánicos, estimulan la oviposición de D. platura.
La continua aplicación de gallinaza en el lote A, puede favorecer el establecimiento de la plaga Delia sp. y su agregación y la segregación detectada por la ley de Taylor en el lote B, puede ser consecuencia de la ausencia de este recurso. La mayor proporción de individuos de este insecto en el lote A, se halló durante el período de cosecha (72,04%), en cual se encontraron hasta tres larvas por planta. Durante el periodo de germinación se encontró el 24,73% de la población total muestreada y el restante 3,23% se halló durante la fase de desarrollo de las hojas. Esta situación contrasta con lo observado en el lote B, donde el 78,26% de la población de Delia sp., se encontró durante el periodo de germinación y el restante 21,74% se halló durante la fase de desarrollo de las hojas. La aplicación de gallinaza en el Lote A al inicio del ciclo, posiblemente favoreció la oviposición, el establecimiento y la permanencia de este insecto. Aunque autores como Chaney et al. (2001) y Guerrero et al. (2001) no mencionan la presencia de esta plaga en los cultivos de espinaca en California (EE.UU.) y Murcia (España) respectivamente, en Cota es necesario iniciar estudios tendientes a diseñar estrategias de manejo integrado. Los estudios deben partir de la identificación taxonómica de esta plaga hasta el nivel de especie, la relación entre la aplicación de diferentes fuentes de materia orgánica y su presencia, así como la búsqueda de enemigos naturales.
Para Delia sp., se determinó un tamaño de muestra preliminar basado en los parámetros a y b de la ley de Taylor y tres valores para el error estándar de la media. Si se desea estimar la población de Delia sp., en una hectárea de cultivo con un error estándar del 10% de la media se deben revisar 1.025 plantas; con un error estándar del 15% se deben examinar 455 plantas y con un error estándar del 20% de la media se deben inspeccionar 256 plantas. Según Southwood (1978) para realizar estudios cuyo objetivo sea el control de la plaga o la valoración del daño, un error estándar del 20% de la media es aceptable. Sin embargo, advierte que para estudios cuyo objetivo sea elaborar tablas de vida, o que requieren estimar la población con un mayor grado de precisión, es necesario emplear un error estándar que no superen el 10%.
Para las colonias del ácaro T. putrescentiae se observó preliminarmente agregación tanto en el lote A (b = 1,54, R2 = 0,98) como en el lote B (b = 1,41, R2 = 0,94), mediante la regresión lineal de ley de poder de Taylor. La mayor proporción del total de colonias de ácaros en ambos lotes (lote A, 52,5% y lote B, 61,5%) se encontró durante el periodo de cosecha; durante el período de desarrollo de hojas la proporción en el lote A fue de 38,5% y en el lote B fue de 47,5%. Sin embargo, durante la germinación se encontró 0% de presencia de ácaros sobre las plantas en ambos lotes. Posiblemente el establecimiento de las colonias de T. putrescentiae sobre las plantas de espinaca está condicionado por la existencia de hojas verdaderas tiernas, bien sea por que le sirven de refugio y/o de alimento. También se determinó que la incidencia de T. putrescentiae al final del ciclo fue mayor en el lote A (79,8%) que en el lote B (28,6%). Esta diferencia, al igual que en las poblaciones de Delia sp., puede estar relacionada con la incorporación de gallinaza, 15 días antes de la siembra en el lote A Chaney et al. (2001), mencionan que la presencia de un ácaro del género Rhizoglyphus en la misma ubicación del encontrado en las plantas de espinaca en Cota, ocasiona la deformación de las hojas. Estebanes-Gonzáles y Rodríguez- Navarro (1991) y Guerrero et al. (2001), también mencionan la presencia del ácaro Tyrophagus similis sobre las hojas tiernas de plantas de espinaca los cuales son descritos como plagas, sin especificar de forma clara el daño que ocasionan. Por lo anterior, son necesarios estudios más detallados para verificar que la especie encontrada en Cota es la mayor responsable de la deformación de las hojas de la espinaca y a partir de esta información diseñar estrategias de manejo integrado.
Agradecimientos
Al Dr. Alexander Cooman, y a la Ing. Agr. Sandra Pulido por revisar y corregir este trabajo. A los productores hortícolas de Municipio de Cota por permitirnos realizar las observaciones para el desarrollo del presente trabajo.
Literatura Citada
BLACKMAN, R. L.; EASTOP, V. F. 2000. Aphids on the world crops. An identification and information guide. Jhon Wiley & Sons. England. 375 p. [ Links ]
BUENO, M. J.; CARDONA, C.; CHACÓN, P. 2005. Fenología, distribución espacial y desarrollo de métodos de muestreo para Trialeurodes vaporariorum (Westwood) (Hemiptera: Aleyrodidae) en habichuela y fríjol (Phaseolus vulgaris L.). Revista Colombiana de Entomología 31 (2): 161-170. [ Links ]
CHANEY, W. E.; LESTRANGE, M.; KOIKE, M.; SMITH, R. F.; FENNIMORE, S. A. 2001. Spinach UC IPM pest management guidelines. http://www.ipm.ucdavis.edu/PDF/PMG/pmgspinach.pdf. Fecha última revisión: 15 mayo 2005. Fecha último acceso: [31 de Julio 2007]. [ Links ]
CORRELL, J. C.; MORELOCK, T. E.; BLACK M. C.; KOIKE, S. T.; BRANDENBERGER, L. P.; DAINELLO, F. J. 1994. Economically important disease of spinach. Plant Disease 78 (7): 653-660. [ Links ]
DEPARTAMENTO ADMINISTRATIVO NACIONAL DE ESTADÍSTICA - DANE. 2002. Ministerio de Agricultura y Desarrollo Rural. Censo Hortícola, Sabana de Bogotá. http://www.dane.gov.co/files/investigaciones/agropecuario/ena/Censo_Horticola_Bta_2002.pdf. Fecha de última revisión: 10 mayo 2005. Fecha de último acceso: [25 de Julio 2007]. [ Links ]
DUQUE-ECHEVERRI, M. C. 2002. Patrones de disposición espacial y su importancia en la definición de un plan de muestreo en MIP, pp. 182-209. En: López-Ávila, A (ed.). Control biológico componente fundamental del manejo integrado de plagas en una agricultura sostenible. Corporación Colombiana de Investigación Agropecuaria. Produmedios. Bogotá. Colombia. 340 p. [ Links ]
DREISTADT, S. H.; PHILLIPS, P. A. 2001. Thrips. Pest notes. University of California Agricultural and Natural Resources. http://www.ipm.ucdavis.edu/PGM/PESTNOTES/pn7429.html. Fecha última revisión: 25 mayo 2005. Fecha último acceso: [16 de Julio 2007]. [ Links ]
ESTEBANES-GONZÁLEZ, M. L.; RODRÍGUEZ-NAVARRO, S. 1991. Observaciones de algunos ácaros de las familias Tetranychidae, Eriophyidae, Acaridae y Tarsonemidae (Acari), en cultivos de Hortalizas en México. Folia Entomológica Mexicana 83: 199-212. [ Links ]
GÓMEZ, H. 1997.Estadística experimental aplicada a la ciencias agrícolas. Imprenta Universidad Nacional, Medellín. 571 p. [ Links ]
GOUINGUENÉ, S. P.; STÄDLER, E. 2006. Oviposition in Delia platura (Diptera, Anthomyiidae): The role of volatile and contact cues of bean. Journal of Chemical Ecology 32 (7): 1399-1413. [ Links ]
GUERRERO, M. M.; LACASA, A.; ALCÁZAR, A.; BIELZA, P. 2001. El ácaro Tyrophagus similis Volgin (Acari: Acaridae) una incómoda plaga de la espinaca. Agrícola Vergel (España) 234: 336-340. [ Links ]
HILL, D. S. 1983. Agricultural insect pest of the tropics and their control. Cambridge University Press. Great Britain. 746 p. [ Links ]
HOUGH-GOLDSTEIN, J.; BASSLER, M. A. 1988. Effects of bacteria on oviposition by seedcorn maggots (Diptera: Anthomyiidae). Environmental Entomology 17 (1): 7-12. [ Links ]
KASUGA, S.; AMANO, H. 2003. Seasonal prevalence and susceptibility to agrochemicals of Tyrophagus similes (Acari:Acaridae) in spinach buds and agricultural soil under greenhouse conditions. Experimental and Applied Acarology 30: 279-288. [ Links ]
KRANTZ, G. W. 1977. A manual of acarology. Oregon State University Book Stores. Oregon. 509 p. [ Links ]
LONDOÑO, M. E. 2000. Control biológico de la chisa (Coleoptera: Melolonthidae), pp. 40-48. En: López A. Memorias I curso taller internacional de control Biológico: Componente fundamental del manejo integrado de plagas en una agricultura sostenible. Bogotá. D.C. [ Links ]
LÓPEZ-ÁVILA, A. 1996. Insectos plaga del cultivo de la papa en Colombia y su manejo, pp. 146-148, 150-154. En: Anon. (ed.). Papas colombianas con el mejor entorno ambiental, Comunicaciones y Asociados Ltda, Santafé de Bogotá, Colombia. [ Links ]
MARTÍNEZ, P.; RODRÍGUEZ D. A.; BORRERO, F. 1999. Manejo de plagas en hortalizas de clima frío. Instituto Colombiano Agropecuario, División de Sanidad Vegetal. Produmedios, Bogotá. 103 p. [ Links ]
MEIER, U. 2001. Growth stages of mono-and dicotyledonous plants. Federal Biological Research Centre for Agriculture and Forestry. http://www.bba.de/veroeff/bbch/bbcheng.pdf. Fecha última revisión: 20 febrero 2005. Fecha último acceso: [23 de Julio 2007]. [ Links ]
OSORIO, J.; CARDONA, C. 2003. Fenología, fluctuación de poblaciones y métodos de muestreo para Thrips palmi (Thysanoptera: Thripidae) en habichuela y fríjol. Revista Colombiana de Entomología 29 (1): 43-49. [ Links ]
PARRA, R.; CARRILLO, D.; GIL, R.; JIMÉNEZ, J. 2006. Fluctuación poblacional anual de cinco especies de escarabajos (Coleoptera: Melolonthidae) en Cota, Cundinamarca. Resúmenes XXXIII Congreso de Entomología. Sociedad Colombiana de Entomología. p. 118. [ Links ]
PEDIGO, L. P.; RICE, M. E. 2006. Entomology and pest management. Prentice Hall, New Jersey 749 p. [ Links ]
SOUTHWOOD, T. R. E. 1978. Ecological methods with particular reference to the study of insect populations. Chapman and Hall, London. 524 p. [ Links ]
TELLO, V.; RAMÍREZ, S.; PINTO, V.; BAUTISTA, N. 2001. Patrones de distribución de áfidos (Homoptera: Aphidadae) asociados con los el cultivo de brócoli en la zona agrícola de San Andres Mixquic, Tlahuac, D.F., México. Folia Entomológica Mexicana 40 (3): 311- 324. [ Links ]
TRICHILO, P. J.; WILSON, L.T.; MACK, T. P. 1993. Spatial and temporal dynamics of the threecornered alfalfa hopper (Homoptera: Membracidae) on soybeans. Environmental Entomology 22 (4): 802-809. [ Links ]
TRIPLEHORN, C. A.; JOHNSON, N. F. 2005. Introduction to the study of insects. Thomson Brooks/Cole. United States of America. 864 p. [ Links ]
VENETTE, C. R.; GOULD, J. R. 2006. A pest risk assessment for Copitarsia spp., insects associated with importation of commodities into the United States. Euphytica 148: 165-183. [ Links ]
ZULUAGA, C. A. 2003. Identificación de chizas (Col: Melolonthidae) asociadas a pastos "Kikuyo" (Pennisetum clandestinum Hoechst) y papa (Solanum tuberosum L.) y sus enemigos naturales en Cundinamarca. Trabajo de grado de ingeniero Agrónomo. Universidad Nacional, Facultad de Agronomía, Bogotá. 52 p. [ Links ]
Recibido: 5-Jul-06 - Aceptado: 16-nov-07














