Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.33 no.2 Bogotá June/Dec. 2007
Sección Agrícola
Frecuencia de cópula de la polilla guatemalteca de la papa Tecia solanivora (Lepidoptera: Gelechiidae)
Mating frequency of the Guatemalan potato moth Tecia solanivora (Lepidoptera: Gelechiidae)
DIEGO FERNANDO RINCÓN1 y JAVIER GARCÍA G.2
1 Autor para la correspondencia: Biólogo. Laboratorio de Ecología y Comportamiento de Insectos. Programa Manejo Integrado de Plagas. Corporación
Colombiana de Investigación Agropecuaria (Corpoica). Centro de Investigación “Tibaitatá”, Kilómetro 14 vía a Mosquera (Cundinamarca).
drincon@corpoica.org.co
2 M. Sc. Ciencias Agrarias. Área de Prevención y Riesgo de Plagas. Instituto Colombiano Agropecuario (ICA). Edificio Cavipetrol, Carrera 13 No. 37 -37 piso 10, Bogota D.C. javier.garcia@ica.gov.co
Resumen: La polilla guatemalteca de la papa Tecia solanivora es considerada una de las principales plagas del cultivo de la papa en Colombia. Actualmente, parte de los esfuerzos para controlar las poblaciones del insecto se enfocan en el desarrollo de metodologías para interrumpir su reproducción. Para esto, es necesario conocer el comportamiento y los factores que afectan el potencial reproductivo de T. solanivora. En el presente trabajo se determinó la frecuencia de cópula de T. solanivora y su efecto sobre el potencial reproductivo de los adultos. Para determinar la frecuencia de cópula de las hembras, se realizaron dos experimentos en donde se confinaron hembras y machos de T. solanivora en diferentes proporciones. Para determinar la frecuencia de cópula de los machos, se realizaron dos experimentos. En el primero se ofreció diariamente una hembra virgen a machos confinados individualmente. En el segundo se ofrecieron diferentes cantidades de hembras a machos individuales. La mayoría de las hembras copulan una vez y aquellas que copulan varias veces no obtienen un beneficio significativo sobre su potencial reproductivo ni sobre su longevidad. Los machos copulan en promedio cinco veces dependiendo de la cantidad de hembras disponibles. Se observó un declive significativo en el potencial reproductivo de los machos con el aumento del número de cópulas, aunque estos parecen tener la capacidad de dosificar la eyaculación de acuerdo con la cantidad de hembras disponibles. Se discute la viabilidad de la implementación de metodologías basadas en la captura masiva de machos para el control de T. solanivora.
Palabras clave: Comportamiento reproductivo. Fecundidad. Fertilidad. Poliandria. Poliginia.
Abstract: The Guatemalan potato moth Tecia solanivora is considered one of the most serious pests of the potato crop in Colombia. Currently, most efforts for controlling populations of the insect are focused in the development of methodologies to disrupt its reproduction. Therefore, it is necessary to understand the behavior and factors affecting the reproductive potential of T. solanivora. In this study the mating frequency of T. solanivora and its effect on adult reproductive potential was determined. To determine the mating frequency of females, two experiments were conducted in which males and females of T. solanivora were confined in different proportions. To establish the mating frequency of males, two experiments were carried out. In the first, one virgin female was offered daily to each male confined individually. In the second, different numbers of females were offered to an individual male. Most females mate just once, and those females that mate more than once do not obtain a significant benefit in their reproductive potential or in their longevity. Males mate an average of five times depending on the number of females available. A significant decline in male reproductive potential with increasing number of copulations was observed, although they seem to have the capacity to dose their ejaculation depending on the number of females available. The viability of the implementation of methodologies based on the mass capture of males for the control of T. solanivora is discussed.
Key words: Reproductive behavior. Fecundity. Fertility. Polyandry. Polygyny.
Introducción
La polilla guatemalteca de la papa Tecia solanivora (Povolný, 1973) (Lepidoptera: Gelechiidae) actualmente es considerada uno de los insectos plaga de mayor importancia económica en el cultivo de la papa en Colombia (Herrera 1998; López-Ávila 2000; Espinal et al. 2005). El daño económico es causado por la larva, la cual, tan pronto emerge, penetra en el tubérculo formando galerías por las que va dejando exuvias y excrementos que propician, junto con patógenos secundarios, la pudrición del tubérculo (Arias 1996).
Estudios recientes (Bosa et al. 2005) han centrado su atención en el desarrollo de feromonas sexuales sintéticas para la interrupción de la reproducción de la plaga. Sin embargo, para la implementación exitosa de estas metodologías es indispensable adelantar estudios sobre el comportamiento reproductivo y los diferentes factores que afectan la fecundidad y la fertilidad de la plaga. En los insectos con reproducción sexual, la cópula es indispensable para a la transferencia de esperma y tiene efectos importantes en la producción y fertilización de los huevos, la oviposición, e incluso en la longevidad de los adultos (Simmons 2001; Wedell et al. 2002). Debido a que no existe evidencia de partenogénesis en la polilla guatemalteca de la papa, la cópula representa un evento fundamental para la reproducción de esta especie (Torres et al. 1997; García et al. 2003).
La asimetría en el costo de producción de huevos y espermatozoides a menudo se ve reflejada en diferencias en el comportamiento reproductivo de las hembras y los machos. Las hembras maximizan su éxito reproductivo incrementando la producción de huevos viables, para lo que una o pocas cópulas son suficientes (Arnqvist y Nilsson 2000). No obstante, las hembras de los insectos pueden presentar diferentes grados de poliandria, es decir, tendencias para copular diferente número de veces. El grado de poliandria puede ir desde hembras que copulan una sola vez en su vida (monoandria) hasta hembras que copulan varias veces con diferentes machos. Paradójicamente, la poliandria es la estrategia reproductiva más común para los lepidópteros (Arnqvist y Nilsson 2000; Torres-Villa y Rodríguez-Molina 2004), aunque se ha discutido si realmente representa una mayor eficacia reproductiva para los individuos o especies que la presentan en mayor grado (Brown et al. 2004).
Para los machos, cada cópula ofrece la oportunidad de producir nueva descendencia, por lo que su éxito reproductivo se encuentra estrechamente relacionado con el número de hembras que éstos tienen la posibilidad de inseminar. Al respecto, Thornhill y Alcock (2001) y Trivers (1972) concluyen que la poliginia, es decir, copular tantas veces y con tantas hembras como sea posible, es la mejor estrategia para que los machos de los insectos maximicen su eficacia reproductiva. Sin embargo, Torres-Vila y Jennions (2005) enfatizan en el gasto energético que implica el apareamiento y concluyen que los machos vírgenes tienen un desempeño reproductivo mayor que el evidenciado por machos que han copulado previamente. Vale anotar que los lepidópteros tienen una ventaja única para ser usados como modelo en el estudio del comportamiento reproductivo. Esto se debe a que, en estos insectos, la esperma es trasferida en paquetes (espermatóforos), uno por cópula, los cuales son retenidos en el tracto reproductor de las hembras a lo largo de sus vidas. Esto hace posible determinar el número de veces que éstas han copulado (Simmons 2001; Wedell 2005a, b).
El presente trabajo tuvo por objeto determinar la frecuencia de cópula de la polilla guatemalteca de la papa y su efecto sobre el potencial reproductivo de las hembras y los machos. Dicho efecto se determinó analizando la variación de la fecundidad, la fertilidad, la longevidad y la capacidad de producción de esperma de acuerdo con la ocurrencia de diferente número de cópulas. Se discute la viabilidad de la implementación de metodologías basadas en la captura masiva de machos para el control de T. solanivora.
Materiales y Métodos
El estudio se llevó a cabo en el Laboratorio de Ecología y Comportamiento de Insectos del Programa de Manejo Integrado de Plagas en el Centro de Investigación “Tibaitatá” de Corpoica, localizado en el municipio de Mosquera (Cundinamarca, Colombia) a una altitud de 2.550 msnm y una temperatura promedio de 19°C.
Cría de los insectos. Se estableció una cría de T. solanivora en la Unidad de Cría y Producción de Insectos del Centro de Investigación “Tibaitatá” de Corpoica, siguiendo la metodología descrita por Vargas et al. (2004). La cría se estableció a partir de tubérculos infestados con la plaga recolectados en las zonas rurales de los municipios de Motavita y Ventaquemada (Boyacá, Colombia).
Frecuencia de cópula de las hembras. Para establecer la frecuencia de cópula de las hembras de T. solanivora y el efecto del número de apareamientos sobre su fecundidad, fertilidad y longevidad, se realizaron dos experimentos teniendo en cuenta el posible efecto de la disponibilidad de machos vírgenes sobre la frecuencia de cópula de las hembras.
En el primer experimento, se confinaron 30 parejas de adultos recién emergidos de T. solanivora cada una en un frasco de vidrio de 300 ml de capacidad. Los frascos se acondicionaron con un algodón impregnado con una solución de miel al 10%, se taparon y aseguraron con muselina y bandas elásticas, y se colocaron boca abajo sobre papel absorbente para recibir las posturas de los insectos. Las 30 parejas se mantuvieron bajo un fotoperíodo controlado de 10h: 14h (luz: oscuridad). Se realizaron observaciones cada 15 minutos durante las cuatro primeras horas de la foto-fase, período que coincide con la mayor actividad sexual de T. solanivora (Okunaga y Ochoa 1987; Torres et al. 1997). Las observaciones se realizaron por diez días durante los cuales se registró el número de apareamientos de cada pareja. Cada tercer día, se remplazó el papel absorbente para contabilizar el número de huevos depositados y el porcentaje de eclosión. Una vez que se detectó la muerte natural de los insectos, se midió su tamaño usando para ello la longitud desde la punta de la cabeza hasta el ápice del ala anterior. Utilizando un estereomicroscopio Ernst Leitz® dotado con reglilla micrométrica, se diseccionaron las hembras para determinar el número y el área de los espermatóforos dejados por los machos.
Debido a que la disponibilidad de un solo macho podría ser insuficiente para determinar la frecuencia de cópula de las hembras (Dewsbury 1982; Simmons 2001), en el segundo experimento se conformaron siete grupos de una hembra con tres machos. Cada grupo se confinó en un frasco de vidrio de 300 ml de capacidad, tapado con muselina y colocado boca abajo sobre papel absorbente. Los machos introducidos en cada frasco se marcaron en el ápice del ala izquierda con marcadores metálicos Zig Poterman Calligraphy® de diferentes colores, de acuerdo con la metodología descrita por Sánchez (1999). Los siete grupos se mantuvieron bajo las mismas condiciones ya descritas. Diariamente, se realizaron observaciones cada 15 minutos durante las cuatro primeras horas de la foto-fase. Las observaciones se realizaron por diez días durante los cuales se registró el número de apareamientos de cada hembra. Para determinar si las hembras copularon con el mismo o con diferentes machos, se registró el color de la marca de los machos que se observaban en copula. Cada tercer día se reemplazó el papel absorbente de las unidades experimentales para contabilizar el número de huevos depositados y el porcentaje de eclosión. Se realizaron disecciones de las hembras y los machos para determinar el número y el área de los espermatóforos encontrados en el interior de las hembras y el área de los testículos de los machos. Se registró además, la longitud de cada hembra desde la punta de la cabeza hasta el ápice del ala anterior.
El número de cópulas fue establecido de acuerdo con el número espermatóforos encontrados en el interior de las hembras. Estos datos fueron comparados con el número de cópulas observadas durante las cuatro primeras horas de la foto-fase. La fecundidad se calculó usando el número de huevos puestos por cada hembra y la fertilidad con el porcentaje de huevos que eclosionaron. La normalidad de las variables se probó mediante el procedimiento de Shapiro-Wilk. Para establecer si la proporción de sexos afectó la distribución de las frecuencias con las que ocurrieron las cópulas, se realizó un ANOVA. Para establecer si había diferencias significativas en el potencial reproductivo y la longevidad de hembras copuladas una o varias veces, se realizaron ANOVA para las variables distribuidas normalmente. Para eliminar el posible efecto del tamaño de las hembras sobre la fecundidad (Barah y Sengupta 1991; Calvo y Molina 2005; Heliövaara et al. 1990), se tomó en cuenta la longitud de cada una de estas como covariable en el análisis. Para las variables que no se distribuyeron normalmente se utilizó la prueba de Kruskal- Wallis.
Frecuencia de cópula de los machos. Para determinar el grado de poliginia de los machos de T. solanivora y el efecto de las cópulas sucesivas sobre el potencial reproductivo de las hembras, se realizaron dos experimentos teniendo en cuenta posibles modificaciones en el comportamiento reproductivo de los machos con la oferta de diferentes cantidades de hembras.
Para determinar el número de veces que puede copular un macho de T. solanivora, 30 machos vírgenes recién emergidos se ubicaron individualmente en frascos de vidrio de 300 ml acondicionados con un algodón impregnado con miel en agua al 10%, y tapados con muselina asegurada con una banda elástica. Cada 24 horas y por diez días, se introdujo una hembra virgen. Cuando las hembras cumplieron 24 horas con el macho, se retiraron y ubicaron individualmente en frascos de vidrio de 300ml. Estos frascos se acondicionaron de la misma manera que los anteriores y se colocaron boca abajo sobre un trozo de papel absorbente para recibir las posturas. Se contabilizó el número total de huevos puestos por cada hembra y el porcentaje de eclosión de las posturas.
Para establecer si la oferta de hembras influye sobre la frecuencia de cópula de los machos de T. solanivora, se llevó a cabo un experimento con cuatro tratamientos y cinco repeticiones. Los tratamientos consistieron en la exposición de diferentes cantidades de hembras a un macho así: 1:1, 1:2, 1:4 y 1:8. Los grupos de insectos se confinaron en cámaras de vidrio de acuerdo con los tratamientos. Durante el experimento, se suministró un algodón impregnado con una solución de miel al 10% en el interior de cada una de las cámaras. Se permitió el contacto continuo de los adultos hasta su muerte. Se retiraron y diseccionaron diariamente las polillas que iban muriendo. Se registró la cantidad de espermatóforos dejados por los machos dentro de cada una de las hembras y el número de huevos puestos y de huevos eclosionados. Adicionalmente, para determinar el efecto del número de apareamientos sobre la capacidad de producción de esperma, se reportó el área de la bolsa testicular de cada macho utilizando un estereomicroscopio Ernst Leitz® dotado con reglilla micrométrica y siguiendo los procedimientos descritos por Simmons et al. (2000) y Ward y Simmons (1991).
Con el fin de analizar la relación entre el número de cópulas de los machos y la fecundidad (número de huevos puestos/ hembra) y la fertilidad (porcentaje de eclosión) de las hembras ofrecidas individualmente, se calcularon coeficientes de correlación de Spearman (rs). Por otro lado, el efecto de los niveles de oferta de hembras sobre la frecuencia de cópula de los machos se analizó mediante ANOVA seguido de una prueba de Tukey. Adicionalmente, se realizaron ANOVA para examinar la relación del número de cópulas de los machos con la fecundidad y la fertilidad de diferentes cantidades de hembras ofrecidas simultáneamente. Finalmente, para determinar la relación fenotípica entre el número de cópulas y el tamaño de la bolsa testicular, se realizó un análisis de regresión lineal simple. La normalidad de las variables se probó mediante el procedimiento de Shapiro-Wilk. Los datos se analizaron usando el software R versión 2.5.1 (R, Development Core Team 2007).
Resultados y Discusión
Frecuencia de cópula de las hembras. En el primer experimento, de acuerdo con el número de espermatóforos encontrados en el interior de las 30 hembras confinadas con un macho, se encontró que el 80% copularon una vez (Fig. 1). Por otra parte, en el segundo experimento, de las siete hembras confinadas cada una con tres machos, el 71,43% copularon una vez, y el resto lo hicieron dos veces (Fig. 1). La proporción de sexos no afectó la distribución de las frecuencias con las que ocurrieron las cópulas (F = 0,032; g. l. = 1, 35; P = 0,85), lo que indica que la frecuencia de cópula de las hembras se mantiene constante independientemente de la disponibilidad de machos. La frecuencia de cópula promedio de las hembras de una especie determina el nivel de competencia espermática que los machos tienen que afrontar, y por ende, la confianza de la paternidad. Wedell (2005a, b) enumera los diferentes mecanismos que los machos de los lepidópteros pueden utilizar para suprimir la receptividad de las hembras y evitar la competencia espermática, a saber: (1) transferencia de antiafrodisiacos, (2) colocación de tapones anexos al espermatóforo (sphraga), (3) presencia física del espermatóforo y de la esperma y (3) transferencia de sustancias inhibitorias de la síntesis de feromona sexual.
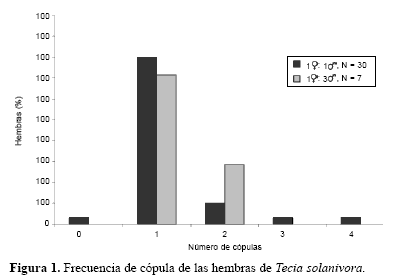
Al comparar el potencial reproductivo de las hembras que copularon una vez con las que lo hicieron varias veces, no se observó que el número de cópulas tuviese un efecto significativo sobre la fertilidad (Kruskal-Wallis; H1,37 = 0,005; P = 0,94) ni sobre la fecundidad (F = 2,08; g. l. = 1,33; P = 0,169) (Fig. 2). Los resultados evidencian que un número elevado de cópulas no trae beneficios significativos sobre el potencial reproductivo de las hembras, al menos cuando éstas tienen la oportunidad de copular con machos vírgenes. En condiciones de campo, requerir un elevado número de cópulas puede disminuir la sobrevivencia de las hembras por el incremento de la exposición a depredadores y patógenos, e incrementar el hostigamiento de machos afectando el tiempo y la energía destinados para la oviposición (Simmons 2001). Contrario a lo esperado, no se observó un efecto significativo del tamaño de las hembras sobre la fecundidad (covariable; F = 2,80; g. l. = 1,33; P = 0,10), por lo que es posible omitir esta variable en futuros estudios relacionados con la fecundidad de T. solanivora realizados en condiciones similares. Esta característica ha sido observada en varias especies de lepidópteros (Boggs 1986), incluyendo la polilla de la papa Phthorimaea operculella (Zeller, 1873) (Gelechiidae) (Fenemore 1977).
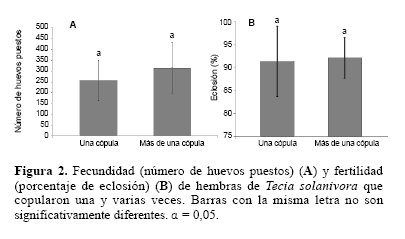
Diferentes revisiones (Simmons 2001; Arnqvist y Nilsson 2000; Torres-Vila y Rodríguez-Molina 2004) concluyen que, en general, altos niveles de poliandria incrementan la oviposición y la fertilidad de los huevos en los insectos. Sin embargo, es común observar que el nivel de poliandria varíe entre especies e incluso dentro de una misma especie. Wedell et al. (2002) afirman que los grados de poliandria son condiciones que deben verse como “estilos de vida” establecidos en el acervo genético de las poblaciones. Según estos autores, las hembras poliandras son exitosas captando los recursos proveídos por los machos durante la cópula para luego invertirlos en la producción de huevos fértiles. Las hembras monoandras, por su parte, son exitosas obteniendo los recursos por si mismas, y aunque generalmente son menos fecundas, viven más tiempo.
Por otro lado, se observó que el espermatóforo encontrado en las hembras que copularon una vez es más grande que el mayor de los espermatóforos encontrados en las hembras que copularon varias veces, con 1,49 mm2 (DE = 0,11) y 1,32 mm2 (DE = 0,09) respectivamente (F = 3,63; g. l. = 1,34; P = 0,06). Esto sugiere que el tamaño del espermatóforo recibido en la primera cópula puede jugar un papel importante en la variación del nivel de poliandria de las hembras de T. solanivora. Se ha reportado que el tamaño del espermatóforo varía dependiendo esencialmente del tamaño del macho (Wedell 2005) y de los apareamientos que este haya sostenido previamente (Simmons 2001). Si la receptividad de las hembras para nuevos apareamientos depende del tamaño del primer espermatóforo, en el campo el porcentaje de hembras que copulan en más de una oportunidad variaría dependiendo de la oferta de machos. Torres-Vila y Jennions (2005) concluyen que si el primer espermatóforo que recibe una hembra es relativamente pequeño, el nivel de poliandria de la hembra se incrementa. Distintos autores (Simmons 2001; Boggs y Gilbert 1979; Simmons y Parker 1989) proponen la hipótesis de inversión parental para explicar el efecto del tamaño del espermatóforo sobre el potencial reproductivo de las hembras. Esta hipótesis sugiere que las donaciones nutricionales suministradas por los machos durante la cópula para su utilización en la producción de huevos y el mantenimiento somático de las hembras (inversión parental) son directamente proporcionales al tamaño del espermatóforo. De esta manera cuando el tamaño de la inversión parental es insuficiente, la receptividad de las hembras se incrementa. Sin embargo, esta explicación ha sido cuestionada en razón a que se ha encontrado muy poca evidencia que soporte la relación positiva entre el tamaño del espermatóforo y el contenido nutricional donado durante la cópula (Marshall y McNeil 1989).
El número de espermatóforos encontrados en el interior de las hembras no coincidió con el número de cópulas observadas. Sólo el 47,90% de los apareamientos ocurrieron durante las horas de observación (cuatro primeras horas de la foto-fase), y el restante 52,1% ocurrió en horas diferentes, presuntamente durante las primeras horas de penumbra. Esto sugiere que el periodo de actividad sexual de la polilla guatemalteca de la papa no está restringido a las primeras horas de la mañana, como es sugerido por Torres et al. (1997) y Okunaga y Ochoa (1987). En cambio, es posible que en las horas de la tarde exista una actividad sexual importante. Debido a esto, no fue posible establecer con exactitud la procedencia de los espermatóforos encontrados y determinar si las hembras que copularon más de una vez lo hicieron con uno o con varios machos.
Contrario a lo esperado, se encontró que las hembras de T. solanivora que copulan más de una vez no exhiben mayor longevidad (F = 0,008; g. l. = 1,34; P = 0,92). Es posible que este incremento no haya sido observado, debido a que todas las hembras mantuvieron una oferta constante de alimento que a la postre impediría observar la diferencia nutricional entre las hembras que copularon una vez y las que lo hicieron varias veces. Es ampliamente aceptado que el espermatóforo transferido por el macho a la hembra durante la cópula contiene sustancias nutritivas que proveen beneficios indirectos como el incremento en la tasa de producción de huevos y en el tiempo de vida de las hembras (Simmons 2001; Wedell et al. 2002).
Frecuencia de cópula de los machos. Se encontró que los machos de T. solanivora copulan en promedio 5,03 veces (DE = 2,33). De los 30 machos utilizados en el experimento, el 29,03% copularon cinco veces (Fig. 3). Es importante anotar que en el campo el gasto energético de los insectos es mayor. Por este motivo, es probable que la frecuencia de cópula de los machos de T. solanivora sea menor en el cultivo, especialmente cuando la densidad del insecto es baja.
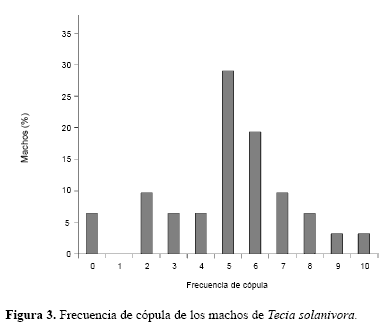
En general, el potencial reproductivo de los machos se redujo con el incremento en el número de apareamientos. La fecundidad, representada en el número de huevos puestos, se redujo linealmente con la cantidad de cópulas (rs = -0,47; P < 0,001) (Fig. 4). Igualmente, la fertilidad representada en el porcentaje de eclosión de los huevos, disminuyó con el aumento en el número de cópulas (rs = -0,34; P = 0,001) (Fig. 5).
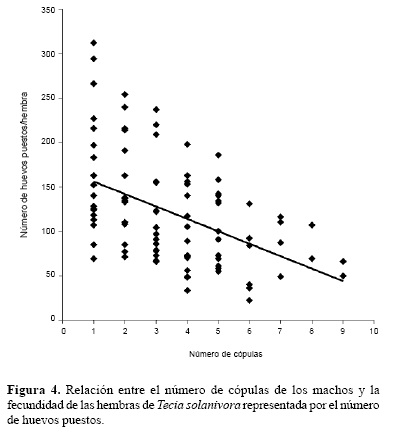
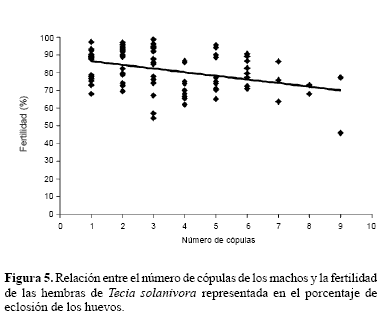
Pese a que el éxito reproductivo de los machos generalmente se encuentra asociado con una frecuencia de apareamiento alta (Trivers 1972; Thornhill y Alcock 2001), se ha comprobado que la producción de esperma es costosa (Dewsbury 1982). Este costo puede verse reflejado en una disminución considerable en el desempeño sexual de los machos que sostienen múltiples copulas en términos de número de espermatozoides, tamaño del espermatóforo, estimulación de la hembra para la producción de huevos, e inhibición de la hembra para nuevos apareamientos (Simmons 2001; Lewis 2004). Torres-Vila y Jennions (2005) demuestran que las hembras de los lepidópteros que copulan con machos vírgenes tienen una mayor fecundidad que las hembras que lo hacen con machos que han copulado previamente.
Por otra parte, cuando se ofrecieron simultáneamente diferentes cantidades de hembras a machos confinados individualmente, se observó que la cantidad de hembras disponibles tuvo un efecto significativo en la frecuencia de cópula de los machos (F = 10,79; g. l. = 3,16; P < 0,001). Los machos que permanecieron en contacto con ocho hembras copularon significativamente más veces que los machos que fueron confinados con una menor cantidad de hembras (Fig. 6). Contrario a lo esperado, en este experimento la fertilidad y la fecundidad de las hembras no se observaron afectadas por el número de cópulas de los machos (F = 0,60; g. l. = 5,10; P = 0,70. F = 1,93; g. l. = 5,10; P = 0,17; respectivamente).
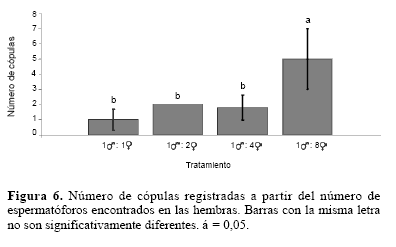
Los resultados sugieren que la frecuencia de apareamiento de los machos de T. solanivora varía dependiendo de la cantidad de hembras disponibles en el ambiente. No obstante, se observó que estos alcanzan un promedio de cinco cópulas cuando se ofrece una cantidad ilimitada de hembras. Con respecto al potencial reproductivo, en el primer experimento se evidenció que cuando el macho percibe una baja cantidad de hembras en el ambiente, éste parece incrementar su eyaculación durante la cópula, lo que provoca un declive significativo en la fecundidad y la fertilidad de apareamientos posteriores. En cambio, cuando en el segundo experimento se incrementó la cantidad de hembras disponibles en el ambiente, el macho parece contar con la capacidad de dosificar la eyaculación con el fin de maximizar su eficacia reproductiva, copulando y dejando descendencia con tantas hembras como sea posible.
Parker (1998) afirma que los machos de diferentes especies de insectos pueden ajustar su gasto en eyaculación de acuerdo con el riesgo de competencia espermática para asegurar el éxito en la fertilización. Adicionalmente, se ha comprobado que los machos usan diferentes señales para estimar el riesgo de competencia espermática, incluyendo la presencia de competidores potenciales, el grado de poliandria de las hembras, y la densidad de la población (Simmons 2001; Gage 1991, 1995; Yamane y Miyatake 2005). En particular, Yamane y Miyatake (2005) en experimentos realizados con Callosobruchus chinensis (L. 1758) (Coleoptera: Bruchidae) encontraron que los machos pertenecientes a linajes con bajos niveles de poliandria eyaculan una mayor cantidad de esperma cuando son criados en densidades bajas, en comparación con las eyaculaciones de aquellos que son criados en densidades altas. El efecto opuesto se observó en linajes con altos niveles de poliandria. La monoandria reduce el riesgo de competencia espermática, por lo que los machos pueden incrementar su eficacia reproductiva disminuyendo la eyaculación en las diferentes cópulas para invertir más esperma y nutrientes en futuros apareamientos.
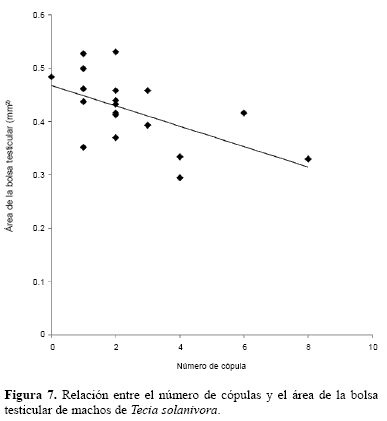
Se encontró que el área promedio de la bolsa testicular de los machos de T. solanivora es de 0,420 mm2 (DE = 0,065). Sin embargo, se observó una disminución significativa del tamaño de esta estructura con el aumento en el número de cópulas de los machos (r2 = 0,30; F = 7,75; P = 0,01) (Fig. 7). De acuerdo con Chapman (2004), el sitio en donde se almacena el esperma en los machos de los lepidópteros es la vesícula seminal, que se ubica por fuera de la bolsa testicular en el punto de convergencia de los vasos deferentes con los ductos de las glándulas accesorias. Baker et al. (2003) reportan que no existe relación fenotípica entre el tamaño de los testículos y la frecuencia de cópula de los machos de Cyrtodiopsis dalmanni (Wiedemann, 1830) (Diptera: Diopsidae). Sin embargo, el encogimiento de los testículos, es un efecto que ha sido comprobado como consecuencia de cópulas sucesivas, e incluso ha sido utilizado en diversos estudios como medida de la cantidad de esperma transferida (Ward y Simmons 1991; Martin y Hosken 2002; Simmons et al. 2000). Es conveniente realizar trabajos encaminados a profundizar en el estudio de esta relación fenotípica en los machos de T. solanivora, debido a que su comprensión es de gran utilidad para el desarrollo de modelos matemáticos que permitan estimar el número de cópulas que ha sostenido un macho de acuerdo con el tamaño de su bolsa testicular. Esta estimación podría ser utilizada para realizar diagnósticos de la efectividad de diferentes metodologías de control, y para pronosticar el daño que puede presentarse en condiciones de cultivo.
Implicaciones y perspectivas. Actualmente, las trampas cebadas con feromona sexual son utilizadas para la vigilancia y el seguimiento de las poblaciones de la polilla guatemalteca en el campo (López-Ávila y Espitia-Malagón 2000). Sin embargo, la captura masiva de machos de la plaga, utilizando esta feromona sexual como atrayente, difícilmente constituye una alternativa de control debido a que su eficacia máxima de captura es sólo del 15% de la población de machos (Sánchez 1999). Para que la captura masiva de machos con trampas de feromona sexual sea eficiente, es necesario reducir la población de machos de la plaga lo suficiente para provocar: (a) que un porcentaje importante de hembras no copulen, o (b) que éstas copulen con machos que, al haber sostenido apareamientos previos, reduzcan significativamente su potencial reproductivo. Para determinar la cantidad de machos que es necesario remover mediante sistemas de captura masiva, es preciso establecer el motivo de la variación en el grado de poliandria de las hembras de la polilla guatemalteca de la papa.
Existen dos posibles explicaciones para la variación en el grado de poliandria de T. solanivora. La primera radica en el tamaño del espermatóforo producido durante la primera cópula. Si bien se evidenció que las hembras de T. solanivora disminuyen su potencial reproductivo cuando se aparean con machos que han copulado previamente, también se observó que el tamaño del espermatóforo de la primera cópula puede ser determinante para incrementar el grado de poliandria de las hembras. De acuerdo con Simmons (2001), los machos que han tenido apareamientos anteriores producen espermatóforos más pequeños que los machos que copulan por primera vez. Esto sugiere que cuando una hembra de T. solanivora se aparea con un macho que ha copulado previamente, éste produce un espermatóforo tan pequeño que incrementa la receptividad de la hembra para nuevos apareamientos incrementando así su potencial reproductivo. Otra posible explicación sugiere que el grado de poliandria es una característica establecida en el genotipo de las hembras, es decir, que este comportamiento es heredado. Esto se ha observado en diferentes especies de insectos como Pieris napi (L., 1758) (Lepidoptera: Pieridae) (Wedell et al. 2002), Gryllus integer Scudder, 1902 (Orthoptera: Gryllidae) (Solymar y Cade 1990) y Drosophila melanogaster (Meigen, 1830) (Diptera: Drosophilidae) (Pyle y Gromko 1981).
A la luz de estas posibilidades, es fundamental adelantar estudios encaminados a determinar la causa de la variación en el grado de poliandria de las hembras de la polilla guatemalteca de la papa con el fin de establecer la viabilidad de las metodologías de control basadas en la captura masiva de machos. Si el grado de poliandria puede ser alterado por las hembras en procura de maximizar su potencial reproductivo, las metodologías de control basadas en la captura masiva de machos podrían resultar inviables en la práctica. En este caso, asumiendo que los machos de T. solanivora copulan en promedio cinco veces y que las hembras pueden expresar su potencial reproductivo ya sea copulando una vez con machos vírgenes, o varias veces con machos no vírgenes, habría que diseñar sistemas de trampeo con la capacidad de remover al menos un 80% de la población de machos para alcanzar una reducción significativa de la población. Esto en razón a que, en teoría y sólo bajo estas condiciones, únicamente el 20% de las hembras tendrían la posibilidad de copular con machos vírgenes, y las hembras restantes no tendrían la oferta suficiente de machos para poder expresar plenamente su potencial reproductivo. Si, por otro lado, el grado de poliandria es una característica establecida en el genotipo de T. solanivora, es posible obtener una disminución considerable de la población en la siguiente generación del insecto acorde con la eficacia de las trampas de feromona sexual.
Agradecimientos
A Diana del Pilar Ojeda por su apoyo en la generación del proyecto de investigación. A Jesús Gómez Benavides por su apoyo logístico durante el desarrollo del trabajo. A Aristóbulo López-Ávila, Diego Cuadros, Ricardo Pérez y al grupo de investigación en Entomología del C.I. “Tibaitatá” de Corpoica. El trabajo fue financiado por el Ministerio de Agricultura y Desarrollo Rural de la República de Colombia a través del Centro Virtual de Investigación de la Cadena Agroalimentaria de la Papa (Cevipapa).
Literatura Citada
ARIAS, J. 1996. Evaluación de la incidencia y severidad de daño de la polilla gigante de la papa Tecia solanivora (Lepidoptera: Gelechiidae) en Antioquia. En: Seminario experiencias y avances en el manejo de la polilla guatemalteca de la papa (1997, Bogotá D. C.) Memorias de Seminario. Sociedad Colombiana de Entomología (Socolen), Bogotá D.C. [ Links ]
ARNQVIST, G.; NILSSON, T. 2000. The evolution of polyandry: multiple mating and female fitness in insects. Animal Behaviour 60: 145-154. [ Links ]
BAKER, R.; DENNIFF, M.; FUTERMAN, P.; FOWLER, K.; POMIANKOWSKI, A.; CHAPMAN, T. 2003. Accessory gland size influences time to sexual maturity and mating frequency in the stalk-eyed fly, Cyrtodiopsis dalmanni. Behavioral Ecology 14: 607-611. [ Links ]
BARAH, A.; SENGUPTA, A. 1991. Correlation and regression studies between pupal weight and fecundity of muga silkworm Antheraea assama Westwood (Lepidoptera: Saturniidae) on four different foodplants. Acta Physiologica Hungarica 78 (3): 261- 264. [ Links ]
BOGGS, C. 1986. Reproductive strategies of female butterflies: variation in and constraints on fecundity. Ecological Entomology 11 (1): 7-15. [ Links ]
BOGGS, C.; GILBERT, L. 1979. Male contribution to egg production in butterflies: evidence for transfer of nutrients at mating. Science 206: 83-84. [ Links ]
BOSA, C.; COTES, A.; FUKUMOTO, T.; BENGTSSON, M.; WITZGALL, P. 2005. Pheromone-mediated communication disruption in Guatemalan potato moth, Tecia solanivora. Entomologia Experimentalis et Applicata 114: 137-142. [ Links ]
BROWN, W.; BJORK, A.; SCHNEIDER, K.; PITNICK, S. 2004. No evidence that polyandry benefits females in Drosophila melanogaster. Evolution 58 (6): 1242-1250. [ Links ]
CALVO, D.; MOLINA, M. 2005. Fecundity-body size relationship and other reproductive aspects of Streblote panda (Lepidoptera: Lasiocampidae). Annals of the Entomological Society of America 98 (2): 191-196. [ Links ]
CHAPMAN, R. 2004. The Insects: Structure and Function. 4th Edition. Cambridge University Press. Cambridge (UK). [ Links ]
DEWSBURY, D. 1982. Ejaculate cost and male choice. American Naturalist 119: 601-610. [ Links ]
ESPINAL, C.; MARTÍNEZ, H.; PINZÓN, N.; BARRIOS, C. 2005. La cadena de la papa en Colombia una mirada global de su estructura y dinámica 1991-2005. Ministerio de Agricultura y Desarrollo Rural. Observatorio de Agrocadenas, Bogotá D.C. Colombia. [ Links ]
FENEMORE, P. 1977. Oviposition of potato tuber moth, Phthorimaea operculella Zell. (Lepidoptera: Gelechiidae); fecundity in relation to mated state, age, and pupal weight. New Zealand Journal of Zoology 4: 187-191. [ Links ]
GAGE, M. 1991. Risk of sperm competition directly affects ejaculate size in the Mediterranean fruit fly. Animal Behaviour 42: 1036- 1037. [ Links ]
GAGE, M. 1995. Continuous variation in reproductive strategy as an adaptive response to population density in the moth Plodia interpunctella. Proceedings of the Royal Society of London, Series B 261: 25-30. [ Links ]
GARCÍA, J.; OJEDA, D.; LÓPEZ-ÁVILA, A. 2003. Determinación de hábitos reproductivos de la polilla guatemalteca de la papa Tecia solanivora (Povolny, 1973) (Lepidoptera: Gelechiidae), pp. 158 -163. En: Tecia solanivora II Taller Nacional. Abril 24 - 25. Memorias. [ Links ]
HELIÖVAARA, K.; VÄISÄNEN, R.; VARAMA, M. 1990. Fecundity and egg viability in relation to female body size in Neodiprion sertifer (Hymenoptera: Diprionidae). Holarctic Ecology 13 (2): 166-172. [ Links ]
HERRERA, F. 1998. La polilla guatemalteca de la papa. Biología, comportamiento y prácticas de manejo integrado. Ministerio de Agricultura y Desarrollo Rural. Corporación Colombiana de Investigación Agropecuaria (Corpoica). Bogotá D.C. (Colombia), 15 p. [ Links ]
LEWIS, S. 2004. Multiple mating and repeated copulations: effects on male reproductive success in red flour beetles. Animal Behaviour 67: 799-804. [ Links ]
LÓPEZ-ÁVILA, A. 2000. Insectos plaga del cultivo de la papa en Colombia y su manejo. Papas Colombianas 2000, con el mejor entorno ambiental. 25 años Fedepapa. Ventana al Campo Andino 3 (1-2): 152-159. [ Links ]
LÓPEZ-ÁVILA, A.; ESPITIA-MALAGÓN, E. 2000. Plagas y benéficos en el cultivo de la papa en Colombia. Boletín técnico divulgativo. Programa Nacional de Manejo Integrado de Plagas. Corpoica-Pronatta. Editorial Produmedios. Bogotá D.C., Colombia. 35 p. [ Links ]
MARSHALL, L.; McNEIL J. 1989. Spermatophore mass as an estimate of male nutrient investment: a closer look in Pseudaletia unipuncta Haworth (Lepidoptera: Noctuidae). Functional Ecology 3: 605-612. [ Links ]
MARTIN, O.; HOSKEN, D. 2002. Strategic ejaculation in the common dung flies Sepsis cynipsea. Animal Behaviour 63: 541- 546. [ Links ]
OKUNAGA, Y.; OCHOA, R. 1987. Estudio de la dinámica reproductiva de la palomilla de papa Scrobipalpopsis solanivora y relación natalidad-mortalidad para S. solanivora y Phthorimaea operculella. En: XII Reunión ANAP. Panamá, 9 al 13 de marzo, p. 402-418. [ Links ]
PARKER, G. 1998. Sperm competition and the evolution of ejaculates: towards a theory base. En: Birkhead, T; Moller, A. (eds.). Sperm competition and sexual selection. Academia Press, London, pp. 3-54. [ Links ]
PYLE, D.; GROMKO, M. 1981. Genetic basis for repeated mating in Drosophila melanogaster. American Naturalist 117: 133-146. [ Links ]
R, DEVELOPMENT CORE TEAM. 2007. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL http://www.R-project.org. [ Links ]
SÁNCHEZ, M. 1999. Efecto de la trampa de feromona sexual en el Monitoreo de poblaciones de la polilla guatemalteca de la papa Tecia solanivora (Povolny). Trabajo de grado para optar al titulo de Biólogo. Pontificia Universidad Javeriana. Facultad de Ciencias Básicas, Departamento de Biología. Bogotá D.C., Colombia. 143 p. [ Links ]
SIMMONS, L. 2001. Sperm competition and its evolutionary consequences in the insects. Monographs in behavior and ecology. Princeton University Press. Oxford (UK). 434 p. [ Links ]
SIMMONS, L.; PARKER G. 1989. Nuptial feeding in insects: mating effort versus parental investment. Ethology 81: 332-343. [ Links ]
SIMMONS, L.; TOMKINS, J.; ALCOCK, J. 2000. Can minor males of Dawson's burrowing bee, Amegilla dawsoni (Hymenoptera: Anthophorini) compensate for reduced access to virgin females through sperm competition? Behavioral Ecology 11: 319-325. [ Links ]
SOLYMAR, B.; CADE, W. 1990. Heritable variation for female mating frequency in field crickets, Gryllus integer. Behavioral Ecology and Sociobiology 26: 73-76. [ Links ]
THORNHILL, R.; ALCOCK, J. 2001. The evolution of insect mating systems. Harvard University Press, Cambridge (United Kingdom). [ Links ]
TORRES, F.; NOTZ, A.; VALENCIA, L. 1997. Ciclo de vida y otros aspectos reproductivos de la polilla de la papa Tecia solanivora (Povolny) (Lepidoptera: Gelechiidae) en el estado Táchira, Venezuela. Boletín Entomología Venezolana 12 (1): 81-94. [ Links ]
TORRES-VILA, L.; JENNIONS, M. 2005. Male mating history and female fecundity in the Lepidoptera: do male virgins make better partners? Behavioral Ecology and Sociobiology 57: 318-326. [ Links ]
TORRES-VILA, L.; RODRÍGUEZ-MOLINA, C. 2004. Polyandry and fecundity in Lepidoptera: can methodological and conceptual approaches bias outcome? Behavioral Ecology and Sociobiology 55: 315-324. [ Links ]
TRIVERS, L. 1972. Parental investment and sexual selection, pp. 136-179. En: Campbell, B. (ed.) Sexual selection and the descent of man, 1871-1971. Aldine, Chicago. [ Links ]
VARGAS, B.; RUBIO, S.; LÓPEZ-ÁVILA, A. 2004. Estudios de hábitos y comportamiento de la polilla guatemalteca de la papa Tecia solanivora (Lepidoptera: Gelechiidae) en papa almacenada. Revista Colombiana de Entomología 30 (2): 211- 217. [ Links ]
WARD, P.; SIMMONS, L. 1991. Copula duration and testes size in the yellow dung fly, Scathophaga stercoraria (L.): The effects of diet, body size, and the mating history. Behavioral Ecology and Sociobiology 29: 77-85. [ Links ]
WEDELL, N. 2005a. Sperm competition in butterflies and moths, pp. 49-81. En: Insect Evolutionary Ecology. M. Fellowes y G. Holloway (eds.). Royal Entomological Society. CABI Publishing, CAB International. Wallingford (Reino Unido). [ Links ]
WEDELL, N. 2005b. Female receptivity in butterflies and moths. The Journal of Experimental Biology 208: 3433-3440. [ Links ]
WEDELL, N.; WIKLUND, C.; COOK, P. 2002. Monoandry and polyandry as alternative lifestyles in a butterfly. Behavioral Ecology 13 (4): 450-455. [ Links ]
YAMANE, T.; MIYATAKE, T. 2005. Intra-specific variation in strategic ejaculation according to level of polyandry in Callosobruchus chinensis. Journal of Insect Physiology 51: 1240- 1243. [ Links ]
Recibido: 9-ene-2007 - Aceptado: 28-oct-2007














