Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.34 n.2 Bogotá jul./dez. 2008
Herbivoría de Atta cephalotes (Hymenoptera: Myrmicinae) sobre tres sustratos vegetales
Herbivory of Atta cephalotes (Hymenoptera: Myrmicinae) on three plant substrates
JHONATTAN RODRÍGUEZ G.1, ZORAIDA CALLE D.2 y JAMES MONTOYA-LERMA3
1 Biólogo, B.Sc. Departamento de Biología, Universidad del Valle, A. A. 25360 Cali-Colombia. dedosnocallados@gmail.com
2 Bióloga, M.Sc. Fundación CIPAV, A. A. 20591 Cali- Colombia. zoraida@cipav.org.co.
3 Biólogo, Ph.D. Grupo de Investigaciones Entomológicas, Departamento de Biología, Universidad del Valle, A. A. 25360 Cali-Colombia. jamesmon@univalle.edu.co.Autor para correspondencia.
Resumen: Un estudio reciente sugiere una significativa reducción de la herbivoría de la hormiga arriera, Atta cephalotes, en plantaciones de arboloco (Montanoa quadrangularis (Asteraceae)) asociadas y abonadas con follaje verde de botón de oro (Tithonia diversifolia (Asteraceae)). Estas observaciones plantean un efecto disuasivo de esta planta sobre el forrajeo de las hormigas. Con el fin de poner a prueba dicha hipótesis, bajo condiciones de laboratorio, a siete colonias experimentales de A. cephalotes se les ofrecieron tres dietas vegetales con opción de selección (i.e.: follaje de mango Mangifera indica (Anacardiaceae), camarón Pachystachys lutea (Anacardiaceae) y botón de oro (Asteraceae) durante tres periodos de 21 días. Se estimó el consumo midiendo y pesando el follaje antes de ser depositado en cada colonia. En el primer ensayo, se observó una preferencia significativa (P < 0,05) por el mango, mientras que el consumo de T. diversifolia fue irregular después del primer día de experimentación y presentó el más bajo porcentaje. En los dos siguientes ensayos no se encontraron diferencias entre los consumos porcentuales de las dietas (P > 0,05), aunque el follaje de mango fue el primero en ser consumido por las hormigas. Los resultados permiten concluir que bajo condiciones de laboratorio A. cephalotes presenta mayor preferencia por el follaje de mango pero que, cuando la disponibilidad de este recurso es mínima, forrajea en forma oportunista sobre otros recursos como T. diversifolia, así éstos no sean de su preferencia. Este estudio provee más elementos que evidencian que esta planta es poco atractiva para la hormiga arriera.
Palabras clave: Tithonia diversifolia. Preferencia de forrajeo. Oportunismo. Mangifera indica.
Abstract: A recent study suggests a significant reduction of herbivory by the leaf cutting ant, Atta cephalotes, in plantations of the pioneer tree (Montanoa quadrangularis (Asteraceae)) when associated and fertilized with green foliage of the Mexican sunflower (Tithonia diversifolia (Asteraceae)). These observations suggest a dissuasive effect of this plant on foraging by the ants. In order to test this hypothesis, under laboratory conditions seven experimental colonies of A. cephalotes were offered three plant diets to choose among (i.e.: foliage of mango, Mangifera indica (Anacardiaceae), yellow candle Pachystachys lutea (Nees) (Anacardiaceae) and T. diversifolia (Asteraceae) during three periods of 21 days. Consumption was estimated by measuring and weighing the foliage before and after being deposited into each colony. In the first assay, there was a significant (P < 0.05) preference for mango while the consumption of T. diversifolia was irregular after the first day of experimentation and had the lowest percentage. In the two following studies no significant differences (P > 0.5) were observed in the percent consumption of the diets, although mango foliage was the first to be consumed by the ants. The results allow us to conclude that under the experimental conditions, A. cephalotes has a greater preference for mango foliage, but when the availability of this resource is minimal, they forage in an opportunistic way on other resources such as T. diversifolia, even if these are not preferred. The study provides more evidence that this plant is not attractive to leaf-cutting ants.
Key words: Tithonia diversifolia. Foraging preference. Opportunism. Mangifera indica.
Introducción
Con el nombre genérico de hormigas cortadoras de hojas, se denominan las especies de los géneros Acromyrmex y Atta (Formicidae: Attini), consideradas como los herbívoros más comunes y polífagos del Neotrópico (Della Lucia 2003; Hölldobler y Wilson 1990; Howard 1987) y percibidas como una de las plagas más limitantes para la producción agrícola y forestal en Suramérica (Lapointe et al. 1990; Fernández y Jaffé 1995; López y Orduz 2004).
En Colombia, de un total de once especies de hormigas cortadoras de hojas, cuatro corresponden al género Atta, i.e.: A. cephalotes (Linnaeus, 1758), A. colombica (Guérin- Méneville, 1844), A. laevigata (F. Smith, 1858) y A. sexdens (Linnaeus, 1758) (Mackay y Mackay 1986), siendo la primera especie, denominada vulgarmente como hormiga arriera, la más abundante en el país. En áreas agrícolas, forestales y urbanas esta hormiga influye en diferentes aspectos de la ecología de las plantas, pudiendo alterar desde la cantidad de luz disponible (Barone y Coley 2002) hasta el reciclaje de nutrientes (Farji-Brener 1992; Barone y Coley 2002) y, eventualmente, alcanzar el nivel de plaga ocasionando pérdidas económicas no cuantificadas (Gómez 2001). De manera similar, en Venezuela, Atta spp. y Acromyrmex spp. son serios limitantes al establecimiento y desarrollo de plantaciones comerciales de Pinus caribaea Morelet. Se ha establecido que en poblaciones mayores a los 30 nidos de Atta por hectárea, en plantaciones de menos de 10 años de edad, el volumen de producción de madera puede reducirse en más del 50 % (Fernández y Jaffé 1995).
Atta y Acromyrmex poseen el hábito de cortar y transportar diversos fragmentos vegetales a sus nidos subterráneos para el cultivo del hongo Leucoagaricus sp. (Valmir et al. 2004), con el cual han establecido una relación simbiótica caracterizada por una completa dependencia mutua (Currie et al. 1999; Forti et al. 2000). Este hongo es utilizado para alimentación directa de sus colonias, conformadas por varias castas (Posada- Flórez 1997). Debido a que el hongo simbionte es la única fuente de alimento de las larvas de hormigas cortadoras, éstas deben cultivarlo con hojas que posean características que permitan su adecuado crecimiento, por lo que escogen follaje rico en agua, nitrógeno y fósforo pero bajo en fibra (Berish 1986; Barone y Coley 2002) y manganeso ya que este elemento interfiere con la actividad metabólica del hongo simbionte (Berish 1986).
Se conoce que las plantas poseen ciertas defensas contra el ataque de los herbívoros. Estas pueden ser físicas (presencia de tricomas, dureza de las hojas); fisiológicas (calidad nutritiva variable para cada hoja, expansión foliar rápida, verdecer tardío) o químicas, las cuales pueden ser constituidas o inducidas (mediante presión de herbivoría) pero que en todo caso pueden resultar tóxicas para los insectos o hacer a las plantas menos digeribles para al herbívoro a través de la producción de metabolitos secundarios (Barone y Coley 2002) tipo terpenoides (Viegas 2003), derivados fenólicos, taninos, cumarinas, alcaloides y flavonoides. Muchas especies de Asteraceae, entre ellas el botón de oro (Tithonia diversifolia (Hemsley) A. Gray, 1881), producen flavonoides (La Duke 1982) y lactonas sesquiterpénicas (De Simoni 2004) (metabolitos secundarios incoloros, amargos y relativamente estables) sustancias con efecto alelopático sobre otras plantas (Taiwo y Makinde 2005).
Recientemente, Giraldo (2005) encontró que árboles de arboloco (Montanoa quadrangularis Sch. Bip. 1864) plantados entre pastos exóticos eran significativamente más propensas o susceptibles al ataque de hormiga arriera que aquellas intercaladas y abonadas con botón de oro. Este fenómeno fue explicado en términos de la posibilidad de rechazo de las hormigas al botón de oro como planta para el forrajeo, ya sea por las características químicas de la planta que la hacen poco apetecible o porque las hojas de la planta causen un efecto antimicótico. Con el ánimo de dar respuesta a esta inquietud, se compararon las preferencias alimenticias de la hormiga arriera A. cephalotes, mediante la cuantificación del forrajeo sobre tres dietas vegetales, siendo una de ellas el botón de oro; a su vez, se estimaron los cambios en el tiempo de los patrones de consumo, de la hormiga, sobre recursos vegetales no óptimos para sus colonias. Como hipótesis de trabajo se planteó que la presencia del botón de oro como recurso alimenticio influye sobre el grado de herbivoría de la hormiga arriera.
Materiales y Métodos
Sitio de estudio. Todos los ensayos se desarrollaron entre octubre de 2005 y abril de 2006 en la Estación Experimental del Departamento de Biología de la Universidad del Valle, situada en Cali (3º27’26”N, 76º31’42”W), a 1.070 msnm, con temperatura y humedad relativa promedios de 24,3ºC y 75%, respectivamente.
Colonias. Siete núcleos (reinas de hormiga arriera con nidos incipientes) se obtuvieron en inmediaciones de la Plaza de Toros de Cali y se transportaron a la Estación Experimental, donde se adecuaron para construir colonias independientes, cada una constituida por una caja plástica rectangular y transparente, en la cual se estableció la cámara de cultivo y cuatro cajas de menor tamaño, transparentes, conectadas mediante mangueras de polivinilo a cada lado. Una vez las hormigas “escogieron” una de estas cajas menores como basurero, las tres restantes se emplearon posteriormente como puntos de forrajeo en los ensayos de preferencia. Cada caja central se cubrió con cartón con el fin de brindar oscuridad al cultivo del hongo, simulando las condiciones naturales (Fig. 1) y el conjunto se dispuso sobre dos mesas rectangulares.
Ensayos de preferencia. Los nidos se numeraron de uno a siete y se colocaron en las mesas en orden numérico con orientación norte-sur. Por un lapso de cuatro meses, a intervalos de 21 días, se les ofreció a las colonias la posibilidad de escoger entre raciones vegetales de hojas de mango (Mangifera indica Linneaus), camarón (Pachystachys lutea Nees) y botón de oro (Tithonia diversifolia). Estas raciones se depositaron en las cajas de forrajeo asignadas.
El alimento se obtuvo en las inmediaciones de la Estación Experimental del Departamento de Biología de la Universidad del Valle, sin tratamientos químicos ni abonos. Las hojas cortadas manualmente se lavaron, secaron, midieron y pesaron antes de ser ofrecidas a las colonias. Después de 24 horas, el material se midió para estimar el área foliar forrajeada. A su vez, se realizaron observaciones de comportamiento de las hormigas frente a las dietas ofrecidas y el crecimiento del hongo simbionte dentro de la cámara de cultivo. Para este objetivo, las cámaras centrales, donde se encontraba el cultivo del hongo se pusieron sobre papel milimetrado para estimar sus dimensiones antes y al finalizar los ensayos. La altura, ancho y largo de los extremos del hongo, se midieron con un calibrador pie de rey.
Después de depositar las raciones de las tres plantas en el interior de las cajas se realizaron durante una hora diaria observaciones de la conducta de las hormigas frente a la dieta, teniendo en cuenta cuál planta era forrajeada primero y si las hojas eran aprovechadas en su totalidad o si algunos fragmentos eran desechados. Para evitar potenciales sesgos relacionados con el sitio, los nidos se rotaron, en el sentido de las manecillas del reloj, un cuarto de giro y se trasladaron, pasando el último del lado derecho a ser el primero en lado izquierdo, cada tres días. Antes del inicio de los ensayos y, por cuatro meses, las colonias se alimentaron con lo que se denominó una dieta neutra (avena, miel y agua), con el fin de no inducir preferencias de los nidos por alguna de las dietas en ensayo. Al finalizar cada ensayo, 21 días, se retomó la dieta neutra por espacio de 25 días. Los datos se compararon con la tasa de herbivoría sobre botón de oro teniendo en cuenta el material desechado por cada colonia.
Análisis estadístico. Las hojas se pesaron en una balanza electrónica. El área foliar forrajeada se estimó con ayuda de unas plantillas, similares a las descritas por Giraldo (2005), elaboradas con papel milimetrado, acetatos y marcador de tinta indeleble.Sobre el acetato (previamente cuadriculado) se calcaron tres hojas de cada planta, de diferentes tamaños, representativas del material suministrado a las colonias. El área de las hojas se estimó contando la cantidad de cuadros incluidos dentro del calcado en el acetato, equivalentes a 1cm2. Debido a la irregularidad que presentan las hojas de botón de oro, éstas no se midieron con plantillas sino que se calcaron individualmente y midieron sobre papel milimetrado. Se calcularon los porcentajes de herbivoría parcial y total y los promedios para cada una de las dietas y se compararon mediante una ANOVA de medidas repetidas y pruebas de PostANOVA de Tukey HSD, usando el programa STATISCA 6 (StatSoft 2001).
Resultados
Ensayos. Aunque no cuantificado, se observó durante los ensayos que las hormigas iniciaron tareas de reconocimiento y limpieza independiente del tipo de dieta ofrecida. En contraste, las actividades de corte y transporte de fragmentos al interior de la cámara de cultivo se realizaron aparentemente siguiendo un orden de prioridad: primero el follaje de mango, seguido por el de camarón y, en última instancia, el de botón de oro. En el ensayo dos, en todos los nidos se observó que las tareas de limpieza, reconocimiento y corte de las hojas, se realizaron más rápido que en el Ensayo 1. En éste, las obreras forrajeras iniciaron el corte del follaje de mango y camarón simultáneamente, mientras que el sobre el follaje de botón de oro se inició poco después. En este mismo, los porcentajes de herbivoría total sobre mango y camarón fueron altos, contrastando con aquellos registrados sobre el botón de oro (Fig. 2).
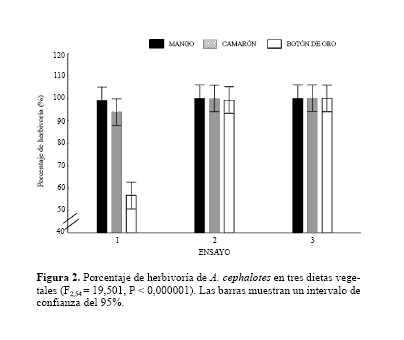
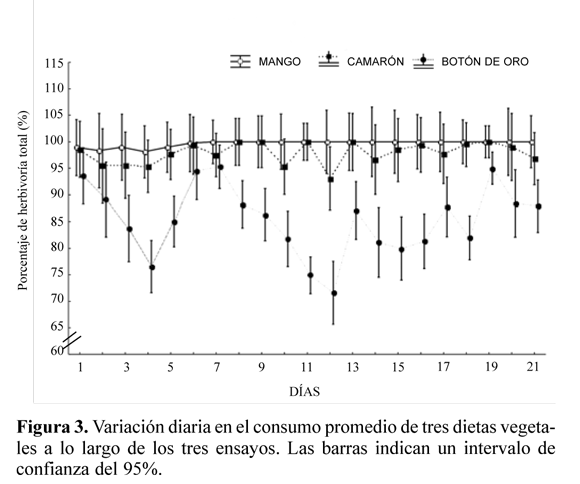
Hubo marcada preferencia de las hormigas por el follaje de mango (F40.1080 = 3.3366, P < 0,000001) siendo su comportamiento de forrajeo continuo y su tasa herbivoría por encima del 90%. Un patrón similar pero con una tasa de herbivoría ligeramente inferior se obtuvo con el camarón. En contraste, el comportamiento de forrajeo exhibido para la dieta del botón de oro fue bastante irregular, con altibajos a lo largo de los días y tendencia a la disminución en la tasa de herbivoría; solo al final del ensayo se observó un aumento en el forrajeo sobre esta planta (Fig. 3).
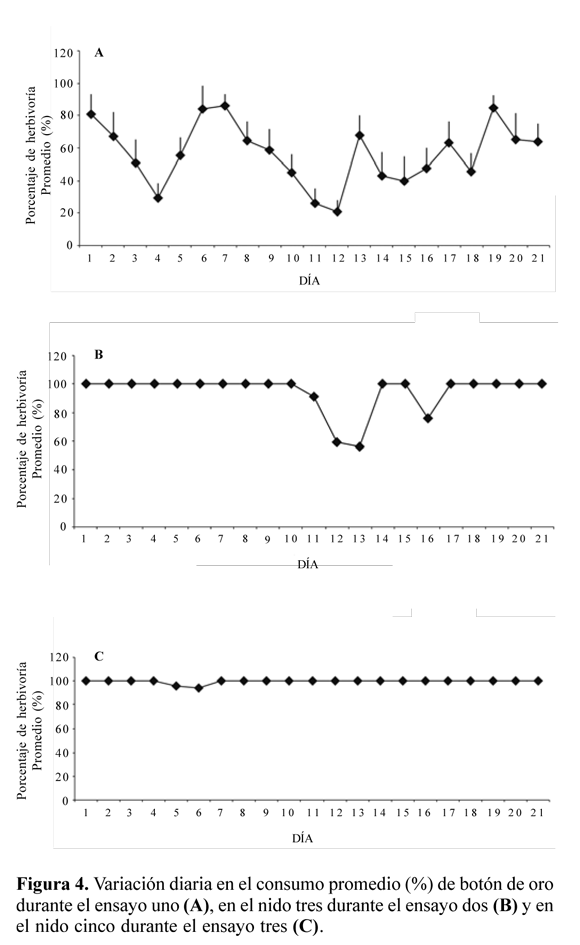
Al estudiar las colonias, por separado y por ensayo, se observa como A. cephalotes presenta cambios temporales en sus preferencias forrajeras. En el primer día del ensayo uno, con excepción de la colonia número 1, forrajearon más del 80% de la hoja de botón de oro, pero su consumo no se mantuvo y, por el contrario, se presentó un comportamiento irregular a lo largo de los siguientes días (Fig. 4A), alcanzando valores de cero. Caso contrario sucedió con las hojas de mango, cuyo porcentaje de consumo no fue inferior al 70% y después del sexto día de experimentación se mantuvo en el 100%. Los porcentajes de consumo para el camarón durante este ensayo fueron similares a aquellos del mango. Su consumo fue continuo y no inferior al 85% en promedio.
En contraste a los resultados del ensayo uno, el consumo promedio de botón de oro se aproximó al 100%, en el ensayo dos. Sólo el nido tres presentó un valor promedio ligeramente inferior, de 94,4%. Cabe anotar que, por cuatro días, sin explicación aparente, las obreras del nido tres no forrajearon en botón de oro, dejando hasta el 54% del tejido foliar intacto (Figura 4B). Finalmente, en el ensayo tres, el consumo de botón de oro no presentó diferencia con respecto al promedio en todos los nidos. Durante este periodo el porcentaje de consumo de botón de oro, mango y camarón fue del 100 % en todas (Fig. 4C las colonias, a excepción de la cinco. Al quinto y sexto día de iniciado el ensayo, las obreras de esta colonia forrajearon, respectivamente, el 96 y 94% de las hojas de botón de oro ). No se presentaron diferencias significativas entre las colonias (F = 0,785, g.l. = 120, P = 0,95), comportándose como repeticiones dentro de los ensayos. Aparentemente, el rango de tamaño de las colonias no influyó sobre la herbivoría de las dietas ofrecidas. Sin embargo, los efectos de los ensayos (F = 3,370, g.l. = 378, P = 0,0001) y las dietas vegetales (F = 2,446, g.l. = 290, P = 0,0001) sobre el porcentaje de herbivoría fueron altamente significativos.
Los ensayos dos y tres no presentaron diferencias significativas entre ellos (P = 0,99), pero sí con respecto al ensayo uno (P = 0,0001). Las dietas causaron un efecto en la experimentación, siendo el botón de oro la dieta responsable de estas diferencias (P < 0,001), esta situación posiblemente como consecuencia de los bajos porcentajes de herbivoría sobre el botón de oro durante el primer ensayo.
Hongo simbionte. En todas las colonias el hongo simbionte presentó crecimiento, principalmente en altura, durante el primer ensayo del experimento. En las colonias donde existían varios fragmentos de hongo simbionte, las hormigas los unieron, construyendo así un cultivo grande donde ubicaron a la reina. Es interesante anotar que el alto porcentaje de crecimiento del hongo simbionte para esta fase coincidió con una baja tasa de herbivoría o baja preferencia sobre el botón de oro (Tabla 1) o en algunos casos (colonia seis y siete) un alto consumo de esta planta condujo a una relativa disminución en el crecimiento del hongo.
En el ensayo uno se observó a las hormigas obreras de todas las colonias transportar fragmentos, aún verdes, de botón de oro a la cámara de desechos sin detenerse en la cámara de cultivo del hongo simbionte, lo cual sugiere que este material no es el más apropiado como sustrato para el cultivo del hongo. Dicho comportamiento no se observó en ninguno de los ensayos siguientes. Cabe anotar que en varias ocasiones, después de 24 horas de haber sido colocada la ración de follaje correspondiente, se observaron fragmentos de hojas de camarón y botón de oro dentro de la cámara central de las colonias, pero no fragmentos de hojas de mango.
La colonia dos presentó un porcentaje elevado de herbivoría sobre botón de oro, muy similar a las colonias de mayor tamaño. A lo largo del primer ensayo las hormigas de esta colonia depositaron cortes de follaje de botón de oro en la caja de desechos. También en la cámara de cultivo se observó que los fragmentos de botón de oro fueron acumulados en una de las esquinas de la caja y sin ser aprovechados para el cultivo como ocurrió con los cortes de mango y camarón. Estas observaciones indican que las hormigas forrajearon el botón de oro, mas no utilizaron la totalidad del material recolectado, como sucedió regularmente con el mango.
Las colonias seis y siete presentaron los más bajos porcentajes de crecimiento, coincidentes con altas tasas de consumo de botón de oro (Tabla 1). En este caso no se observaron con frecuencia cortes de hojas de esta planta al interior de la cámara de cultivo, como tampoco en la cámara de desechos de los nidos, lo que permite deducir que estas colonias utilizaron en mayor proporción el follaje de botón de oro para cultivar el hongo simbionte. Éste, presentó un crecimiento leve durante los ensayos dos y tres, en todas las colonias y no comparable con el alcanzado en el Ensayo 1. Aún así, al finalizar este estudio se observó que el hongo abarcaba gran parte de las cámaras de las colonias, formando un solo bloque.
Discusión
En términos generales, nuestros resultados dan soporte a observaciones e hipótesis previas. En primera instancia sobre los grados de preferencia y selección del recurso por parte de las hormigas cortadoras de hojas y, en segundo lugar, a la capacidad intrínseca de esta especie para responder ante presiones selectivas. Ambos aspectos ameritan ser analizados a la luz de investigaciones previas.
La marcada preferencia de la forrajeras por las hojas de mango reitera lo expresado por Cherrett (1972) y Howard (1987, 1988) y comprobado por Knapp et al. (1990), Franzel y Farji-Brener (2000), Leal y Oliveira (2000), que estas hormigas exhiben un marcado patrón de preferencia por algunas plantas y tejidos vegetales, el cual es independiente de la abundancia y distancia con respecto del nido de éstas (Rockwood 1976). Éste está condicionado, en gran medida, por el estado fisiológico (dureza) de la planta (Cherrett y Seaforth 1970; Howard 1988; Barone y Coley 2002). No obstante, dado que el consumo de botón de oro a lo largo del estudio fue menor que el de las otras dos dietas (P < 0,0001, Prueda de Tukey) y que a su vez, se presentó una disminución en el desarrollo del hongo simbionte, hay indicios que la preferencia también está mediada por otros factores como por ejemplo los metabolitos secundarios en el follaje de esta planta (La Duke 1982; De Simoni 2004; Taiwo y Makinde 2005) los cuales, muy probablemente, influyeron sobre las decisiones de forrajeo de A. cephalotes. En un estudio de campo, Giraldo (2005) observó que colonias de esta hormiga no cosechaban botón de oro, a pesar de ser éste un recurso abundante en su área de forrajeo, y que presentaron preferencia por el follaje de arboloco (M. quadrangularis) siempre y cuando los árboles no hubieran sido fertilizados con biomasa de botón de oro.
Franzel y Farji-Brener (2000) sugieren que el aprovechamiento de las plantas por parte de las hormigas al momento de forrajear se debe a una jerarquización de las especies en función de su abundancia relativa, o a que las hormigas presentan preferencias, forrajeando más sobre especies que consideran de mayor calidad, como ha sido sugerido en otros estudios (Berish 1986; Howard 1987, 1988). Los resultados de este estudio indican que la hormiga A. cephalotes presenta una combinación de estrategias, forrajeando de manera preferencial sobre el mango pero aprovechando el follaje de botón en reacción a una baja oferta de la especie preferida.
Observaciones realizadas por Knapp et al. (1990) de colonias experimentales de Acromyrmex octospinosus (Reich), donde partes de algunas plantas ofrecidas como recurso forrajero sólo fueron cortadas, pero no introducidas al nido, apoyan la afirmación de que las hormigas pueden diferenciar sustancias químicas al palpar las hojas o lamer los bordes de los cortes (Forti et al. 2000) y que distinguen sustancias tóxicas que impiden que éstos sean acarreados al interior del nido (Escobar et al. 2002). Esto sucede después de que las colonias han detectado que este material está causando daño al interior del nido (Escobar et al. 2002).
Aunque la literatura en el tema es profusa es posible destacar los resultados obtenidos por Serna y Correa (2003) con extractos hexánicos y diclometano de hojas de tomate, Lycopersicon esculentum (Mill., 1768) (Solanaceae) las cuales presentaron alta actividad fagoinhibidora en concentraciones relativamente bajas (33 y 44 ppm) al impregnar hojas de Acalipha wilkesiana (Muell.-Arg.) (Euphorbiaceae), utilizadas como dieta en colonias experimentales de A. cephalotes. En el caso de especies de la familia Asteraceae, que incluye al botón de oro, existen varias que presentan lactonas sesquiterpénicas, sustancias biológicamente activas con efectos cardiotónicos, neurotóxicos y citotóxicos sobre células de diferentes vertebrados (Popich et al. 2005) e invertebrados.
Por ejemplo, las lactonas sesquiterpénicas de Cyrtocymura cincta (Griseb.) H. Robinson 1987 en una concentración de 600 ppm ocasionaron una mortalidad de 100% sobre larvas de Spodoptera latifascia (Walker 1856). Con una concentración de 300 ppm se registró una prolongación del tiempo de desarrollo de los estados larvales, disminución hasta 40% de la oviposición y una pérdida completa de viabilidad de los huevos (Popich et al. 2005). El glaucolideo-A es una lactona sesquiterpénica presente en plantas del género Vernonia que inhibe el apetito de las larvas de lepidópteros (Viegas 2003).
Otros triterpenoides presentes en Junellia aspera (Gillies & Hook) 1940 (Verbenaceae) resultan altamente tóxicos para el gorgojo Tribolium castaneum (Herbst, 1797), mientras que el ácido maslínico incrementa la duración de su estadio pupal (Pungitore et al. 2005). Los sesquiterpenos aislados de partes aéreas de Tessaria absinthioides (Hook. & Arn.) DC. 1836 (Asteraceae) pueden afectar el sistema endocrino de T. castaneum, al causar alteraciones en los estadios larvales, un incremento en la duración del estadio pupal, alteraciones morfológicas y muerte por inanición después de largos periodos de exposición (García et al. 2003).
Un aspecto importante de resaltar fue el consumo irregular de botón de oro y su aumento en el segundo y tercer ensayos sin el evidente desarrollo del hongo simbionte. Según Levin (1976), los organismos generalistas, como las hormigas arrieras, pueden aumentar su tolerancia a productos secundarios como consecuencia de haber sido forzados a consumirlos cuando la vegetación es pobre en especies. Por lo tanto, es posible que ésta sea la respuesta a un proceso de inducción y asimilación metabólica a la planta por las colonias, iniciado en el primer ensayo. A este nivel cabe agregar que en las hormigas cortadoras de hojas, los mecanismos de detoxificación parecen estar ubicados en el hongo simbionte, a través de un sistema enzimático inducible, capaz de inactivar compuestos extraños provenientes de las plantas usadas como forraje (Levin 1976). Por su parte, Cedeño-León (1984) afirma que la interacción entre la hormiga y el hongo depende mucho de la habilidad de la primera para seleccionar materiales vegetales que no sobrepasen la capacidad de detoxificación del hongo.
El desechar los cortes de botón de oro, durante el Ensayo 1, revela la no preferencia de las hormigas por el follaje ofrecido, coincidiendo con lo observado por Knapp et al. (1990) donde hormigas A. octospinosus realizaron las tareas de reconocimiento y limpieza del material vegetal ofrecido, mas no lo cortaron y en los pocos casos en que lo hicieron, los fragmentos fueron trasportados al basurero. Asumiendo que T. diversifolia produce metabolitos secundarios, esta actividad puede darse también como respuesta a un posible efecto antimicótico, generado por las lactonas sesquiterpenoides presentes en esta planta (De Simoni 2004; Taiwo y Makinde 2005; Obafemi et al. 2006) o al sabor amargo de algunos compuestos presentes en las hojas de esta planta (De Simoni 2004) el cual es percibido por las hormigas al momento de hacer el corte de las hojas y tener contacto con los jugos celulares.
Durante los Ensayos 2 y 3 las colonias no depositaron material vegetal en la cámara de desechos como tampoco se encontraron vestigios de éste cortado y sin utilizar al interior de la cámara de cultivo, transcurridas 24 horas. Estas observaciones concuerdan con lo descrito por Della Lucia (1993), y sugieren que el crecimiento de la población de las colonias, aumenta la capacidad de forrajeo y procesamiento de los fragmentos vegetales para el cultivo del hongo simbionte.
Las diferencias en el porcentaje de crecimiento del hongo simbionte, sugieren la presencia de compuestos en las hojas de de T. diversifolia con posibles efectos antimicrobial y antimicótico sobre el hongo pero sin directa toxicidad para las hormigas como sí fue registrado por Hebling et al. (2000), quienes observaron, bajo condiciones de laboratorio, que el hongo simbionte de A. sexdens L. decreció en aquellas colonias que cosecharon como único recurso forrajero hojas de Ipomoea batatas (L.) (Convolvulaceae), elevando la tasa de mortalidad en obreras. Ribeiro et al. (1998), observaron la inhibición en el crecimiento del hongo simbionte Leucoagaricus gonglyophorus (Moeller) en más del 40%, con extractos de hojas de Sessamum indicum (L.) (Pedaliaceae). Lapointe et al. (1996) registraron que el peso seco del hongo simbionte de A. landolti se reduce hasta en un 80% en cultivares de Brachiaria spp. resistentes a la hormiga, en comparación con el peso del hongo de aquellas colonias de la sabana. Más recientemente, Valderrama et al. (2007) registran que colonias alimentadas con T. diversifolia presentaron una reducción del 100% en el tamaño del hongo al día 45 del experimento y una mortalidad en hormigas del 83,3%, mientras que aquellas alimentadas con Canavalia ensiformis (L.) alcanzaron una máxima reducción en el volumen del hongo (95,3%) a los 57 días y 66,6% de mortalidad.
El hallazgo realizado por Obafemi et al. (2006) de que los extractos de hojas de T. diversifolia inhiben el crecimiento de más de 10 bacterias (gram positivas y gram negativas) y del hongo Candida albicans (Robin), agregado a las observaciones de Currie et al. (2006) quienes encontraron que hormigas Attini hospedan bacterias del género Pseudonocardia sp. en lugares específicos del exoesqueleto y que debido a su capacidad de producir antibióticos, posiblemente, están relacionadas con el control de Escovopsis sp. permite pensar que T. diversifolia puede actuar de manera negativa sobre el desarrollo de estas bacterias, lo cual favorecería el crecimiento de Escovopsis sp. y por ende una baja tasa de crecimiento del hongo simbionte.
Aunque nuestros resultados no permiten confirmar que los metabolitos secundarios presentes en el botón de oro tengan un efecto netamente antimicótico si marcan una tendencia en esa dirección sin que se descarte que su consumo afecte la fisiología de las hormigas. Por otro lado es importante tener en mente que nuestro estudio el empleo de los otros dos recursos vegetales puede contribuir a neutralizar el impacto de los metabolitos secundarios del botón de oro en la colonia, por lo cual a futuro se plantea una investigación dirigida a estudiar los efectos de extractos de T. diversifolia sobre las colonias de hormigas arrieras, separando su impacto sobre las hormigas, el hongo simbionte, o sobre ambos.
Agradecimientos
A Carolina Giraldo por su valiosa colaboración durante la investigación. A CIPAV por la financiación del proyecto. Al personal a cargo de la microestación de Biología en la Universidad del Valle. A todas las personas que de una u otra forma colaboraron para la realización de esta investigación y en especial a los revisores anónimos que al efectuar una revisión crítica del documento lo enriquecieron con sus comentarios y sugerencias.
Literatura citada
BARONE, J. A.; COLEY, P. D. 2002. Herviborismo y las defensas de las plantas. 465-492. En Guariguata, M. R.; Kattan, G.H. (eds). 2002. Ecología y Conservación de Bosques Neotropicales. 1ª. Edición, Ediciones LUR. Cartago, Costa Rica. 692 p. [ Links ]
BERISH, C. W. 1986. Leaf-cutting ants (Atta cephalotes) select nitrogen-rich forage. American Midland Naturalist 115: 268-276. [ Links ]
CEDEÑO-LEON, A. 1984. Los bachacos: aspectos de su ecología. Fondo editorial: Acta Científica Venezolana. 73 p. [ Links ]
CHERRETT, J. M. 1972. Some factors involved in the selection of vegetable substrate by Atta cephalotes (L.) (Hymenoptera, Formicidae) in the tropical rain forest. Journal Animal Ecology 41: 647-660. [ Links ]
CHERRETT, J. M.; SEAFORTH, C. E. 1970. Phytochemical arrestants for the leaf-cutting ants, Atta ceohalotes (L.) and Acromyrmex octopinosus (Reich) with some notes on the ants’ response. Bulletin of Entomological Research 59: 615-625. [ Links ]
CURRIE, C.; SCOTT, J.; SUMMERBELLS, R.; MALLOCH, D. 1999. Fungus-growing ants use antibiotic-producing bacteria to control garden parasites. Nature 398: 701-704. [ Links ]
CURRIE, C.; POULSEN, M.; MENDENHALL, J.; BOOMSMA, J.; BILLEN, J. 2006. Coevolved crypts and exocrine glands support mutualistic bacteria in Fungus-growing ants. Science 311: 81-83. [ Links ]
DE SIMONI, P. C. 2004. Efeito da variação sazonal na produção de compostos ativos em Tithonia diversifolia (Hemsl) Gray, utilizando ensaio com microorganismos. Tesis de postgrado. Escuela Superior de Agricultura. Universidad de Sao Paulo, Sao Paulo– Brasil. 46 p. [ Links ]
DELLA LUCÍA, T. M. C. (ed.). 1993. As formigas cortadeiras. Folha de Viscosa. Viscosa. Brasil. 262 p. [ Links ]
DELLA LUCÍA, T. M. C. 2003. Hormigas de importancia económica en la región Neotropical, pp. 337-349. En: Fernández, F. (ed.). Introducción a las Hormigas de la Región Neotropical. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá. Colombia. 398 p. [ Links ]
ESCOBAR, R.; GARCÍA, F.; RENTERÍA, N. Y.; NEITA, J. C. 2002. Manejo y control de hormiga arriera (Atta spp y Acromyrmex spp) en sistemas de producción de importancia económica en el departamento del Chocó. Quibdó. Cartilla No. 2.22 p. [ Links ]
FARJI-BRENER, A. 1992. Modificaciones al suelo realizadas por hormigas cortadoras de hojas (Formicidae, Attini): una revisión de efectos sobre la vegetación. Asociación Argentina de Ecología. Ecología Austral 2: 87-94. [ Links ]
FERNÁNDEZ, J. V.; JAFFE, K. 1995. Dano economico causado por populacoes de formigas Atta laevigata (F. Smith) em plantacoes de Pinus caribaea Mor. E elementos para o manejo da praga. Annais da Sociedade Entomológica do Brasil 24: 287- 289. Colombia. 171 p. [ Links ]
FORTI, L. C.; PROTTI, A. P.; RAMOS, V. M. 2000. Biología e comportamento de Atta sexdens rubropilosa (Hymenoptera, Formicidae): implicações no seu controle. Série Técnica IPEF 13: 103-114. [ Links ]
FRANZEL ,C.; FARJI- BRENER, A. G. 2000. ¿Oportunistas o selectivas? Plasticidad en la dieta de la hormiga cortadora de hojas Acromyrmex lobicornis en el noreste de la Patagonia. Ecología Austral 10: 159-168. [ Links ]
GARCÍA, M.; SOSA, M. E.; DONADEL, O. J.; GIORDANO, O. S.; TONN, C. E. 2003. Allelochemical effects of eudesmane and eremophilane sesquiterpenes on Tribolium castaneum larvae. Journal of Chemical Ecology 29: 175-187. [ Links ]
GIRALDO, C. 2005. Efecto del botón de oro Tithonia diversifolia sobre la herbivoría de hormiga arriera Atta cephalotes en una plantación de arboloco Montanoa quadrangularis. Tesis de pregrado. Cali, Colombia, Universidad de Antioquia, CIPAV, Universidad del Valle, Facultad de Ciencias. 82 p. [ Links ]
GÓMEZ, A. L. E. 2001. Anotaciones para el manejo ambiental de ciertos ecosistemas: “Recopilación de cursos, conferencias y artículos sobre ecología, etología y medio ambiente, utilizados en enseñanza formal y no formal des de 1991” Segunda edición. Medellín. Colombia.171 p. http://www.bibliotecavirtualantioquia.udea.edu.co/pdf/51/51_1190384414.pdf. Fecha último acceso: [10 diciembre 2006]. [ Links ]
HEBLING, M. J. A.; BUENO, O. C.; MAROTI P, S.; PAGNOCCA, F. C.; DA SILVA, O. A. 2000. Effects of leaves of Ipomoea batatas (Convolvulaceae) on nest development and on respiratory metabolism of leaf-cutting ant Atta sexdens L. (Hym., Formicidae). Journal of Applied Entomology 124: 249-252. [ Links ]
HÖLLDOBLER, B.; WILSON, E. O. 1990. The ants. Harvard University Press, Cambridge. EE.UU. [ Links ]
HOWARD, J. J. 1987. Leaf cutting ant diet selection: the role of nutrients, water, and secondary chemistry. Ecology 68: 503-515. [ Links ]
HOWARD, J. J. 1988. Leaf-cutting and diet selection: Relative influence of leaf chemistry and physical features. Ecology 69: 250-260. [ Links ]
KNAPP, J. J.; HOWSE, P. E.; KERMARREC, A. 1990. Factors controlling foraging patterns in the leaf-cutting ant Acromyrmex octospinosus (Reich), pp. 382-409. En: Vander Meer R.K.; Jaffe, K.; Cedeño A. (eds.). Applied Mirmecology: A world perspective. Westview Press Boulder, San Francisco, Oxford. [ Links ]
LA DUKE, J. C. 1982. Flavonoid chemistry and systematics of Thitonia (Compositae). American Journal of Botany 69: 784-792. [ Links ]
LEAL, I. R.; OLIVEIRA, P. S. 2000. Foraging ecology of attine ants in a neotropical savanna: seasonal use of fungal substrate in the cerrado vegetation of Brazil. Insectes Sociaux 47: 376-382. [ Links ]
LAPOINTE, S. L.; GARCIA, C. A.; SERRANO, M. S. 1990. Control of Acromyrmex landolti in the improved pastures of Colombian Savanna, pp. 511-518. En: Vander Meer R.K.; Jaffe, K.; Cedeño A. (eds.). Westview Press Boulder, San Francisco, Oxford. [ Links ]
LAPOINTE, S. L.; SERRANO, M. S.; CORRALES, I. I. 1996. Resistance to leafcutter Ants (Hymenoptera: Formicidae) and inhibition of their fungal sybiont by tropical forage grasses. Journal of Economic Entomology 89: 757-765. [ Links ]
LEVIN, D. 1976. The chemical defences of plant pathogens and herbivores. Annual Review of Ecology and Systematics 7: 121- 159. [ Links ]
LÓPEZ, E.; ORDUZ, S. 2004. Metharizium anisoplae y Trichoderma viride controlan colonias de Atta cephalotes en campo mejor que un insecticida químico. Revista Colombiana de Biotecnología 4: 71-78. [ Links ]
MAcKAY, W.; MAcKAY, E. 1986. Las hormigas de Colombia: arrieras del género Atta (Hymenoptera: Formicidae). Revista Colombiana de Entomología 12: 23-30. [ Links ]
OBAFEMI, C. A.; SULAIMON, T. O.; AKINPELU D, A.; OLUGBADE, T. A. 2006. Antimicrobial activity of extracts and germicranolide-type sesquiterpene lactona from Tithonia diversifolia leaf extract. African Journal of Biotechnology 5: 1254- 1258. [ Links ]
POPICH, S.; ALVARES VALDES, D.; BARDON, A. 2005. Toxicidad de terpenoides de Cyrtocymura cincta (Asteraceae) sobre el ciclo de vida de Spodoptera latifascia (Lepidoptera: Noctuidae). Boletín de sanidad vegetal “Plagas”. Ministerio de Agricultura y Alimentación de España. 31: 179-186. [ Links ]
POSADA-FLÓREZ, J. 1997. Infección natural de Metharizium anisoplae sobre la hormiga arriera. Cenicafé 48: 204-208. [ Links ]
PUNGITORE, C. R.; GARCÍA, M.; GIANELLO, J. C.; TONN, C. E.; SOSA, M. E. 2005. Lethal and sublethal effects or tripernes from Junellia aspera (Verbenaceae) on the grain storage insect Tribolium castaneum (Coleoptera: Tenebrionidae). Revista Sociedad Entomológica Argentina 64: 45-51. [ Links ]
RIBEIRO, S. B.; PAGNOCCA, F. C.; VICTOR, S. R.; BUENO, O. C.; HEBLING, M. J.; BACCI, JR M.; SILVA, O. A.; FERNANDES, J. B.; VIEIRA, P. C.; SILVA, M. F. G. 1998. Activity of Sesame leaf extracts against the symbiotic fungus os Atta sexdens L. Anais da Sociedade Entomológica do Brasil 27: 421-426. [ Links ]
ROCKWOOD, L. L. 1976. Plant selection and foraging patterns in two species of leaf-cutting ants (Atta). Ecology 57: 48-61. [ Links ]
SERNA, F. J.; CORREA, J. A. 2003. Extractos de hojas de tomate Lycopersicon esculentum como fagoinhibidores de Atta cephalotes. Agronomía Colombiana 21: 142-153. [ Links ]
STATSOFT . 2001 STATISTICA (data analysis software system), version 6. www.statsoft.com. [ Links ]
TAIWO, L. B.; MAKINDE, J. O. 2005. Influence of water extract of Mexican sunflower (Tithonia diversifolia) on growth of cowpea (Vigna unguiculata). African Journal of Biotechnology 4: 355- 360. [ Links ]
VALDERRAMA, E. I.; HERRERA, J.; GIRALDO, C.; MONTOYALERMA, J. 2007. Efecto de Canavalia ensiformis y Tithonia diversifolia sobre colonias artificiales de hormigas cortadora de hojas Atta cephalotes. Resúmenes VI Coloquio de Insectos Sociales IUSSI- Sección Bolivariana. Higuerote, Edo. Miranda, Venezuela. Septiembre 25-27, pp. 39-40. [ Links ]
VALMIR, S. V.; DILLON, B. R. J.; DILLON, B. V. M.; REYNOLDS, B. S. E.; SAMUEL, R. I., 2004. Ocurrence of the antibiotic producing bacterium Burkholderia sp. in colonies of the leafcutting ant Atta sexdens rubropilosa. Microbiology Letters 239: 319-323. [ Links ]
VIEGAS, C. 2003. Terpenos com atividade inseticida: uma alternative para o controle químico de insetos. Química Nova 26: 390-400. [ Links ]
Recibido: 24-ene-2008 - Aceptado: 16-oct-2008