Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.34 no.2 Bogotá July/Dec. 2008
Efecto de un bioplaguicida sobre la actividad depredadora de Delphastus pusillus
(Coleoptera: Coccinellidae)
Effect of a biopesticide on the predatory activity of Delphastus pusillus (Coleoptera: Coccinellidae)
RICARDO PÉREZ1, JAVIER GARCÍA-GONZÁLEZ2 y ALBA MARINA COTES3
1 Biólogo. Laboratorio de Ecología y Comportamiento de Insectos. Grupo de Manejo Fitosanitario. Corporación Colombiana de Investigación Agropecuaria (Corpoica). Centro de Investigación “Tibaitatá”, Km 14 vía Mosquera (Cundinamarca). mperez@corpoica. org.co. Autor para correspondencia.
2 M. Sc. Ciencias Agrarias. Área de Prevención y Riesgo de Plagas. Instituto Colombiano Agropecuario (ICA) Edificio Cavipetrol, Carrera 13 No. 37-37 Piso 10, Bogotá, D.C. javier.garcia@ica.gov.co.
3 Ph. D. Investigador principal. Laboratorio de Control biológico. C.I., Tibaitatá. Corpoica. acotes@corpoica.org.co.
Resumen: Uno de los aspectos a considerar en el desarrollo de un bioplaguicida, es la determinación de su compatibilidad con otros agentes de control dentro de una estrategia de manejo integrado de plagas.Se determinó el efecto de un bioplaguicida con base en el hongo Lecanicillium lecanii, desarrollado para el control de la mosca blanca Trialeurodes vaporariorum, sobre la actividad depredadora de Delphastus pusillus. En un primer experimento, se determinó el consumo del depredador sobre ninfas previamente tratadas con el bioplaguicida a las 0, 24, 48, 72 y 96 horas después de aplicado el producto. En un segundo experimento, se determinó la preferencia de consumo del depredador por presas sanas o infectadas con L. lecanii. El consumo de ninfas disminuyó en relación con el aumento en el tiempo de infección de las presas. El mayor consumo se observó en el testigo (ninfas sanas) con un 64,1%, mientras que con presas infectadas a las 0, 24, 48, 72 y 96 horas el consumo fue de 39,6, 10,3, 11,4, 19,6 y 4,3% respectivamente. El depredador mostró preferencia por las presas sanas con un consumo del 41,0%, frente a un 2,3% de consumo sobre las presas infectadas. Los resultados sugieren que aunque el bioplaguicida puede tener un efecto indirecto sobre el depredador, la combinación de los dos agentes de control biológico puede ser compatible.
Palabras clave: Compatibilidad. Entomopatógeno. Lecanicillium lecanii. Trialeurodes vaporariorum.
Abstract: One of the aspects to consider in the development of a biopesticide is the determination of its compatibility with other control agents within an integrated pest management strategy. The effect of a biopesticide based on the fungus Lecanicillim lecanii, developed for the control of the whitefly Trialeurodes vaporariorum, on the predatory activity of Delphastus pusillus was determined. In a first experiment, the consumption of nymphs by the predator previously treated with the biopesticide was determined at 0, 24, 48, 72 and 96 hours after application of the product. In a second experiment, the consumption preference by the predator for prey that were healthy or infected with L. lecanii was determined. The consumption of nymphs decreased with the increase in time after prey infection. The greatest consumption was observed in the control treatment (healthy prey) with 64.1%, while with infected prey at 0, 24, 48, 72 and 96 hours the consumption was 39.6, 10.3, 11.4, 19.6 and 4.3% respectively. The predator showed a preference for healthy prey with a consumption of 41%, in comparison to 2.3% consumption of infected prey. The results suggest that although the biopesticide can have an indirect effect on the predator, the combination of the two biological control agents could be compatible.
Key words: Compatibility. Entomopathogen. Lecanicillium lecanii. Trialeurodes vaporariorum.
Introducción
La mosca blanca de los invernaderos, Trialeurodes vaporariorum (Westwood, 1856) (Hemiptera: Aleyrodidae), es considerada uno de los insectos plaga más limitantes para la producción agrícola en diferentes regiones del mundo. En Colombia, T. vaporariorum es la especie predominante en el trópico alto y en los valles interandinos atacando principalmente cultivos de fríjol, habichuela, tomate y papa (Buitrago 1992; Quintero et al. 2001); Oscilando las pérdidas entre un 25 y un 100%, dependiendo de factores de tipo biológico, ambiental y de manejo específico de la plaga (García-González 2003). Frente a esta situación, el control químico es sin lugar a dudas la principal, y en ocasiones la única herramienta para la regulación de la plaga (Cardona 1999). Sin embargo, la creciente ineficacia de los plaguicidas empleados para su control ha llevado a los agricultores a la aplicación desmedida de los mismos, incrementando los problemas de resistencia, la contaminación del ambiente y los efectos nocivos sobre la salud humana (Rodríguez y Cardona 2001).
En la búsqueda de alternativas sostenibles para el manejo de las moscas blancas, López–Ávila et al. (2001) realizaron el reconocimiento e identificación de enemigos naturales de las especies de mosca blanca de mayor incidencia en las regiones productivas de Colombia y Ecuador. Para T. vaporariorum, se reconocieron once especies de enemigos naturales potenciales, los cuales incluyeron al hongo entomopatógeno Lecanicillium (= Verticillium) lecanii (Zimmerman) (Zare y Gams, 2001) y al insecto depredador Delphastus pusillus (Le Conte, 1852) (Coleoptera: Coccinellidae).
Estudios posteriores realizados en el programa de manejo integrado de plagas de Corpoica, permitieron el desarrollo de un bioplaguicida con base en el hongo L. lecanii para el control de T. vaporariorum. Dicho producto ha demostrado su eficacia en campo, alcanzando niveles superiores al 70% en el control de la plaga (Jiménez 2002). Así mismo, se han adelantado estudios con el depredador D. pusillus con miras a su utilización dentro de una estrategia de manejo integrado. Este depredador puede alcanzar niveles de consumo sobre el estado de huevo y ninfa de la mosca blanca del 86% y del 25% respectivamente, en un período de 24 horas (García-González 2003).
En algunos casos el empleo de un único agente de control biológico no puede proveer una regulación suficiente o satisfactoria sobre la mosca blanca y por lo tanto, métodos de control adicionales se hacen necesarios (Roselyne 2005; Liu y Stansly 1999). Es así como el control biológico, mediante la utilización combinada de D. pusillus con hongos entomopatógenos de las especies Paecilomyces fumosoroseus (Wize) Brown y Smith, 1957 y Beauveria bassiana (Balsamo) Vuillemin, 1912, han demostrado mejorar los niveles de control sobre las poblaciones de la mosca blanca (Wraight et al. 1998; Osborne y Landa 1992). Con este panorama, es posible pensar en un programa para el control de la mosca blanca donde se involucre el bioplaguicida y el depredador. No obstante, existe muy poca información relacionada con la compatibilidad entre L. lecanii y D. pusillus. De este modo, el desarrollo de una estrategia de manejo efectiva, en la cual los dos agentes de control sean integrados, requiere en primera instancia, de un profundo conocimiento de sus interacciones. En esta investigación se evaluaron dos aspectos de la interacción entre el entomopatógeno y el depredador: (1) el efecto de la exposición indirecta del bioplaguicida sobre la capacidad de consumo de D. pusillus y (2) la habilidad del depredador para discriminar entre ninfas sanas y ninfas infectadas con L. lecanii.
Materiales y Métodos
El trabajo se llevó a cabo en el centro de investigación “Tibaitatá” de la Corporación Colombiana de Investigación Agropecuaria –Corpoica-, localizado en el municipio de Mosquera (Cundinamarca). El mantenimiento de las colonias de los insectos T. vaporariorum y de D. pusillus así como la fase experimental, se realizaron en los laboratorios e invernaderos del Programa de Manejo Integrado de Plagas de dicho centro.
Colonias de Insectos. En condiciones de invernadero se mantuvo una colonia de T. vaporariorum sobre plantas de fríjol (Phaseolus vulgaris L., 1753) variedad ICA-Pijao sembradas en materas. En estas plantas se obtuvieron los diferentes estados de la mosca blanca, los cuales sirvieron de alimento al insecto depredador en el proceso de cría y en los experimentos propuestos.
La colonia de D. pusillus se inició con adultos recolectados en cultivos de algodón (Gossypium hirsutum L., 1763) del municipio de Espinal (Tolima). Estos adultos se ubicaron por parejas en cajas de Petri que contenían papel absorbente humedecido y trozos de hojas de fríjol infestadas con estados inmaduros de la mosca blanca. Las hojas se renovaron periódicamente con el fin de retirar las posibles posturas así como para proporcionarle alimento fresco a las parejas de adultos. Una vez emergidas las larvas del depredador, se separaron y ubicaron en nuevas cajas de Petri hasta que alcanzaron el estado adulto. Con los adultos se continuó el ciclo de vida del depredador. La cría de D. pusillus se mantuvo a 21 ± 4ºC, 50- 70% HR y un fotoperíodo de 14:10 h (luz: oscuridad).
Bioplaguicida. La producción del bioplaguicida se realizó en el laboratorio de control biológico de Corpoica según metodología estandarizada por Villamizar y Cotes (2006). El bioplaguicida consiste en un polvo mojable diseñado para reconstituirse en la emulsión resultante de la mezcla de una base autoemulsificable y agua. Dentro del polvo se encuentran los conidios del hongo entomopatógeno, que se aplica para el control de T. vaporariorum a una dosis de 1x107 conidios/ml. Por su parte, la base autoemulsificable contiene una mezcla de aceite vegetal (80%), tensioactivos (10%) y un agente emulgente (10%), todos ellos inocuos y comúnmente empleados en la industria cosmética y de alimentos. Para garantizar la estabilidad de la emulsión, la base autoemulsificable y el agua se combinan en relación 1:200 (v/v) respectivamente. En su composición el bioplaguicida también incluye un protector solar que absorbe la luz UV y adherentes que le proporcionan protección en el momento de su aplicación en campo. Las ninfas infectadas se obtuvieron con ayuda de un microaspersor aplicando el bioplaguicida directamente sobre las plantas de fríjol infestadas a razón de 0,9 ± 0,1 ml de producto por foliolo.
Bioensayos
Efecto del bioplaguicida en la capacidad de consumo de adultos de D. pusillus. En cajas de Petri de 6 cm de diámetro se dispuso una capa de agar-agua al 5% y sobre ésta un disco foliar de 2,8 cm de diámetro infestado con ninfas en segundo instar de mosca blanca. Las ninfas se asperjaron con el bioplaguicida para luego suministrarlas al depredador a las 0, 24, 48, 72 y 96 horas de infección. Previo a la introducción de D. pusillus, los adultos se sometieron a un período de ayuno por 24 h, con el fin de estimular el consumo de las presas. Posteriormente, los adultos se introdujeron en las arenas experimentales sobre las ninfas infectadas. Estos tratamientos se compararon con un testigo, que consistió en la liberación del depredador sobre presas asperjadas con agua destilada. El experimento se organizó bajo un diseño completamente aleatorio, con seis tratamientos y cinco repeticiones por tratamiento.
Transcurridas 24 horas de contacto depredador-presa, los adultos se retiraron y las presas se observaron al estereoscopio para registrar la población total de mosca blanca y la población consumida por el depredador. Las ninfas consumidas por el depredador se diferencian fácilmente de las ninfas vivas por la apariencia flácida y tonalidad transparente (García-González y López-Ávila 1998).
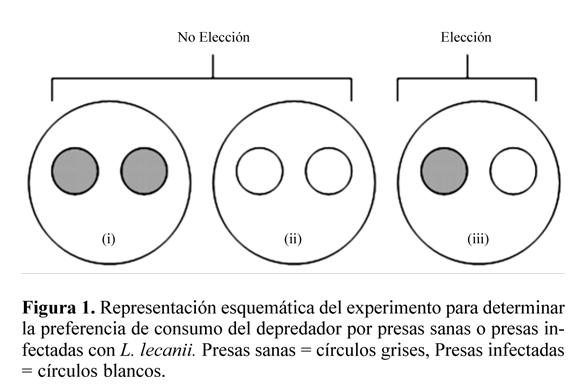
Preferencia de consumo de D. pusillus por presas sanas o infectadas con L. lecanii. En una misma arena experimental se ubicaron individualmente adultos del depredador con ninfas de mosca blanca en segundo instar dispuestas en dos discos foliares, cada uno de 1,5 cm de diámetro e infestado con 60 ± 5 ninfas. Previo a la introducción de D. pusillus, los adultos se sometieron a un período de ayuno por 24 horas, tiempo después del cual se les suministraron las poblaciones de mosca blanca. Se utilizó un diseño completamente aleatorio con tres tratamientos consistentes en: dos condiciones de no elección (i) los dos discos foliares con ninfas sanas, (ii) los dos discos foliares con ninfas infectadas (96 h de infección), y una condición de elección (iii) un disco foliar con ninfas sanas y el otro con ninfas infectadas (96 h de infección) (Fig. 1). Cada tratamiento se repitió cinco veces. A las 24 horas de suministradas las presas, el depredador se retiró de la arena experimental y se procedió a la observación del material bajo el estereoscopio, donde se registró el número de presas consumidas por D. pusillus en cada uno de los discos foliares.
Análisis de la información. En la prueba del efecto del bioplaguicida sobre la capacidad de consumo de D. pusillus, los datos se sometieron a un análisis de varianza y a la prueba de comparación de medias de Tukey. En la prueba de preferencia, los datos correspondientes a los porcentajes de consumo se transformaron con arcoseno para posteriormente analizarlos por medio de un diseño jerárquico (anidado). Los promedios obtenidos se compararon con una prueba t de una cola con base en las medias ajustadas por mínimos cuadrados. Todos los análisis estadísticos se realizaron empleando el Software SAS versión 8 (SAS Institute 1999).
Resultados
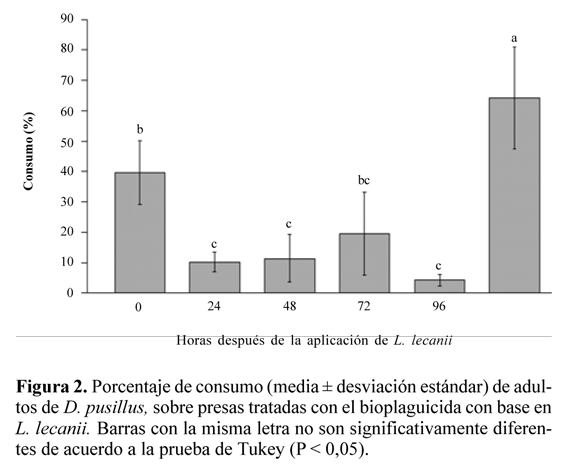
Efecto del bioplaguicida en la capacidad de consumo de adultos de D. pusillus. Hubo diferencias altamente significativas entre tratamientos (ANAVA, F = 20,26; g.l. = 5, 24; P < 0,0001). La prueba de comparación de medias de Tukey determinó diferencias entre el control y los tratamientos donde se aplicó el bioplaguicida. Así mismo, se encontraron diferencias entre el tratamiento donde el depredador se introdujo inmediatamente después de la aplicación del bioplaguicida (0 horas) con los tratamientos donde el depredador se liberó a las 24, 48 y 96 horas después de la aplicación del entomopatógeno. No se encontraron diferencias en el consumo, para los tratamientos donde el depredador se liberó a las 0 y 72 h de la aplicación del bioplaguicida (Fig. 2). En general, se observó reducción en el consumo por parte del depredador con el incremento en el tiempo de infección de las presas. Los mayores consumos se registraron en el control con un 64,1%, mientras que con presas infectadas a las 0, 24, 48, 72 y 96 horas el consumo correspondió a 39,6%, 10,3%, 11,4%, 19,6% y 4,3%, respectivamente.
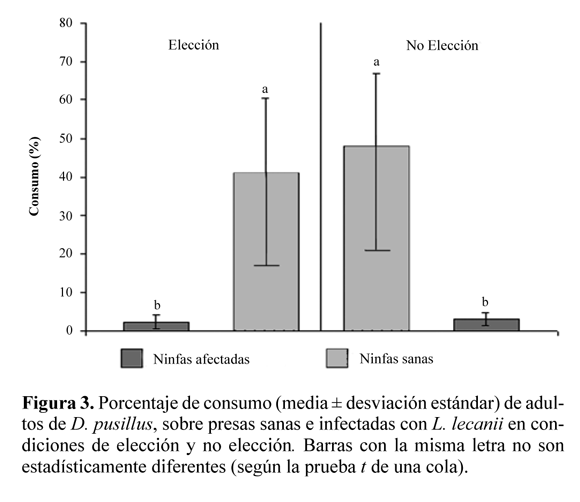
Preferencia de consumo de D. pusillus por presas sanas o infectadas con L. lecanii. Hubo diferencias altamente significativas entre el consumo de ninfas sanas con respecto al consumo de ninfas infectadas (ANAVA, F = 35,02; g.l. = 1, 8; P < 0,0001). Cuando el depredador se ubicó en la misma arena experimental con ninfas sanas y ninfas infectadas (elección), el consumo de presas sanas fue del 41,0% frente a un consumo del 2,3% en la condición de presas infectadas (Fig. 3). Por otra parte, la prueba t no evidenció diferencias significativas en el consumo de presas sanas entre el tratamiento donde se ubicaron únicamente ninfas sanas con respecto al tratamiento donde se ubicaron ninfas sanas y ninfas infectadas (P = 0,3676). Esta misma prueba, no detectó diferencias significativas en el consumo de ninfas infectadas entre la condición de elección y no elección (P = 0,7332) (Fig. 3). Estos resultados sugieren que el depredador presenta preferencia por el consumo de ninfas sanas en ambientes con posibilidad de escogencia entre ninfas sanas o infectadas. Adicionalmente, un ambiente que combina presas sanas con presas infectadas, no altera el consumo potencial de presas sanas por parte de D. pusillus.
Discusión y Conclusiones
Los resultados sugieren que la aplicación del bioplaguicida afecta la capacidad de consumo de presas por D. pusillus dependiendo del tiempo de infección por parte del entomopatógeno. Lo anterior concuerda con estudios realizados por Sewify y El Arnaouty (1998) y Wang et al. (2005), quienes observaron que la aplicación de L. lecanii o sus metabolitos afectaron el consumo de presas de los insectos depredadores Chysoperla carnea Stephens, 1836 (Neuroptera: Chysopidae) y Delphastus catalinae (Horn, 1895) (Coleoptera: Coccinellidae).
Las diferencias en el consumo de presas entre el control y los tratamientos donde se aplicó el bioplaguicida pueden deberse a efectos de corto y mediano plazo desencadenados por el entomopatógeno durante su proceso de infección de las ninfas de T. vaporariorum. En el corto plazo (cero horas de aplicación), la disminución del consumo de presas por D. pusillus puede atribuirse a un efecto de repelencia del depredador por las presas tratadas con el bioplaguicida. Dicho efecto se debe entender como una alteración fisiológica en el insecto que se da como resultado del contacto directo con el plaguicida o con volátiles derivados del mismo y en donde está implicada una evaluación sensorial del insecto entomófago sobre el alimento tratado (Avé 1995). Este tipo de efectos sobre el comportamiento de los insectos ha sido registrado para algunas formulaciones de bioplaguicidas con base en Bacillus thuringiensis Berliner, 1915 y para los hongos entomopatógenos B. bassiana y Metarhizium anisopliae (Metsch.) Sorokin, 1883 (Avé 1995; Staples y Milner 2000; Meyling y Pell 2006).
En el mediano plazo, la disminución en el consumo de presas podría deberse a una combinación del efecto de repelencia y a la pérdida del reconocimiento que hace el depredador sobre sus presas, debido a las alteraciones físicas y fisiológicas que ejercen los entomopatógenos sobre sus hospederos. En el caso de las presas infectadas con L. lecanii existen varias razones que podrían explicar la ausencia de reconocimiento de las presas por D. pusillus.
Primero, las ninfas infectadas con L. lecanii son visualmente diferentes de aquellas no infectadas por lo que larvas y adultos de coccinélidos podrían percibir estas diferencias (Said et al. 1985 citado por Roy et al. 2003). Segundo, para algunos coccinélidos el fluido interno de las presas es la señal final para su reconocimiento (Nakamuta 1984 citado por Roy et al. 1998). Si la presa es aceptada por el depredador, éste inserta su par de mandíbulas para proceder a consumir el contenido interno de la misma. García-González (1996) observó que las ninfas de mosca blanca infectadas con L. lecanii pierden gradualmente su contenido interno; por consiguiente, esta señal de reconocimiento estaría ausente en las presas infectadas.
Tercero, D. pusillus depende de la digestión extraoral y es factible que tal digestión sea menos efectiva sobre ninfas infectadas.Tanto larvas como adultos del depredador regurgitan el contenido líquido que van consumiendo dentro de la ninfa para posteriormente seguir consumiendo las sustancias de la misma (García-González y López-Ávila 1998). En este proceso las enzimas digestivas del depredador son introducidas al interior de la presa y el material resultante es succionado. La colonización interna de las ninfas por las hifas del hongo entomopatógeno podrían alterar la actividad de las enzimas digestivas que el depredador libera sobre sus presas, lo que trae como consecuencia un aumento en el tiempo de manipulación de las presas. En este mismo sentido, los estudios de Pell et al. (1997) y Roy et al. (1998, 2003) argumentan que áfidos infectados con el entomopatógeno Pandora neoaphidis (Remaudiére y Hennebert) Humber, 1989, pueden interferir en la digestión extraoral de adultos y larvas del coccinélido depredador Coccinella septempunctata L., 1758.
Finalmente, la experiencia previa de un depredador (aprendizaje) también puede influir en su comportamiento de búsqueda, lo mismo que en el tipo y proporción de presas que consume (Begon et al. 1996 citado por Obrycki et al.1997). De este modo, los individuos que se alimentan continuamente de una especie particular de presa, podrían acondicionarse a este tipo de presa (Ettifouri y Ferran 1993; Bell et al. 2004). Los adultos de D. pusillus empleados durante la prueba, se alimentaron sólo con presas sanas antes de la realización del experimento; así ellos podrían haberse acondicionado a este tipo de presa. De otro lado, al analizar el comportamiento de preferencia de consumo de D. pusillus, se observó que en ambientes donde el depredador tuvo la oportunidad de escoger entre ninfas sanas o infectadas, hubo un mayor número de presas sanas consumidas. El depredador posiblemente detecta las modificaciones que aparecen en las ninfas infectadas, que le permitirían discriminarlas de las ninfas sanas y en consecuencia rechazarlas como presas. Este resultado es relevante si se tiene en cuenta dos aspectos concernientes a la plaga: 1) La mosca blanca tiene poblaciones con generaciones continuas de tal forma que todos los estados de desarrollo pueden estar presentes simultáneamente en el campo; 2) Los estados de desarrollo de T. vaporariorum presentan distinto grado de susceptibilidad a la infección por L. lecanii (García-González 1996). De acuerdo con lo anterior, las aplicaciones del bioplaguicida en condiciones de campo no infectarían a todos los individuos de la plaga. Si el depredador tiene la habilidad de discriminar entre ninfas sanas e infectadas, es posible que cause una mortalidad adicional y complementaria a la ocasionada por el bioplaguicida. Comportamientos de selección de presas similares al encontrado para D. pusillus han sido descritos para otros coccinélidos. Por ejemplo, Roy et al. (2003) observaron que las larvas del depredador C. septempunctata no consumieron áfidos infectados con el entomopatógeno P. neoaphidis, cuando se les brindó la posibilidad de libre elección entre áfidos sanos e infectados.
En síntesis, los resultados sugieren que la aplicación del bioplaguicida puede tener un efecto indirecto sobre el depredador D. pusillus. No obstante, estas interacciones parecen no tener grandes implicaciones para sistemas de producción en condiciones de invernadero o a campo abierto, lo cual puede ser explicado por varias razones. D. pusillus se alimenta principalmente del estado de huevo de la mosca blanca, mientras que el bioplaguicida afecta en mayor medida los estados ninfales de la plaga (Fransen 1990; Hoelmer et al. 1993; Liu y Stansly 1999; García-González 2003). De esta forma, es posible encontrar un efecto biocontrolador combinado entre los dos agentes si se manejan tiempos adecuados para la liberación del depredador y para la aplicación del bioplaguicida. Adicionalmente, la habilidad del depredador para discriminar entre presas sanas o infectadas podría permitir la distribución de los coccinélidos en áreas no tratadas del cultivo, donde lograría encontrar mayor cantidad de presas sanas. Finalmente, las moscas blancas típicamente infestan cultivos de rápido crecimiento y prefieren las hojas jóvenes para ovipositar (Lenteren y Noldus 1990). La rápida aparición de nuevo follaje y de presas no tratadas puede facilitar la utilización del bioplaguicida junto con D. pusillus, en un programa para el control de la mosca blanca donde se involucren estos dos agentes biológicos.
Agradecimientos
A la Sociedad Colombiana de Entomología (SOCOLEN) por el apoyo otorgado al primer autor como ganador de la “Beca de incentivo a la investigación entomológica en las universidades colombianas”, versión 2005. Este trabajo hace parte de los resultados del proyecto “Incorporación de un Bioplaguicida en el manejo integrado de la mosca blanca” financiado por COLCIENCIAS. Los autores del trabajo agradecen a esta entidad el apoyo financiero. A Carlos Espinel, investigador de Corpoica, por su valioso apoyo científico.
Literatura citada
AVÉ, D. A. 1995. Stimulation of feeding: Insect control agents, pp. 345-363. En: Chapman, R. F.; De Boer, G. (eds.). Regulatory Mechanism in Insect Feeding. Chapman & Hall, Inc. New york. U.S.A. 398 p. [ Links ]
BELL, H. A.; DOWN, R. E.; KIRKBRIDE-SMITH, A. E.; EDWARDS, J. P. 2004. Effect of microsporidian infection in Lacanobia oleracea (Lep., Noctuidae) on prey selection and consumption by the spined soldier bug Podisus maculiventris (Het., Pentatomidae). Journal of Applied Entomology 128 (8): 548-553. [ Links ]
BUITRAGO, N. 1992. Niveles de resistencia a insecticidas en Trialeurodes vaporariorum plaga del fríjol común. Trabajo de grado. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá, 99 p. [ Links ]
CARDONA, C. 1999. Las moscas blancas (Homoptera: Aleyrodidae) como plagas de cultivos semestrales en Colombia y Ecuador: Visión general del problema, pp. 1-13. En: Memorias seminario moscas blancas y thrips. Un agresivo complejo de plagas agrícolas de fin de milenio. XXVI Congreso de la Sociedad Colombiana de Entomología. Santa Fe de Bogotá. Colombia. 64 p. [ Links ]
ETTIFOURI, M.; FERRAN, A. 1993. Influence of larval rearing diet on the intensive searching behaviour of Harmonia axyridis larvae. Entomophaga 38(1): 51-59. [ Links ]
FRANSEN, J. 1990. Natural enemies of whiteflies: Fungi, pp. 187- 211. En: Gerling, D.(ed.).Whiteflies: Their Bionomics, pest status and management. Intercept, Ltd., Andover, U.K. 348 p. [ Links ]
GARCÍA-GONZÁLEZ, J. 1996. Evaluación de seis cepas nativas de Verticillium lecanii (Zimm), Viegas (Deuteromycetes: Moniliales) en el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood). Trabajo de grado. Universidad Nacional de Colombia, Facultad de Agronomía. Bogotá. 126 p. [ Links ]
GARCÍA-GONZÁLEZ, J. 2003. Estudio de los componentes de depredación para el sistema Delphastus pusillus (Le Conte) (Coleoptera: Coccinellidae) y su presa la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae). Tesis de grado en M. Sc. en Ciencias Agrarias. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá. 108 p. [ Links ]
GARCÍA-GONZÁLEZ, J.; LÓPEZ-ÁVILA, A. 1998. Biología y hábitos alimenticios de Delphastus pusillus (Coleoptera: Coccinellidae) depredador de moscas blancas. Revista Colombiana de Entomología. Bogotá 24 (3-4): 95-102. [ Links ]
HOELMER, K.A.; OSBORNE, L.; YOKOMI, R. 1993. Reproduction and feeding behavior of Delphastus pusillus (Coleoptera: Coccinellidae), a predator of Bemisia tabaci (Homoptera: Aleyrodidae). Journal of Economic Entomology 86 (2): 322-329. [ Links ]
JIMÉNEZ, L.G. 2002. Evaluación de técnicas de aplicación de un bioplaguicida a base de Verticillium lecanii, para el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum en un cultivo de fríjol. Tesis ingeniería agronómica. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá. 73 p. [ Links ]
LENTEREN, J.C.; NOLDUS, P.J.J. 1990. Whitefly-plant relationships: Behavioural and ecological aspects, pp. 47-88. En: Gerling, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept, Ltd., Andover, Hants., UK. 348 p. [ Links ]
LIU, T. X.; STANSLY, P. A. 1999. Searching and feeding behaviour of Nephaspis oculatus and Delphastus catalinae (Coleoptera: Coccinellidae), predators of Bemisia argentifolii (Homoptera: Aleyrodidae). Environmental Entomology 28 (5): 901-906. [ Links ]
LÓPEZ-ÁVILA, A.; CARDONA, C.; GARCÍA, J.; RENDÓN, F.; HERNÁNDEZ, P. 2001.Reconocimiento e identificación de enemigos naturales de moscas blancas (Homoptera: Aleyrodidae) en Colombia y Ecuador. Revista Colombiana de Entomología 27 (3-4): 137-141. [ Links ]
MEYLING, N.; PELL, J.K. 2006. Detection and avoidance of an entomopathogenic fungus by a generalist insect predator. Ecological Entomology 31: 162-171. [ Links ]
OBRYCKI, J.J.; TAUBER, M.J.; TAUBER, C.A.; RUBERSON J.R. 1997. Prey specialization in insect predators. http://ipmworld.umn.edu/chapters/obrycki.htm. Fecha última revisión: 1 octubre 1997. Fecha último acceso: [11 noviembre 2005]. [ Links ]
OSBORNE, L.S.; LANDA, Z. 1992. Biological control of whiteflies with entomopathogenic fungi. Florida Entomologist 75 (4): 456- 471. [ Links ]
PELL, J.K.; PLUKE, R.; CLARK, S.J.; KENWARD, M.G.; ALDERSON, P.G. 1997. Interaction between two aphid natural enemies, the entomopathogenic fungus Pandora neoaphidis Remaudiere & Hennebert (Zygomycetes: Entomophthorales) and the predatory beetle Coccinella septempunctata L. (Coleoptera: Coccinellidae). Journal of Invertebrate Pathology 69: 261-268. [ Links ]
QUINTERO, C.; RENDÓN, F.; GARCÍA, J.; CARDONA, C.; LÓPEZ-ÁVILA, A.; HERNÁNDEZ, P. 2001. Especies y biotipos de moscas blancas (Homoptera: Aleyrodidae) en cultivos semestrales de Colombia y Ecuador. Revista Colombiana de Entomología 27 (1-2): 27-31. [ Links ]
RODRÍGUEZ, I.; CARDONA, C. 2001. Problemática de Trialeurodes vaporariorum y Bemisia tabaci (Homoptera: Aleyrodidae) como plagas de cultivos semestrales en el valle del cauca. Revista Colombina de Entomología 27 (1-2): 21-26. [ Links ]
ROSELYNE, L. 2005. Intraguild interactions of the greenhouse whithefly natural enemies, predator Dicyphus hesperus, pathogen Beauveria bassiana and parasitoid Encarsia formosa. Maîtrise en biologie végétale (M.Sc.). Faculté des sciences DE L’ agriculture et DE L’ alimentation. Université Laval. Québec. Canada. 99 p. [ Links ]
ROY, H. R.; PELL, J. K.; CLARK, S. J.; ALDERSON, P. G. 1998. Implications of predator foraging on aphid pathogen dynamics. Journal of Invertebrate Pathology 71: 236-247. [ Links ]
ROY, H. E.; ALDERSON, P. G.; PELL, J. K. 2003. Effects of spatial heterogeneity on the role of Coccinella septempunctata as an intra-guild predator of the aphid pathogen Pandora neoaphidis. Journal of Invertebrate Pathology 82: 85-95. [ Links ]
SAS INSTITUTE. 1999. SAS Language. Reference. Version 8. Sas Institute.Cary NC. [ Links ]
SEWIFY, G. H.; EL ARNAOUTY, S. A. 1998. The effect of the entomopathogenic fungus Verticillium lecanii (Zimm.) Viegas on mature larvae of Chrysoperla carnea Stephens (Neuroptera, Chrysopidae) in the laboratory. Acta Zoologica Fennica 209: 233- 237. [ Links ]
STAPLES, J. A.; MILNER, R. J. 2000. A laboratory evaluation of the repellency of Metarhizium anisopliae conidia to Coptotermes lacteus (Isoptera: Rhinotermitidae). Sociobiology 36: 133-148. [ Links ]
VILLAMIZAR, L. F.; COTES, A. M. 2006. Desarrollo de un bioplaguicida a base de Lecanicillium lecanii para el control de la mosca blanca Trialeurodes vaporariorum, pp. 12-13. En: Díaz, A. (ed.). Resumen de investigaciones en el control biológico de las moscas blancas. Publicación Corpoica-Colciencias. Produmedios. Bogotá D.C. Colombia. 20 p. [ Links ]
WANG, L.; HUANG, J.; YOU, M.; GUAN, X.; LIU, B. 2005. Effects of toxins from two strains of Verticillium lecanii (Hyphomicetes) on bioattributes of a predatory ladybeetle, Delphastus catalinae (Col., Coccinellidae). Journal of Applied Entomology 129 (1): 32-38. [ Links ]
WRAIGHT, S. P.; CARRUTHERS, R. I.; BRADLEY, C. A.; JARONSKY, S. T.; LACEY, L. A.; WOOD, P.; GALAINIWRAIGHT, S. 1998. Pathogenicity of the entomopathogenic fungi Paecilomyces spp. and Beauveria bassiana against the silver whitefly Bemisia argentifolii. Journal of Invertebrate Pathology 71: 217-226. [ Links ]
Recibido: 18-jun-2006 - Aceptado: 24-sep-2008