Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.1 Bogotá Jan./June 2009
Sección Agrícola
Evaluación de la estabilidad de Paecilomyces sp. y Beauveria bassiana frente a la radiación ultravioleta
Evaluation of the stability of Paecilomyces sp. and Beauveria bassiana under ultraviolet radiation
ERIKA PAOLA GRIJALBA B.1, LAURA VILLAMIZAR R.2 y ALBA MARINA COTES P.3
1 Investigadora. Q.F. CORPOICA. A.A 240142 Parque Central Bavaria Las Palmas, Bogotá. egrijalba@corpoica.org.co. Autor para correspondencia.
2 Investigadora. M. Sc. Microbiología. CORPOICA. A.A 240142 Parque Central Bavaria Las Palmas, Bogotá. lvillamizar@corpoica.org.co.
3 Investigadora. Ph. D. Fitopatología. CORPOICA. A.A 240142 Parque Central Bavaria Las Palmas, Bogotá. acotes@corpoica.org.co.
Resumen: Se desarrollaron dos prototipos de bioplaguicida formulados como polvos mojables a partir de dos aislamientos nativos de Paecilomyces sp. y Beauveria bassiana previamente seleccionados por su alta actividad biocontroladora de Bemisia tabaci. Dado que la radiación ultravioleta (UV) es uno de los factores más limitantes al emplear microorganismos en campo, el presente trabajo determinó la estabilidad de conidios formulados y sin formular de estos dos hongos, frente a la luz ultravioleta (UV). Se evaluó la germinación de los microorganismos en agar extracto de malta, antes y después de ser expuestos durante tres, seis y 24 horas a radiación ultravioleta C (UVC) bajo condiciones de laboratorio. Adicionalmente se evaluó el efecto de la radiación solar sobre conidios de los dos hongos durante seis horas de exposición directa al sol en el municipio de El Espinal (Tolima). La radiación UVC no afectó la germinación de conidios de Paecilomyces sp. sin formular, en tanto que la radiación solar redujo su germinación en 43% y en 42% para los conidios sin formular y formulados, respectivamente. La radiación UVC y la luz solar disminuyeron la germinación de conidios sin formular de B. bassiana en 43% y 46% respectivamente. Para los conidios formulados, la radiación solar redujo en 26% la germinación. La formulación evaluada protegió los conidios de B. bassiana de la radiación solar pero no los de Paecilomyces sp., siendo necesario para este último evaluar filtros solares que puedan incluirse en la formulación.
Palabras clave: Radiación solar. Bioplaguicida. Formulación.
Abstract: Two biopesticide prototypes were developed, formulated as wettable powders by using two native isolates of Paecilomyces sp. and Beauveria bassiana previously selected for their high biocontrol activity on Bemisia tabaci. Considering that ultraviolet (UV) radiation is one of the most limiting factors when microorganisms are applied under field conditions, the aim of this study was to determine the stability of formulated and unformulated conidia of these fungi when exposed to UV light. Germination of the microorganisms was evaluated in malt extract agar before and after three, six and 24 hours of exposure to UV “C” radiation, under laboratory conditions. In addition, the effect of solar radiation under field conditions was evaluated during six hours of direct exposure to sun in the municipality of El Espinal (Tolima). The UVC radiation did not affect germination of unformulated Paecilomyces sp. conidia, while solar radiation reduced germination by 43 and 42% for unformulated and formulated conidia, respectively. UVC and solar radiation reduced germination of unformulated B. bassiana conidia by 43 and 46%, respectively. For formulated conidia, solar radiation reduced germination by 26%. The evaluated formulation protected conidia of B. bassiana against solar radiation, but not those of Paecilomyces sp., making it necessary for the latter to evaluate sunscreens that might be included in the formulation.
Key words: Solar radiation. Biopesticide. Formulation.
Introducción
Los hongos entomopatógenos Paecilomyces sp. y Beauveria bassiana (Balsamo) Vuillemin son comúnmente empleados en el control biológico de insectos de la familia Aleyrodidae (Eyal et al. 1994). Dentro de las 1200 especies de moscas blancas, Bemisia tabaci (Gennadius, 1889) se destaca debido a las pérdidas ocasionadas en diferentes cultivos y a las dificultades para su control mediante métodos químicos (López 1994). Estudios realizados por López y García (2000), mostraron que los departamentos de Tolima, Cundinamarca, Santander y Cesar tienen mayor incidencia de esta plaga, con pérdidas que oscilan entre el 25 y el 100% en cultivos de tomate, algodón, fríjol, melón y varias plantas ornamentales. Por otra parte, en los departamentos de Magdalena, Guajira y Atlántico, B. tabaci se presentó de manera aislada en algunos municipios, aunque su incidencia fue elevada y causó pérdidas hasta del 100% en diversos cultivos.
La eficacia de los microorganismos utilizados como principio activo de bioplaguicidas está directamente relacionada con su viabilidad y puede ser afectada por diferentes factores ambientales. La persistencia de los conidios de los hongos entomopatógenos en campo, es afectada principalmente por la radiación ultravioleta proveniente del sol (Smits et al. 2004). Por ejemplo, de acuerdo con los estudios realizados por Moore et al. (1996), la germinación de conidios de Metarhizium anisopliae (Metschnikoff) Sorok expuestos a la radiación solar disminuyó su viabilidad a la mitad después de dos horas de exposición.
La radiación solar de acuerdo con su longitud de onda, se ha clasificado en tres tipos, entre 100 a 280 nm se denomina UVC, de 280 a 320 nm correspondiente a UVB y UVA desde 320 a 400 nm, siendo estas dos últimas capaces de atravesar la atmósfera terrestre y de ocasionar diversos efectos sobre los seres vivos. La radiación UVC es absorbida por parte de las moléculas de ozono y oxígeno molecular presentes en la estratosfera (Ribera y Paradelo 1997). La acción de la radiación ultravioleta sobre los microorganismos, se debe a la presencia de grupos cromóforos en diferentes estructuras celulares, tales como ácidos nucleicos, lípidos y proteínas capaces de absorber ciertas longitudes de onda que ocasionan daños directos o indirectos sobre las macromoléculas. Los daños directos se refieren a la formación de fotoproductos generalmente a nivel del ADN, donde se forman dímeros de bases pirimidínicas adyacentes sobre la misma cadena de ADN tipo timina - timina, timina - citosina y citosina - citosina, por acción de la radiación UVC o UVB (Nicholson et al. 2005). Sin embargo, la radiación UVA puede también generar dímeros de timina (Young et al. 1998; Kielbassa y Epe 2000).
En segundo lugar, la radiación UVA causa daños directos debido a la formación de especies reactivas de oxígeno tales como peróxido de hidrógeno, radicales hidroxilo o superóxidos, capaces de oxidar las pentosas del ADN y de romper la doble cadena de la molécula (Diffey 1991). También puede producir peroxidaciones lipídicas al reaccionar con los ácidos grasos de los fosfolípidos, lo cual afecta la fluidez de la membrana celular (Gutteridge y Halliwell 1990; Aikens y Dix 1991; Choe et al. 1995). Además de los daños que a nivel del ADN nuclear puede causar el estrés oxidativo, el ADN mitocondrial también puede sufrir alteraciones considerando que los mecanismos de reparación de los ácidos nucleicos en la mitocondria son menos eficaces (Krutmann 2001). Estos daños se traducen en retraso en el crecimiento, mutaciones o muerte celular de los hongos (Braga et al. 2001).
Para asegurar la eficacia de los microorganismos empleados para el control de plagas bajo condiciones de campo, se pueden utilizar cepas tolerantes a la radiación ultravioleta, las cuales emplean mecanismos de defensa tales como la secreción de pigmentos de absorción (Hullo et al. 2001; Saxene et al. 2002) o la reparación de los daños del ADN (Setlow 1988). También es posible tener en cuenta en el diseño de formulaciones, el uso de adyuvantes que actúen como protectores solares. Los filtros solares absorben selectivamente la radiación UV incidente. Otros protectores solares pueden dispersar o reflejar la radiación (pantallas solares), entre los que se destacan el óxido de zinc (ZnO) y el dióxido de titanio (TiO2) (Mulero 2004). En un trabajo desarrollado por Villamizar et al. (1997), se evaluó el efecto de la radiación UVC y de la luz solar sobre conidios de M. anisopliae formulados y sin formular. La formulación incluía pantallas solares que protegieron al microorganismo, ya que se encontró que la viabilidad de los conidios sin formular expuestos a los dos tipos de radiación, disminuyó significativamente con respecto a los tratamientos no expuestos. En el caso de los conidios formulados, la viabilidad no presentó pérdidas significativas después de la exposición a la luz, confirmando la eficacia de los protectores utilizados contra la luz UV.
En trabajos previos realizados en el Laboratorio de Control Biológico de Corpoica, se seleccionaron por su alto potencial biocontrolador de B. tabaci, un aislamiento de Paecilomyces sp. y uno de B. bassiana codificados como Pc013 y Bv056, obtenidos a partir de este insecto en un cultivo de tomate en Ciénaga (Magdalena) y en un cultivo de algodón en Prado (Tolima), respectivamente. Con estos microorganismos se desarrollaron dos prototipos de bioplaguicidas formulados como polvos mojables. Teniendo en cuenta que en el desarrollo de nuevas formulaciones a base de hongos, bacterias o virus, se hace necesario conocer el efecto que la radiación ultravioleta ejerce sobre los mismos y llevar a cabo pruebas que permitan seleccionar el protector solar más adecuado en cada caso, se planteó como objetivo del presente estudio, determinar la estabilidad de los conidios de Paecilomyces sp. y de B. bassiana formulados y sin formular frente a la luz ultravioleta.
Materiales y Métodos
Este trabajo se dividió en dos etapas: en la primera se determinó el efecto de la radiación UVC sobre los conidios sin formular de Paecilomyces sp. y de B. bassiana bajo condiciones de laboratorio y en la segunda fase se estableció el efecto de la radiación solar sobre los conidios formulados y sin formular de cada hongo, en condiciones de campo.
Radiación UVC sobre conidios sin formular. El efecto de la radiación UVC se determinó mediante pruebas realizadas en el Laboratorio de Control Biológico de CORPOICA. Se utilizó un diseño experimental completamente al azar con tres repeticiones por tratamiento. La unidad experimental consistió en una caja de Petri estéril sobre la que se colocaron 0,1 g de conidios puros y secos de Paecilomyces sp. Pc013 o de B. bassiana, Bv056, los cuales se extendieron cubriendo la superficie de la caja.
Las cajas se cubrieron con una película plástica de polivilideno (Vinipel) que permite el paso de la radiación UV y se expusieron a una distancia de 20 cm de una lámpara (Silvana T8G30) que emite radiación ultravioleta monocromática tipo C con una longitud de onda de 254 nm (95 μwatt/cm2/seg). Se evaluó la germinación de los conidios en cuatro momentos: antes de iniciar la exposición y pasadas tres, seis y 24 horas de exposición. Para tal fin, los conidios se suspendieron en una solución de Tween 80 al 0,1% y a partir de esta suspensión se realizó una dilución decimal. De cada dilución se tomaron 0,1 ml y se inocularon en una caja de Petri con agar extracto de malta por triplicado. Las cajas se incubaron durante 24 horas a 25°C, tiempo después del cual, se cortó un cuadrado de agar de 1 cm2 que se colocó sobre una lámina portaobjetos. Sobre el agar se adicionó una gota de azul de lactofenol y posteriormente, utilizando un microscopio con el objetivo de 40X, se realizó la lectura de los conidios germinados y sin germinar en 10 campos ópticos por réplica. Los resultados se analizaron mediante un ANAVA y una comparación de medias de los valores de germinación de los conidios no formulados (Tukey, α = 0,05).
Radiación solar sobre conidios formulados y sin formular. La segunda parte de este trabajo se realizó en el municipio de El Espinal (Tolima), debido a que en esta región se presenta una alta incidencia de Bemisia tabaci. Este municipio se encuentra ubicado a 04°09’19”N y 74°53’19”W, a una altitud de 320 msnm, con una temperatura media de 27,1°C (Instituto Geográfico Agustín Codazzi 1996) y un promedio diario de radiación solar global en el mes de agosto año 2005 (época en la que se llevó a cabo este estudio) de 4,5 - 5,0 KWh/m² (IDEAM, UPME 2005). La unidad experimental consistió en una caja de Petri con agar agua y un foliolo de tomate previamente desinfectado con una solución de hipoclorito de sodio al 3%, sobre el que se colocaron muestras de 0,1 g de los conidios formulados o sin formular. Las unidades experimentales se expusieron a la radiación solar durante seis horas, entre las 9:00 a.m. y las 3:00 p.m., retirando cada hora, una muestra por tratamiento a la cual se le determinó la germinación de los conidios, siguiendo la metodología descrita previamente.
Teniendo en cuenta que el valor de germinación en el tiempo cero para los conidios formulados y sin formular era diferente, los resultados se expresaron como reducción en la germinación con respecto a la germinación original (tiempo cero) de cada tratamiento y cada una de las seis horas de exposición a la radiación solar. El análisis estadístico se realizó con el programa SAS versión 9.1.3. La normalidad de los datos se determinó mediante la prueba de Shapiro – Wilk (α = 0,05) y la homogeneidad de varianzas mediante la prueba de Levene (α = 0,05). Se realizó un análisis de varianza (ANAVA) para cada uno de los tiempos (una, dos, tres, cuatro, cinco y seis horas) y una comparación de medias de Tukey (α = 0,05) para establecer diferencias significativas entre conidios formulados y no formulados.
Resultados y Discusión
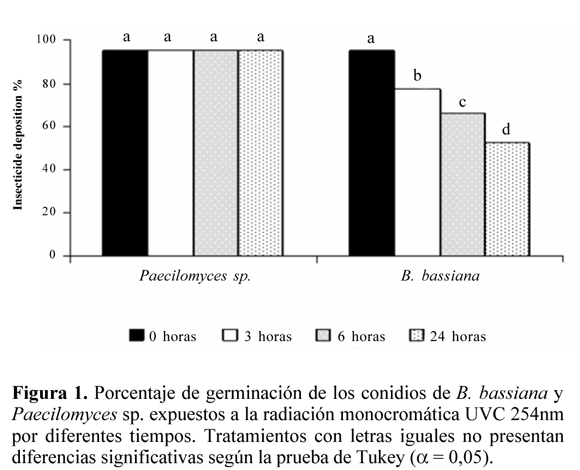
Efecto de la radiación UVC. Los conidios de Paecilomyces sp. sin formular expuestos a la radiación monocromática UVC (254 nm), no presentaron una reducción significativa de su capacidad de germinación aún después de 24 horas de exposición (P > 0,001) (Fig. 1). Contrario a lo que ocurrió con los conidios sin formular de B. bassiana, los cuales redujeron significativamente su germinación después de las tres primeras horas de exposición (P < 0,001), presentando una germinación final del 42,7% a las 24 horas de exposición (Fig. 1).
La radiación UVC tiene menor longitud de onda que la tipo A y tipo B, por lo que posee mayor energía y causa un daño mayor que el originado por los otros dos tipos de radiación UV. Sin embargo, esta radiación no causó un efecto significativo sobre los conidios de Paecilomyces sp. (Pc013), sugiriendo que estos no son sensibles a la misma durante el tiempo de exposición evaluado. Este comportamiento podría atribuirse a que los conidios de Paecilomyces sp. posiblemente utilizan algún mecanismo de reparación del ADN como la escisión de nucleótidos, o la acción de la enzima fotoliasa, que en presencia de la luz visible, rompe los dímeros de pirimidina evitando el daño letal causado por la radiación. Esta enzima ha sido reportada en varios organismos procariotas y eucariotas (Britt 1996; Thoma 1999; Sinha et al. 2002). Un segundo mecanismo de protección empleado por algunos microorganismos, consiste en la acumulación de pigmentos de absorción, generalmente en la capa externa de la membrana (Riesenman y Nicholson 2000; Saxene et al. 2002). Macroscópicamente la colonia de la cepa de Paecilomyces sp. estudiada presenta una ligera coloración violeta, sugiriendo la presencia de un pigmento, el cual podría absorber la radiación con una longitud de onda de 254 nm protegiendo al microorganismo. Algunas cepas de microorganismos como Bacillus thuringiensis, poseen un pigmento de melanina que las hace significativamente más resistentes a la radiación UVC (Saxene et al. 2002). Así mismo, estudios realizados por Riesenman y Nicholson (2000) establecieron que algunas de las cepas esporuladas de B. thuringiensis más sensibles a la radiación UVB y UVA son resistentes a la radiación UVC.
Los conidios de B. bassiana muestran susceptibilidad a la radiación UVC, que aumentó directamente con el tiempo de exposición, lo que se evidenció por una reducción significativa de la germinación. La reducción de la germinación posiblemente se debió a que la longitud de onda empleada, interfirió con la replicación normal del ADN, superó los mecanismos de reparación de la célula y produjo mutaciones o la muerte celular dependiendo de la cantidad de energía recibida (Cerda- Olmedo et al. 1996). Resultados similares fueron obtenidos por Moore et al. (1993) quienes observaron que algunos géneros de los hongos entomopatógenos Metarhizium sp., Beauveria sp. y Nomuraea sp. expuestos a radiación UVC redujeron su germinación conforme aumentó el tiempo de exposición a la misma, con un tiempo letal medio entre uno y cuatro horas de exposición. De igual forma, Devotto y Gerding (2003) establecieron que para los conidios de dos aislamientos de M. anisopliae, se redujo la germinación a menos del 5% después de 40 segundos de exposición a la radiación UVC. Al comparar estos resultados con los obtenidos aquí, se evidencia que la cepa de B. bassiana Bv056 soporta mayores tiempos de exposición a la luz UVC. Esto puede deberse a diferencias genéticas entre los aislamientos (Morley et al.1996; Tobar et al.1996), además de las diferencias metodológicas entre los estudios, ya que en el presente trabajo se expusieron conidios puros y secos a la radiación, en tanto que en el trabajo realizado por Devotto y Gerding (2003) se utilizó una suspensión de conidios, inoculada sobre la superficie de una caja Petri con agar (Devotto y Gerding 2003).
A partir de este trabajo se estableció que B. bassiana Bv056 fue sensible a la radiación UVC (254 nm), mientras que Paecilomyces sp. Pc013 toleró esta radiación. Sin embargo, la radiación UVC no es ecológicamente relevante debido a que es absorbida por el oxígeno y el ozono atmosféricos como se mencionó anteriormente, por lo tanto las longitudes de onda tipo UVA y tipo UVB son las que pueden producir efectos sobre la biota y las que deben ser consideradas con mayor atención (Mckenzie et al. 2003).
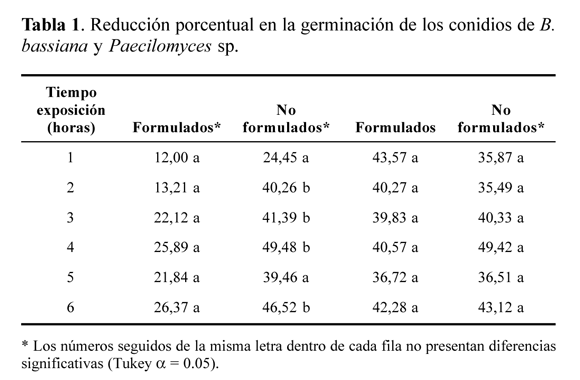
Radiación solar y conidios formulados y sin formular. Los conidios formulados y sin formular de B. bassiana (Bv056) y Paecilomyces sp. (Pc013) expuestos a la radiación solar disminuyeron su germinación conforme se incrementó el tiempo de exposición a la radiación solar, indicando que el efecto que ejerce este factor sobre la viabilidad de dichos microorganismos depende de la exposición a la misma (Tabla 1). En el caso de B. bassiana se observó que a partir de la primera hora de exposición a la radiación solar, la reducción en la germinación de los conidios formulados fue menor en comparación con la de los conidios no formulados. Durante la primera hora, los conidios no formulados presentaron una reducción de 24% en su germinación, mientras que para los conidios formulados, la disminución fue de sólo el 12%. Durante la segunda hora de exposición, los conidios no formulados mostraron una reducción en la germinación del 40%, en comparación con 13% para los conidios formulados. Esta tendencia continuó en cada uno de los tiempos evaluados. Finalmente, después de seis horas de exposición, los conidios sin formular mostraron una reducción en la germinación de 46%, mientras que los conidios formulados sólo perdieron el 26,37% (Tabla 1).
En el caso de Paecilomyces sp. Pc013 se observó el comportamiento contrario, ya que durante todo el tiempo de exposición a la radiación solar, los conidios sin formular mostraron una menor reducción en la germinación o muy similar a la de los conidios formulados. Después de una hora de exposición a la luz solar, los conidios formulados redujeron su germinación en un 43% y los no formulados en un 35%. Después de seis horas de exposición, los conidios no formulados presentaron una reducción en su germinación del 43% en tanto que para los formulados se alcanzó una pérdida de la germinación de un 42% (Tabla 1).
Para B. bassiana se presentaron diferencias significativas entre la pérdida de germinación de los conidios formulados y no formulados en cada tiempo de exposición, siendo menor la reducción en la germinación de los conidios formulados (P < 0.001). Por el contrario, para Paecilomyces sp., no se detectaron diferencias entre los dos tratamientos. Este resultado sugiere que la formulación desarrollada para B. bassiana protegió eficientemente los conidios del hongo frente a la radiación solar, mientras que para Paecilomyces sp., el prototipo de formulación no ejerció ningún tipo de protección.
Los prototipos de formulación incluyen un filtro solar ampliamente utilizado en la industria farmacéutica, el cual consiste en una mezcla de dos sales azoicas, una de ellas con un máximo de absorción a los 308 nm y mínimos a los 270 nm y 348 nm y la otra con máximos de absorción a los 252 nm y 287 nm y mínimos a los 231 nm y 266 nm. Por lo tanto, el filtro solar empleado presenta una mejor absorción de longitudes de onda que pertenecen a la radiación UVC y UVB. Por tales razones, se puede deducir que los conidios formulados fueron protegidos de la radiación UVB del sol, pero el UVA que no fue absorbido, probablemente causó un efecto deletéreo en las células, debido a la generación de especies reactivas de oxígeno (Friedberg et al. 1995). Por tal razón, se puede sugerir que los conidios de Paecilomyces sp. (Pc013) probablemente son más sensibles a la radiación UVA en comparación con los conidios de B. bassiana (Bv056) y por tanto, a pesar de ser la misma formulación no se preservó la viabilidad del microorganismo.
Los filtros solares consisten en su mayoría en químicos orgánicos aromáticos que están conjugados con un grupo carbonilo, los cuales pueden absorber generalmente un tipo de radiación UVA ó UVB, de acuerdo con su estructura química, el solvente y el pH del medio en el que se encuentran (Serra 1994). Es conveniente al desarrollar una formulación incluir un filtro físico o pantalla solar que pueda bloquear los dos tipos de radiación UVA/UVB al reflejar y dispersar la luz, o una mezcla de dos filtros solares químicos que provean una mayor protección contra todo el rango de radiación solar (Serpone et al. 2007).
Los resultados mostraron que la reducción en la germinación de los conidios de Paecilomyces sp. fue mayor que la obtenida para B. bassiana (Tabla 1, Figura 1). Este resultado sugiere que los conidios de Paecilomyces sp. son más susceptibles a la radiación solar, lo que probablemente se deba a la pigmentación (mecanismo hipotético 1) ligeramente amarilla de los conidios de B. bassiana Bv056, en comparación con la coloración púrpura de los conidios de Paecilomyces sp. Un ejemplo de este mecanismo de protección fue reportado por Braga et al. (2006), quienes evaluaron la importancia de la pigmentación de cepas de Metarhizium anisopliae var. anisopliae como mecanismo de tolerancia frente a la radiación solar, comparando el nivel de inactivación y la cinética de germinación de conidios de una cepa silvestre (conidios de color verde oscuro) y tres mutantes que producían conidios de color blanco, amarillo y púrpura, respectivamente. Los resultados evidenciaron la importancia de la pigmentación como mecanismo de protección frente a la radiación UV, ya que los conidios blancos fueron los más sensibles, seguidos de los de color púrpura, los de color amarillo y finalmente, los más resistentes fueron los de color verde oscuro.
La mejor tolerancia de Paecilomyces sp. también podría estar relacionada con una posible mayor producción de enzimas que controlen el estrés oxidativo (mecanismo hipotético 2) generado por acción de la radiación UVA, tales como la superóxido dismutasa, la catalasa y glutatión reductasa, entre otras. La primera enzima, cataliza la reducción del anión superóxido, transformándolo en un producto menos reactivo (peróxido de hidrógeno) y la segunda, cataliza la conversión del peróxido de hidrógeno en agua y oxígeno molecular, reduciendo sus efectos dañinos (Mulero 2004). La existencia de distintos genes que codifican para catalasas vegetativas y conidiales, ha sido demostrada en hongos filamentosos (Chary y Natvig 1989; Bussnink y Oliver 2001; Kawasaki y Aguirre 2001). En un trabajo realizado por Miller et al. (2004) se estableció que la exposición de los conidios de M. anisopliae a la radiación UVA y UVB, incrementó la intensidad de una de las bandas de glutatión reductasa en una de las cepas estudiadas, sugiriendo que esta enzima puede proveer protección contra la acción de la radiación. Sin embargo, estos mecanismos no han sido estudiados para B. bassiana y Paecilomyces sp.
A partir de este trabajo se puede concluir que la inactivación que la luz ultravioleta produce sobre los conidios de Pc013 y Bv056 depende del tipo de radiación, de la presencia de adyuvantes y del tiempo de exposición. La radiación UVC afectó a los conidios sin formular de Bv056, pero no a los de Pc013. La radiación solar inactivó los conidios sin formular de Bv056 y Pc013, confirmando este resultado la importancia de desarrollar una formulación en la cual se incluyan antioxidantes, filtros y pantallas solares, o la elaboración de encapsulados o prototipos oleosos, que protejan de la luz solar bajo condiciones de campo (Shah et al. 1998; Ragaei 1999).
Dentro del desarrollo de un producto, posterior a la formulación. se realiza una etapa de optimización en la cual se debe ajustar la composición con el fin de mejorar la eficacia, la estabilidad y la calidad del producto. Teniendo en cuenta los resultados, se hace necesario reemplazar el filtro utilizado en el prototipo a base de Paecilomyces sp. por un filtro o pantalla solar que provea a los conidios una adecuada protección en el rango de radiación de 280 a 400 nm, el cual debe ser compatible con el hongo y con los demás auxiliares de formulación.
Literatura citada
AIKENS, J.; DIX, T. 1991. Perhydroxyl radical (HOO.) initiated lipid peroxidation: the role of fatty acid hydroperoxides. Journal of Biology and Chemistry (266): 15091-15098. [ Links ]
BRAGA, G.; FLINT, S.; MESSIAS, C.; ANDERSON, A.; ROBERTS, D. 2001. Variability in response to UV - B among species and strains of Metarhizium isolated from sites at latitudes from 61º N to 54º S. Journal of Invertebrate Pathology 78: 98-108. [ Links ]
BRAGA, G.; RANGEL, D.; FLINT, S.; ANDERSON, A.; ROBERTS, D. 2006. Conidial pigmentation is important to tolerance against solar-simulated radiation in the entomopathogenic fungus Metarhizium anisopliae. Photochemistry and Photobiology (82): 418-422. [ Links ]
BRITT, A. B.; 1996. DNA damage and repair in plants. Annual Reviews in Plant Physiology and Plant Molecular 47: 75-100. [ Links ]
BUSSNINK, H. J.; OLIVER, R. 2001. Identification of two highly divergent catalase genes in the fungal tomato pathogen, Cladosporium fulvum. European Journal of Biochemistry 268: 15-24. [ Links ]
CERDA-OLMEDO, E.; ROJAS, M.; CUBERO, B. 1996. Causes of cell death following ultraviolet B and C exposures and the role of carotenes. Photochemical Photobiology 64: 547-551 [ Links ]
CHARY, P.; NATVIG, D. 1989. Evidence for three differentially regulated catalase genes in Neurospora crassa: effects of oxidative stress, heat shock and development. Journal of Bacteriology 171: 2646-2652. [ Links ]
CHOE, M.; JACKSON, C.; YU, B. 1995. Lipid peroxidation contributes to age-related membrane rigidity. Free Radical Biology Medical 18: 977-984. [ Links ]
DEVOTTO, L.; GERDING, M. 2003. Respuesta de dos aislamientos chilenos de Metarhizium anisopliae (Metschnikoff) sorokin a la adición de un protector solar. Agricultura Técnica 63: 339-346. [ Links ]
DIFFEY, B. 1991. Solar ultraviolet radiation effects on biological systems. Physics in Medicine and Biology 36: 299-328. [ Links ]
EYAL, J.; MABUD, M.; FISCHBEIN, K.; WALTER, J.; OSBORNE, L.; LANDA, Z. 1994. Assessment of Beauveria bassiana Nov. EO-1 strain, which produced a red pigment for microbial control. Applicated Biochemistry and Biotechnology 44: 65-80. [ Links ]
FRIEDBERG, E. C.; WALKER, G. C.; SIEDE, W. 1995. DNA repair and mutagenesis. American Society for Microbiology. Washington, D. C. 698 p. [ Links ]
GUTTERIDGE, J.; HALLIWELL, B. 1990. The measurement and mechanism of lipid peroxidation in biological systems. Trends Biochemistry Science 15: 129-135. [ Links ]
HULLO, M., MOSZER, I.; DANCHIN, A.; MARTIN, I. 2001. CotA of Bacillus subtilis is a copper - dependent laccase. Journal of Bacteriology 183: 5426-5430. [ Links ]
IDEAM; UPME 2005. Atlas de Radiación Solar de Colombia. Instituto de meteorología, hidrología y estudios ambientales; Unidad de planeación minero energética (eds.) Bogotá, Colombia 175 p. [ Links ]
INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI. 1996 Diccionario Geográfico de Colombia. Colombia. 2.504 p. [ Links ]
KAWASAKI, I.; AGUIRRE, J. 2001. Multiple catalase genes are differentially regulated in Aspergillus nidulans. Journal of Bacteriology 183: 1434-1440. [ Links ]
KIELBASSA, C.; EPE, B. 2000. DNA damage induced by ultraviolet and visible light and its wavelength dependence. Methods in Enzymology 319: 436-445. [ Links ]
KRUTMANN, J. 2001. New developments in photoprotection of human skin. Skin Pharmacology and Applicate Skin Physiology 14: 401-407. [ Links ]
LÓPEZ, A. 1994. Avance y perspectivas del control biológico de las moscas blancas. En: Memorias del seminario manejo integrado de mosca blanca y técnicas de aplicación de pesticidas. SOCOLEN. Bogotá, pp. 42-53. [ Links ]
LÓPEZ, A.; GARCÍA, J. 2000. Manejo integrado sostenible de moscas blancas como plagas y vectores de virus en los trópicos. 1. Reconocimiento, diagnóstico y caracterización de moscas blancas como plagas en el trópico alto de América Latina. Informe final. Convenio DANIDA-CORPOICA. CIAT. 43 p. [ Links ]
MCKENZIE, R.; BJÔRN, L.; BAIS, A.; ILYAS, M. 2003. Changes in biologically active ultraviolet radiation reaching the earth's surface. Photochemical Photobiology Science 2: 5-15. [ Links ]
MILLER, CH; RANCEL, D.; BRAGA, G.; FLINT, S.; KWON, S.; MESSIAS, C.; ROBERTS, D.; ANDERSON, A. 2004. Enzyme activities associated with oxidative stress in Metarhizium anisopliae during germination, mycelial growth, and conidiation and in response to near-UV irradiation. Journal of Microbiology 50: 41-49. [ Links ]
MOORE, D.; BRIDGE, P. D.; HIGGINS, P.; BATEMAN, R.; PRIOR, C. 1993. Ultra-violet radiation damage to Metarhizium flavoviride conidia and the protection given by vegetable and mineral oils and chemical sunscreens. Annuary of Applicated Biology 122: 605-616. [ Links ]
MOORE, D.; HIGGINS, P. M.; LOMER, C. J. 1996. Effects of simulated and natural sunlight on the germination of conidia of Metarhizium flavoviride Gams and rozsypal and interactions with temperature. Biocontrol Science and Technology 6: 63-76. [ Links ]
MORLEY, D.; MOORE, D.; PRIOR, C. 1996. Screening of Metarhizium and Beauveria spp. spores with exposure to simulated sunlight and a range of temperatures. Mycological Research 100: 31-38. [ Links ]
MULERO, M. 2004. Efecto de la radiación ultravioleta (RUV) sobre los procesos de estrés oxidativo e inmunosupresión cutánea. Efecto protector de los filtros solares. Tesis doctoral. Facultad de Medicina. Universidad Rovira I Virgili. 174 p. [ Links ]
NICHOLSON, W.; SCHUERGER A.; SETLOW P. 2005. The solar UV environment and bacterial spore UV resistance: considerations for earth - to Mars transport by natural processes and human spaceflight. Mutation Research 571: 249-264. [ Links ]
RAGAEI, M. 1999. Radiation protection of microbial pesticides. Journal of Applied Entomology 123: 381-384. [ Links ]
RIBERA, P.; PARADELO, C. 1997. El sol y la piel: Fotoprotección y filtros solares. Medicina Integral 30 (2): 64-71. [ Links ]
RIESENMAN, P.; NICHOLSON W. 2000. Role of the spore coat layers in Bacillus subtilis spore resistance to hydrogen peroxide, artificial UVC, UVB and solar UV radiation. Applied Environment Microbiology 66: 620-626. [ Links ]
SAXENE, D.; BEN-DOV, E.; MANSHEROB, R.; BARAK. Z.; BOUSSIBA, S.; ZARITSKY, A. 2002. A UV tolerant mutant of Bacillus thuringiensis spp. Kurstaki producing melanin. Microbiology 44: 25-32. [ Links ]
SERPONE, N.; DONDI, D.; ALBINI, A. 2007. Inorganic and organic UV filters: Their role and efficacy in sunscreens and suncare products. Inorganica Chimica Acta 360: 794-802. [ Links ]
SERRA, N. 1994. Fotoprotectores y bronceadores. Actualidad Dermatológica 33: 447-458. [ Links ]
SETLOW, P. 1988. Resistance of bacterial spores to ultraviolet light. Comments Molecular Cell Biology Biophysics 5: 253-264. [ Links ]
SHAH, P. A.; DOURO-KPINDOU, O. K.; SIDIBE, A.; DAFFE, C. O.; PAUUW, H.; LOMER, C. J. 1998. Effects of the sunscreen oxybenzone on field efficacy and persistente of Metarhizium falvoviride conidia against Kraussella amabile (Orthoptera: Acrididae) in Mali, West Africa. Biocontrol Science Technology 8: 357-364. [ Links ]
SMITS, N.; SINOQUET H. 2004. Fungal bioinsecticide survival in response to UVB in 3D digitized grapevine canopies: a simulation study, pp. 187-189. En: Godin, C. (ed). 4th International workshop on functional-structural plant models. 7-11 june 2004. Montpellier. France. 201 p. [ Links ]
THOMA, F. 1999. Light and dark in chromatin repair: repair of UV - induced DNA lesions by photolyase and nucleotide excision repair. EMBO Journal 18: 6585-6598. [ Links ]
TOBAR, S.; VÉLEZ, P.; MONTOYA, E. 1996. Selección de aislamientos patogénicos de Beauveria bassiana y Metarhizium anisopliae por resistencia a la luz ultravioleta. Congreso de la Sociedad Colombiana de Entomología (SOCOLEN). Cartagena - Colombia. 17 - 19 de julio de 1996, p. 76. [ Links ]
VILLAMIZAR, L.; COTES, A.; GÓMEZ, M. 1997. Producción masiva y preformulación de Metarhizium spp. (Metschnicov) para el control biológico de la langosta llanera Rhammatocerus schistocercoides (Rhen). Revista Colombiana de Entomología 23 (3-4): 119-124. [ Links ]
YOUNG, A.; POTTE, C.; NIKAIDO, O.; PARSONS, P.; BOENDERS, J.; RAMSDEN, J. 1998. Human melanocytes and keratinocytes exposed to UVB or UVA in vivo show comparable levels of thymine dimers. Journal Investigation Dermatology 111: 936-940. [ Links ]
Recibido: 29-ene-2007 - Aceptado: 14-dic-2008