Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.1 Bogotá Jan./June 2009
Transmisión experimental de Tomato yellow leaf curl virus (TYLCV) por Bemisia tabaci (Aleyrodidae) a solanáceas
Experimental transmission of Tomato yellow leaf curl virus (TYLCV) by Bemisia tabaci (Aleyrodidae) to solanáceas
DORYS T. CHIRINOS1, PASCUAL GÜERERE2, FRANCIS GERAUD-POUEY1, GUSTAVO ROMAY3, MARÍA A. SANTANA4 y LISETH BASTIDAS5
1 Laboratorio de Manejo Integrado de Plagas en Frutales y Hortalizas, Unidad Técnica Fitosanitaria (MIPFH-UTF), Facultad de Agronomía, La Universidad del Zulia (LUZ), Maracaibo, 4005, estado Zulia, Venezuela. dtchirinos@gmail.com, fgeraudp@gmail.com.
2 Departamento de Ciencias Agropecuarias, Instituto Universitario de Tecnología de Maracaibo, Maracaibo, estado Zulia, Venezuela. pguerere@cantv.net.
3 Instituto de Estudios Avanzados (IDEA). Apartado 17606. Parque Central. Caracas 1015A, Venezuela. gromay@idea.gob.ve.
4 Departamento de Biología Celular, División de Ciencias Biológicas, Universidad Simón Bolívar (USB). Caracas, Venezuela. msantana@usb.ve.
5 Centro de Investigaciones Agrícolas del estado Zulia, Instituto Nacional de Investigaciones Agrícolas (INIA), Maracaibo, estado Zulia. lisethbastidas@gmail.com.
Resumen: Entre diciembre 2006 y mayo 2007 se estudió la transmisión de un aislado del Tomato yellow leaf curl virus (TYLCV) por Bemisia tabaci a algunas especies de solanáceas cultivadas y silvestres para evaluarlas como posibles hospederas de dicho virus. Plantas de Solanum lycopersicum L., S. melongena L., S. hirtum Vahl, S. sisymbriifolium Lam., Datura stramonium L., D. inoxia Mill. Physalis angulata L. y P. ixocarpa Brot. se expusieron individualmente durante 48 horas a adultos de B. tabaci criados sobre plantas de tomate enfermas. Como control se utilizaron plantas de las mismas especies, expuestas a adultos criados sobre plantas de algodón libre del Begomovirus. Posteriormente, las plantas se mantuvieron dentro de jaulas a prueba de B. tabaci, sobre las cuales se hicieron observaciones para detectar síntomas hasta 30 días post-período de exposición al vector. Luego se tomaron muestras de ápices foliares para determinaciones del virus mediante PCR. Sólo se observaron síntomas de infección por TYLCV en S. lycopersicum y D. stramonium a los 12 y 13 días respectivamente, alcanzando el 100% de las plantas evaluadas. Infección por TYLCV fue corroborada a través de PCR. En el resto de las plantas expuestas a moscas infectadas además de no mostrar síntomas, el virus no fue detectado por PCR. En observaciones adicionales se detectó que el insecto no formó colonias sobre D. inoxia y S. sisymbriifolium. Estos resultados aportan información acerca de las especies de hospederas de ese aislado de TYLCV en Venezuela, país donde se reportó recientemente por primera vez este virus para Suramérica.
Palabras clave: Mosca blanca. Reservorio. Solanum.
Abstract: Between December 2006 and May 2007 the transmission of an isolate of the Tomato yellow leaf curl virus (TYLCV) by Bemisia tabaci to several cultivated and wild solanaceous species was studied to determine their role as possible hosts of this virus. Plants of Solanum lycopersicum L., S. melongena L., S. hirtum Vahl, S. sisymbriifolium Lam., Datura stramonium L., D. inoxia Mill. Physalis angulata L., and P. ixocarpa Brot. were individually exposed during 48 h to B. tabaci adults reared on infected tomato plants. Control plants belonged to the same species but these were exposed to adults reared on virus free cotton plants. Thereafter, the plants were maintained inside B. tabaci test cages and observations were made to detect symptoms up to 30 days post exposure to the vector. Then foliar apex samples were taken for virus determinations through PCR. Symptoms of TYLCV infection were only observed on S. lycopersicum and D. stramonium at days 12 and 13, respectively, reaching 100% of the plants evaluated. TYLCV infection was corroborated through PCR. In the other plants exposed to infected adults, besides not showing symptoms, the virus was not detected by PCR. Additional observations it was detected that the insect did not form colonies on D. inoxia and S. sisymbriifolium. These results contribute information about the host range of this isolate of TYLCV in Venezuela, where this virus was recently reported for the first time in South America.
Key words: Whitefly. Reservoir. Solanum.
Introducción
El tomate, Solanum lycopersicum L. es una de las hortalizas más cultivadas en Venezuela cuya producción se destina tanto al consumo fresco como para uso industrial (Baptista y Felipe 1990; Fernández-Bravo et al. 2006). Entre los artrópodos que pueden limitar su rendimiento se encuentran gusanos perforadores de frutos, tales como Heliothis spp. (Lepidoptera: Noctuidae) en zonas bajas (< 400 msnm) donde se siembra una sola vez al año (Geraud-Pouey et al. 1995) y Neoleucinodes elegantalis Guenee, 1854 (Lepidoptera: Pyralidae) en zonas más altas (> 400 msnm) donde se cultiva todo el año (Fernández y Salas 1985; Geraud-Pouey et al. 1995). No obstante, Bemisia tabaci (Gennadius, 1889) (Hemiptera: Aleyrodidae) es probablemente el artrópodo de mayor relevancia en este y otros cultivos, pues además de los daños directos que causa a las plantas como insecto chupador, principalmente por su capacidad para trasmitir enfermedades virales, entre las cuales han adquirido especial relevancia las causadas por los Begomovirus (Polston y Anderson 1997; Rojas et al. 2000; Urbino et al. 2004).
Los Begomovirus pertenecen a la familia Geminiviridae que comprende virus de cápside icosahédrica geminada (partícula viral formada por dos porciones gemelas de 18 nm de diámetro) las cuales contienen cadenas simples circulares ADN de 2,5 a 3 Kb de tamaño (Hull 2002). La mayoría de los Begomovirus tienen genoma bipartito (ADN A y B), aunque algunos virus dentro de este grupo tienen genoma monopartito similar al ADN A de los Begomovirus anteriores, siendo uno de los más estudiado el TYLCV (Stanley et al. 2001). Los Begomovirus son transmitidos exclusivamente por B. tabaci de manera circulativa (Jones 2003) y representan alrededor del 90% de los virus descritos dentro de la familia Geminiviridae (Fauquet y Stanley 2003).
El primer Begomovirus reportado en Venezuela fue el inicialmente referido como “un mosaico amarillo del tomate” (Debrot et al. 1963), el cual posteriormente fue denominado como virus del mosaico amarillo del tomate (Lastra y Uzcátegui 1975). La controversia taxonómica surgida a raíz de haber sido reportado y descrito el Potato yellow mosaic virus (PYMV) (Roberts et al. 1986; Coutts et al. 1991), el cual ha sido considerado como sinónimo del Tomato yellow mosaic virus (ToYMV) (Morales et al. 2001), fue discutida por Geraud-Pouey et al. (2009). Resulta interesante que las epifitias del PYMV (descrito como virus de papa, Solanum tuberosum L.,) sean mucho más comunes en tomate tanto en Venezuela como en otras regiones de América (Lastra y Uzcátegui 1975; Polston et al. 1998; Rojas et al. 2000; Urbino et al. 2004; Nava et al. 2006).
Dada la importancia adquirida por las enfermedades virales trasmitidas por B. tabaci, desde fines de los ochenta en Venezuela, comenzaron a realizarse inventarios de enfermedades virales sobre plantas sintomáticas (Nava et al. 1997, 1998a, 1998b), de los cuales se describieron dos Begomovirus bipartitos en tomate (Nava et al. 2006). Más recientemente, ha sido reportado para Venezuela y Suramérica el Begomovirus monopartito, Tomato yellow leaf curl virus (TYLCV) (Zambrano et al. 2007) el cual parece estar ampliamente distribuido en el territorio nacional. Esta enfermedad viral ha causado cuantiosas pérdidas tanto en el nuevo como en el viejo mundo y en consecuencia, su importancia como problema fitosanitario ha sido ampliamente discutida (Polston et al. 1999; Moriones y Navas-Castillo 2000; Accotto et al. 2000).
B. tabaci coloniza más de 500 especies de plantas en 74 familias botánicas (Greathead 1986). Esta condición polífaga del insecto permite la transmisión de TYLCV en el campo tanto a especies cultivadas pertenecientes a otras familias botánicas (Navas-Castillo et al. 1999), como a otras solanáceas (Kashina et al. 2002) que en Venezuela se rotan o siembran en conjunto con el cultivo del tomate. Este virus puede también ser trasmitido a plantas silvestres (Sánchez-Campos et al. 2000; Kashina et al. 2002; García-Andrés et al. 2006), las cuales también crecen en los campos de cultivo y por tanto podrían constituir reservorios sintomáticos o asintomáticos de dichos virus (Umaharan et al. 1998; Salati et al. 2002).
Por tales razones, es importante, evaluar plantas cultivadas y silvestres como posibles hospederas de este Begomovirus en Venezuela. En consecuencia, este trabajo tuvo como fin evaluar la transmisión experimental de TYLCV por B. tabaci a algunas especies de solanáceas cultivadas y silvestres con el fin de aproximar su amplitud de hospederas que podrían constituir eslabones de la cadena epifitótica de esta enfermedad viral en el cultivo del tomate en Venezuela.
Materiales y Métodos
Ambiente experimental. Este trabajo fue conducido en condiciones de laboratorio (temperatura: 26,74 ± 1,5°C, Humedad Relativa (HR) 82 ± 3,7%) combinado con umbráculo (jaulasumbráculos, en el exterior del laboratorio, aproximadamente 34°C y HR de 87%) en el laboratorio MIPFH-UTF, Facultad de Agronomía, LUZ, Maracaibo, estado Zulia, Venezuela, durante diciembre 2006 - mayo 2007.
Del vector, del virus y de plantas fuentes. Las metodologías para la obtención de colonias de B. tabaci libre de virus, determinación del biotipo del vector, identificación del agente viral y mantenimiento de plantas fuentes, fueron detallados por Geraud-Pouey et al. (2009) y son aquí resumidas. Dado que el algodón Gossypium hirsutum L., ha sido reportado como planta no hospedera de TYLCV (Czosnek et al. 1993; Ghanim y Czosnek 2000), la colonia de B. tabaci libre de virus fue mantenida sobre esta especie de planta dentro de jaulas entomológicas en el laboratorio. De dicha colonia se obtuvieron adultos de B. tabaci no virulíferos para infestar las plantas utilizadas como testigos.
La determinación del biotipo B de B. tabaci en la colonia libre de virus fue confirmada mediante amplificación parcial del gen mitocondrial mtCOI que codifica para la enzima Citocromo Oxidasa I (Frohlich et al. 1999). Por otro lado, las plantas de tomate híbrido Río Orinoco (Petoseed, Saticoy, California, EE. UU.) utilizadas como fuentes del TYLCV también se mantuvieron en jaulas entomológicas dentro del laboratorio. En las mismas, a partir de un fragmento amplificado de 851 pares de bases que incluye la secuencia completa del gen que codifica la proteína de la cápside (Ling et al. 2006), se obtuvo un 96% de identidad nucleotídica con el aislado TYLCV Mild [Portugal] recién reportado para Venezuela por Zambrano et al. (2007).
Producción de plantas experimentales. Las seMillas de las plantas silvestres evaluadas se colectaron de plantas en los alrededores de campos de tomate en el estado Zulia, ubicado al noroccidente del país. Las seMillas de especies tanto silvestres como cultivadas se sembraron en bandejas iniciadoras de polietileno de 52 x 62cm con 128 receptáculos, sobre sustrato de turba de musgo (Sunshine Plug Mix 5, Sun Gro Horticulture Inc. Bellevue, Washinton, EE. UU.) y mantenidas dentro del laboratorio, envueltas en bolsa negras de polietileno hasta que se completaba la germinación. Luego, las bandejas descubiertas se transfirieron a jaulas-umbráculo con estructura de perfiles de aluminio (2,3m x 1,12m x 0,63m; largo x ancho x alto), cerradas con malla de nylon muy fina a prueba de B. tabaci (18 x 18 hilos/cm2), ubicadas en el exterior del laboratorio. Después de veinte días, las plantas se transplantaron a vasos plásticos (capacidad 250 cc) utilizando como sustrato una mezcla de dos partes de suelo areno-francoso y una parte de materia orgánica vegetal descompuesta, previamente esterilizada en autoclave (120ºC, 15-20 psi durante 1 h). Los transplantes se hicieron dentro del laboratorio para evitar riesgos de transmisión de cualquier enfermedad por insecto. Seguidamente se realizaron las inoculaciones para los ensayos de transmisión.
Ensayos de transmisión. Se evaluaron ocho especies de solanáceas, entre éstas cinco silvestres comunes en Venezuela: ñongue morado, Datura stramonium L., ñongue, D. inoxia DC., huevo de gato, Solanum hirtum Vahl, revientacaballos S. sisymbriifolium Lam., huevo de sapo, Physalis angulata L. y tres cultivadas, berenjena, S. melongena L, tomate verde, P. ixocarpa Brot. y tomate, S. lycopersicum L., esta última como testigo positivo. Dado que las mencionadas especies se expusieron por separado a moscas virulíferas y a moscas no virulíferas, se evaluaron un total de 16 tratamientos en tres repeticiones, utilizándose 12 plantas/repetición/tratamiento para las plantas expuestas a moscas virulíferas y nueve plantas/ repetición/tratamiento para aquellas expuestas a moscas no virulíferas, usadas como control negativo (testigo), totalizando 504 plantas. Los adultos usados tenían máximo 24h de emergidos. Cada planta experimental fue expuesta a quince adultos por un período de 48 h, tiempo este, considerando la naturaleza persistente de la transmisión de los Begomovirus.
Los adultos virulíferos se criaron sobre plantas de tomate fuentes del virus y los utilizados en las plantas testigos sobre plantas de algodón. Para la exposición individual, cada planta se colocó en el interior de una jaula cilíndrica de plástico transparente (sección de envase de gaseosa de 2 l, 10 cm x 15 cm, diámetro x altura) con el tope cerrado con organza. Los adultos de B. tabaci se introdujeron dentro de la jaula, colocando al pie de la planta el tubo de vidrio del succionador con el cual habían sido colectados, destapados boca hacia arriba.
Una vez culminado este período de inoculación, se retiraron las jaulas plásticas y para eliminar los adultos de B. tabaci, las plantas se asperjaron con una solución de imidacloprid (Relevo 500®, INICA, Cagua, Venezuela) preparada a 0,04% v/v de ingrediente activo. En ese momento las plantas se transplantaron a macetas plásticas (capacidad 2 l) y fueron pasadas a las jaulas umbráculos ya descritas.
Posterior al periodo de inoculación, las plantas se observaron a diario para detectar síntomas hasta los treinta días post exposición al vector, estimándose así el día de aparición de síntomas. Además se calculó el porcentaje de plantas sintomáticas para cada una de las repeticiones, obteniéndose así tres valores por tratamiento totalizando 48. Con el objeto de confirmar la transmisión del agente viral observada inicialmente por la aparición de síntomas así como para descartar la existencia de especies asintomáticas en aquellas plantas sometidas a moscas virulíferas, se tomaron muestras de ápices foliares en seis plantas, dos por repetición, para cada especie evaluada. Igual número de muestras fueron tomadas en los testigos.
Para evitar deterioro de las proteínas por putrefacción, cada muestra se depositó dentro de una copa de papel secante moldeada dentro de un envase de plástico transparente (2,8 cm x 4,5 cm, diámetro x altura, dimensiones internas), con tapa enroscada, conteniendo silica gel como desecante, en la mitad inferior. Para completar la rápida deshidratación, se cambió la silica gel al siguiente día.
AisLamiento de ADN y Reacción en Cadena de la Polimerasa (PCR). De las muestras de plantas se extrajo ADN siguiendo el protocolo de Gilbertson et al. (1991). Del ADN aislado se amplificó por PCR el fragmento de 850 pares de bases correspondiente a la secuencia completa del gen que codifica la proteína de la cápside del virus TYLCV. Para la amplificación de este fragmento se usaron los cebadores específicos KL04- 06_TYLCV CP F (5’-gcc gcc gaa ttc aag ctt act atg t cg aag-3’) y KL04-07_TYLCV CP R (5’-gcc gcc ctt aag ttc gaa act cat gat ata-3’) diseñados por Ling et al. (2006). Los componentes de la reacción se colocaron en las siguientes concentraciones finales: 20 mM de Tris-HCl, 100 mM de KCl, 2,5 mM de MgCl2, 150 μM de dNTPs, 1 unidad de Taq polimerasa y 20 pM de cada cebador. La cantidad de ADN total de planta usada en cada reacción fue de 1μg aproximadamente de acuerdo con la metodología seguida por Wyatt y Brown (1996). Como control negativo se incluyeron plantas sanas crecidas en condiciones de aisLamiento. Las condiciones del termociclador fueron 35 ciclos de 92ºC por 1 minuto, 55ºC por 20 segundos y 72ºC por 30 segundos. El producto de PCR fue analizado por electroforesis en agarosa al 1% y solución tampón de Tris-Acetato EDTA pH 8,0. En cada bolsillo se colocaron 8 μl del producto de PCR y 2 μl de tampón de carga, luego se corrieron aproximadamente a 60 V por 30 minutos, al final de la corrida se tiñó el gel con bromuro de etidio (1 μg/ml) para visualización del fragmento.
Relación insecto-planta. Con el fin de establecer posibles limitaciones derivadas de la relación insecto-planta en la capacidad de transmitir el virus, tres plantas de cada especie se expusieron individualmente a 50 adultos no virulíferos de B. tabaci, durante 48 h, posterior a las cuales comenzaron a ser observada la formación y desarrollo de colonias del insecto sobre las mismas, tomando en cuenta la supervivencia de los individuos.
Análisis estadístico. El análisis de la varianza fue hecho utilizando un diseño completamente al azar. El porcentaje de plantas sintomáticas se transformaron con la función de raíz cuadrada de (x + 1) para ajustarlos a la distribución normal. Las comparaciones de media para ambas variables se hicieron con la prueba de Tukey (P < 0.05) utilizándose el programa estadístico SAS.
Resultados y Discusión
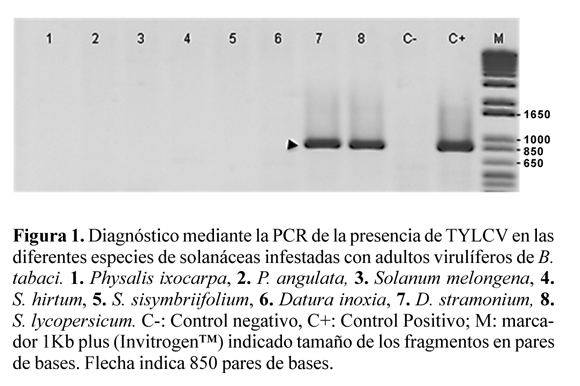
La Tabla 1 muestra el tiempo de aparición de síntomas y el porcentaje de plantas sintomáticas para las especies expuestas a moscas blancas virulíferas y no virulíferas. Entre las primeras, solo S. lycopersicum y D. stramonium manifestaron síntomas de TYLCV. Dichos resultados fueron corroborados por PCR (Fig. 1). En el resto de las plantas infestadas con moscas blancas virulíferas, además de no manifestar síntomas, el virus no fue detectado por PCR. Ninguna de las plantas expuestas a moscas blancas no virulíferas mostró síntomas (Tabla 1), ni se detectó el virus mediante las PCR realizadas (Fig. 1).
El tiempo promedio de aparición de síntomas resultó 11,58 ± 0,85 (amplitud: 11-15 días) y 12,95 ± 1,61 (amplitud: 11-14 días) para S. lycopersicum y D. stramonium respectivamente sin diferencias significativas entre éstas (Tabla 1). En tomate los síntomas se caracterizaron por acortamiento de los entrenudos apicales así como encrespado de las hojas terminales y amarilLamiento acentuado hacia los bordes (Fig. 2A) comparado con las plantas sanas (Fig. 2B) mientras que en D. stramonium, las hojas tendían a ondularse mostrando también amarilLamiento intervenal algo difuso (Fig. 2C), contrastante con la superficie plana y el color verde uniforme observado en las plantas sanas de esta especie (Fig. 2D).
En ambos casos, la presencia del virus fue detectada en el 100% de las plantas (Tabla 1). Esto indica que D. stramonium se comportó como un hospedero sintomático, el cual podría ser reservorio del referido virus en el campo. Esto corrobora experimentalmente para Venezuela, estudios que la han referido como hospedera sintomática de TYLCV tanto en el campo como en ensayos experimentales (Ramos et al. 1996; Kashina et al. 2002; Salati et al. 2002; De Blas et al. 2004).
A pesar que D. inoxia pertenece al mismo género que D. stramonium, no resultó infectada por este aislado de TYLCV (Tabla 1, Fig. 1). En ello aparentemente podría haber influido la inadaptabilidad de la mosca blanca a la planta pues en las infestaciones con adultos de B. tabaci se observó menor oviposición y no hubo formación de colonias (Tabla 2), ya que las escasas ninfas que se fijaron no sobrevivieron más allá del segundo estadío. Estos resultados contrastan con lo referido por Gilbertson (2007), quien señala a D. meteloides (sinónimo de D. inoxia) como hospedero de TYLCV. No obstante, este autor no da detalles de la metodología seguida. Variantes poblacionales que pueden ocurrir en especies de plantas así como en los aislados del virus, entre otros, podrían explicar tales diferencias.
Tampoco se detectó TYLCV (Fig. 1) ni se desarrollaron colonias del insecto vector (Tabla 2) en S. sisymbriifolium. Esta planta posee una alta densidad de pequeños tricomas glandulares distribuidos sobre toda su superficie y que exudan sustancias pegajosas. Adultos de B. tabaci quedaron atrapados en esos tricomas. La importancia de esta incompatibilidad insecto-planta podría evaluarse como posible práctica para el manejo de este problema fitosanitario. Estudios realizados por Haider et al. (2001) utilizaron esta especie como patrón injertado sobre tomate más la aplicación de un insecticida, como parte de un programa de manejo integrado de plagas en ese cultivo y encontraron baja incidencia tanto de B. tabaci como de TYLCV en ese tratamiento comparado con las otras alternativas.
Por el contrario, tanto en S. hirtum, S. melongena, así como en las dos especies de Physalis, donde tampoco ocurrió infección viral (Fig. 1), B. tabaci formó colonias apreciables, de manera similar a D. stramonium. Ello descarta cualquier limitación debido a que el insecto vector no se alimente de la planta. Los resultados con S. melongena, coinciden con los obtenidos por Rubinstein y Czosnek (1997). Por el contrario los de P. angulata, contrastan con los de Yutaka et al. (2002). Asimismo, también se ha descrito que TYLCV pudo ser trasmitido mediante injerto desde tomate a P. ixocarpa (Valverde et al. 2001).
Conclusiones
Las plantas silvestres evaluadas ocurren comúnmente en campos de Venezuela donde se siembra tomate. Por esta razón estos trabajos contribuyen al conocimiento de la amplitud de hospederas de TYLCV como reservorios del virus en el campo. Estos resultados muestran que D. inoxia, S. sisymbriifolium, S. hirtum, S. melongena, Physalis angulata, y P. ixocarpa, no se infectaron con este aislado de TYLCV. En las dos primeras especies mencionadas podría influir la incompatibilidad entre el insecto vector y la planta. Las diferencias frente a lo observado en otras investigaciones en cuanto a la no detección del virus en D. inoxia, y las dos especies de Physalis sugieren variantes en el comportamiento de los organismos involucrados. Como se ha comentado anteriormente, variantes poblacionales de las especies de plantas o del aislado viral, podrían explicar las discrepancias de resultados. Finalmente es importante resaltar que aunque la biología del vector sobre las diferentes hospederas no fue objeto de este trabajo, a la vista de lo obtenido, podría ser interesante realizar estos estudios especialmente en aquellas hospederas donde se observó posible antibiosis sobre el vector para eventualmente evaluarla como fuentes de resistencia o prácticas tendientes a disminuir las poblaciones de B. tabaci y así interferir con las relaciones de transmisión.
Agradecimientos
Al FONACIT por haber financiado parcialmente la presente investigación a través de las subvenciones “G-2000001610” y “Diseño de un Esterilizador de suelos”. A Enrique Moriones, de La Estación La Mayora, Málaga, España por las correcciones hechas a este manuscrito y a los evaluadores anónimos.
Literatura citada
ACCOTTO, G.; NAVAS-CASTILLO, J.; NORIS, E.; MORIONES, E.; LOURO, D. 2000. Typing of Tomato yellow leaf curl virus in Europe. European Journal of Plant Pathology 106 (2): 179-186. [ Links ]
BAPTISTA, B.; FELIPE, E. 1990. Densidad de siembra y nivel de fertilización en almácigos de tomate (Lycopersicon esculentum Mill.). Revista de la Facultad de Agronomía (Maracay) (Venezuela) 16 (2): 115-132. [ Links ]
COUTTS, R. H. A.; COFFIN, R. S.; ROBERTS, E. J. F.; HAMILTON W. D. O. 1991. The nucleotide sequence of the infectious cloned DNA components of potato yellow mosaic virus. Journal of Genetic Virology 72 (7): 1515-1520. [ Links ]
CZOSNEK, H.; KHEYR-POUR, A.; GRONENBORN, B.; REMETZ, E.; ZEIDAN, M.; ALTMAN, A.; RABINOWITCH, H.D.; VIDAVSKY, S.; KEDAR, N.; GAFNI, Y.; ZAMIR, D. 1993. Replication of Tomato yellow leaf curl virus (TYLCV) DNA in agroinoculated leaf discs from selected tomato genotypes. Plant Molecular Biology 22 (6): 995-1005. [ Links ]
DE BLAS, C.; JIANG, Y. X.; BEDFORD, I. D.; NOMBELA, G.; MUÑIZ, M. 2004. Effect of Bemisia tabaci biotype in the transmission of Tomato Yellow Leaf Curl Sardinia Virus (TYLCSV-ES) between tomato and common weeds: Short communication. Spanish Journal of Agricultural Research (1): 116- 120. [ Links ]
DEBROT, E.; HEROLD, F.; DAO, F. 1963. Notas preliminares sobre un mosaico amarillento del tomate en Venezuela. Agronomía Tropical 13 (1): 33-41. [ Links ]
FAUQUET, C.; STANLEY, J. 2003. Geminivirus classification and nomenclature: progress and problems. Annals of Applied Biology 142 (2): 165-189. [ Links ]
FERNÁNDEZ, S.; SALAS, J. 1985. Estudios sobre la biología del perforador del fruto del tomate Neoleucinodes elegantalis Guenee (Lepidoptera: Pyraustidae). Agronomía Tropical 35 (1-3): 77-82. [ Links ]
FERNÁNDEZ-BRAVO, C.; URDANETA, N.; SILVA, W.; POLISZUK, H.; MARÍN, M. 2006. Germinación de seMillas de tomate (Lycopersicon esculentum Mill.) cv 'Río Grande sembradas en bandejas plásticas, utilizando distintos sustratos. Revista de la Facultad de Agronomía (LUZ) (Venezuela) 23 (2): 188-195. [ Links ]
FROHLICH, D. R.; TORRES-JEREZ, I. I.; BEDFORD, I. D.; MARKHAM, P. G.; BROWN, J. K. 1999. A phylogeographic analysis of the Bemisia tabaci species complex based on mitochondrial DNA markers. Molecular Ecology 8 (10): 1683- 1691. [ Links ]
GARCÍA-ANDRÉS, S.; MONCI, F.; NAVAS-CASTILLO, J.; MORIONES E. 2006. Begomovirus genetic diversity in the native plant reservoir Solanum nigrum: evidence for the presence of a new virus species of recombinant nature. Virology 350 (2): 433- 442. [ Links ]
GERAUD-POUEY, F.; CHIRINOS, D. T.; RIVERO, G. 1995.Artrópodos asociados con el cultivo del tomate (Lycopersicon esculentum Mill.) en Venezuela. Boletín de Entomología Venezolano 10 (1): 31-49. [ Links ]
GERAUD-POUEY, F.; CHIRINOS, D. T.; ROMAY, G.; SANTANA, M. A.; BASTIDAS, L.; FLORES, L. 2009. Transmisión del TYLCV a diferentes materiales de tomate (Lycopersicon esculentum Miller) mediado por el Biotipo B del complejo Bemisia tabaci (Gennadius) en Venezuela. Bioagro (Venezuela) 21 (1): en prensa. [ Links ]
GHANIM, M.; CZOSNEK, H. 2000. Tomato yellow leaf curl geminivirus (TYLCV-Is) is transmitted among whiteflies (Bemisia tabaci) in a sex-related manner. Journal of Virology 74 (10): 4738- 4745. [ Links ]
GILBERTSON, R. L. 2007. Tomato spotted wilt and tomato yellow leaf curl: Update on the current status of these insect-transmitted viral diseases. http://www.ceyolo.ucdavis.edu. Fecha última revisión: 28 enero 2008. Fecha último acceso: [21 agosto 2008]. [ Links ]
GILBERTSON, R. L.; ROJAS, M. R.; RUSELL, D. R.; MAXWELL D. P. 1991. Use of the asymmetric polymerase chain reaction and DNA sequencing to determine genetic variability of Bean golden mosaic geminivirus in the Dominican Republic. Journal of Genetic Virology 72 (11): 2843-2849. [ Links ]
GREATHEAD, A. H. 1986. Host plants, pp. 17-26. En: Cock M. J. W. (Ed.). En: Bemisia tabaci a literature survey on the cotton whitefly with an annotated bibliography. CAB International Institute, Biological Control. Silkwood Park, UK. [ Links ]
HAIDER, M. Z.; TABEL, M. A.; HOSSIAN, M. B. 2001. Effectiveness of some IPM packages for the managements of virus-disseminating whitefly on tomato. Bangladesh Journal of Agricultural Research (Bangladesh) 26 (3): 309-317. [ Links ]
HULL, R. 2002. Matthews. Plant Virology. Academic Press. 1001 p. [ Links ]
JONES, R. 2003. Plant viruses transmitted by whiteflies. European Journal of Plant Pathology 109 (3): 195-219. [ Links ]
KASHINA, B.; MABAGALA, R.; MPUNAMI, A. 2002. Reservoir weed hosts of Tomato yellow leaf curl Begomovirus from Tanzania. Archives of Phytopathology and Plant Protection 35 (4): 269- 278. [ Links ]
LASTRA, J. R.; UZCÁTEGUI, R. C. 1975. Viruses affecting tomatoes in Venezuela. Phytopathology Z 84 (3): 253-258. [ Links ]
LING, K.; SIMMONS, A. M.; HASSELL, R. L.; KEINATH, A. P.; POLSTON, J. E. 2006. First report of tomato yellow leaf curl virus in South Carolina. Plant Disease 90 (4): 379. [ Links ]
MORALES, F. J.; LASTRA, R.; DE UZCÁTEGUI, R. C.; CALVERT, L. 2001. Potato yellow mosaic virus: a synonym of Tomato yellow mosaic virus. Archives of Virology 146 (11): 2249-2253. [ Links ]
MORIONES, E.; NAVAS-CASTILLO, J. 2000. Tomato yellow leaf curl virus, an emerging virus complex causing epidemics worldwide. Virus Research 71 (1): 123-134. [ Links ]
NAVA, A.; TRUJILLO, G.; CHIRINOS, D. T.; RIVERO, G. 1997. Detección de virus de las zonas productoras de tomate (Lycopersicon esculentum Mill.) en Venezuela. II. Estados andinos (Mérida, Táchira y Trujillo). Revista de la Facultad de Agronomía (LUZ) (Venezuela) 14 (6): 611-624. [ Links ]
NAVA, A.; TRUJILLO, G.; CHIRINOS, D. T.; RIVERO, G. 1998a. Detección de virus de las zonas productoras de tomate (Lycopersicon esculentum Mill.) en Venezuela. III. Estados centro occidentales (Lara, Portuguesa, Barinas y Cojedes). Revista de la Facultad de Agronomía (LUZ) (Venezuela) 15 (1): 23-29. [ Links ]
NAVA, A.; TRUJILLO, G.; CHIRINOS, D. T.; RIVERO, G. 1998b. Detección de virus de las zonas productoras de tomate (Lycopersicon esculentum Mill.) en Venezuela. IV. Estados Zulia. Revista de la Facultad de Agronomía (LUZ) (Venezuela) 15 (2): 135-141. [ Links ]
NAVA, A. R.; PATTE, C. P.; HIEBERT, E.; POLSTON, J. E. 2006. Detection and variability of Begomoviruses in tomato from the andean states of Venezuela. Plant Disease 90 (1): 61-66. [ Links ]
NAVAS-CASTILLO, J.; SÁNCHEZ-CAMPOS, S.; DÍAZ, J. A. 1999. Tomato yellow leaf curl virus-Is causes a novel disease of common bean and severe epidemics in tomato in Spain. Phytopathology 83 (1): 29-32. [ Links ]
POLSTON, J. E ; ANDERSON, P. K. 1997. The emergence of whitefly-transmitted geminiviruses in tomato in the Western Hemisphere. Plant Disease 81 (12): 1358-1369. [ Links ]
POLSTON, J. E.; BOIS, D.; POLIAKOFF, F.; ANO, G.; URBINO, C. 1998. Occurrence of a strain of Potato yellow mosaic geminivirus infecting tomato in the Eastern Caribbean. Plant Disease 82 (1): 126. [ Links ]
POLSTON, J.; MCGOVERN, R.; BROWN, L. 1999. Introduction of Tomato yellow leaf curl virus in Florida and implications for the spread of this and other geminiviruses of tomato. Plant Disease 83 (11): 984-988. [ Links ]
POLSTON, J. E ; ANDERSON, P. K. 1997. The emergence of whitefly-transmitted geminiviruses in tomato in the Western Hemisphere. Plant Disease 81 (12): 1358-1369. [ Links ]
POLSTON, J. E.; BOIS, D.; POLIAKOFF, F.; ANO, G.; URBINO, C. 1998. Occurrence of a strain of Potato yellow mosaic geminivirus infecting tomato in the Eastern Caribbean. Plant Disease 82 (1): 126. [ Links ]
RAMOS, P. L.; GUERRA, O.; DORESTES, V.; RAMIREZ, N.; RIVERA-BUSTAMANTE, R.; ORAMAS, P. 1996. Detection of TYLCV in Cuba. Plant Disease 80 (12): 1208. [ Links ]
ROBERTS, E. J. F.; BUCK, K. W.; COUTTS, R. H. A. 1986. A new virus infecting potatoes in Venezuela. Plant Disease 70 (1): 603. [ Links ]
ROJAS, A.; KVARNHEDEN, A.; VALKONEN, J. P. T. 2000. Geminiviruses infecting tomato crops in Nicaragua. Plant Disease 84 (8): 843-846. [ Links ]
RUBINSTEIN, G.; CZOSNEK, H. 1997. Long-term association of Tomato yellow leaf curl virus with its whitefly vector Bemisia tabaci: effect on the insect transmission capacity, longevity and fecundity. Journal of General Virology 78 (10): 2683-2689. [ Links ]
SALATI, R.; NAHKLA, M. F.; ROJAS, M. R.; GUZMAN, P.; JAQUEZ, J.; MAXWELL, D. P.; GILBERTSON, R. L. 2002. Tomato yellow leaf curl virus in the Dominican Republic: characterization of an infectious clone, virus monitoring in whiteflies, and identification of reservoir hosts. Phytopathology 92 (5): 487-496. [ Links ]
SÁNCHEZ-CAMPOS, S.; NAVAS-CASTILLO, J.; MONCI, F.; DÍAZ, J. A.; MORIONES, E. 2000. Mercurialis ambigua and Solanum luteum: two newly discovered natural hosts of Tomato yellow leaf curl geminivirus. European Journal of Plant Pathology 106 (4): 391-394. [ Links ]
STANLEY, J.; BOULTON, M.; DAVIES, W. 2001. Geminiviridae. Encyclopedia of life sciences nature Publishing Group. http://www.els.net [ Links ]
UMAHARAN, P.; PADIDAM, M.; PHELPS, R. H.; BEACHY, R. N.; FAUQUET, C. M. 1998. Distribution and diversity of geminiviruses in Trinidad and Tobago. Phytopathology 88 (12): 1262-1268. [ Links ]
URBINO, C.; POLSTON, J. E.; PATTE C. P.; CARUANA M. L. 2004. Characterization and genetic diversity of Potato yellow mosaic virus from the Caribbean. Archives of Virology 149 (2): 417-424. [ Links ]
VALVERDE, R. A.; LOTRAKUL P.; LANDRY, A. D.; BOUDREAUX, J. E. 2001. First Report of Tomato yellow leaf curl virus in Louisiana. Plant Disease 85 (2): 230. [ Links ]
WYATT, S. D.; BROWN, J. K. 1996. Detection of subgroup III geminivirus isolates in leaf extracts by degenerate primers and polymerase chain reaction. Phytopathology 86 (12): 1288-1293. [ Links ]
YUTAKA, G.; KEISUKE, U.; TADASHI, F.; YASUHIRO, O.; TAKESHI, Y.; KAZUTOSHI M. 2002. Plants with confirmed natural infection of Tomato yellow leaf curl virus. Kyushu Okinawa Nogyo Kenkyu Seika Joho 17: 521-522. [ Links ]
ZAMBRANO, K.; CARBALLO, O.; GERAUD, F.; CHIRINOS, D.; FERNÁNDEZ, C.; MARYS, E. 2007. First report of Tomato yellow leaf curl virus in Venezuela. Plant Disease 91 (6): 768. [ Links ]
Recibido: 9-sep-2008 - Aceptado: 8-mar-2009