Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.1 Bogotá Jan./June 2009
Control de la garrapata Boophilus microplus con Metarhizium anisopliae, estudios de laboratorio y campo
Control of the cattle tick Boophilus microplus with Metarhizium anisopliae, laboratory and field studies.
ELKIN LÓPEZ1,4, GUSTAVO LÓPEZ2 y SERGIO ORDUZ3,4
1 Natural Control Ltda. La Ceja, Antioquia, Colombia, Km 3 vereda San Nicolás, Tel.: (574) 5536232, Correo electronico: elopez34@gmail.com. Autor para correspondencia.
2 Facultad de Medicina Veterinaria y Zootecnia, Universidad CES; Instituto Colombiano de Medicina Tropical ICMT, Medellín Colombia.
3 Facultad de Ciencias, Universidad Nacional de Colombia, sede Medellín, Colombia.
4 Unidad de Biotecnología y Control Biológico, Corporación para Investigaciones Biológicas, Medellín, Colombia.
Resumen: Se evaluó la capacidad biocontroladora de ocho cepas Metarhizium anisopliae sobre la garrapata Boophilus microplus en condiciones de laboratorio y campo. La cepa 137bm causó el efecto más fuerte sobre la capacidad reproductiva de la garrapata, disminuyendo la oviposición de la garrapatas del 90 al 96% cuando las garrapatas adultas fueron tratadas in vitro con 1x108 y 1x109 conidias/ml. También redujo la viabilidad de los huevos de este artrópodo en más del 98% en las mismas dosis. En ensayos de campo se logró reducir la infestación de garrapatas en un 75% en vacas Holstein x Cebú, cuando se aplicó M. anisopliae 137bm a una concentración de 1x108 conidias/ml. Además, se observó que la fecundidad de las garrapatas provenientes de vacas tratadas con M. anisopliae fue tres veces inferior que las del grupo control. Por otra parte, la cepa 137bm aplicada en la pradera a una concentración de 5x1012 conidias/ha, causó una disminución en la población de larvas en cerca del 86% una semana después de una aspersión con conidias de M. anisopliae.
Palabras clave: Control biológico. Fertilidad de garrapatas. Ganado Holstein x Cebú.
Abstract: The biocontrol potential of eight strains of Metarhizium anisopliae was evaluated for the cattle tick Boophilus microplus under laboratory and field conditions. The strain 137bm caused the highest effect on the reproductive capacity of the tick, decreasing tick oviposition by 90 and 96% when adult ticks were treated in vitro with 1x108 and 1x109 conidia/ ml. It also reduced egg viability by more than 98% in the same doses. In the field trials it was possible to reduce tick infestation by 75% in Holstein x Cebú cows when M. anisopliae 137bm was applied at a concentration of 1x108 conidias/ ml. Also, the fecundity of the ticks coming from cows treated with M. anisopliae was three times lower than that of the control group. On the other hand, strain 137bm applied to the meadow at a concentration of 5x1012 conidia/ha concentration caused a decrease in the larval tick population close to 86% one week after an application with conidia of M. anisopliae.
Key words: Biological control. Tick fertility. Holstein x Cebú cattle
Introducción
La garrapata Boophilus microplus (Canestrini, 1887) es considerada como uno de los más importantes ectoparásitos del ganado bovino en los países tropicales debido a los daños directos que ocasiona y a los agentes infecciosos que transmite y que causan enfermedades como anaplasmosis y babesiosis (da Guedes et al. 2000; Costa et al. 2002). Las garrapatas se encuentran distribuidas en diferentes zonas en todo el mundo pero es principalmente en Centro y Sur América y el occidente de África donde generan las más grandes pérdidas económicas, que en años anteriores fueron calculadas entre US$ 13.900 y 18.700 millones debido a que causan disminución en la producción de leche y carne, mortalidad del ganado, sin considerar el costo derivado de su control (Bittencourt et al. 1997; Kaaya y Asan 2000).
El control de las garrapatas se realiza comúnmente mediante acaricidas, pero por el desarrollo de resistencia (Rodriguez- Vivas et al. 2006), por la demanda de alimentos libres de residuos químicos y por el cuidado del ambiente, se sugiere la utilización de sistemas alternativos de control entre los que se pueden contar el empleo de nemátodos (Hill 1998), vacunas (Jonsson et al. 2000; Ruiz et al. 2007), bacterias (Hassanain et al. 1997)., aceites esenciales (Prates et al. 1998) y hongos entomopatógenos como Beauveria bassiana (Bals. Vuill, 1806) y Metarhizium anisopliae (Metschnikoff ,1879, Sorokin, 1883). Se ha reportado que estos hongos causan mortalidad en garrapatas adultas, a la vez que disminuyen su fecundidad (Bittencourt et al. 1997; Zhioua et al. 1997; Barcelos et al. 1998; Kaaya 2000; Guedes et al. 2000; Kaaya y Asan 2000; Benjamín et al. 2002; da Costa et al. 2002).
M. anisopliae es un hongo Deuteromycete, patógeno generalista que ataca un diverso grupo de insectos (Benjamín et al. 2002; Quesada-Moraga et al. 2004). Este hongo invade el cuerpo del artrópodo hospedero a través de la cutícula y posteriormente se reproduce en él, favoreciendo así la transmisión horizontal del hongo y además puede tener efecto sobre la reproducción del organismo que está siendo atacado (Quesada- Moraga et al. 2004). M. anisopliae ha sido utilizado comúnmente para el control de insectos entre los que se destacan hormigas, termitas, langostas y cucarachas entre otros, y también se ha usado para el control de ácaros y garrapatas (Souza et al. 1999; Bittencourt 2000; Kaaya y Asan 2000; López y Orduz 2003).
El objetivo de este trabajo fue estudiar el efecto patógeno de M. anisopliae sobre diferentes estados de desarrollo de la garrapatas B. microplus mediante bioensayos en el laboratorio y pruebas en campo, utilizando ganado y pasto naturalmente infestados.
Materiales y Métodos
Cepas de hongos. Se utilizaron las cepas 77, 81, 94, 95, 115, 136 y 137bm de M. anisopliae que hacen parte de la colección de hongos de la Unidad de Biotecnología y Control Biológico de la Corporación para Investigaciones Biológicas (CIB). Los hongos se cultivaron en agar papa dextrosa (PDA) y se incubaron a 26ºC por dos semanas. Las conidias de los hongos se cosecharon por lavado de la superficie del medio de cultivo con agua destilada estéril (Gindin et al. 2000).
Bioensayos en laboratorio. Se recolectaron garrapatas teleoginas B .microplus de vacas Holstein en el centro de acopio de ganado en la ciudad de Medellín, Colombia. Grupos de 10 garrapatas fueron lavadas, pesadas y posteriormente sumergidas durante tres minutos en suspensiones de conidias de cada cepa de M. anisopliae con un rango de concentración entre 103 y 109 conidias/ml. Posteriormente, las garrapatas se colocaron en cajas de Petri e incubaron a 26ºC, 85-90% de humedad y fotoperíodo luz: oscuridad 12:12 horas por 21 días para permitir la ovoposición. Los huevos se recolectaron, pesaron e incubaron bajo las mismas condiciones para permitir la eclosión larvaria. Las garrapatas control se trataron con agua destilada estéril e incubaron bajo las mismas condiciones. Se registró la infección producida por el hongo en las garrapatas y el peso de los huevos ovipositados y posteriormente se registró el porcentaje de eclosión larvaria (Bittencourt et al. 1997; Zhioua et al.1997; da Costa et al. 2002).
También se realizaron bioensayos con larvas de B. microplus obtenidas de teleoginas que se incubaron como se mencionó anteriormente. Las larvas se trataron con conidias de cada una de las cepas de M. anisopliae en un rango de concentración entre 103 y 109 conidias/ml. Se agregaron 3 ml de las suspensiones de conidias en cajas de petri con círculos de papel filtro. Posteriormente, se depositaron entre 300 y 500 larvas de 11 a 21 días de nacidas, se cubrieron con otro círculo de papel filtro y se agregaron nuevamente 3 ml de las suspensiones de conidias de M. anisopliae. Se incubaron por 3 min a temperatura ambiente y después las larvas se colocaron en tubos de ensayo cerrados con tapones de algodón e incubadas a 26ºC, 85-90% de humedad por 10 días. Las larvas del grupo control se trataron con agua destilada estéril. Se evaluó la mortalidad larvaria de acuerdo con la técnica descrita por Souza et al. (1999) y Chagas et al. (2003).
Ensayos en campo. Se utilizó la cepa 137bm de M. anisopliae debido a que en los ensayos de laboratorio demostró una la mayor patogenicidad para las garrapatas que las otras cepas. M. anisopliae cepa 137bm fue producido por una empresa dedicada a la comercialización de microorganismos para control biológico y la formulación de las conidias incluye lactosa, talco y goma xantan. El ensayo se realizó en una finca situada a 1600 msnm en el municipio de Barbosa, 50 km al norte de Medellín, Colombia, con una temperatura promedio de 26ºC y una humedad relativa entre 65-75%.
En la prueba se utilizaron 20 vacas del cruce Holstein x Cebú distribuidas en dos grupos de 10 animales cada uno. Un grupo de vacas fue bañado con una suspensión acuosa de conidias de M. anisopliae cepa 137bm a una concentración de 1x108 conidias/ml. Se aplicó 1 litro de la suspensión de conidias por cada 100 kg de peso del animal. El otro grupo de vacas sirvió como control y se utilizó solamente agua en la misma cantidad que el grupo tratado con el hongo. La elección de la dosis utilizada en estas pruebas se hizo teniendo en cuenta los buenos resultados con esta concentración en pruebas de laboratorio y por el costo del tratamiento de un producto comercial.
Las aplicaciones se hicieron en tres ocasiones con una bomba de aspersión, con intervalos de una semana y se continuó el monitoreo por tres semanas después de la última aplicación. El seguimiento del experimento se realizó mediante el recuento semanal de garrapatas adultas con un tamaño superior a 4 mm en cada uno de los animales. Después de 48 horas de las aplicaciones de M. anisopliae, de cada una de las vacas se recolectaron garrapatas que fueron llevadas al laboratorio para determinar el peso de los huevos ovipositados y el porcentaje de eclosión larvaria. Los especimenes recogidos se trataron de igual forma como se mencionó en los bioensayos en laboratorio.
El hongo M. anisopliae cepa 137bm se aplicó también en el pasto (pradera) en parcelas de 9 m2 con una dosis de 5x1012 conidias/ha. Se utilizó un potrero distinto al experimento con vacas y libre de ganado. Las aplicaciones y evaluaciones se hicieron en las mismas fechas en que se hizo el experimento con los bovinos. Se determinó el número de larvas de garrapatas en las parcelas contabilizando las larvas que se adherían a una tela blanca de 1 m2 que se extendió sobre el pasto tres veces durante tres minutos en cada visita (Benjamín et al. 2002). Una parcela de igual tamaño que la anterior donde se aplicó solamente agua sirvió como control. Durante el período de observación no se permitió al ganado pastorear en esas parcelas.
Análisis de datos. Se obtuvieron índice de producción de huevos (IPH= peso postura/peso inicial de garrapatas) y eficiencia reproductiva (ER= IPH x % eclosión larvaria) (Bittencourt et al. 1994a; 1997). Los datos fueron sometidos a análisis de varianza y a la prueba de Tukey para determinar diferencias significativas entre tratamientos y controles. En los ensayos con larvas en laboratorio se determinó la concentración letal media (LC50) usando el programa Probit.
Resultados
Bioensayos en laboratorio. En todas las concentraciones utilizadas se observó esporulación del hongo M. anisopliae sobre las garrapatas tratadas siete días después de la inoculación. M. anisopliae causó disminución en el IPH y en la ER de las garrapatas cuando se aplicó cualquier cepa y en todas las concentraciones usadas, con diferencias estadísticamente significativas respecto al grupo control (Tabla 1). La cepa 137bm causó la más alta IPH llegando a ser entre las dosis 1x106 y 1x109 conidias/ml de hasta 22 veces menor que en el control. Además, mientras que el valor de ER en el grupo control fue cercano al 50%, en el grupo tratado con la cepa 137bm en las dosis 1x108 y 1x109 conidias/ml, estuvo por debajo del 0,1% (Tabla 1). La eclosión larvaria a partir de huevos que procedían de las garrapatas tratadas también disminuyó con la aplicación de todas las cepas y dosis, pero, particularmente con la cepa 137bm con la que la eclosión de larvas fue de 1,67% y 0,5% en las dosis 1x108 y 1x109 conidias/ml respectivamente, mientras que en el grupo control el porcentaje de eclosión fue del 97,5% (Tabla 2).
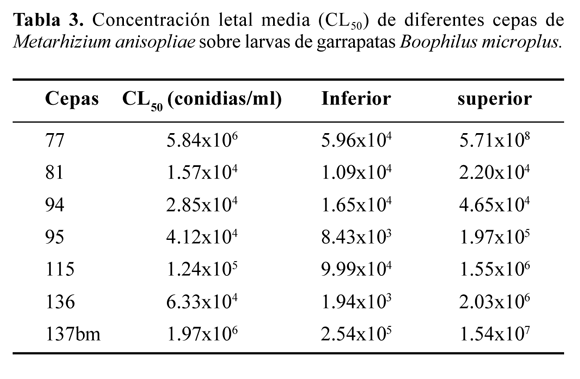
En los bioensayos con larvas de garrapata se encontró una alta susceptibilidad de las larvas a todas las cepas de M. anisopliae y se determinó que las cepas 81, 94, 95 y 136 fueron las más efectivas para matar larvas de garrapata y presentaron una concentración letal media (CL50) en un rango entre 1,57x104 y 6,33x104 conidias/ml (Tabla 3).
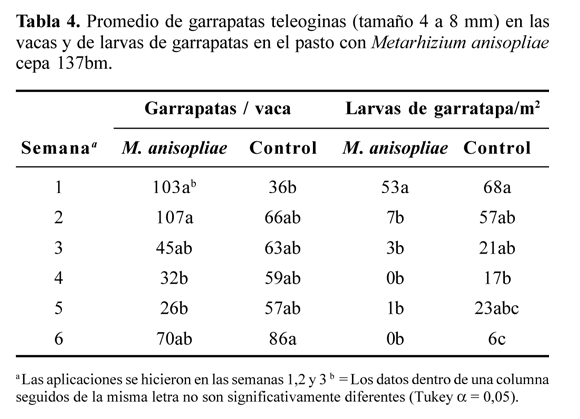
Ensayos en campo. Los datos de la semana uno corresponden a la población natural de garrapatas teleoginas o larvas de garrapata en las vacas o en el pasto, respectivamente. Después de las aplicaciones de M. anisopliae cepa 137bm se observó una disminución del 75% en la infestación de garrapatas en los animales del grupo tratado, con diferencias estadísticamente significativas, entre los datos, a partir de la tercera semana (después de dos aplicaciones) y del inicio del experimento (Tabla 4).
En el grupo de vacas control se presentó un aumento en la infestación de garrapatas durante el mismo periodo (Tabla 5). Además, la cepa 137bm M. anisopliae causó una disminución de oviposición y eclosión de larvas provenientes de vacas tratadas por lo que los valores de IPH y ER son de tres y dos veces menores que en el control, con diferencias estadísticamente significativas, después de la segunda y tercera aplicación del hongo, respectivamente (Tabla 5).
En el experimento en pasto el efecto biocontrolador de M. anisopliae fue menos notorio debido a que tanto en la parcela tratada como en el control hubo una disminución en la población de larvas garrapata durante el tiempo de evaluación. De manera que en la segunda semana del experimento en pasto, después de la primera aspersión con las conidias de M. anisopliae, se encontró una reducción del 87% de la población de larvas de garrapata (Tabla 4). Mientras que en el control solo se presentaron diferencias significativas respecto al recuento inicial, hasta cuatro semanas después de haber iniciado el experimento (Tabla 4).
Discusión
M. anisopliae presentó una alta capacidad para atacar las garrapatas, puesto que aun en las concentraciones más bajas utilizadas afectó diferentes estados de desarrollo de este ectoparásito sobre los bovinos o en el pasto. Además, M. anisopliae causó disminución en la oviposición de garrapatas provenientes de vacas tratadas y en la eclosión larvaria, lo que podría ser interpretado como la transmisión vertical del efecto controlador del hongo a la descendencia del artrópodo. Resultados similares han sido demostrados en otros estudios de control de garrapatas (Bittencourt et al. 1994a, 1994b; Barcelos et al. 1998; Bittencourt 2000; Kaaya 2000; Guedes et al. 2000; Quesada-Moraga et al. 2004). El efecto de transmisión vertical de M. anisopliae ha sido estudiado en cucarachas, en las que se encontró disminución cercana al 50% en la producción de huevos y en la eclosión de ninfas cuando los adultos fueron tratados con la cepa EAMa01/121-Su (Quesada-Moraga et al. 2004).
Los resultados de laboratorio pudieron ser extrapolados a la prueba de campo que se realizó con la cepa 137bm, aunque los cambios en los resultados de IPH, ER y eclosión no tuvieron la misma intensidad de los ensayos de laboratorio posiblemente debido a que las conidias del hongo se vieron afectadas por condiciones ambientales como la intensidad solar y la lluvia.
M. anisopliae causó una disminución en la infestación de garrapatas en el ganado y en el pasto. Este efecto controlador de M. anisopliae sobre las garrapatas se conservó en el ganado tratado durante dos semanas después de la última aplicación. Resultados similares fueron observados en un trabajo previo donde el efecto de las conidias de los hongos B. bassiana y M. anisopliae persistieron entre una a tres semanas en las orejas del ganado después de la aplicación (Kaaya et al. 1996).
De acuerdo con los datos de IPH, ER y el porcentaje de eclosión larvaria, no se presentaron diferencias significativas entre el grupo de vacas tratadas y el control cuando se aplicó M. anisopliae la primera vez, pero después de la segunda y de la tercera aplicación del hongo sobre las vacas se encontró reducción de los parámetros en el grupo de animales tratados, situación que sugiere que una sola aplicación no es lo suficientemente efectiva, por lo que se deben realizar aplicaciones periódicas de hongos en un esquema similar al que se hace cuando se aplican productos químicos. Además, la aplicación de M. anisopliae también debe realizarse en el pasto donde se encuentran las larvas de garrapatas con el fin de disminuir la posibilidad de una nueva infestación en el ganado, ya que se conoce que las larvas son altamente susceptibles a la acción del hongo, como se logró comprobar en este trabajo.
A pesar de que en el experimento de campo en la parcela control hubo disminución en la población de garrapatas, ésta sólo presentó diferencias significativas respecto a la población inicial de larvas a partir de la cuarta semana del experimento mientras que en el lote tratado la disminución se dio una semana después. Además, el experimento de campo fue realizado durante octubre y noviembre de 2003 que estuvieron entre los meses más lluviosos del año con 202 y 156 mm, y 21 y 14 días de lluvia en el mes, respectivamente (Datos obtenidos del Instituto de Estudios Ambientales de Colombia IDEAM). Esta precipitación puede tener dos efectos, el primero es mantener una alta humedad en el ambiente lo que favorece la germinación de las conidias de M. anisopliae y promueve el proceso de infección (Luz y Fargues 1997), pero por otro lado puede causar disminución de la población de larvas del pasto por lavado, tendencia que se observó en el grupo control.
Agradecimientos
Este proyecto se desarrolló con el apoyo financiero de Colciencias, Corporación para Investigaciones Biológicas y la Empresa Colombiana de Productos Veterinarios, Vecol S.A.
Literatura citada
BARCELOS, A.; FIORIN, A.; MONTEIRO, A.; VERÍSSIMO, C. 1998. Effects of Metarhizium anisopliae on the tick Boophilus microplus (Acari: Ixodidae) in stabled cattle. Journal of Invertebrate Pathology 71 (2): 189-191. [ Links ]
BENJAMÍN, M.; ZHIOUA, E.; OSTFELD, R. 2002. Laboratory and field evaluation of the entomopathogenic fungus Metarhizium anisopliae (Deuteromycetes) for controlling questing adult Ixodes scapularis (Acari: Ixodidae). Journal of Medical Entomology 39 (5): 723-728. [ Links ]
BITTENCOURT, V. 2000. Trials to control south american ticks with entomopathogenic fungi. Annals of the New York Academy of Sciences 916: 555-558. [ Links ]
BITTENCOURT, V.; MASSARD, C.; LIMA, A. 1994a. Ação do fungo Metarhizium anisopliae sobre a fase não parasitaria do ciclo biológico de Boophilus microplus. Revista Universidad Rural. Série Ciências da Vida 16 (1-2): 49-55. [ Links ]
BITTENCOURT, V.; MASSARD, C.; LIMA, A. 1994b. Ação do fungo Metarhizium anisopliae em ovos e larvo do garrapato Boophilus microplus. Revista Universidad Rural. Série Ciências da Vida 16 (1-2): 41-47. [ Links ]
BITTENCOURT, V.; SOUZA, E.; PERALVA, S.; MASCARENIAS, A.; ALVES, S. 1997. Avaliação da eficacia in vitro de dois isolados do fungo entomopatogênico Beauveria bassisana (Bals.) Vuill. Em fêmeas ingurgitadas de Boophilus microplus (Canestrini, 1887) (Acari: Ixodidae). Revista Brasileira de Parasitologia Veterinaria 6 (1): 49-52. [ Links ]
CHAGAS, A.; LEITE, R.; FURLONG, J.; PRATES, H.; PASSOS, W. 2003. Susceptibilidade do carrapato Boophilus microplus a solventes. Ciencia Rural 33 (1): 109-114. [ Links ]
DA COSTA, G.; SARQUIS, M.; DE MORAES, A.; BITTENCOURT, V. 2002. Isolation of Beauveria bassisana and Metarhizium anisopliae var anisopliae from Boophilus microplus tick (Canestrini, 1887); in Rio de Janeiro State; Brazil. Mycopathologia 154 (4): 207-209. [ Links ]
GINDIN, G.; SAMISH, M.; ALEKSEEV, E.; GLAZER, I. 2000. The susceptibility of Boophilus annulatus (Ixodidae) ticks to entomopathogenic fungi. Biocontrol Science and Technology 11 (1): 111-118. [ Links ]
GUEDES, A.; DA SILVA, I.; MASUDA, A.; SCHRANK, A.; HENNING, M. 2000. In vitro assessment of Metarhizium anisopliae isolates to control the cattle tick Boophilus microplus. Veterinary Parasitology 94 (1-2): 117-125. [ Links ]
HASSANAIN, M.; EL-GARBY, M.; ABDEL-GHAFFAR, F.; ELSHARABY, A.; ABDEL MEGEED, K. 1997. Biological control studies of soft and hard Ticks in Egypt. I The effect of Bacillus thurigiensis varieties of soft and hard tick (Ixodidae). Parasitology Research 83 (3): 209-213. [ Links ]
HILL, E. 1998. Entomopathogenic nematodes as control agents of developmental stags of the black legged tick: Ixodes scapularis. Journal of Parasitology 84(6): 1124-1127. [ Links ]
JONSSON, N.; MATSCHOSS, A.; PEPPER, P.; GREEN, P.; ALBRECHT, M.; HUNGERFORD, J.; ANSELL, J. 2000. Evaluation of TickGARDPLUS; a novel vaccine against Boophilus microplus; in lactating Holstein-Friesian cows. Veterinary Parasitology 88 (3-4): 275-285. [ Links ]
KAAYA, G. 2000. Laboratory and field evaluation for entomogenous fungi for tick control. Annals of the New York Academy of Sciences 916: 559-564. [ Links ]
KAAYA, G.; ASAN, S. 2000. Entomogenous fungi as promising biopesticides for tick control. Experimental and Applied Acarology 24 (12): 913-926. [ Links ]
KAAYA, G.; MWANGI, E.; OUNA, E. 1996. Prospects for biological control of livestock ticks; Rhipicephalus appendiculatus and Amblyomma variegatum; using the entomogenous fungi Beauveria bassiana and Metarhizium anisopliae. Journal of Invertebrate Pathology 67 (1): 15-20. [ Links ]
LÓPEZ, E.; ORDUZ, S. 2003. Metarhizium anisopliae and Trichoderma viride for control nests of the fungus-growing ant; Atta cephalotes. Biological Control 27 (2): 194-200. [ Links ]
LUZ, C.; FARGUES, J. 1997. Temperature and moisture requirements for conidial germination of an isolate of Beauveria bassiana; pathogenic to Rhodnius prolixus. Mycopathologia 138 (3): 117- 125. [ Links ]
PRATES, H.; LEITE BR.; CRAVEIRO CA.; OLIVEIRA D A. 1998. Identification of some chemical components of the essential oil from molasses grass (Melinis minutiflora Beauv.) and their activity against cattle-tick (Boophilus microplus). Journal of the Brazilian Chemical Society 9 (2): 193-197. [ Links ]
QUESADA-MORAGA, E.; SANTOS-QUIROS, R.; VALVERDEGARCIA, P.; SANTIAGO-ALVAREZ, C. 2004. Virulence; horizontal transmission; and subletal reproductive effects of Metarhizium anisopliae (Anamorphic fungi) on the German cockroach (Blattodea: Blattellidae). Journal of Invertebrate Pathology 87 (1): 51-58. [ Links ]
RODRÍGUEZ-VIVAS, R.; RODRIGUEZ-AREVALO F.; ALONSODIAZ M.; FRAGOSO-SANCHEZ H.; SANTAMARIA V.; ROSARIO-CRUZ R. 2006. Prevalence and potential risk factors for amitraz resistance in Boophilus microplus ticks in cattle farms in the State of Yucatan, Mexico. Preventive Veterinary Medicine 75 (3-4): 280-286. [ Links ]
RUIZ, L.; ORDUZ, S.; LÓPEZ, E.; GUZMAN, F.; PATARROYO, M.; ARMENGOL, G. 2007. Immune response in mice and cattle after immunization with a Boophilus microplus DNA vaccine containing bm86 gene. Veterinary Parasitology 144 (1-2): 138- 145. [ Links ]
SOUZA, E.; REIS, R.; BITTENCOURT, V. 1999. Evaluation of in vitro effect of the fungi Beauveria bassiana and Metarhizium anisopliae on eggs and larvae or Amblyomma cajennense. Revista Brasileira de Parasitologia Veterinaria 8 (2): 127-131. [ Links ]
ZHIOUA, E.; BROWING, M.; JOHNSON, P.; GINSBERG, H.; LEBRUN, R. 1997. Pathogenicity of the entomopathogenic fungus Metarhizium anisopliae (Deuterocycetes) to Ixodes scapularis (Acari: Ixodidae). Journal of Parasitology 83 (5): 815-818. [ Links ]
Recibido: 28-oct-2008 - Aceptado:10-mar-2009