Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.35 n.1 Bogotá jan./jun. 2009
Parámetros de vida de Tetranychus cinnabarinus (Acari: Tetranychidae) sobre hojas de clavel, Dianthus caryophyllus
Life history parameters of Tetranychus cinnabarinus (Acari: Tetranychidae) on leaves of carnation, Dianthus caryophyllus
VÍCTOR TELLO M.1*, ROBINSON VARGAS M.2 y JAIME ARAYA C.3
1 Doctor. Universidad Arturo Prat, Departamento de Agricultura del Desierto. Avenida Arturo Prat 2120, Casilla 121, Iquique, Chile. vtello@unap.cl *Autor para correspondencia.
2 Doctor. Instituto de Investigaciones Agropecuarias, Centro Regional de Investigación La Cruz, Casilla 3, La Cruz, Chile. rvargas@inia.cl.
3 Doctor. Universidad de Chile, Facultad de Agronomía. Santa Rosa 11.315, La Pintana, Santiago, Chile. jearaya@uchile.cl.
Resumen: Se estudió la biología de Tetranychus cinnabarinus sobre Dianthus caryophyllus var. Celta bajo condiciones controladas de 29,44 ± 1,47°C de temperatura, 42,35 ± 5,01% HR y un fotoperiodo de 14:10 h (L:O). El ciclo de huevo a adulto duró 12,84 ± 0,21 días, con una supervivencia del 80,22%. La proporción sexual fue de 76,28% hembras: 23,72% machos. La longevidad media de las hembras fue de 24,28 ± 1,37 días y la tasa de oviposición diaria fue de 3,92 ± 0,21 huevos/hembra/día. La tasa intrínseca de incremento (rm) fue de 0,183; la tasa finita de crecimiento (λ) fue de 1,201 individuos/hembra/día; el tiempo generacional medio (T) fue de 20,24 días y la tasa neta de reproducción (R0) fue de 40,809. Los patrones de desarrollo de T. cinnabarinus están dentro de los descritos para ácaros de la familia Tetranychidae.
Palabras clave: Desarrollo postembrionario. Fecundidad. Supervivencia. Tabla de vida.
Abstract: The biology of Tetranychus cinnabarinus on Dianthus caryophyllus var. Celta was studied under controlled conditions of 29.44 ± 1.47°C temperature, 42.35±5.01% RH and 14:10 h (L:D) photophase. The cycle from egg to adult lasted 12.84 ± 0.21 days, with 80.22% survival. The sex ratio was 76.28% females: 23.72% males. The mean female longevity was 24.28 ± 1.37 days and the mean daily oviposition rate was 3.92 ± 0.21 eggs/female/day. The intrinsic rate of increase (rm) was 0.183; the finite rate of increase (λ) was 1.201 individuals/female/day; the mean generation time (T) was 20.24 days; and the net rate of reproduction (R0) was 40.809. The development patterns of T. cinnabarinus fall within those described for mites of the family Tetranychidae.
Key words: Postembryonic development. Fecundity. Survival. Life table.
Introducción
Los ácaros (Orden Acarina) de la familia Tetranychidae están entre las plagas más importantes de plantas cultivadas. La familia Tetranychidae incluye un número de especies de importancia económica entre las cuales Tetranychus urticae Koch, 1836 y la arañita carmin T. cinnabarinus (Boisduval, 1867) se destacan. La arañita carmín, se encuentra asociada a más de 120 plantas hospederas como algodón, frutilla, plantas ornamentales, frutales de hoja caduca, tomate, berenjena y otros vegetales (LaPlante y Sherman 1976; Hill 1983; Goff 1986; Biswas et al. 2004)
En Chile, la arañita carmín tiene como hospederos primarios al clavel, alfalfa, melón, frutilla y fréjol. Se distribuye desde la Región de Arica y Parinacota a la Región del Maule. En la zona desértica de Chile (Región de Tarapacá) se asocia principalmente con clavel y melón, donde se le controla únicamente con productos químicos (Klein y Waterhouse 2000). La reproducción en las arañitas rojas es muy sensible a una amplia variedad de condiciones intrínsecas y extrínsecas. Los factores intrínsecos que influencian los parámetros de tabla de vida de los ácaros tetraníquidos incluyen la raza y el nivel de endogamia, densidad de la colonia, edad de las hembras y de la población, fertilidad de las hembras (Wrensch 1985). Los factores extrínsecos incluyen la temperatura, humedad, luz, depredación, y también diferentes características de las plantas hospederas, tales como la variedad, estado nutricional y edad de la planta (Adango et al. 2006). Pocos estudios se han realizado sobre la biología de este ácaro (Biswas et al. 2004) por lo que en este estudió se buscó obtener una mejor comprensión de su biología sobre clavel para desarrollar futuros programas de manejo integrado de plagas en las zona áridas de Chile.
Materiales y Métodos
Los bioensayos se hicieron en los laboratorios del Centro Regional de Investigación La Cruz (Quillota-Chile), dependiente del Instituto de Investigaciones Agropecuarias (INIA), a 29,44 ± 1,47°C, 42,35 ± 5,01% HR y un fotoperíodo de 14:10 h (L:O) entre el 22 enero al 30 junio 2008. Tetranychus cinnabarinus se recolectó de plantas de clavel en Quillota, Región de Valparaíso, Chile (32°49’S, 71°17’W). Se multiplicaron en plantas de clavel Dianthus caryophyllus L, 1753, var. Celta, en secuencias que se infestaron cada siete días. Las plantas provinieron del predio Agrícola Terra Ltda. de Quillota, Región de Valparaíso.
Para determinar los parámetros poblacionales de T. cinnabarinus se cortaron rectángulos de hojas de clavel de madurez estándar de 3,6 cm², que se pusieron con la superficie abaxial hacia arriba sobre una capa de algodón saturado de agua en placas Petri plásticas de 12 cm de diámetro. Estas placas Petri, a su vez, se pusieron en bandejas plásticas de 41x31x7 cm con una esponja de poliuretano saturada de agua. En cada trozo de hoja se dispuso una hembra grávida para obtener huevos. Estos sustratos se revisaron después de 24 h para verificar la ovipostura. Posteriormente se dejó un huevo por hoja y se removió el exceso de huevos y también la hembra. Las evaluaciones del tiempo de desarrollo de cada estadío, desde huevos a adultos de machos y hembras, se hicieron dos veces al día (9:00 y 16:00). Una vez que las hembras alcanzaron la adultez, se introdujeron dos machos en cada hoja para que las fertilizaran y poder determinar los períodos de preoviposición. Para obtener la proporción sexual, los huevos puestos por cada hembra se registraron diariamente, se retiraron de la hoja y se ubicaron en otras placas hasta la emergencia de los adultos. Los períodos de oviposición y postoviposición de las hembras fueron calculados desde el momento en que el primer huevo fue depositado hasta la postura del último huevo y desde el momento en que el último huevo fue puesto hasta la muerte de la hembra, respectivamente.
Análisis estadístico. Se utilizó un diseño completamente aleatorizado con cinco repeticiones para cada tratamiento. La unidad experimental fue un grupo de seis rectángulos de hojas de clavel con un huevo cada uno. Los resultados de desarrollo postembrionario se transformaron a log(x+1) (Zar 2006). Posteriormente se aplicó un ANAVA y la prueba de comparación múltiple de Tukey (Zar 2006). La tasa de supervivencia (lx) se expresó como el número de individuos vivos a un tiempo “x”, mientras que la fecundidad a una edad específica (mx) se calculó tomando como base el número de hembras descendientes producidas a partir de una hembra en un tiempo “x”. Los parámetros poblacionales estimados fueron: 1) tasa neta de reproducción (R0), 2) tiempo generacional (T), 3) tasa intrínseca de crecimiento (rm) y 4) tasa finita de crecimiento natural (λ), que se estimaron a partir de los resultados de fecundidad y supervivencia de las hembras (Birch 1948). Los parámetros de la tabla de vida se calcularon a través del programa computacional LIFE 48 escrito en BASIC (About-Setta et al. 1986).
Resultados y Discusión
Desarrollo postembrionario. En la Tabla 1 se presentan los estadísticos para el tiempo de duración de los diferentes estados de desarrollo de la arañita cinabarina. El período de cada estadío presentó diferencias altamente significativas entre ellos (F = 65,98, g.l. = 3,96, P < 0,0001), con la mayor duración para la incubación de los huevos, la que varió entre cuatro y seis días, y los de menor duración fueron los estados de proto y deutoninfas, que variaron entre dos y tres días para las primeras y entre dos y cuatro para las segundas. El desarrollo completo hasta la hembra adulta varió entre 10 y 14 días.
Los resultados para el desarrollo de T. cinnabarinus están dentro de los patrones de variación de ácaros Tetranychidae. Carey y Bradley (1982) encontraron períodos de incubación para tres especies de tetraníquidos variando entre 4,41 y 4,95 días a 23,8°C. Crooker (1985) indicó que el período de desarrollo desde huevo hasta adulto en los Tetranychidae puede variar desde seis a 10 días o más, dependiendo de las especies, temperatura, humedad, planta hospedera y otros factores. Similar a lo registrado por Biswas et al. (2004), la baja humedad relativa no afectó a ninguno de los estados postembrionarios. De acuerdo con Jeppson et al. (1975), al estudiar los parámetros de vida de Tetranychus desertorum Banks, 1900 determinaron que los períodos de incubación variaron entre dos y cinco días; estos mismos autores obtuvieron para Tetranychus evansi Baker y Pritchard, 1960 un período de incubación de tres días a 23°C y 50% HR.
La duración de la larva, protoninfas y deutoninfas de nuestros resultados son coincidentes con los registrados por Kazak y Kibritçi (2008) para T. cinnabarinus criado sobre ocho cultivares de fresa (Fragaria ananassa Duchesne) quienes obtuvieron rangos entre 2,00 y 2,16; 1,62 y 1,85 y 2,08 y 2,25 días, respectivamente, a 25°C, 65% de HR y 14:10 L:O. Para Oligonychus perseae Tuttle, Baker y Abbatiello, 1976 desarrollado sobre hojas de aguacate, Persea americana Mill., a 30°C; 60-80% HR y 12 horas de luz, Ramírez et al. (1993) registraron 1,68 días para la etapa larval; 1,19 días para las protoninfas y 1,71 días para las deutoninfas. Morros y Aponte (1994) obtuvieron una duración de 1,75, 1,31 y 1,85 días para larvas, protoninfas y deutoninfas, respectivamente, para Tetranychus ludeni Zacher, 1913 desarrollado sobre hojas aisladas de fríjol, Phaseolus vulgaris L., a 26,34 ± 3,92ºC y 69,44 ± 19,54% de HR. Gotoh y Gomi (2003) estudiaron el desarrollo de dos especies de tetraníquidos muy relacionadas, Tetranychus kanzawai Kishida, 1927 y T. parakanzawai Ehara, 1999 a 25°C, 16:8 h (L:O). La duración de cada estadío fue, para T. kanzawai, entre 1,0 a 1,9 días para las larvas; 0,6 a 1,6 días para las protoninfas y 0,3 a 1,7 días para las deutoninfas. En el caso de T. parakanzawai obtuvieron una duración de un día para las larvas, entre 0,8 a 0,9 días para las protoninfas y entre 0,4 a 0,9 días para las deutoninfas.
Biswas et al. (2004) registraron para T. cinnabarinus sobre Solanum melongena L., una duración de 1,47 días para el período larval, 1,33 días para las protoninfas y 1,87 días para las deutoninfas entre 21-31°C. Adango et al. (2006) obtuvieron para T. ludeni, alimentado con Amaranthus cruentus L. y Solanum macrocarpon Mol., una duración para las larvas de 1,87 y 1,98 días; para las protoninfas de 1,59 y 1,82 días y para las deutoninfas de 1,90 y 2,12 días, respectivamente, a 27°C, 70% HR y 12:12 h (L:O). Noronha (2006), indicó que Tetranychus marianae McGregor, 1950 alimentado sobre Passiflora edulis Sims, f. flavicarpa Deg. a una temperatura de 25±1°C, 80 ± 10% HR y 12:12 h (L:O) presentó una duración de 1,37 días para las larvas, 0,96 días para las protoninfas y 1,31 días para las deutoninfas.
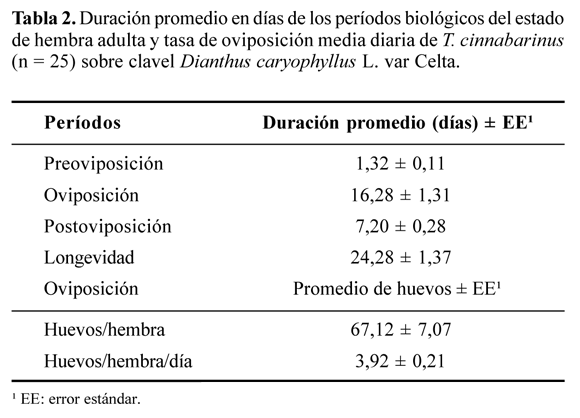
Fases adultas. Tanto las fases adultas (preoviposición, oviposición, postoviposición, además de la longevidad) como las tasas de oviposición (Tabla 2) son coincidentes con lo registrado por la literatura para especies de Tetranychidae. Kazak y Kibritçi (2008), obtuvieron rangos entre 1,19 y 1,50; 13,22 y 20,06; 2,45 y 4,53 y 18,03 y 25,34 días para los períodos de preoviposición, oviposición, postoviposición y longevidad, respectivamente, para T. cinnabarinus sobre fresa. Estos mismos autores encontraron una oviposición por hembra entre 62,71 y 163,44 huevos y una tasa de oviposición diaria entre 4,83 y 8,46 huevos a 25 ± 2°C, 65 ± 10% HR y 14:10 h (L:O).
La duración promedio en días para T. ludeni, fue de 1,15; 14,73 y 2,35 días para los períodos de preoviposición, oviposición y postoviposición, respectivamente. La fertilidad máxima fue de 118,09 huevos/hembra y la tasa de oviposición fue de 7,90 huevos/hembra/día. La longevidad para esta especie a 26,34 ± 3,92°C y 69,44 ± 19,54% HR fue de 18,35 días (Morros y Aponte 1994). Adango et al. (2006) obtuvieron para T. ludeni una duración para los períodos de preoviposición, oviposición, postoviposición y longevidad (hembras) de 1,25; 15,55; 1,95 y 28,33 días sobre A. cruentus y de 1,24; 12,88; 0,77 y 24,93 días sobre S. macrocarpon.
Biswas et al. (2004) obtuvieron para T. cinnabarinus una duración para el período reproductivo entre 9,07 y 15,33 y longevidad entre 15,00 y 29,93 días sobre S. melongena. La fertilidad máxima varió entre 24,27 y 33,03 huevos/hembra. La fertilidad máxima sobre A. cruentus y S. macrocarpon fue de 111,55 ± 10,73 y 84,29 ± 10,51huevos/hembra, respectivamente. Noroha (2006) obtuvo una duración para los períodos de preoviposición y oviposición en T. marianae sobre Passiflora edulis de 1,10 y 19,85 días, respectivamente. La longevidad para las hembras fue de 24,53 días. La fertilidad máxima fue de 75,46 ± 6,22 huevos/ hembra y la tasa de ovipostura fue de 3,69 ± 0,15 huevos/ hembra/día. Bonato et al. (2000) obtuvieron una tasa de ovipostura (huevos/hembra) y una longevidad (días) para las hembras de T. ogmophallos Ferreira y Flechtmann, 1997 de 60,0 ± 2,9 y 16,5 ± 0,8 sobre Arachis hypogaea L., 63,9±5,7 y 15,4±1,2 sobre Glycine max Merr., y 104,3 ± 7,8 y 25,3 ± 1,1 sobre Phaseolus vulgaris L., respectivamente.
Parámetros de tabla de vida. La supervivencia de los estados juveniles fue de un 80,22% (n = 253) y la proporción o razón sexual fue de 76,28% de hembras (n = 253). Nuestros resultados concuerdan con los registrados por Bonato et al. (2000) con un 85,0 ± 5,0% de supervivencia para juveniles de T. ogmophallos. La alta supervivencia de los estados juveniles en nuestro estudio difiere con la registrada por esos autores con un 45 y 72% sobre A. cruentus y S. macrocapon, respectivamente. La supervivencia de los juveniles, además de los factores abióticos, puede ser influenciada por la calidad del hospedero (Kerguelen y Hoddle 2000). De esta manera, T. cinnabarinus pudo haber encontrado en esta variedad de clavel los nutrientes adecuados que favorecieron su reproducción, así lo confirman los estudios de Kazak y Kibritçi (2008) con este tetraníquido en diferentes cultivares de fresa.
Con respecto a la proporción sexual, nuestros resultados coinciden con lo observado por Noronha (2006) para T. marianae con 81,0% de hembras y con los registrados por Adango et al. (2006) para T. ludeni desarrollado sobre A. cruentus y S. macrocarpon con 72,72 y 78,68% de hembras, respectivamente. De forma similar, Bonato et al. (2000) observaron una proporción sexual de 80% hembras para T. ogmophallos sobre tres especies de fabáceas (A. hypogaea, G. max y P. vulgaris). Contrariamente a nuestros resultados, Morros y Aponte (1994) registraron para T. ludeni una proporción sexual de 62,41% de hembras. De acuerdo con Boudreaux (1963) esta variación se debe a que no existe una distribución normal de la proporción sexual en los tetraníquidos y por lo tanto la relación de sexos depende de la cantidad de espermatozoides introducidos durante la cópula y del tiempo de duración de la misma.
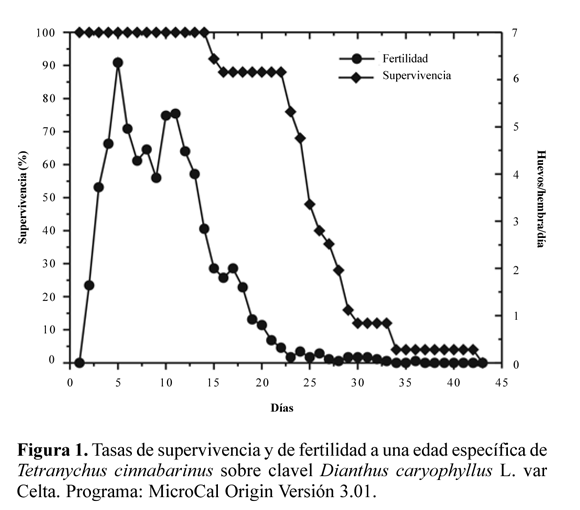
La tasa de oviposición diaria máxima se alcanzó al quinto día desde el comienzo de la ovipostura y se mantuvo a niveles altos hasta al día 13, a partir del cual la tasa comenzó a decaer. La tasa de supervivencia fue máxima (100%) hasta el día 14, a partir del cual comenzó a disminuir, aunque manteniéndose hasta el día 22 sobre el 80%, alcanzando el 50% de mortalidad el día 25 (Fig. 1). La tasa neta de reproducción (R0) y la tasa intrínseca de crecimiento (rm) son indicadores importantes de las dinámicas poblacionales de los tetraníquidos (Sabelis 1985; Krisp et al. 1998). Las comparaciones de R0 y rm ofrecen mayor información que la disponible de análisis independientes de parámetros de vida individuales (Zhang et al. 2007).
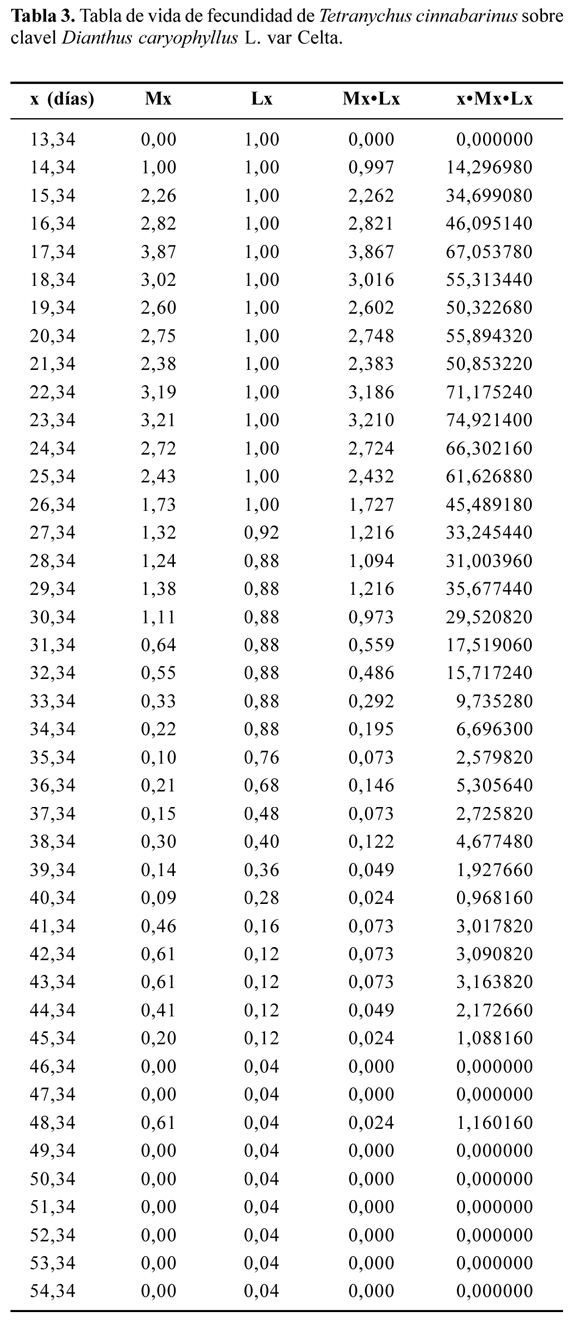
Para la tabla de vida de fecundidad (Tabla 3), la tasa neta de reproducción (R0) fue 40,809 y el tiempo generacional (T) 20,24 días. La tasa intrínseca de crecimiento (rm) fue 0,1832 por individuo/ día, convirtiendo este valor a una tasa finita de crecimiento (λ) por individuo/hembra/día se obtiene 1,2011. Los parámetros de la tabla de vida coinciden con los determinados por Kazan y Kibritçi (2008) para T. cinnabarinus sobre diferentes variedades de fresa, quienes indicaron tasas intrínsecas de crecimiento entre 0,208 y 0,253, tasas netas de reproducción entre 39,51 y 120,19 y tiempos generacionales entre 18,96 y 22,32 días. Las diferencias de nuestros resultados con los descritos podrían deberse a los diferentes sustratos vegetales y condiciones experimentales utilizados. En general, los resultados para el desarrollo de T. cinnabarinus están dentro de los rangos de variación para arañitas del género Tetranychus indicados en la literatura.
Diferentes autores han consignado la dificultad de controlar biológicamente plagas de ácaros fitófagos en ambientes áridos, como por ejemplo Mononychellus tanajoa (Bondar, 1938) (Acari: Tetranychidae) (Yaninek et al. 1993; Zundell et al. 2007) y T. urticae (Morris et al. 1999). El control biológico de tetraníquidos se realiza principalmente por ácaros depredadores de la familia Phytoseiidae (Lofego et al. 2000). Walzer et al. (2007) indicaron que faltan especies de esta familia que sean propias de ambientes áridos. Se suma a esto que las especies de fitoseidos que están disponibles comercialmente, no funcionan en este tipo de condiciones (Zundell et al. 2007). De acuerdo con Bakker et al. (1993) la humedad del aire es uno de los principales factores que influencian la eficiencia de los ácaros depredadores. Confirmando esto, Sabelis (1985) y Walzer et al. (2007) sostienen que el huevo es el estado más susceptible a las condiciones climáticas más adversas. Estudios recientes (Ragusa 2000; Ragusa y Vargas 2002; Peralta 2008) han revelado la presencia, en las zonas áridas del norte de Chile, de las especies Cydnodromus californicus (McGregor, 1945), Cydnodromus sp., Cydnodromus picanus Ragusa, 2000, Neoseiulus benjamini (Schicha, 1981), Euseius sp, Neoseiulus barkeri Hughes, 1948, Proprioseiopsis iorgius Karg, 1976, Metaseiulus flumenis (Chant, 1957), Typhlodromus nerudensis Ragusa, 2003 (Acari: Phytoseiidae).
Tello (2008) evaluó la capacidad depredadora de C. picanus sobre diferentes estadíos de T. cinnabarinus en condiciones de baja humedad relativa (42%) obteniendo una alta supervivencia del fitoseido a esa humedad y altas tasas de consumo y oviposición, concluyéndose que C. picanus es una especie depredadora promisoria para un posible manejo integrado de la arañita cinabarina en ambientes áridos.
Conclusiones
La arañita presentó una alta supervivencia de los estados juveniles indicando su adaptación a la baja humedad relativa del desierto chileno. Los tiempos de incubación de los huevos, así como la duración del estado larval y ninfales, están dentro de los registrados por la literatura. La arañita mostró una alta prolificidad demostrada por la alta proporción sexual de hembras, las tasas de ovipostura y las tasas de crecimiento (R0 y rm). Estos resultados explicarían la alta incidencia de esta plaga para los cultivos hospederos de esta plaga, especialmente clavel, fresa y melón. La presencia de ácaros fitoseidos en las zonas áridas de Chile representan una fuente potencial de biocontroladores cuya acción sobre T. cinnabarinus debe ser evaluada en laboratorio y campo, para contar con un manejo alternativo al control químico, único sistema utilizado por los agricultores de la zona.
Agradecimientos
Este trabajo forma parte de los resultados de la tesis de doctorado del primer autor titulada “Parámetros biológicos de Cydnodromus picanus Ragusa y Phytoseiulus persimilis (Athias-Henriot) (Acari: Phytoseiidae), sobre la arañita cinabarina, Tetranychus cinnabarinus (Boisduval) (Acari: Tetranychidae) del Programa de Doctorado en Ciencias Silvoagropecuarias de la Facultad de Agronomía de la Universidad de Chile. La tesis contó con el financiamiento del proyecto de investigación “Centro de Investigación el Hombre en el Desierto”, convenio entre la Comisión Nacional de Ciencia y Tecnología (CONICYT), el Gobierno Regional de Tarapacá y las Universidades Arturo Prat de Iquique y Universidad de Tarapacá de Arica.
Literatura citada
ABOUT-SETTA, M. M., DORRELL, R. R.; CHILDRES, C. C. 1986. Life 48: a BASIC computer program to calculate life table parameters for an insect or mites species. Florida Entomologist 69: 690-697. [ Links ]
ADANGO, E.; ONZO, A.; HANNA, R.; ATACHI, P.; JAMES, B. 2006. Comparative demography of the spider mite, Tetranychus ludeni, on two host plants in West Africa. Journal of Insect Science 6: 49. [ Links ]
BAKKER, F. M., KLEIN, M. E., MESA, N. C., BRAUN, A. R. 1993. Saturation deficit tolerante spectra of phytophagous mites and their phytoseiid predators on cassava. 1993. Experimental and Applied Acarology 17 (1-2): 97-113. [ Links ]
BIRCH, L. C. 1948. The intrinsic rate of natural increase of an insect population. Journal Animal of Ecology 17: 15-26. [ Links ]
BISWAS, G. C.; ISLAM, W.; HAQUE, M.M.; SAHA, R. K.; HOQUE, K. M. F.; ISLAM, M. S; HAQUE, M. E. 2004. Some biological aspects of Carmine Mite, Tetranychus cinnabarinus Boisd. (Acari: Tetranychidae) infesting egg-plant from Rajshahi. Journal of Biological Sciences 4 (5): 588-591. [ Links ]
BONATO, O.; SANTAROSA, L.; RIBEIRO, G.; LUCCHINI, F. 2000. Suitability of three legumes for development of Tetranychus ogmophallos (Acari: Tetranychidae). Florida Entomologist 83 (2): 203-205. [ Links ]
BOUDREAUX, B. H. 1963. Biological aspects of some phytophagous mites. Annual Review of Entomology 8: 137-154. [ Links ]
CAREY, R. J.; BRADLEY, J. W. 1982. Developmental rates, vital schedules, sex ratios, and life tables for Tetranychus urticae, T. turkestani and T. pacificus (Acarina: Tetranychidae) on cotton. Acarologia, Montpellier 23 (4): 333-345. [ Links ]
CROOKER, A. 1985. Embryonic and juvenile development - The Tetranychidae, pp. 149-163. En: Helle, W.; Sabelis, M. W. (eds.). Spider mites: their biology, natural enemies and control. World Crop Pests, Vol 1A. Elsevier, Amsterdam, 199 p. [ Links ]
GOFF, L. 1986. Spider mites (Acari: Tetranychidae) in the Hawaiian Islands. International Journal of Acarology 12 (1): 43-49. [ Links ]
GOTOH, T.; GOMI, K. 2003. Life-history traits of the Kanzawa spider mite Tetranychus kanzawai (Acari: Tetranychidae). Applied Entomology and Zoology 38 (1): 7-14. [ Links ]
HILL, D. S. 1983. Tetranychus cinnabarinus (Boisd.). Agricultural insect pests of the tropics and their control, 2nd Edition. Cambridge University Press. 746 p.. [ Links ]
JEPPSON, I.R.; KEIFER, H.H.; BAKER, E.W. 1975. Mites injurious to economic plants. University of California Press. Berkeley. 614 p. [ Links ]
KAZAK, C.; KIBRITÇI, C. 2008. Population parameters of Tetranychus cinnabarinus Boisduval (Prostigmata: Tetranychidae) on eight strawberry cultivars. Turkish Journal of Agriculture and Forestry 32: 19-27. [ Links ]
KERGUELEN, V.; HODDLE, M. S. 2000. Comparison of the susceptibility of several cultivars of avocado to the persea mite, Oligonychus perseae (Acari: Tetranychidae). Scientia Horticulturae 84: 101-114. [ Links ]
KLEIN, C.; WATERHOUSE, D. F. 2000. The distribution and importance of arthropods associated with agriculture and forestry in Chile (Distribución e importancia de los artrópodos asociados a la agricultura y silvicultura en Chile). ACIAR Monograph 68, Canberra, Australia. 234 p. [ Links ]
KRISP, O. E.; WITUL, A.; WILLEMS, P. E. L.; DICKE, M. 1998. Intrinsic rate of population increase of the spider mite Tetranychus urticae on the ornamental crop gerbera: intraspecific variation in host plant and herbivore. Entomologia Experimentalis et Applicata 89: 159-168. [ Links ]
LAPLANTE, A. A.; SHERMAN, M. 1976. Carmine Spider Mite. Cooperative Extension Service, College of tropical Agriculture, Insect Pest Series 3: 2 p. [ Links ]
LOFEGO, A.; MORAES, G. J. DE; McMURTRY, J. 2000. Three new species of Phytoseiid mites (Acari: Phytoseiidae) from Brazil. Anais da Sociedade Entomológica do Brasil 29: 461-553. [ Links ]
MORRIS, M. A.; BERRY, R. E.; CROFT, B. A. 1999. Phytoseiid mites on peppermint and effectiveness of Neoseiulus fallacis to control Tetranychus urticae (Acari: Phytoseiidae, Tetranychidae) in arid growing regions. Journal of Economic Entomology 92 (5): 1072-1078. [ Links ]
MORROS, M.; APONTE, O. 1994. Biología y tabla de vida de Tetranychus ludeni Zacher en carota Phaseolus vulgaris L. Agronomía Tropical 44 (4): 667-677. [ Links ]
NORONHA, A. 2006. Biological aspects of Tetranychus marianae McGregor (Acari: Tetranychidae) reared on yellow passion fruit (Passiflora edulis Sims f. flavicarpa Deg.) leaves. Revista Brasileira de Zoologia 23 (2): 404-407. [ Links ]
PERALTA, O. 2008. Estudio taxonómico de ácaros de la familia Phytoseiidae (Acarina: Mesostigmata) asociados a plantas silvestres y cultivadas de la Primera Región de Tarapacá, Chile. Tesis de Ingeniero Agrónomo. Iquique-Chile. Universidad Arturo Prat. Departamento de Agricultura del Desierto y Biotecnología. 129 p. [ Links ]
RAGUSA, S. 2000. A new Cydnodromus (Parasitiform, Phytoseiidae), from the desert of the Northern Chile. Phytophaga 10: 3-103. [ Links ]
RAGUSA, S.; VARGAS, R. 2002. On some phytoseiid mites (Parasitiformes, Phytoseiidae) from Chile. Phytophaga 12: 129- 139. [ Links ]
RAMÍREZ, M.; OTERO, G.; LOPEZ, J.; RESENDIZ, B. 1993. Constantes térmicas y tablas de vida de Oligonychus perseae (Trombidiformes: Tetranychidae). Agrociencia 4 (1): 67-80. [ Links ]
SABELIS, M. W. 1985. Reproductive strategies, pp. 265-278. En: Helle, W.; Sabelis, M. W. (eds.). Spider mites: their biology, natural enemies and control. World Crop Pests, Vol 1A. Elsevier, Amsterdam, 199 p. [ Links ]
TELLO, V. 2008. Parámetros biológicos de Cydnodromus picanus Ragusa y Phytoseiulus persimilis (Athias-Henriot) (Acari: Phytoseiidae), sobre la arañita cinabarina, Tetranychus cinnabarinus (Boisduval) (Acari: Tetranychidae). Tesis de doctorado. Santiago-Chile. Universidad de Chile. Facultad de Ciencias Agronómicas. 73 p. [ Links ]
WALZER, A.; CASTAGNOLI, M.; SIMONI, S.; LIGUORI, M.; PALEVSKY, E.; SCHAUSBERGER, P. 2007. Intraspecific variation in humidity susceptibility of the predatory mite Neoseiulus californicus: Survival, development and reproduction. Biological Control 41: 42-52. [ Links ]
WRENSCH, D. L. 1985. Reproductive parameters, pp. 165-170. En: Helle, W.; Sabelis, M. W. (eds.) Spider mites: their biology, natural enemies and control. World Crop Pests, Vol 1A. Elsevier, Amsterdam, 199 p. [ Links ]
YANINEK, J. S.; ONZO, A.; OJO, J. B. 1993. Continent-wide releases of neotropical phytoseiids against the exotic cassava green mite in Africa. Experimental and Applied Acarology 17 (1-2): 145- 160. [ Links ]
ZHANG, Z. J.; WU, Q. J.; LI, X. F.; ZHANG, Y. J.; XU, B. Y.; ZHU, G. R. 2007. Life history of western flower thrips, Frankliniella occidentalis (Thysan., Thripidae), on five different vegetable leaves. Journal of Applied Entomology 131: 347-354. [ Links ]
ZAR, J. H. 2006. Biostatistical analysis. Prentice-Hall Inc. 5 edition, Englewood Cliffs, New Jersey, USA. 960 p. [ Links ]
ZUNDELL, CH.; HANNA, R.; SCHEIDEGGER, U.; NAGEL, P. 2007. Living at the threshold: Where does the neotropical phytoseiid mite Typhlodromus aripo survive the dry season? Experimental and Applied Acarology 41 (1-2): 11-26. [ Links ]
Recibido: 17-ago-2008 - Aceptado: 16-feb-2009