Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.1 Bogotá Jan./June 2009
Sinantropía de Calliphoridae (Diptera) del Municipio La Pintada, Antioquia - Colombia
Synanthropy of Calliphoridae (Diptera) from La Pintada, Antioquia-Colombia
AUGUSTO LEÓN MONTOYA G.1, JUAN DAVID SÁNCHEZ R.1 y MARTA WOLFF E.2
1 Estudiante de Biología. Grupo de Entomología (GEUA). Universidad de Antioquia. Calle 67 #53-108 Bloque 7-311. Medellín-Colombia. guto_spider@yahoo.com; juanpixie@gmail.com
2 Bióloga, Ph. D. Directora Grupo de Entomología (GEUA). Profesora, Instituto de Biología. Universidad de Antioquia. Calle 67 #53-108 Bloque 7- 311. Medellín-Colombia. mwolff@matematicas.udea.edu.co.
Resumen: Los Calliphoridae se encuentran en una gran variedad de hábitats, mostrando preferencia por los ambientes humanos, fenómeno conocido como sinantropía. La importancia de estas moscas, a nivel ecológico, médico y sanitario, radica en que sus hábitos de alimentación y desarrollo tienen lugar en excretas, basuras, materia orgánica en descomposición y cadáveres de animales. Además, son vectores mecánicos de patógenos y causantes de miasis. El propósito de este estudio fue determinar el índice de sinantropía (SI) de adultos de Calliphoridae presentes en La Pintada-Antioquia, Colombia, mediante muestreos mensuales simultáneos en tres ambientes (urbano, rural y bosque), para lo cual se utilizaron trampas van Someren Rydon cebadas con excremento humano, vísceras de pollo, pescado y cebolla en descomposición. En cada zona se pusieron cuatro trampas (una por atrayente), durante 48 horas cada mes, realizando colectas cada 12 horas. Se colectaron 2406 individuos, pertenecientes a 10 especies. Chysomya megacephala (SI = + 96,47) mostró fuerte preferencia por asentamientos urbanos densos. Cochliomyia macellaria (SI = + 78,1), Lucilia eximia (SI = + 74,94) y Chysomya albiceps (SI = + 59,12) tuvieron preferencia por asentamientos humanos (eusinantrópicas). Hemilucilia semidiaphana (SI = -50) mostró rechazo por los asentamientos humanos (asinantrópica). Por su parte, Cochliomyia hominivorax, Chloroprocta idioidea, Lucilia cuprina, Hemilucilia segmentaria y Paralucilia pseudolyrcea fueron poco abundantes y no se determinó su SI. La abundancia mensual y la eficiencia en la atracción de cebos, se discutieron de acuerdo con su importancia médica y sanitaria. Se registra por primera vez Paralucilia pseudolyrcea en Colombia. Las especies sinantrópicas podrían estar involucradas en la transmisión de patógenos en esta localidad.
Palabras clave: Califóridos. Índice de Sinantropía. Importancia Médica y Sanitaria. Paralucilia pseudolyrcea.
Abstract: Calliphoridae are found in a variety of habitats, showing preference for human environments, a phenomenon known as synanthropy. The medical, ecological and sanitary importance of these flies resides in their feeding and development habits, which occur in excrement, garbage, decomposing organic matter and animal carcasses. In addition, they are mechanical vectors of pathogens and causal agents of myiasis. The objective of this study was to determine the synanthropic index (SI) of adult Calliphoridae in La Pintada-Antioquia, Colombia, through simultaneous monthly samplings in three environments (urban, rural, and forest) using van Someren Rydon traps baited with human excrement, decomposing chicken viscera, fish and onion. Four traps (one for each bait) were placed in each environment for 48 hours each month, making collections every 12 hours. A total of 2406 individuals was captured belonging to 10 species. Chysomya megacephala (SI = + 96.47) showed the strongest preference for dense human settlements. Cochliomyia macellaria (SI = + 78.1), Lucilia eximia (SI = + 74,94) and Chysomya albiceps (SI = + 59.12) had preferences for human settlements (eusynanthropic). Hemilucilia semidiaphana (SI = -50) showed a preference away from human settlements (asynanthropic). Cochliomyia hominivorax, Chloroprocta idioidea, Lucilia cuprina, Hemilucilia segmentaria and Paralucilia pseudolyrcea were collected in small numbers, and their SI could not be determined. The monthly abundance and the efficiency of the attractiveness to baits are discussed according to their medical and sanitary importance. Paralucilia pseudolyrcea is recorded for first time in Colombia. Synanthropic species could be involved in the transmission of pathogens in this locality.
Key words: Blow flies. Synanthropic Index. Medical and Sanitary Importance. Paralucilia pseudolyrcea.
Introducción
Calliphoridae es una familia diversa establecida en la mayoría de las regiones biogeográficas del mundo con cerca de 1.000 especies descritas, de las cuales 126 se encuentran en el Neotrópico (Amorin et al. 2002) y alrededor de 29 han sido registradas para Colombia (Pape et al. 2004). La familia es importante a nivel ecológico, médico y sanitario, debido a su preferencia por heces, basura orgánica y carne en descomposición (Mariluis y Mulieri 2005) adquiriendo de estos sustratos una gran cantidad de patógenos tales como virus, bacterias, hongos, protozoos y helmintos (Ferreira y Barbola 1998; Förster et al. 2007), causantes de más de 65 enfermedades en humanos y animales (Greenberg 1971, 1973). Adicionalmente, las larvas de algunas especies causan miasis en aves y mamíferos, afectando ocasionalmente al hombre (Stevens 2003; Visciarelli et al. 2003).
La asociación de los animales con los ambientes humanos se conoce como sinantropía (Linhares 1981). El grado y modo en que esta relación ocurre, es diferente dependiendo de la especie, de las características geográfico-climáticas de cada grupo humano, el que, con su cultura y peculiar modo de vida modifica de una forma determinada el hábitat a su alrededor, afectando las poblaciones de insectos (Nuorteva 1963). Gregor y Povolný (1958) clasificaron la sinantropía en tres categorías de acuerdo con la abundancia de cada especie en un área ecológica: eusinantrópicas, hemisinantrópicas y asinantrópicas, mientras que Nuorteva (1963) propuso expresar nu méricamente el grado de sinantropía por medio del índice de sinantropía (SI), efectuando una aguda distinción entre cada categoría. En éste, el índice varía entre +100 y -100; donde el valor extremo +100 indica una fuerte preferencia de la especie por áreas urbanas densamente pobladas y -100 expresa el rechazo total de las especies por asentamientos humanos, los valores intermedios indican los grados específicos diferenciales de sinantropía. Las especies eusinantrópicas son típicamente urbanas y pueden encontrarse al interior de viviendas, las especies hemisinantrópicas habitan áreas semirurales y las asinantrópicas se encuentran principalmente en ambientes conservados, siendo las dos primeras de importancia médica y sanitaria (Greenberg 1971).
Entre los estudios de sinantropía de Calliphoridae en Sur América se encuentran los realizados por Ferreira (1978, 1983), Linhares (1981), D'Almeida y Lopes (1983), Ferreira y Barbola (1998), Rodrigues-Guimarães et al. (2008) en Brasil; Baumgartner y Greenberg (1985) en Perú; Mariluis y Schnack (1989), Schnack et al. (1995), Mariluis y Schnack (2002) en Argentina y Figueroa-Roa y Linhares (2002) en Chile. En Colombia, el conocimiento de la familia es relativamente reciente, enfocándose principalmente en aspectos relacionados con la entomología forense como la determinación de intervalos post-mortem (Wolff et al. 2001; Barreto et al. 2002; Pérez et al. 2005; Camacho 2005; Martínez et al. 2007; Vélez y Wolff 2008) y análisis de entomotoxicología (Wolff et al. 2004, 2006). Además, se han realizado varias investigaciones sobre la fauna cadavérica y sus patrones de desarrollo en modelos animales (Usaquén y Camacho 2004); sin embargo, hay muchos trabajos que no han sido publicados o se encuentran en memorias y resúmenes de congresos (Idrobo y Martínez 2000; Restrepo et al. 2000; Wolff y Uribe 2000; Jiménez et al. 2002; Yusseff 2006). El presente es el primer estudio en el cual se determina el grado de sinantropía de algunas de las especies de Calliphoridae en Colombia.
Métodos
Área de estudio. El municipio de La Pintada está localizado al suroeste del departamento de Antioquia a los 5º44'N; 75º36'W y a una altitud de 600 msnm. La temperatura promedio anual es 27°C, la humedad relativa es 76% y la precipitación promedio anual es 1.000 mm, comprendiendo una distribución bimodal caracterizada por dos periodos húmedos (Abril-Mayo y Septiembre- Noviembre) y dos de menor precipitación (Diciembre- Marzo y Junio-Agosto) (Velásquez et al. 2006). De acuerdo con la clasificación de zonas de vida propuesta por Holdridge, las áreas de muestreo corresponden a Bosque Seco Tropical (bs-T) (Holdridge 1978).
Procedimiento de colecta. El estudio se realizó simultáneamente en tres áreas con diferentes características ecológicas: Zona Urbana; el muestreo se efectuó en el Camping Los Farallones, ubicado en la cabecera municipal a 610 msnm, este cuenta con un número variable de visitantes mensuales, agua potable, alcantarillado y recolección periódica de basuras. Zona Rural: la colecta se realizó en un área de potreros perteneciente a la Hacienda Montenegro a 5 km de la zona Urbana y 770 msnm, la cual cuenta con agua de un nacimiento, pozo séptico y enterramiento de basuras. El lugar tiene fines ecoturísticos con aproximadamente 150 visitantes mensuales y cuatro habitantes permanentes, ganado bovino y equinos. Zona Bosque: área con muy baja intervención humana, localizada en el Farallón de la Paz a 5,5 km de la zona urbana y a 850msnm.
Las moscas se capturaron con trampas van Someren Rydon; estas consisten de un tubo cilíndrico recubierto por un velo blanco; en la parte inferior se coloca un plato ancho, en donde se adiciona el atrayente (Villareal et al. 2004). Las trampas se colocaron a un metro del suelo y una separación de 50m entre ellas. Se utilizaron cuatro tipos de atrayentes: excremento humano, vísceras de pollo, pescado y cebolla en descomposición, utilizando aproximadamente 150g en cada uno. En cada zona se colocaron simultáneamente una trampa por atrayente por 48 horas cada mes, realizando colectas cada 12 horas, hidratando los cebos que lo requirieran. Se separaron capturas por trampa y por horario; diurnas (6am-6pm) y nocturnas (6 pm-6am).
El estudio se efectuó durante los meses de Febrero a Julio del 2007: 15-16 de Febrero, 15-16 de Marzo, 19-20 de Abril, 24- 25 de Mayo, 21-22 de Junio y 25-26 de Julio. Los datos de temperatura, humedad relativa y precipitaciones de los periodos de colecta corresponden a los proporcionados por el IDEAM (Instituto de Hidrología, Meteorología y Estudios Ambientales de Colombia).
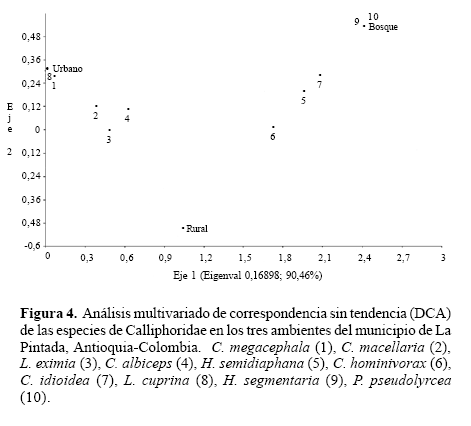
Procedimiento en el laboratorio. El material fue separado, cuantificado e identificado siguiendo la clave de Calliphoridae de Colombia (Amat et al. 2008). Adicionalmente, se realizó una colección de referencia que se depositó en la Colección Entomológica de la Universidad de Antioquia (CEUA, registro 036). El índice de sinantropía fue calculado con la fórmula de Nuorteva (1963) SI = (2a+b-2c)/2; donde a es el porcentaje de los individuos de una especie colectada en la zona urbana, b el porcentaje de la misma especie colectada en el zona rural y c el porcentaje de la misma especie colectada en la zona silvestre. Adicionalmente, se discute la abundancia mensual, la eficiencia en la atracción de los cebos y la importancia médica y sanitaria de cada una de las especies. Se realizó un análisis multivariado de correspondencia sin tendencia (DCA) para observar las variaciones espaciales de las poblaciones en los tres ambientes utilizando el programa PAST versión 1.81. Se realizó una correlación entre las variables ambientales y la abundancia de las especies utilizando el programa SPSS 15.0 para Windows.
Resultados
Se colectaron 2.406 individuos pertenecientes a 10 especies: Chysomya megacephala Fabricius, 1794; Cochliomyia macellaria Fabricius, 1775; Lucilia eximia Wiedemann, 1819; Chysomya albiceps Wiedemann, 1819; Hemilucilia semidiaphana Rondani, 1850; Cochliomyia hominivorax Coquerel, 1858; Chloroprocta idioidea Robineau-Desvoidy, 1830; Lucilia cuprina Wiedemann, 1830; Hemilucilia segmentaria Fabricius, 1805 y Paralucilia pseudolyrcea Bigot, 1877. Para todas ellas se muestra la frecuencia absoluta y relativa en las tres aéreas de muestreo (tabla 1).
El aumento y disminución del número de Califóridos capturados estuvo más relacionado probablemente con las precipitaciones, mostrando un elevado número de capturas en los meses más lluviosos (86%) y una disminución en los meses más secos (14%) (figs. 1 y 2). No obstante, no se encontró una correlación entre las variables climáticas y la abundancia mensual de las moscas (F=0,789; R2=0,542; P = 0,601). Particularmente, Abril y Marzo fueron los meses con mayor número de colectas (60,5%, con seis y siete especies respectivamente), por su parte, Junio y Julio albergaron el menor número de colectas (11%) pero tuvieron el mayor número de especies, con nueve y ocho respectivamente. Las especies más abundantes fueron C. macellaria y C. megacephala mostrando un patrón de co-dominancia, con alternancia en su abundancia mensual durante el tiempo de muestreo (fig 1). Respecto a la variaciones horarias, el 97,26% de los individuos se colectaron durante el día (tabla 3) y las vísceras de pollo fue el atrayente más importante en los tres ambientes (67,78%), seguido por pescado descompuesto (27,28%), heces humanas (4,78%) y cebolla (0,17%) (tabla 2). Adicionalmente, las áreas urbana y rural tuvieron el mayor número de individuos (73,76% y 20,62% respectivamente) con el 94,38% respecto al bosque (5,61%) (fig 2, tabla 1). Para cada uno de los ambientes y para todas las especies se observó que la mayor cantidad de individuos colectados fueron hembras (70%) (tabla 4).
Índice de sinantropía. De acuerdo con lo sugerido por Nuorteva (1963) los índices de sinantropía se obtuvieron a partir de muestreos simultáneos y mediante la misma metodología operativa (uniformidad en el muestreo, tipo de atrayente) en los tres hábitats. De las 10 especies encontradas, sólo cinco se consideraron para el Índice de Sinantropía (SI) debido a que las demás se presentaron un número menor a 15 individuos (tabla 5).
Chysomya megacephala es una especie recientemente introducida al país y registrada por primera vez en el 2002 (Barreto et al. 2002). Actualmente se encuentra en varios departamentos en pisos bioclimáticos entre los 0 y 1500msnm (Pape et al. 2004; Wolff y Vélez 2007). En este estudio, se encontró en la zona urbana con frecuencia (95,79%) (fig 1), especialmente atraída por vísceras de pollo (73,85%) (tabla 2) y mostrando actividad principalmente diurna; sin embargo, se colectaron 25 individuos en la noche (14 hembras y 11 machos) (tablas 3 y tabla 4). Esta especie tuvo el índice de sinantropía más alto (SI = +96,47) mostrando una fuerte preferencia por asentamientos urbanos densamente poblados (tabla 5).
Cochliomyia macellaria es una especie Neotropical, en Colombia se halla frecuentemente entre 0 y 1500 msnm en las provincias biogeográficas del Cinturón Precaribeño, Provincia de la Amazonia y Provincia Norandina (Pape et al. 2004; Wolff y Vélez 2007). En este estudio estuvo presente durante todo el tiempo de muestreo en las tres zonas, encontrándose mayormente en el ambiente urbano (70%) (fig 2, tabla 1), con preferencia por las vísceras de pollo (65,7%) (tabla 2) y de comportamiento básicamente diurno, con tan solo seis individuos colectados en la noche (tabla 3). Su índice de sinantropía (SI = +78,1) indica una fuerte preferencia por asentamientos humanos (tabla 5).
Lucilia eximia tiene una distribución Neotropical, en Colombia se encuentra en una gran variedad de zonas bioclimáticas entre 0 y 2600 msnm (Wolff y Vélez 2007). Se capturaron 220 individuos en el aérea urbana (tabla 1). El cebo más atractivo fue vísceras de pollo (73,74%) y fue la única capturada con cebolla en el ambiente de bosque (tabla 2). Adicionalmente, esta especie presentó la mayor actividad en las horas de la noche, con 31 individuos, de los cuales 28 fueron hembras (tabla 3 y tabla 4). Su índice de sinantropía (SI = +74,94) sugiere una fuerte preferencia por asentamientos humanos (tabla 5).
Chysomya albiceps es una especie introducida, registrada por primera vez en Colombia en el 2001 (Wolff et al. 2001) y a partir del incremento de colectas por el interés suscitado en la Entomología Forense, esta especie se ha encontrado en casi la totalidad del territorio nacional, entre los 0 y 2700 msnm (Pape et al. 2004; Wolff y Vélez 2007). En este estudio se encontraron 241 individuos (58%) en el área urbana (tabla 1), colectados principalmente en vísceras de pollo (57,3%) y pescado descompuesto (56,71%) (tabla 2). Su índice de sinantropía (SI = +59,1), indica preferencia por asentamientos humanos (tabla 5).
Hemilucilia semidiaphana es una especie Neotropical, en Colombia inicialmente se registro para Amazonas y Putumayo (Pape et al. 2004) y actualmente se encuentra entre 0 y 1400msnm (Wolff y Vélez 2007). Para este estudio se obtuvo un número bajo de especímenes (0,62%) (tabla 1), atraídos por pescado y vísceras de pollo en igual proporción (tabla 2). Esta especie se encontró únicamente en las áreas de bosque y rural. Su índice de sinantropía (SI = -50) sugiere un rechazo por los asentamientos humanos (tabla 5).
Cochliomyia hominivorax es una especie Neotropical, en Colombia solo se ha registrado para el departamento de Antioquia (Pape et al. 2004). En el estudio se colectaron cuatro especímenes, dos en el ambiente de bosque y dos en el rural (tabla 1), moderadamente atraídos por vísceras de pollo, pescado y heces humanas (tabla 2).
Chloroprocta idioidea es una especie de distribución Neotropical, en Colombia es encontrada en tierras bajas y cálidas por debajo de los 400 msnm (Pape et al. 2004; Wolff y Vélez 2007). En este estudio fue poco frecuente, con sólo un espécimen en el área rural (vísceras de pollo) y tres en zona de bosque (pescado descompuesto) (Tablas 1 y 2).
Lucilia cuprina presenta una distribución Neotropical, registrada inicialmente en Cundinamarca (Pape et al. 2004) y recientemente en Antioquia. Se registra entre los 1500 y 2600 msnm, particularmente asociada con ambientes urbanos (Wolff y Vélez 2007). En este estudio, dicha especie tuvo el mismo comportamiento, colectándose sólo tres especímenes en el área urbana, atraídos exclusivamente por vísceras de pollo (Tablas 1 y 2).
Hemilucilia segmentaria, especie Neotropical, en Colombia se registró inicialmente para los departamentos de Amazonas y Putumayo (Pape et al. 2004) entre los 300 y 1900 msnm (Wolff y Vélez 2007). De esta especie solo se colectaron dos especímenes en la zona de bosque, atraídos por vísceras de pollo y pescado descompuesto (Tablas 1 y 2).
Paralucilia pseudolyrcea es una especie Neotropical que no había sido registrada para Colombia. Se colectó solo un individuo en el área de bosque atraído con vísceras de pollo (Tablas 1 y 2).
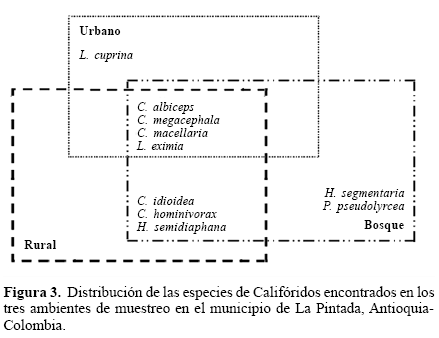
El análisis multivariado de correspondencia sin tendencia (DCA), mostró que los ambientes urbano y rural fueron más similares en cuanto a composición y abundancia de especies (Fig. 4). En cuanto a la diferencia en la distribución, L. cuprina se comportó como exclusiva, colectándose tan solo en el ambiente urbano, mientras que H. segmentaria y P. pseudolyrcea se colectaron solo en el bosque. Con respecto a los ambientes compartidos, cuatro especies estuvieron en todos los ambientes y tres en rural y bosque (Fig. 3).
DiscusiónLos resultados muestran diferencias en la distribución y abundancia mensual de las especies de Calliphoridae en las áreas de muestreo, variaciones relacionadas principalmente con las precipitaciones. C. megacephala, C. macellaria, L. eximia y C. albiceps se encontraron principalmente en ambientes humanos, mostrando índices de sinantropía positivos. Por su parte, H. semidiaphana se encontró principalmente en el área de bosque, obteniendo un índice de sinantropía negativo. L. cuprina fue exclusiva en el ambiente urbano, siendo capturada únicamente en los meses de Junio y Julio; durante estos meses, H. segmentaria y en el mes de mayo P. pseudolyrcea fueron especies exclusivas del ambiente de bosque. Éstas, al igual que C. hominivorax, H. semidiaphana y C. idioidea fueron muy asinantrópicas, capturándose en bajo número en el ambiente rural y de bosque. C. macellaria y C. megacephala se encontraron principalmente en el ambiente urbano, siendo co-dominantes y alternando su abundancia mensual. La gran abundancia de hembras de todas las especies en cada uno de los ambientes, se puede explicar por la necesidad de sustratos adecuados para la oviposición.
Chysomya megacephala fue la especie más eusinantrópica en el municipio de La Pintada, con una fuerte preferencia por asentamientos urbanos densos, debido a su característica asociación a la antropobiocenosis (Espindola 2006). Esto concuerda con lo registrado en Campinas, Brasil (SI = +75,2) (Linhares 1981) donde fue la especie más abundante, siendo también eusinantrópica, sin embargo, en Baixada Fluminense, Brasil se observo un SI de +33,01 (Rodrigues-Guimarães et al. 2008). A nivel epidemiológico, C. megacephala ha sido considerada como uno de los más peligrosos vectores de patógenos entéricos, protozoos y helmintos (Greenberg 1971, 1973). La especie es causante de miasis facultativa en animales y en el hombre, además se ha encontrado visitando alimentos, cadáveres, heces animales y humanas (Zumpt 1965), siendo este último el sustrato más importante para la cría (Norris 1965); no obstante, no se observó preferencia por este recurso.
D'Almeida y Almeida (1998) registraron para esta especie un nicho extenso, con una sobreposición importante con L. eximia en el área urbana y cierta interacción con L. cuprina en el área rural. La permanencia de C. megacephala podría deberse a que su ciclo de vida varía entre 11,7 y 14,9 días (bajo condiciones semicontroladas), no obstante, variaciones geográficas y climáticas podrían influenciar sus tasas de desarrollo (Vélez y Wolff 2008), además de factores como la competencia intra e interespecífica (Battan et al. 2007). C. megacephala fue la segunda especie más activa durante la noche, posiblemente debido al comportamiento de oviposición nocturna registrado por Singh y Bharti (2001).
El género Chrysomya fue introducido en América en la década de los 70 y ha venido desplazando a las especies nativas de sus nichos originales (Guimarães et al. 1978). De acuerdo con Prado y Guimarães (1982), Ferreira (1983), Baumgartner y Greenberg (1985) y Godoy et al. (1997) C. albiceps, C. chloropyga Wiedemann, 1818, C. megacephala y C. putoria Wiedemann, 1818 están relacionadas con la disminución de Cochliomyia macellaria, especie nativa que probablemente fue dominante en las áreas Neotropicales (Baumgartner y Greenberg 1985). Factores como su rápida adaptabilidad a ambientes de claros, su gran asociación con los ambientes urbanos y sus altos índices sinantrópicos podrían determinar su éxito como colonizadoras (Paraluppi 1996). Esto ha sido evidenciado en Brasil, donde la mayoría de las colectas de Califóridos son del género Chrysomya, siendo las especies más abundantes (Ferreira 1978, 1983; Lomônaco y Almeida 1995), lo cual también se evidencia en este trabajo (50,27%) (tabla 1).
Contrario a lo encontrado en otros estudios, la población de C. macellaria fue abundante en comparación con Chrysomya spp; esto podría deberse a la reciente introducción de este género al país (Wolff et al. 2001; Barreto et al. 2002), presentando una mayor abundancia en el área urbana, permitiendo a C. macellaria ocupar otros ambientes como el rural y el bosque en los cuales fue más abundante (tabla 1). Cochliomyia macellaria fue la segunda especie con mayor preferencia por asentamientos humanos, siendo muy abundante, lo cual concuerda con lo registrado por Paraluppi (1996) y Linhares (1981). En Perú (Baumgartner y Greenberg 1985) y Buenos Aires (Mariluis y Schnack 2002) fue altamente eusinantrópica (SI = +94 y +70,5 respectivamente), contrario a lo encontrado en Goiânia (SI = +48; +62) (Ferreira 1978, 1983), Campinas (SI = +42,1) (Linhares 1981) y Baixada Fluminense, Brasil (SI = +21,14) (Rodrigues-Guimarães et al. 2008). En Curitiba por su parte, se registró asinantrópica (SI = -2,4) (Ferreira 1978). A nivel sanitario, C. macellaria se ha registrado como causante de miasis facultativa en ovejas (James 1955) y humanos (Fox y Rodríguez-Torrens 1972), en México ha sido encontrada transportando Salmonella (Enterobacteriaceae: Enterobacteriaceae) alrededor de mataderos y mercados (Greenberg et al. 1963). Los adultos son endófilos, encontrándose en casas y mercados, alimentándose de pescado (Baumgartner y Greenberg 1985), hígado (Ferreira 1983) y heces humanas (Ferreira 1978; Linhares 1981), registrándose emergencia en letrinas en Texas (Killpatrick y Bogues 1956); la preferencia por algunos de estos sustratos se evidencia en este estudio. En Colombia, esta especie se encuentra en ambientes rurales y urbanos, siendo endófilas y exófilas (Wolff y Vélez 2007). Baumgartner y Greenberg (1985) sugieren que su distribución es poco afectada por las precipitaciones y la humedad relativa, siendo muy frecuentes en los meses más cálidos (Linhares 1981).
Lucilia eximia mostró un índice de sinantropía positivo, con fuerte preferencia por asentamientos humanos, coincidiendo con lo registrado en Perú (SI = +77) por Baumgartner y Greenberg (1985). No obstante, ha sido considerada como hemisinantrópica en Campinas (SI = +27,1) (Linhares 1981), Río de Janeiro (SI = +65.26) (D'Almeida y Lopes 1983) y Curitiba, Brasil (SI = +54,90) (Ferreira y Barbola 1998). Por su parte, en Paracambi y Baixada Fluminense, Brasil fue asinatrópica (SI = -63,77; -9,67 respectivamente) (Espindola 2006; Rodrigues- Guimarães et al. 2008). Ferreira (1978, 1983) registró modificaciones en el índice de sinantropía en Goiânia Brasil, posterior al establecimiento de Chrysomya putoria Wiedemann, 1818; en la primera etapa del estudio obtuvo un índice de sinantropía de +42,9 y posterior a la llegada de C. putoria el índice se redujo a +12,2 encontrándose más frecuentemente en la zona rural. L. eximia es causante de miasis secundaria en humanos y miasis primaria en animales (Murray y Thompson 1976; Madeira et al. 1989), encontrándose en áreas rurales y urbanas atraída por fruta podrida, basura urbana (Prado y Guimarães 1982; Madeira et al. 1989), moderadamente por heces humanas y cadáveres de animales (Ferreira 1978, 1983; Linhares 1981), llegando a estos sustratos primariamente para ovipositar y secundariamente para obtener proteína (D'almeida 1986). Debido a esto, la especie ha sido incriminada en la transmisión de patógenos de importancia médico veterinaria. Esta especie fue la más activa durante la noche, lo cual podría sugerir un comportamiento de oviposición nocturna similar al registrado por Singh y Bharti (2001) para C. megacephala.
Chysomya albiceps presentó un comportamiento hemisinantrópico, con preferencia por asentamientos humanos obteniendo un valor cercano al encontrado en Argentina (SI = +47,6) (Mariluis y Schnack 2002), Brasil (SI = +26,4; +41,7) (Linhares 1981; Rodrigues-Guimarães et al. 2008) y Perú (SI = +16) (Baumgartner y Greenberg 1985). Por su parte, en Curitiba, Brasil tuvo un índice de sinantropía bajo (SI = +1,98) (Ferreira y Barbola 1998) encontrándose principalmente en áreas no habitadas.
Esta especie ha sido registrada como causante de miasis secundaria en animales (Zumpt 1965; Erzinclioglu y Whitcombe 1983); no obstante, Baumgartner y Greenberg (1985) sugirieron que su hábito alimenticio más importante es la depradación de larvas de otras moscas sinantrópicas. En África y Brasil es atraída por basuras, carne y heces humanas, mientras que en Omán se ha registrado en estiércol de cabra y ovejas, en los cuales se desarrollan (Erzinclioglu y Whitcombe 1983), en Perú se colectó en pescado, hígado y fruta (Baumgartner y Greenberg 1985). La preferencia por algunos de estos sustratos también se evidenció en este estudio. En Colombia, C. albiceps es comúnmente encontrada en ambientes rurales y urbanos, comportándose como endófila y exófila (Wolff y Vélez 2007). Greenberg (1971) sugirió que C. albiceps prefiere áreas donde la temperatura y la humedad son altas.
Hemilucilia semidiaphana fue poco abundante, coincidiendo con lo registrado por Linhares (1981) y Ferreira (1983). Por el contrario, en Perú llegó a constituir el 20% del total de Califóridos comportándose asinatrópica (SI = –73) (Baumgartner y Greenberg 1985), muy similar a lo registrado por Ferreira y Barbola (1998) en Curitiba (SI = –61,53) y Rodrigues-Guimarães et al. (2008) en Baixada Fluminense (SI = -100). Esta especie es moderadamente atraída por heces humanas en Brasil (Ferreira 1978). La especie presenta un bajo rango de distribución y al parecer prefiere temperaturas altas (Baumgartner y Greenberg 1985).
Cochliomyia hominivorax es poco común siendo capturada en pescado, hígado y ocasionalmente en heces humanas; adicionalmente ha sido registrada causando miasis obligada en el nuevo mundo (Baumgartner y Greenberg 1985). En Baixada Fluminense se calculó un SI de +24,1 mostrando preferencia sinantropía de +42,9 y posterior a la llegada de C. putoria el índice se redujo a +12,2 encontrándose más frecuentemente en la zona rural. L. eximia es causante de miasis secundaria en humanos y miasis primaria en animales (Murray y Thompson 1976; Madeira et al. 1989), encontrándose en áreas rurales y urbanas atraída por fruta podrida, basura urbana (Prado y Guimarães 1982; Madeira et al. 1989), moderadamente por heces humanas y cadáveres de animales (Ferreira 1978, 1983; Linhares 1981), llegando a estos sustratos primariamente para ovipositar y secundariamente para obtener proteína (D'almeida 1986). Debido a esto, la especie ha sido incriminada en la transmisión de patógenos de importancia médico veterinaria. Esta especie fue la más activa durante la noche, lo cual podría sugerir un comportamiento de oviposición nocturna similar al registrado por Singh y Bharti (2001) para C. megacephala.
Chysomya albiceps presentó un comportamiento hemisinantrópico, con preferencia por asentamientos humanos obteniendo un valor cercano al encontrado en Argentina (SI = +47,6) (Mariluis y Schnack 2002), Brasil (SI = +26,4; +41,7) (Linhares 1981; Rodrigues-Guimarães et al. 2008) y Perú (SI = +16) (Baumgartner y Greenberg 1985). Por su parte, en Curitiba, Brasil tuvo un índice de sinantropía bajo (SI = +1,98) (Ferreira y Barbola 1998) encontrándose principalmente en áreas no habitadas. Esta especie ha sido registrada como causante de miasis secundaria en animales (Zumpt 1965; Erzinclioglu y Whitcombe 1983); no obstante, Baumgartner y Greenberg (1985) sugirieron que su hábito alimenticio más importante es la depradación de larvas de otras moscas sinantrópicas. En África y Brasil es atraída por basuras, carne y heces humanas, mientras que en Omán se ha registrado en estiércol de cabra y ovejas, en los cuales se desarrollan (Erzinclioglu y Whitcombe 1983), en Perú se colectó en pescado, hígado y fruta (Baumgartner y Greenberg 1985). La preferencia por algunos de estos sustratos también se evidenció en este estudio. En Colombia, C. albiceps es comúnmente encontrada en ambientes rurales y urbanos, comportándose como endófila y exófila (Wolff y Vélez 2007). Greenberg (1971) sugirió que C. albiceps prefiere áreas donde la temperatura y la humedad son altas.
Hemilucilia semidiaphana fue poco abundante, coincidiendo con lo registrado por Linhares (1981) y Ferreira (1983). Por el contrario, en Perú llegó a constituir el 20% del total de Califóridos comportándose asinatrópica (SI = –73) (Baumgartner y Greenberg 1985), muy similar a lo registrado por Ferreira y Barbola (1998) en Curitiba (SI = –61,53) y Rodrigues-Guimarães et al. (2008) en Baixada Fluminense (SI = -100). Esta especie es moderadamente atraída por heces humanas en Brasil (Ferreira 1978). La especie presenta un bajo rango de distribución y al parecer prefiere temperaturas altas (Baumgartner y Greenberg 1985).
Cochliomyia hominivorax es poco común siendo capturada en pescado, hígado y ocasionalmente en heces humanas; adicionalmente ha sido registrada causando miasis obligada en el nuevo mundo (Baumgartner y Greenberg 1985). En Baixada Fluminense se calculó un SI de +24,1 mostrando preferencia por áreas habitadas por el hombre, con el mayor número de individuos colectados en el área rural (Rodrigues-Guimarães et al. 2008).
Chloroprocta idioidea es el único miembro del género reconocido en Sur América (Dear 1985). En Cuba se registró hemisinantrópica (comunicativa), con igual preferencia por carne, heces humanas y fruta (Gregor 1975). En Perú, fue fuertemente atraída por pescado y en menor proporción por hígado, fruta y heces humanas, encontrándose en ambientes conservados (SI = -73) (Baumgartner y Greenberg, 1985), al igual que en Baixada Fluminense (SI = -100) (Rodrigues-Guimarães et al. 2008), lo cual concuerda con lo observado en este estudio. Baumgartner y Greenberg (1985) sugieren que la preferencia por fruta en esta especie aumenta en ambientes urbanos. La especie es poco común o extremadamente local en su distribución y su presencia se ha asociado con las temporadas de lluvias (Baumgartner y Greenberg 1985).
Lucilia cuprina tuvo un comportamiento eusinantrópico en Campinas (SI = + 83,5) (Linhares 1981), Rio de Janeiro (SI = + 89,39) (D'Almeida y Lopes 1983) y Buenos Aires (SI = + 96,3) (Mariluis y Schnack 2002), coincidiendo con lo encontrado en este estudio. Por el contrario, en Baixada Fluminense su SI fue de +18,78 siendo más abundante en el área rural (Rodrigues- Guimarães et al. 2008), en Perú fue asinantrópica (SI = -99) (Baumgartner y Greenberg 1985). La especie es causante de miasis facultativa (Stevens 2003), en Australia se ha registrado como la mayor causante de miasis cutánea en ovejas, produciendo grandes pérdidas anuales en la producción (Norris 1965). En Colombia se encuentra particularmente en ambientes urbanos (Wolff y Vélez 2007).
Hemilucilia segmentaria es poco común y ha sido registrada como asinantrópica en Curitiba (SI = -50) (Ferreira 1978), Campiñas (SI = -93,4) (Linhares 1981), Goiânia (SI = -83,4; -85,6) (Ferreira 1983) y Baixada Fluminense, Brasil (SI = -100) (Rodrigues-Guimarães et al. 2008), en este último fue altamente atraída por heces humanas. En Perú se colectó en bosque lluvioso bajo con fuerte preferencia por lugares deshabitados o bosques conservados (Baumgartner y Greenberg 1985), similar a lo registrado por D'Almeida y Lopes (1983) (SI = –6,7) y a lo encontrado en este estudio. En Curitiba, se encontró en eubiocenosis (áreas de bosques primarios), exhibiendo un índice altamente negativo (SI = -100) (Ferreira y Barbola 1998). Por otro lado, Marinho et al. (2003) la registraron como vector mecánico de huevos de Dermatobia hominis Linnaeus, 1781 (Diptera: Oestridae) un importante agente causante de miasis en humanos y animales.
Paralucilia pseudolyrcea se ha registrado como asinatrópica en Buenos Aires Argentina (SI = -76,2) (Mariluis y Schnack 2002), coincidiendo con lo observado en el municipio de La Pintada.
Conclusiones
Chrysomya megacephala, Cochliomyia macellaria y Lucilia eximia fueron altamente sinantrópicas y de acuerdo con lo registrado para estas especies, pueden considerarse potencialmente importantes a nivel médico y sanitario en esta localidad. No obstante, no se encontró una asociación importante de estas especies con las heces humanas. Las poblaciones de Califóridos en el municipio de La Pintada podrían estar influenciadas por factores antrópicos que afectan su abundancia y determinan diferentes índices de sinantropía; estos mismos factores además de las condiciones climáticas podrían estar afectando su abundancia estacional.
La preferencia por lugares de alimentación de los adultos y de oviposición es importante para determinar la distribución ecológica y epidemiológica potencial de estas moscas. Evidenciar el desplazamiento de Cochliomyia macellaria requerirá un nuevo muestreo con la misma metodología, debido a que procesos como estos, solo pueden ser evaluados sistemáticamente en un largo periodo de tiempo. Se registra por primera vez a Paralucilia pseudolyrcea en Colombia. Adicionalmente, se proponen a Paralucilia pseudolyrcea y Hemilucilia segmentaria como especies marcadoras del ambientes de bosque y a Lucilia cuprina como especie marcadora de ambiente urbano para su utilización en casos de entomología forense en este municipio.
Agradecimientos
Agradecemos a la Universidad de Antioquia, a Comfenalco Antioquia y al CODI por la financiación de este proyecto. Al Laboratorio de Colecciones Entomológicas de la Universidad de Antioquia (CEUA). A Carolina Vélez por la confirmación y apoyo en la determinación taxonómica. A Natalia Uribe por su valiosa colaboración en la separación del material y a todas personas que colaboraron de una u otra forma en la realización de este proyecto.
Literatura citada
AMAT, E.; VÉLEZ, M. C.; WOLFF, M. 2008. Clave ilustrada para la identificación de los géneros y las especies de Califóridos (Diptera: Calliphoridae) de Colombia. Caldasia 30 (1): 231-244. [ Links ]
AMORIN, D.S.; SILVA, C.; BALBI, M. I. 2002. Estado do conhecimento dos dipera neotropicais, Proyecto de red Iberomaericana de Biogeografía y Entomología Sistemática Pribes 2002. p. 29-36. En: Costa, C.; Vanin, S. A.; Lobo, J. M.; Melic, A. (eds). Monografías Tercer Milenio, Volumen 2. Sociedad Entomológica Aragonesa (SEA) y Cyted, Zaragoza. España. 329 p. [ Links ]
BARRETO, M.; BURBANO, M. E.; BARRETO, P. 2002. Flies (Calliphoridae, Muscidae) and Beetles (Silphidae) from Human Cadavers in Cali, Colombia. Memórias do Instituto Oswaldo Cruz, Rio de Janeiro 97 (1): 137-138. [ Links ]
BATTAN, M.; LINHARES, A.; ROSSO, B.; GARCÍA, M. 2007. Species composition and seasonal succession of saprophagous calliphorids in a rural area of Córdoba, Argentina. Biological Research 40: 163-171. [ Links ]
BAUMGARTNER, D.; GREENBER, B. 1985. Distribution and medical ecology of the blow flies (Diptera: Calliphoridae) of Peru. Annals of the Entomological Society of America 78 (5): 565-587. [ Links ]
CAMACHO, G. 2005. Sucesión de la entomofauna cadavérica y ciclo de vida de Calliphora vicina (Diptera: Calliphoridae) como primera especie colonizadora, utilizando cerdo blanco (Sus scrofa) en Bogotá. Revista Colombiana de Entomología 31 (2): 189-197. [ Links ]
D'ALMEIDA, J. M. 1986. Substratos utilizados para a criação de dípteros caliptrados em uma área rural do Estado do Rio de Janeiro. Arquivos da Universidade Federal Rural do Rio de Janeiro 9: 13- 22. [ Links ]
D'ALMEIDA, J. M.; ALMEIDA, J. R. 1998. Nichos tróficos em dípteros caliptrados, no Rio de Janeiro. Revista Brasileira de Biologia 58 (4): 563-570. [ Links ]
D'ALMEIDA, J. M.; LOPES, H. S. 1983. Sinantropia de dípteros Caliptrados (Calliphoridae) no estado do Rio de Janeiro. Arquivos da Universidade Federal Rural do Rio de Janeiro 6: 31-38. [ Links ]
DEAR, J. P. 1985. A revision of the New World Chrysomyini (Diptera: Calliphoridae). Revista Brasileira de Zoologia 3 (3): 109-169. [ Links ]
ERZINCLIOGLU, Y. Z.; WHITCOMBE, R. P. 1983. Chrysomya albiceps (Wiedemann) (Diptera: Calliphoridae) in dung and causing myiasis in Oman. Entomologist's Monthly Magazine 119: 51- 52. [ Links ]
ESPINDOLA, C. B. 2006. Composição e estrutura de comunidades de muscóides (Diptera) em Paracambi, Rio de Janeiro. Tesis de Doctorado presentada al Programa de Pós-grado en Ciencias Biológicas (Zoologia), Museu Nacional de la Universidade Federal do Rio de Janeiro. 124 p. [ Links ]
FERREIRA, M. J. M. 1978. Sinantropía de dípteros muscoideos de Curitiba, Paraná I. Calliphoridae. Revista Brasileira de Biologia 38: 445-454. [ Links ]
FERREIRA, M. J. M. 1983. Sinantropía de Calliphoridae (Diptera) em Goiânia, Goiás. Revista Brasileira de Biologia 43 (2): 199- 210. [ Links ]
FERREIRA, M. J. M; BARBOLA, I. F. 1998. Sinantropía de Califorídeos (Insecta, Diptera) de Curitiba, Paraná, Brasil. Revista Brasileira de Biologia 58 (2): 203-209. [ Links ]
FIGUEROA-ROA, L.; LINHARES, A. X. 2002. Sinantropía de los Calliphoridae (Diptera) de Valdívia, Chile. Neotropical Entomology 31 (2): 233-239. [ Links ]
FÖRSTER, M.; KLIMPEL, S.; MEHLHORN, H.; SIEVERT, K.; MESSLER, S.; PFEFFER, K. 2007. Pilot study on synanthropic flies (e.g. Musca, Sarcophaga, Calliphora, Fannia, Lucilia, Stomoxys) as vectors of pathogenic microorganisms. Parasitology Research 101: 243-246. [ Links ]
FOX, I.; RODRIGUEZ-TORRES, R. 1972. Human macellaria myiasis in Puerto Rico. Boletín de la Asociación Médica de Puerto Rico 64: 53-55. [ Links ]
GODOY, W. A. C.; von ZUBEN, C. J.; dos REIS, S. F.; von ZUBEN, f. j. 1997. The spatial dynamics of native and introduced blowflies (Diptera: Calliphoridae). Journal of Applied Entomology 121: 305-309. [ Links ]
GREENBERG, B. 1971. Flies and Disease, Vol. I: Ecology, classification and biotic association. Princeton University Press, Princeton, New Jersey. 856 p. [ Links ]
GREENBERG, B. 1973. Flies and Disease, Vol. II: Biology and Disease Transmission. Princeton University Press, Princeton, New Jersey. 447 p. [ Links ]
GREENBERG, B.; VARELA, G.; BORNWSTEIN, A.; HERRNANDEZ, H. 1963. Salmonella from flies in a Mexican slaughterhouse. American Journal of Hygiene 77: 177-183. [ Links ]
GREGOR, F. 1975. Synanthropy of Anthomyiidae. Muscidae and Calliphoridae (Diptera) in Cuba. Folia Parasitologica 22: 57-71. [ Links ]
GREGOR, F.; POVOLNY, D. 1958. Versuch einer Klassifikation der synanthropen Fliegen. Journal Hygiene Epidemiology Microbiology & Inmunology 2: 205-016. [ Links ]
GUIMARÃES, J. H.; PRADO, A. P.; LINHARES, A. X. 1978. Three newly introduced blowfly species in Southern Brazil (Diptera: Calliphoridae). Revista Brasileira de Entomología 22 (1): 53-60. [ Links ]
HOLDRIDGE, L. 1978. Ecología basada en zonas de vida. San de José, Costa Rica. 216 p. [ Links ]
IDROBO, C. J.; MARTÍNEZ, W. A. 2000. Interrelaciones de insectos asociados a hígado humano en descomposición, Popayán, Colombia. Resúmenes XXVII Congreso Sociedad Colombiana de Entomología 98 p. [ Links ]
JAMES, M. T. 1955. The blowflies of California (Diptera: Calliphoridae). Bulletin of the California Insect Survey 4 (1): 1- 34. [ Links ]
JIMÉNEZ, S.; LATORRE, L.; ROMAN, A.; USAQUEN, W. 2002. Estudio preliminar de sucesión entomológica en el cuerpo de cerdo doméstico (Sus scrofa) en la estación de carabineros Parque Nacional de Bogotá. En: Resúmenes XI congreso Nacional de Medicina Legal y Ciencias Forenses. "Desastres y derecho internacional humanitario". CD. Manizales. [ Links ]
KILLPATRIC, J. W.; BOGUES, M. D. 1956. Adult fly production from garbage can sites and privy pits in the lower Rio Grande Valley. American Journal of Tropical Medicine and Hygiene 5: 331-339. [ Links ]
LINHARES, A. X. 1981. Synanthropy of Calliphorid and Sarcophagidae (Diptera) in the city of Campinas, Sao Paulo, Brazil. Revista Brasileira de Entomologia 25 (3): 189-215. [ Links ]
LOMôNACO, C.; ALMEIDA, J. R. 1995. Estructura comunitária de dípteros muscóides da restinga de Jacarepaguá, Rio de Janeiro, Brasil. Revista Brasileira de Entomologia 39 (4): 891-896. [ Links ]
MADEIRA, N. G.; SILVEIRA, G. A. R.; PAVAN, C. 1989. The ocurrence of primary myiasis in cat caused by Phaenicia eximia (Diptera: Calliphoridae). Memórias do Instituto Oswaldo Cruz 84: 341. [ Links ]
MARILUIS, J. C.; SCHNACK, J. A. 1989. Ecology of the blow flies of an eusynanthropic habitat near Buenos Aires (Diptera, Calliphoridae). Eos 165: 93-101. [ Links ]
MARILUIS, J.C.; SCHNACK, J.C. 2002. Calliphoridae de la Argentina. Sistemática, ecología e importancia sanitaria (Insecta, Diptera), pp. 23-37. En O.D. Salomón (ed.), Actualizaciones en artropodología sanitaria Argentina. Ed. Fundación Mundo Sano. Buenos Aires. Argentina. 302 p. [ Links ]
MARILUIS, J.; MULIERI, P. R. 2005. Calliphoridae, Califóridos. p 95-100. En: O.D. Salomón (ed.), Artrópodos de interés médico en Argentina. Ed. Fundación Mundo Sano, Buenos Aires. Argentina. 112 p. [ Links ]
MARINHO, C. R.; BARBOSA, L. S.; GRANTHON DE AZEVEDO, A. C.; DE CARVALHO QUEIROZ, M. M.; AGUIAR VALGODE, M.; AGUIAR COELHO, V. M. 2003. Hemilucilia segmentaria (Fabricius, 1805) (Diptera: Calliphoridae) as new biological vector of eggs of Dermatobia hominis (Linnaeus Jr., 1781) (Diptera: Oestridae) in Reserva Biológica do Tinguá, Rio de Janeiro, Brazil. Memórias do Instituto Oswaldo Cruz, Rio de Janeiro 98 (7): 937-938. [ Links ]
MARTÍNEZ E.; DUQUE, P.; WOLFF, M. 2007. Succession pattern of carrion-feeding insects in Paramo, Colombia. Forensic Science International 166: 182-189. [ Links ]
MURRAY, V. I. E.; THOMPSON, K. 1976. Myiasis in man and other animals in Trinidad y Tobago (1972-1973). Tropical Agriculture 53: 263-266. [ Links ]
NORRIS, K. R. 1965. The bionomics of blow flies. Annual Review of Entomology 10: 47-68. [ Links ]
NUORTEVA, P. 1963. Synanthropy of blowflies (Dipt., Calliphoridae) in Finland. Annales Entomologici Fennici. 29: 1-49. [ Links ]
PAPE T.; WOLFF, M.; AMAT, E. 2004. Los Califóridos, Éstridos, Rinofóridos y Sarcofágidos (Diptera: Calliphoridae, Oestridae, Rhinophoridae, Sarcophagidae) de Colombia. Biota Colombiana 5 (2): 201-208. [ Links ]
PARALUPPI, N. D. 1996. Calliphoridae (Diptera) da Bacia do Alto Rio Rucu, Amazônia Central, Brasil. Revista Brasileira de Zoologia 13 (3): 553-559. [ Links ]
PÉREZ, S. P.; DUQUE, P.; WOLFF, M. 2005. Successional behavior and occurrence matrix of carrion-associated arthropods in the urban area of Medellín, Colombia. Journal of Forensic Science 50 (2): 448-454. [ Links ]
PRADO, A. P.; GUIMARAES, J. H. 1982. Estado atual de dispersão e distribucão do genero Chysomyia Robineau-Desvoidy na regiao neotropical (Diptera, Calliphoridae). Revista Brasileira de Entomologia 26: 225-231. [ Links ]
RESTREPO, F.; VALDERRAMA, R.; MARÍN, M. A.; CADAVID, G. A. 2000. Artropofauna cadavérica asociada con los estados de descomposición del intervalo post-mortem en el cerdo Sus scrofa, en dos medios ecológicos diferentes. Resúmenes XXVII Congreso Sociedad Colombiana de Entomología 98 p. [ Links ]
RODRIGUES-GUIMARÃES, R.; RODRIGUES, G. R.; MAGALHÃES, B. H.; CARVALHO, R. W.; MOYA-BORJA, G. E. 2008. Sinantropia da fauna de Califorídeos (Diptera, Calliphoridae) na Baixada Fluminense, Rio de Janeiro, Brasil. Revista de Ciência & Tecnologia 8 (1): 22-33. [ Links ]
SCHNACK, J. A.; MARILUIS, J. C.; CENTENO, N.; MUZÓN, J. 1995. Composición especifica, ecología y sinantropía de Calliphoridae (Insecta: Diptera) en el Gran Buenos Aires. Revista de la Sociedad Entomológica Argentina 54: 161-171. [ Links ]
SINGH, D.; BHARTI, M. 2001. Further observations on the nocturnal oviposition behaviour of blow flies (Diptera: Calliphoridae). Forensic Science International 120: 124-126. [ Links ]
STEVENS, J. R. 2003. The evolution of myiasis in blowflies (Calliphoridae). International Journal for Parasitology 33: 1105 - 1113. [ Links ]
USAQUÉN, W.; CAMACHO, G. P. 2004. Ciclo de vida de Lucilia sericata (Diptera: Calliphoridae) como primera especie colonizadora en hígado humano realizado en el Instituto de Medicina Legal y Ciencias Forenses. Revista del Instituto Nacional de Medicina Legal y Ciencias Forenses 18 (2): 31-36. [ Links ]
VELÁSQUEZ, J. O.; ARANGO, B.; JARAMILLO, N.; FRANCO, M.; MOLINA, V.; CANO, J. 2006. Plan de manejo ecoturístico del municipio de La Pintada. Universidad Nacional de Colombia, CORANTIOQUIA. Medellín. 259 p. [ Links ]
VÉLEZ, M. C.; WOLFF, M. 2008. Rearing five species of Diptera (Calliphoridae) of forensic importance in Colombia in semicontrolled field conditions. Papéis Avulsos de Zoologia 48 (6): 41-47. [ Links ]
VILLAREAL, H.; ALVAREZ, M.; CORDOBA, S.; ESCOBAR, F.; FAGUA, G.; GAST, F.; MENDOZA, H.; OSPINA, M.; UMAÑA, A. M. 2004. Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de inventarios de biodiversidad. Instituto de Investigaciones de Recursos Biológicos Alexander Von Humboldt Bogotá, Colombia. 236 p [ Links ]
VISCIARELLI, E. C.; GARCÍA, S. H.; SALOMÓN, C.; JOFRÉ, C.; COSTAMAGNA, S. R. 2003. Un caso de miasis humana por Cochliomyia hominivorax (Diptera: Calliphoridae) asociado a pediculosis en Mendoza, Argentina. Parasitología Latinoamericana 58: 166-168. [ Links ]
WOLFF, M.; URIBE, A. 2000. Sucesión de insectos carroñeros en cerdo blanco (Sus scrofa). Memorias XXVII Congreso Sociedad Colombiana de Entomología 177-185 p. WOLFF, M.; URIBE, A.; ORTIZ, A.; DUQUE, P. 2001. A preliminar study of forensic entomology in Medellín, Colombia. Forensic Science International 3058: 1-7. [ Links ] [ Links ]
WOLFF, M.; BUILES, A.; ZAPATA, G.; BENECKE, M. 2004. Detection of Parathion (O, O-diethyl O- 4nitrophenyl phosphorothio) by HPLC in insects of forensic importance in Medellin, Colombia. Aggrawal's Internet Journal of Forensic Medicine and Toxicology 5 (1): 6-11. [ Links ]
WOLFF, M.; ZAPATA, Y.; MORALES, G.; BENECKE, M. 2006. Detección y cuantificación de Propoxur en la sucesión de insectos de importancia médico-legal. Revista Colombiana de Entomología 32 (2): 159-164. [ Links ]
WOLFF, M.; VÉLEZ, M. 2007. Calliphoridae (Diptera): de importancia forense en Colombia, anotaciones sobre su comportamiento y distribución. Memorias XXXIV Congreso Sociedad Colombiana de Entomología 88-98 p. [ Links ]
YUSSEFF, S. Z. 2006. Entomología forense: los insectos en la escena del crimen. Revista Luna Azúl, Universidad de Caldas 23 (23): 42-49. [ Links ]
ZUMP, F 1965. Myiasis in man and animals in Old World. Butterworths, London: 267 p. [ Links ]
Recibido: 18-sep-2008 - Aceptado: 15-feb-2009