Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.2 Bogotá July/Dec. 2009
Artículo de Revisión
El nucleopoliedrovirus de Spodoptera exigua (Lepidoptera: Noctuidae) como bioplaguicida: análisis de avances recientes en España
The nucleopolyhedrovirus of Spodoptera exigua (Lepidoptera: Noctuidae) as a biopesticide: analysis of recent advances in Spain
PRIMITIVO CABALLERO1,2*, ROSA MURILLO1,2, DELIA MUÑOZ1 y TREVOR WILLIAMS3
1 Departamento de Producción Agraria, Universidad Pública de Navarra, 31006 Pamplona, Navarra, España. pcm92@unavarra.es. Autor para correspondencia (Primitivo Caballero).
2 Instituto de Agrobiotecnología, CSIC-Gobierno de Navarra, 31192 Mutilva Baja, España.
3 Instituto de Ecología A.C., Apartado Postal 63, Xalapa, 91070 Veracruz, México.
Recibido: 3-mar-09 - Aceptado: 24-sep-09
Resumen: Los invernaderos de Almería, España, representan la extensión más grande de cultivos cubiertos en Europa. Larvas de Spodoptera exigua son una plaga importante en muchos de estos cultivos y han desarrollado resistencia a la mayoría de insecticidas registrados en Europa. El nucleopoliedrovirus de S. exigua (SeMNPV; Baculoviridae) es un patógeno autóctono de este insecto. La persistencia del virus es alta en el suelo de todos los cultivos aunque su incidencia es mayor en primavera y verano. Se han podido identificar hasta nueve variantes genotípicas del virus en esta zona. En términos de patogenicidad, virulencia y producción de los poliedros o cuerpos de inclusión (OBs, por sus siglas en inglés), las mezclas de ciertos genotipos tienen mayor potencial insecticida que los genotipos puros. La producción de OBs in vivo puede ser hasta tres veces mayor en las larvas tratadas con análogos de la hormona juvenil. Compuestos derivados del estilbeno tienen una actividad sinérgica con los OBs en condiciones de laboratorio y reducen la dosis letal del virus en campo. La eficacia en campo de una formulación sencilla fue mejor que la que ofrecen los tratamientos de varios insecticidas de síntesis. Actualmente el virus se produce masivamente en una planta comercial y se ha iniciado el proceso de registro del producto para su utilización en cultivos de pimiento dulce en los invernaderos de Almería. Los resultados de estas investigaciones pueden facilitar el desarrollo del SeMNPV como insecticida biológico en otras partes del mundo, incluyendo América Latina.
Palabras clave: Lepidópteros. Baculovirus. Insecticida biológico. Selección de materia activa. Eficacia en campo. Cultivos de invernadero.
Abstract: The greenhouses of Almeria, Spain, represent the largest extension of covered crops in Europe. Larvae of Spodoptera exigua are an important pest in many of these crops and have developed resistance to the majority of insecticides registered in Europe. The nucleopolyhedrovirus (SeMNPV; Baculoviridae) of S. exigua is a native pathogen of this insect. The persistence of the virus is high in the soil of all crops, although its incidence is highest in spring and summer. As many as nine genotypic variants of the virus have been identified in this zone. In terms of pathogenicity, virulence and production of progeny virus occlusion bodies (OBs), mixtures of certain genotypes have greater insecticidal potential than pure genotypes. Production of OBs in vivo can be up to three-fold greater in larvae treated with juvenile hormone analogues. Compounds derived from stilbene have a synergistic activity with OBs in the laboratory and reduce the lethal dosis in the field. The field efficacy of a simple formulation was greater than that offered by treatments of various synthetic insecticides. The virus is currently being mass-produced in a commercial production facility and the process of registration has begun for its use in sweet pepper crops in Almerian greenhouses. The results of these investigations should facilitate the development of SeMNPV as a biological insecticide in other parts of the world, including Latin America.
Key words: Lepidopterans. Baculovirus. Biological insecticide. Active material selection. Field efficacy. Greenhouse crops.
Introducción
La producción de hortalizas en invernaderos representa una parte importante de la economía del sector agrícola del sur de España, principalmente en la provincia de Almería. En la campaña 2005-2006, la producción de los principales cultivos hortícolas en invernadero en Almería alcanzó una superficie de 38.700 Ha, con un volumen de producción de 2,75 millones de toneladas, y un valor de dicha producción de 1,53 mil millones de euros, equivalente a aproximadamente US$~1,93 mil millones (Junta de Andalucía 2006). Entre los principales cultivos destacan, tanto por superficie como por producción y valor de la misma, pimiento, tomate, sandía, melón, calabacín, pepino, judía y berenjena. La problemática fitosanitaria asociada a estos cultivos es bastante amplia concurriendo en ellos plagas y enfermedades muy favorecidas por las especiales condiciones que se dan dentro de los invernaderos (Cabello et al. 1990). Entre todos estos problemas, uno de los que más preocupan a los agricultores por la constancia con que se produce y su importancia económica, es el lepidóptero Spodoptera exigua (Hübner, 1808) (Lepidoptera: Noctuidae) (Belda 1994).
El gusano soldado, conocido en España como la rosquilla verde, S. exigua, es una especie polífaga originaria del sureste asiático que actualmente se encuentra distribuida por todas las regiones subtropicales y templadas del mundo y es especialmente abundante en América Central y del Norte, África, Australia, y el sur de Asia y Europa. En el sur de España, S. exigua está presente durante todo el año y, entre los meses de junio y octubre, origina plagas frecuentes en los cultivos de pimiento dulce, tomate, calabacita, sandía y melón de los invernaderos de Almería (Belda 1994).
Los agricultores almerienses tratan de evitar o reducir las pérdidas económicas ocasionadas por las infestaciones larvarias de S. exigua mediante aplicaciones frecuentes de insecticidas químicos de amplio espectro solos o en cócteles. El uso frecuente de estos insecticidas de síntesis ha dado lugar al desarrollo de resistencias en muchas poblaciones de S. exigua, incluidas las que se encuentran en Almería (Smagghe et al. 1997, 2003; Mascarenhas et al. 1998; Torres-Vila et al. 1998; Moulton et al. 1999, 2002). Como consecuencia de ello, en la actualidad la mayoría de los insecticidas comercialmente disponibles no permiten un adecuado control de esta plaga (Cuadrado y Viñuela 1998). Por otra parte, tampoco hay disponibles agentes de control biológico efectivos contra S. exigua. El uso repetido de insecticidas químicos contra S. exigua lleva asociados otros problemas en los invernaderos de Almería como son: 1) la presencia de residuos plaguicidas que deben ser controlados y mantenidos por debajo de ciertos límites según las regulaciones establecidas para frutas y hortalizas (European Commission 2006) en la Unión Europea, y 2) la imposibilidad de realizar liberaciones de insectos polinizadores, por ejemplo Bombus terrestris (Linnaeus, 1758), o de implementar programas de control biológico dirigidos contra otras plagas importantes como los trips, moscas blancas y pulgones, contra las que sí hay disponibles eficaces enemigos naturales (Lara y Urbaneja 2002; Stansly et al. 2005).
Últimamente, sobre todo durante los tres últimos años, en Almería se ha despertado un creciente interés por desarrollar métodos más sostenibles para el control de S. exigua, especialmente los dirigidos a la puesta a punto y aplicación de programas de control biológico y control integrado (Lacasa 2004). Dicho interés ha generado la necesidad de evaluar el potencial insecticida de distintas materias activas que puedan tener cabida en tales programas. Una de las alternativas más prometedora y realista al control químico de S. exigua en los invernaderos de Almería la constituye un baculovirus nativo, concretamente el nucleopoliedrovirus múltiple de S. exigua (SeMNPV, familia Baculoviridae), que habitualmente causa epizootias en las poblaciones larvarias de este insecto. En este trabajo se revisan los avances recientes que han contribuido al desarrollo del SeMNPV como bioinsecticida en España y que también podrían ser relevantes para varios países de Latinoamérica en los que haya una producción importante de hortalizas en invernadero.
Los baculovirus: potencial como bioplaguicidas. La familia Baculoviridae es la más numerosa y ampliamente estudiada de todos los grupos de virus patógenos de insectos. Esta familia agrupa a virus de ADN de doble cadena cuyos viriones están característicamente incluidos en una matriz proteínica llamado poliedro o cuerpo de inclusión, OB del inglés occlusion body (Theilmann et al. 2005). Después de un cambio reciente en su clasificación (Jehle et al. 2006), la familia consta de cuatro géneros: Alphabaculovirus, que comprende los nucleopoliedrovirus específicos para lepidópteros, Betabaculovirus, que comprende los granulovirus específicos para lepidópteros,Gammabaculovirus, que comprende los nucleopoliedrovirus específicos para himenópteros fitófagos y Deltabaculovirus, que comprende los nucleopoliedrovirus específicos para dípteros. Todos los virus de esta familia se caracterizan por tener un estrecho espectro de hospedero y una elevada patogenicidad y virulencia que son las características ideales en un microorganismo entomopatógeno para que pueda ser desarrollado como bioinsecticida. El OB que los caracteriza los hace estables durante largos periodos (Jaques 1985) y facilita su aplicación mediante pulverizaciones acuosas convencionales. Además, el uso insecticida de los baculovirus, debido a su estrecho espectro de hospedero (Gröner 1986) y a la ausencia de otros posibles efectos perjudiciales, no entraña riesgos ambientales mayores.
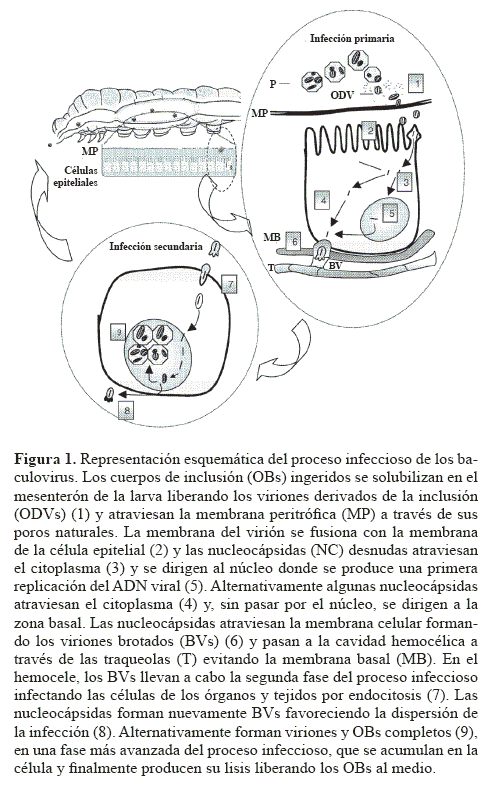
Los baculovirus son una parte integrante de los ecosistemas e inciden en las poblaciones naturales de los insectos como un factor de mortalidad que contribuye a regular su densidad. El estado susceptible es la larva que es infectada al alimentarse de un substrato vegetal contaminado con OBs. En el intestino de la larva se dan las condiciones alcalinas (pH 9-11) que favorecen la disolución de la proteína, la cual es el principal componente del OB, permitiendo la liberación de los viriones derivados de la inclusión, las ODVs, partículas infectivas. Los viriones infectan las células epiteliales del mesenterón y el virus se replica en su núcleo dando lugar a nuevos viriones que infectan las células de otros órganos y tejidos de la cavidad hemocélica (Fig. 1). Al final del proceso infeccioso, que se completa entre tres y seis días, la larva muere conteniendo en su cavidad hemocélica grandes cantidades de OBs que son fácilmente observables al microscopio óptico (Granados y Williams 1986). Como consecuencia del proceso infeccioso, el tegumento de la larva se degrada liberando millones de OBs que contaminan el follaje de la plantas los cuales constituyen el inóculo que sirve para dar origen al proceso de infección en otros hospederos susceptibles.
La distribución espacial de los OBs de un baculovirus varía en función del tipo de ecosistema, de las diferentes combinaciones baculovirus-insectos y de las distintas plantas sobre las que se alimentan los insectos hospederos (Fuxa 2004). En los invernaderos de cultivos hortícolas de Almería los OBs se encuentran ampliamente distribuidos tanto en las distintas zonas geográficas como en los diferentes cultivos. La distribución en el tiempo es más variable ya que la concentración de OBs en el suelo es mayor en primavera y verano que en otoño e invierno, coincidiendo con cambios importantes en la densidad poblacional del hospedero. De igual modo, se ha observado que el pH del suelo afecta de forma importante tanto a la abundancia como la composición genética de los OBs. Por otra parte, el análisis con enzimas de restricción del ADN genómico de los distintos aislados procedentes de la zona ha revelado una gran diversidad genética habiéndose identificado por lo menos nueve variantes genotípicas del SeMNPV. Los invernaderos de Almería representan, por tanto, un reservorio adecuado para la supervivencia de los OBs del SeMNPV (Murillo et al. 2007) y dada la elevada frecuencia con que se producen las epizootias por este virus en las poblaciones larvarias de S. exigua (Caballero et al. 1992a), se pueden considerar como un ecosistema permisivo para el SeMNPV según la clasificación de Fuxa (2004).
La utilidad y efectividad de los baculovirus para el control de las plagas, tanto en cultivos agrícolas como en ecosistemas forestales, han sido ampliamente demostradas (Cherry y Williams 2001). Actualmente hay comercializados más de treinta bioinsecticidas basados en baculovirus contra algunas de las plagas más importantes en el ámbito mundial entre las que se incluye S. exigua. La mayoría de ellos son productos de medianas o pequeñas empresas o bien son producidos por las propias instituciones públicas que los utilizan como es el caso del Departamento de Agricultura de los Estados Unidos de América del Norte (USDA). En algunas partes del mundo, se ha demostrado que la utilización de bioinsecticidas basados en baculovirus puede reducir de forma significativa el consumo de plaguicidas químicos. Sin duda, el ejemplo más destacado es el programa brasileño de control de Anticarsia gemmatalis Hübner, 1818 mediante la aplicación de un baculovirus para la protección de casi dos millones de hectáreas de soya; se trata de un programa sostenible que se ha mantenido durante más de tres décadas (Moscardi 1999). Los bioinsecticidas basados en baculovirus, dadas sus características, son agentes de control ideales para su inclusión en programas de control integrado y su acción insecticida es especialmente útil: 1) contra aquellas especies fitófagas que han desarrollado resistencia múltiple o cruzada a los insecticidas químicos de síntesis y 2) en los programas de control donde se incluyen agentes biológicos de control susceptibles a la acción de los insecticidas químicos (Rodgers 1993).
Tanto los técnicos extensionistas como los agricultores de la zona hortícola de Almería han mostrado un gran interés por disponer de un bioinsecticida basado en un baculovirus para el control de las plagas de S. exigua. El uso específico del SeMNPV para el control de S. exigua permitiría eliminar el cuello de botella que actualmente representa esta especie impidiendo un uso más generalizado de los programas de control biológico de plagas en los invernaderos de Almería. A continuación se analizan algunos de los aspectos esenciales para el desarrollo tecnológico de un bioinsecticida basado en el nucleopoliedrovirus de S. exigua.
Selección de la materia activa: Actividad insecticida del SeMNPV. La eficacia insecticida de diferentes aislados de nucleopoliedrovirus homólogos y heterólogos para las larvas de S. exigua, es decir un virus originario de la misma especie o de una diferente especie de hospedero respectivamente, ha sido extensamente estudiada por distintos autores para poblaciones de diferentes orígenes geográficos tanto en condiciones de laboratorio (Smits 1987; Caballero et al. 1992b) como de campo (Kolodny-Hirsch et al. 1997). Sin duda, S. exigua es susceptible a la infección por varios nucleopoliedrovirus entre los que se encuentran los de Autographa californica (Speyer, 1875) (AcMNPV), Spodoptera littoralis (Boisduval, 1833) (SpliMNPV), S. frugiperda (J.E. Smith, 1797) (SfMNPV), Mamestra brassicae (Linnaeus, 1758) (MbMNPV), Helicoverpa armigera (Hübner, 1805) (HaMNPV) y otros. No obstante, su nucleopoliedrovirus homólogo (SeMNPV) es el más virulento y patogénico para los distintos estadíos larvarios de S. exigua (Smits 1987; Murillo et al. 2003a). Con frecuencia se encuentra que los distintos aislados de un mismo baculovirus también difieren significativamente en sus propiedades insecticidas para un mismo insecto (Caballero et al. 1992b; Muñoz et al. 1998). Por tanto, la selección de la variante genotípica del virus más efectiva para una determinada especie fitófaga es un importante elemento a la hora de desarrollar un bioinsecticida.
El SeMNPV se ha aislado en diferentes regiones del mundo incluyendo México, los Estados Unidos, Tailandia, Países Bajos, Taiwán, India, Egipto y Japón. Este virus también se ha aislado en España, donde provoca epizootias naturales en poblaciones de S. exigua en los cultivos hortícolas de los invernaderos de Almería (Caballero et al. 1992a). Un aislado del SeMNPV originario de Florida, USA, se ha desarrollado como un producto comercial registrado bajo el nombre de Spod-X® en Holanda, Estados Unidos y Tailandia (Smits y Vlak 1994). El producto se utiliza en los invernaderos de los Países Bajos en cultivos de plantas ornamentales y actualmente el virus es comercializado por la empresa Certis USA (Certis 2009). Sin embargo, la calidad biológica del producto está afectada por la presencia de genotipos defectuosos que reducen la capacidad insecticida del virus (Muñoz et al. 1998). Estos genotipos se caracterizan por haber perdido genes esenciales para su replicación y dependen de manera parasítica de otros genotipos presentes en la cepa silvestre para producir las proteínas necesarias durante su replicación (Muñoz y Caballero 2000).
La identificación y clonación de las diferentes variantes genotípicas presentes en las poblaciones naturales de baculovirus es posible mediante la utilización de diversas técnicas moleculares y biológicas (Muñoz y Caballero 2001). Nuestro grupo de investigación ha llevado a cabo una detallada caracterización molecular, genética, ecológica e insecticida de un amplio número de aislados del SeMNPV originarios de los invernaderos del suroeste almeriense (Caballero et al. 1992b). Estos aislados son en general mezclas heterogéneas de genotipos individuales que se encuentran en distintas proporciones relativas (Murillo et al. 2006a). Dichos genotipos difieren en su patogenicidad, virulencia y capacidad de producir OBs en larvas infectadas (Muñoz y Caballero 2000) pero, es interesante que no se hayan detectado genotipos autoparásitos (Muñoz et al. 1999). Sí se ha demostrado en cambio, que en los aislados heterogéneos los genotipos interaccionan produciendo un inóculo con propiedades insecticidas únicas, es decir un fenotipo único (Murillo et al. 2006a). Algunos de estos genotipos, o determinadas mezclas de los mismos, exhiben la más alta patogenicidad, en términos de su dosis letal, y virulencia, en términos de su tiempo letal, para las larvas de las poblaciones nativas de S. exigua en Almería, por lo que han sido seleccionados para su desarrollo como bioinsecticida comercial (Murillo et al. 2006a).
Producción masiva de virus: obtención del producto técnico. La explotación comercial de un baculovirus requiere el desarrollo de una tecnología que haga posible la producción del virus a gran escala a un costo aceptable, como condición necesaria para la obtención de un producto técnico. La producción in vivo sobre hospedero susceptible es la metodología actualmente utilizada para la producción de todos los bioinsecticidas basados en baculovirus disponibles en el mercado, incluido el SeMNPV. Esta técnica consiste básicamente en alimentar larvas con dieta semisintética que es superficialmente contaminada con una suspensión del virus que se quiere multiplicar. Algunos de los aspectos esenciales de esta metodología, como por ejemplo las dietas para insectos o los métodos de cría masiva, deben ser específicamente desarrollados para cada sistema hospedero-baculovirus. El método de cría masiva de S. exigua ha sido optimizado para la producción de SeMNPV en Tailandia (Cherry et al. 1997). Sin embargo, el desarrollo de este método requiere una gran cantidad de mano de obra que hace que no sea viable en países desarrollados. Para otros sistemas hospedero-baculovirus se han desarrollado métodos de producción masiva que permiten utilizar una alta densidad de larvas y automatizar el proceso en gran medida, reduciendo así los costos de producción.
El método utilizado en nuestro laboratorio para la producción del SeMNPV consiste en infectar larvas del quinto estadío de S. exigua, en grupos de 100 larvas/caja, alimentándolas con dieta semisintética contaminada superficialmente por aspersión con 1,5×108 OBs. Las larvas muertas por virus son recogidas y los cadáveres triturados y homogenizados.De esta manera se obtiene una producción de entre 1,2×109 y 2,3×109 OBs/larva. Este método permite recuperar aproximadamente el 80% de las larvas infectadas, mientras que el 20% restante se pierde debido al canibalismo, lo cual resulta en una producción entre 1,1×1011 y 1,4×1011 OBs/caja. La producción del SeMNPV en nuestro laboratorio consiste en un sistema en el que se requieren unas 320 larvas es decir cuatro cajas con 80 cadáveres recogidos/caja, para la producción de 5×1011 OBs que es la cantidad de principio activo o virus necesario para tratar una hectárea de invernadero. La tecnología generada en estas investigaciones ha sido transferida a la empresa Biocolor S.L., Almería, España, en la que actualmente hay funcionando una planta para la producción comercial de este bioinsecticida con capacidad de infectar más de 50 mil larvas diarias. El bioinsecticida se comercializa como un líquido concentrado en botellas de 350 ml, que contiene al menos 5×1011 OBs/botella. La producción prevista para el año 2009 es de más de 25 mil botellas, principalmente destinadas al mercado local de los invernaderos de Almería. Para el año 2010 se espera un incremento significativo de la producción y ampliar la comercialización a otras regiones de España y otros países.
La productividad de este sistema puede ser mejorada significativamente si las larvas de S. exigua recién mudadas al quinto estadío son tratadas con un análogo de la hormona juvenil con anterioridad a ser alimentadas con dieta artificial superficialmente contaminada con el virus (Lasa et al. 2007a). Por ejemplo, las larvas tratadas con fenoxicarb (1%) experimentan una muda supernumeraria que da lugar a un sexto estadío. Cuando estas larvas son tratadas, utilizando la misma concentración de virus y la misma metodología señaladas para el quinto estadío, se obtienen producciones que oscilan entre 1,82×109 y 1,04×1010 OBs/larva. El método de producción in vivo que utiliza un análogo de la hormona juvenil produce un incremento medio de casi tres veces en la cantidad de OBs producidos por larva (Lasa et al. 2007a). Esto significa que con poco más de 100 larvas infectadas es posible producir la cantidad de OBs necesarios para tratar una hectárea de cultivo.
Formulación. Los bioinsecticidas basados en baculovirus, a diferencia de los plaguicidas químicos, actúan exclusivamente por ingestión y su persistencia sobre el cultivo es mucho menor; sin embargo, la mayoría de los baculovirus actualmente comercializados como bioinsecticidas utilizan el mismo tipo de formulación que los insecticidas químicos. Este tipo de formulación no tiene en cuenta las reconocidas ventajas de emplear sustancias fagoestimulantes, sustancias con actividad sinérgica o sustancias fotoprotectoras (Williams y Cisneros 2001) y por lo tanto frecuentemente no maximiza la capacidad insecticida de los baculovirus. El uso comercial de los baculovirus requiere el desarrollo de un producto formulado de fácil manejo y eficacia fiable. Para facilitar esto, una formulación correcta debe: (1) aumentar la actividad insecticida del patógeno, (2) optimizar la aplicación y la ingestión del virus por el fitófago, (3) maximizar la persistencia ambiental del mismo, (4) estabilizar el virus durante su almacenamiento, y (5) facilitar el manejo del producto por parte del agricultor (Jones y Burges 1998).
Las sustancias que actúan como fagoestimulantes permiten incrementar la actividad alimentaria del fitófago con lo que un mayor número de individuos consumen una dosis letal del virus y además lo hacen en menos tiempo (Bell y Kanavel 1978; Bartelt et al. 1990). También se ha comprobado que las formulaciones que incorporan fagoestimulantes requieren menos virus que otras formulaciones más sencillas (Bartelt et al. 1990) y aumentan la eficiencia del depósito bioinsecticida en el sitio del que se alimenta el fitófago. Bartelt et al. (1990) demostraron que los carbohidratos, lípidos y proteínas son componentes esenciales de los mejores fagoestimulantes para las larvas de muchas especies de lepidópteros. En nuestro laboratorio se ha determinado el efecto fagoestimulante para larvas de S. exigua de una gama de 13 sustancias naturales, de bajo costo, la mayoría de las cuales habían sido identificadas en estudios previos por sus propiedades fagoestimulantes para distintas especies de lepidópteros (Burges y Jones 1998; Williams y Cisneros 2001). En estos estudios se llegó a tres conclusiones relevantes. En primer lugar, que la mayoría de las sustancias evaluadas, incluidos los potenciadores de sabor glutamato monosódico y Sorbex, no actúan como estimulantes alimenticios para las larvas de S. exigua independientemente de que se haya señalado su actividad como atrayente alimentario para otras especies de lepidópteros. En segundo lugar, que la actividad de sustancias potencialmente fagoestimulantes depende de la experiencia que tienen las larvas de S. exigua. Por último, que los bioensayos de laboratorio en los que se utilizan insectos criados sobre dietas artificiales requieren ser validados utilizando larvas criadas sobre plantas naturales antes de ser desarrollados en evaluaciones de campo (Lasa-Covarrubias 2007).
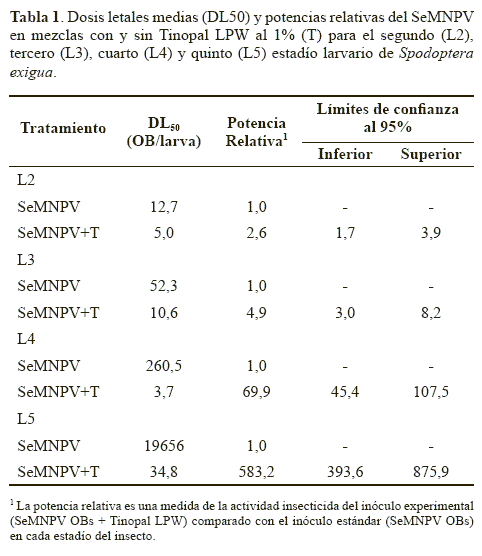
La radiación solar ultravioleta es el factor que tiene mayor efecto destructivo sobre la actividad de los baculovirus por lo que generalmente se recomienda incluir en la formulación de los bioinsecticidas una o más sustancias fotoprotectoras (Killick y Warden 1991). Los blanqueadores ópticos son sustancias derivadas del estilbeno que, por su capacidad de absorber la radiación UV y emitir luz en la región azul del espectro visible, son utilizados comúnmente para dar mayor brillo a pinturas, fibras, ropas, etc. Inicialmente, Shapiro y Robertson (1992) describieron su uso como protector de radiación para los baculovirus con resultados insólitos. Los virus formulados con ciertos blanqueadores mantuvieron el 100% de su actividad insecticida después de dos semanas de exposición a una fuente de luz UV. Simultáneamente, se demostró la capacidad que tienen estas sustancias de potenciar hasta en más de mil veces la actividad insecticida del baculovirus debido a la interacción del blanqueador con la membrana peritrófica del intestino del insecto (Shapiro y Robertson 1992; Hamm 1999; Wang y Granados 2000). En nuestro laboratorio se ha determinado la influencia de un abrillantador óptico, Tinopal LPW, sobre la actividad insecticida del SeMNPV para larvas del segundo al quinto estadío de S. exigua. Cuando las larvas son infectadas con una suspensión de OBs a la que se añade Tinopal LPW al 1% (peso/volumen), el valor de la dosis letal media (DL50) del virus se reduce en todos los estadíos larvarios en comparación con los insectos que han sido tratados con OBs del SeMNPV sólo (Tabla 1). De esta manera se consigue mejorar la actividad insecticida, calculada con base en los valores de la DL50, entre 2,6 y 580 veces dependiendo del estadío larvario. La mejora más importante se consigue en el cuarto (70 veces) y quinto (580 veces) estadío, que muestran una menor susceptibilidad a la infección por el SeMNPV que los primeros estadíos (Murillo et al. 2003b). Se concluye, por tanto, que la incorporación de sustancias con actividad sinérgica puede aumentar de forma importante la utilidad del SeMNPV para el control de las plagas ocasionadas por S. exigua. Esto nos permite pensar en novedosas formulaciones que deben ser estudiadas más detalladamente para este sistema hospedero-baculovirus.
Control de calidad. Los bioinsecticidas basados en baculovirus deben satisfacer todas las condiciones de calidad exigibles a cualquier insecticida microbiano. El control de calidad, además de descartar la presencia de otros microorganismos contaminantes, incluidos otros genotipos virales no deseables en el producto, nos permitirá garantizar que las características genéticas y físicas del virus no se han visto alteradas durante su producción o almacenamiento y que la actividad insecticida del producto final es la esperada.
El número y tipo de microorganismos contaminantes en cada lote de virus producido no deben representar un riesgo para la salud humana o el ambiente. Se ha establecido que el número máximo de bacterias aerobias no debe exceder de las 108 colonias por gramo de producto y que debe estar libre de coliformes y bacterias patógenas para los humanos como por ejemplo las pertenecientes a los géneros Salmonella, Vibrio, Shigella, etc. (Shapiro 1986). El SeMNPV producido según el método descrito anteriormente puede mantenerse dentro de los límites aceptables de contaminantes, durante por lo menos 18 meses, cuando las condiciones de almacenamiento son entre -20 y 4ºC. En cambio, a temperatura ambiente tiene lugar una proliferación no admisible de microorganismos no deseables en tan solo unas pocas semanas (Lasa et al. 2008).
Los principales cambios genéticos que pueden alterar la capacidad insecticida del virus son: 1) la pérdida de genes importantes para la transmisión del virus, los cuales no son importantes para la producción en laboratorio, como los genes auxiliares de quitinasa y catepsina que son responsables de la desintegración del cadáver infectado dando lugar a la diseminación de los OBs, y 2) la generación de genotipos defectuosos, los cuales no tienen la capacidad de replicarse por sí mismos. Tanto estos cambios como la presencia de genotipos contaminantes, cuya presencia no es deseable en el producto técnico, se pueden detectar mediante análisis del genoma del virus con endonucleasas de restricción. Cuanto mayor sea nuestro conocimiento sobre las características moleculares del baculovirus en cuestión, podremos utilizar más y mejores marcadores moleculares para detectar posibles cambios en el ADN genómico durante la producción masiva del bioinsecticida. En el caso del SeMNPV se conoce la secuencia completa del genoma (Ijkel et al. 1999) y se ha determinado que las enzimas de restricción PstI y BglII son las que mejor permiten discriminar cambios en el genoma (Caballero et al. 1992b; Muñoz et al. 1999). La digestión del ADN genómico con las endonucleasas BglII y PstI produce perfiles de restricción característicos y únicos para cada uno de los genotipos conocidos del SeMNPV (Fig. 2). Por ejemplo, los fragmentos polimórficos generados por las enzimas BglII (BglII-A, BglII-H, BglII-J o K) o PstI (PstI-M) pueden utilizarse como marcadores moleculares para diferenciar entre dos o más genotipos.
Una diferenciación más precisa de cada uno de los genotipos, o la detección de posibles cambios que estos puedan experimentar durante su replicación, se obtiene empleando una combinación de la técnica basada en la reacción en cadena de la polimerasa (Polymerase Chain Reaction, PCR) junto con la digestión de los fragmentos amplificados por PCR con endonucleasas de restricción (Murillo et al. 2006b). El empleo de dos cebadores genéricos para todos los genotipos del SeMNPV permite amplificar una zona hipervariable del genoma comprendida en el fragmento de restricción PstI-M. La digestión de los fragmentos amplificados con BglII produce perfiles de restricción únicos para cada unos de los genotipos del SeMNPV (Fig. 2). Finalmente, la secuenciación de los nucleótidos del genoma completo, o de las regiones variables entre genotipos, es el método más preciso para detectar posibles alteraciones genéticas así como para proteger los derechos de patente a los que puedan estar acogidos determinados genotipos.
La actividad insecticida de un producto cualquiera se verifica por comparación de los valores de la DL50 y el tiempo letal medio (DL50) del producto en cuestión con los valores correspondientes a un producto estándar que se mantiene almacenado a -20ºC que es la temperatura a la cual la actividad insecticida de un producto se mantiene constante durante muchos años. Por ejemplo, el valor de la DL50 de un lote experimental del SeMNPV, producido según se ha descrito anteriormente, fue de 7,8 OBs/larva (+/- 6,1 a 10,0 OBs/larva) para larvas de segundo estadío de S. exigua. Este valor es estadísticamente similar al valor de 9,2 OBs/larva (+/- 7,3 a 11,7 OBs/larva) obtenido en una estimación previa de la actividad del SeMNPV para larvas del mismo estadío de S. exigua. Se consideró, por tanto, que el lote de virus reunía las condiciones de calidad necesarias para ser utilizado como agente de control en ensayos de campo (Lasa et al. 2008).
Eficacia en campo. La eficacia de las aplicaciones de baculovirus para el control de plagas depende de múltiples factores pero principalmente de la dosis aplicada, la susceptibilidad a la infección de cada uno de los estadíos del fitófago, la estructura poblacional de la plaga y la tasa de desactivación de los OBs sobre el filoplano del cultivo (Pinnock y Brand 1981). La proporción de la población del fitófago que adquiere una dosis letal de virus también está influenciada por la distribución de los depósitos de OBs, que a su vez depende de factores físicos como el volumen de aplicación, la formulación, el equipo de pulverización, las características de las boquillas y la propia estructura vegetativa del cultivo (Smits y Vlak 1988; Burges y Jones 1998). La probabilidad de que el insecto adquiera una infección depende asimismo del comportamiento alimentario de las larvas en los cultivos de invernadero por lo que normalmente se hacen tratamientos con volúmenes altos para asegurar la máxima cobertura del cultivo (Smits et al. 1987; Bianchi et al. 2000).
Para determinar la eficacia de un formulado sencillo del SeMNPV para el control de S. exigua se evaluaron el daño alimentario en pimiento dulce y la mortalidad larvaria de esta plaga después de dos aplicaciones del SeMNPV en once invernaderos comerciales de Almería (Lasa et al. 2007b). Los propietarios de los invernaderos participaron como voluntarios para evaluar la validez de un programa de control biológico contra S. exigua en la zona. A los agricultores se les suministraron botellas de polietileno de un litro, que contenían una suspensión acuosa con una concentración de 5×1011 OBs/ litro, para que aplicaran tratamientos con los equipos y prácticas que rutinariamente utilizan con los plaguicidas químicos. Se les recomendó una concentración de 5×108 OBs/litro de caldo aplicado y la incorporaran un agente mojante a una concentración final del 0,05% (vol/vol) y un acidificante para reducir el pH del caldo hasta un valor aproximado a 6,5. En cada invernadero se hicieron dos aplicaciones con un intervalo de entre siete y nueve días dependiendo de los agricultores y otras circunstancias. El número de plantas con daños fue evaluado en cada invernadero justo antes de la primera aplicación (día cero) y a los siete días después de cada aplicación.
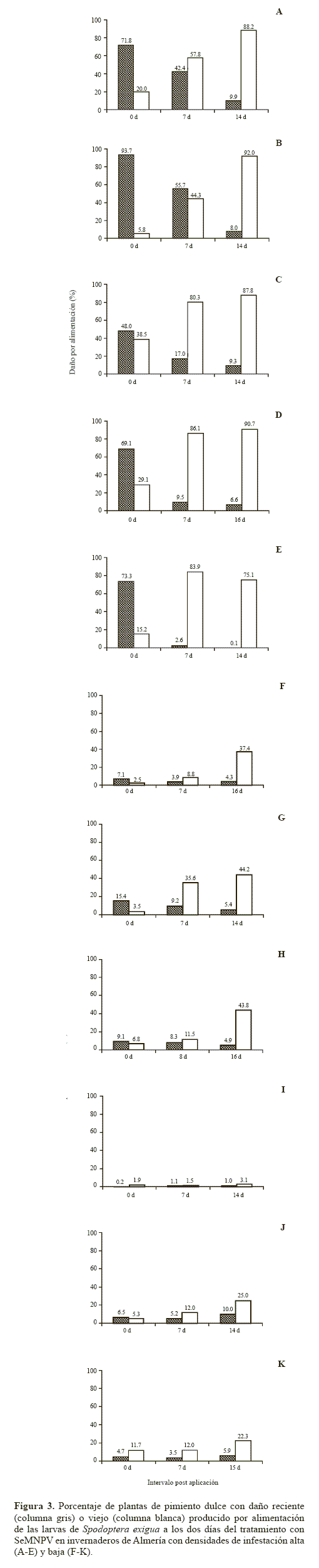
El daño de S. exigua fue clasificado como reciente si se había producido en las últimas 48 h o viejo si era de más de 48 h, para lo cual el criterio utilizado fue la ausencia o presencia, de un halo necrótico amarillento que rodea la parte dañada de la hoja.
La evaluación de daños en el día cero puso de manifiesto que en cinco de los invernaderos había inicialmente un alto porcentaje de plantas (45-94%) con daños recientes (Figs. 3A-E), mientras que, en los seis invernaderos restantes se encontró un bajo porcentaje de plantas (<16%) que exhibían daños recientes (Figs. 3F-K). En todos los invernaderos con un alto nivel de infestación de S. exigua el porcentaje de plantas con daños recientes descendió pronunciadamente, después de la aplicación de los dos tratamientos con el SeMNPV. Simultáneamente se observó un incremento del porcentaje de plantas que exhibían daños viejos (Figs. 3A-E). En los invernaderos con bajos niveles de infestación también se observó un descenso de los daños recientes y un aumento de los daños viejos, aunque el efecto no fue tan pronunciado como en los invernaderos con altas infestaciones (Figs. 3F-K) (Lasa et al. 2007b).
Aunque el modo de acción de los baculovirus hace que su tiempo letal sea más lento que el de la mayoría de los insecticidas químicos, nuestros resultados muestran que el porcentaje de plantas con daños recientes descendió de forma muy marcada después de la aplicación del SeMNPV en los invernaderos. Sin embargo, en el intervalo que transcurre entre el momento en que la larva ingiere una dosis letal de OBs y su muerte, las larvas continúan alimentándose y moviéndose en busca de alimento. Estudios previos indican que el 95% de la defoliación total de plantas de crisantemos la producen las larvas del cuarto y quinto estadío de S. exigua (Smits et al. 1987). Teniendo esto en cuenta, una clara ventaja sería dirigir los tratamientos contra los primeros estadíos larvarios para controlar la población antes de que lleguen a producir defoliaciones significativas. Los dos primeros estadíos larvarios causan un daño insignificante en el envés de las hojas por lo que suelen pasar desapercibidos para los agricultores hasta que las larvas alcanzan el tercer estadío (Smits et al. 1987). Una forma de detectar precozmente niveles de infestación significativos de los primeros estadíos es mediante la implantación de un sistema de seguimiento de la población adulta utilizando trampas de luz o de feromonas en cada invernadero.
Cuatro días después de cada aplicación del virus se recogieron al azar larvas que se encontraban sobre las plantas tratadas y fueron individualmente criadas en condiciones de laboratorio para determinar la mortalidad debida al virus. La mortalidad debida al virus estuvo entre 70 y 89% en todos los casos y no hubo diferencias significativas entre el primer y segundo tratamiento o entre invernaderos con alto o bajo nivel de infestación de S. exigua. El sistema de aplicación mediante una bomba de aspersión asistida por aire aseguró en todos los invernaderos una buena cobertura de la superficie foliar del cultivo por los depósitos del bioinsecticida. Las plantas de pimiento dulce tienen una densa masa foliar que facilita el depósito de las gotas de la aspersión y mejora la probabilidad de que las larvas adquieran pronto una dosis letal de OBs después de cada aplicación. La susceptibilidad de las larvas a la infección disminuye con la edad de las mismas pero esto es compensado por un mayor consumo de superficie foliar, y por tanto de OBs, en los últimos estadíos (Smits 1987). El bioinsecticida basado en el SeMNPV proporciona una excelente protección del cultivo, especialmente cuando se trata de controlar las poblaciones de alta densidad como las observadas en cinco de los once invernaderos en los que las medidas de control químico han fallado, aún cuando se utilizan modernas materias activas tales como spinosad, indoxacarb, flufenoxuron, lufenuron, tebufenozida y Bacillus thuringiensis solos o en cócteles de varios productos.
Estudios previos en los que se utilizó el SeMNPV en mezclas con un blanqueador óptico derivado del estilbeno con actividad sinérgica indican que las 48 primeras horas de alimentación por las larvas de S. exigua son claves para la adquisición de una infección letal (Lasa et al. 2007c). Por tanto, en un experimento separado, se evaluó el tiempo de adquisición de la infección por las larvas de S. exigua en dos concentraciones del virus sin el efecto confuso de una sustancia con actividad sinérgica. Dicha evaluación se realizó en siete invernaderos, cuatro de los cuales fueron tratados con una concentración de 5×108 OBs por litro de aspersión mientras que en los tres restantes la concentración de virus aplicada fue de 1×108 OBs por litro. En cada invernadero se recogieron al azar larvas que se encuentran sobre las plantas inmediatamente antes de la aplicación (tiempo cero) y a las seis, 24 y 48 horas después de haber sido tratadas. Estas larvas fueron criadas individualmente en condiciones de laboratorio para determinar su mortalidad debida a la infección por el SeMNPV. El porcentaje de larvas de S. exigua que adquirió una infección letal aumentó significativamente a medida que aumentó el intervalo desde la aplicación del tratamiento (Fig. 4). La probabilidad de adquirir una infección estuvo influenciada de forma significativa por la concentración de SeMNPV (Lasa et al. 2007c). En invernaderos tratados con 5×108 OBs/litro el porcentaje de infección fue del 60%, en larvas recogidas 48 horas después de haberse realizado el tratamiento, mientras que en invernaderos tratados con 1×108 OBs/litro el porcentaje de infección fue de sólo el 27% para ese mismo intervalo. Consecuentemente, se concluye que el porcentaje de la población de la plaga que adquiere una infección letal depende claramente de la concentración de virus aplicado. Aplicaciones de 3×1011 OBs/Ha de SeMNPV en cultivos de crisantemo dieron una mortalidad del 90% en los primeros estadíos de S. exigua (Smits et al. 1987; Bianchi et al. 2000) y proporcionaron un buen control de esta plaga en Tailandia en cultivos de tomates, pimientos, uvas, y garbanzos pero no en col china (Kolodny-Hirsch et al. 1997).
Conclusiones
Los resultados de los ensayos en los invernaderos de Almería demuestran que la utilización de un bioinsecticida basado en una cepa nativa del SeMNPV proporciona un excelente control de las poblaciones de S. exigua en los cultivos de pimiento dulce. Este bioinsecticida controla de un modo efectivo infestaciones que no pueden ser controladas por otros insecticidas comerciales. El número de insectos que adquieren una infección letal aumenta rápidamente en las seis horas siguientes a la aplicación de OBs y posteriormente aumenta hasta que el 80% de la población queda infectada a los cuatro días. La mayoría de los insectos infectados mueren entre los cinco y siete días después del tratamiento resultando en un excelente nivel de protección, especialmente cuando se hace una segunda aplicación siete días después de la primera. Actualmente se está llevando a cabo el registro de un formulado basado en el SeMNPV para su utilización como insecticida biológico microbiano para el control de S. exigua en los invernaderos del sur de España. El uso comercial de este bioinsecticida elimina la necesidad de utilizar insecticidas químicos de amplio espectro en los invernaderos, lo cual favorece en gran medida la posibilidad de incluir otros enemigos naturales como agentes de control, en programas de control integrado. La introducción de este bioinsecticida en los invernaderos de Almería, junto con otras circunstancias, ha hecho que se multiplique más de 15 veces la superficie de cultivos producidos bajo un régimen de control biológico, que en el año 2008 alcanzó las 23 mil Ha (Dr. Jan van der Blom, com. pers.). Los resultados de estas investigaciones y las experiencias altamente positivas con el SeMNPV en el sur de España pueden servir para ayudar a fomentar el desarrollo y registro de productos basados en el SeMNPV para el control de S. exigua en los cultivos de invernadero en Latinoamérica.
Agradecimientos
Esta revisión ha sido posible gracias a la financiación recibida de la Comisión Interministerial de Ciencia y Tecnología (CICYT) del Gobierno de España para llevar a cabo los proyectos AGL2002-04320-2-01 y AGL2005-07909-3-01.
Literatura citada
BARTELT, R. J.; MCGUIRE, M. R.; BLACK, D. A. 1990. Feeding stimulants for the european corn borner (Lepidoptera: Pyralidae): additives to starch-based formulation for Bacillus thuringiensis. Environmental Entomology 19: 182-189. [ Links ]
BELDA, J. E. 1994. Biología, ecología y control de Spodoptera exigua en cultivo de pimiento en invernadero. Tesis doctoral, Universidad de Almería, España. 223 p. [ Links ]
BELL, M. R.; KANAVEL, R. F. 1978. Tobacco budworm: development of a spray adjuvant to increase effectiveness of a nuclear polyhedrosis virus. Journal of Economic Entomology 71: 350-352. [ Links ]
BIANCHI, F. J.; SNOEIJING, I.; VAN DER WERF, W.; MANS, R. M.; SMITS, P. H.; VLAK, J. M. 2000. Biological activity of SeMNPV, AcMNPV, and three AcMNPV deletion mutants against Spodoptera exigua larvae (Lepidoptera: Noctuidae). Journal of Invertebrate Pathology 75: 28-35. [ Links ]
BURGES, H. D.; JONES, K. A. 1998. Formulation of bacteria, viruses and protozoa to control insects, pp. 33-127. En: Burges, H. D. (Ed.). Formulation of microbial biopesticides: Beneficial microorganisms, nematodes and seed treatments. Kluwer, Dordrecht, Países Bajos. 496 p. [ Links ]
CABALLERO, P.; ALDEBIS, H. K.; VARGAS-OSUNA E.; SANTIAGO- ÁLVAREZ, C. 1992a. Epizootics caused by a nuclear polyhedrosis virus in populations of Spodoptera exigua in southern Spain. Biocontrol Science and Technology 2: 35-38. [ Links ]
CABALLERO, P.; ZUIDEMA, D.; SANTIAGO-ÁLVAREZ, C.; VLAK, J. M. 1992b. Biochemical and biological characterization of four isolates of Spodoptera exigua nuclear polyhedrosis virus. Biocontrol Science and Technology 2: 145-157. [ Links ]
CABELLO, T. SAÉZ; GÓMEZ, V.; ABAD, M. M.; BELDA, J. J. 1990. Problemática fitosanitaria en cultivos hortícolas intensivos de Almería. Agrícola Vergel 104: 640-647. [ Links ]
CERTIS. 2009. Spod-X LC Biological insecticide product webpage. Disponible en: http://www.certisusa.com/products/spod-xlc- biological-insecticide.htm. Fecha última revisión: 02 marzo 2009. [ Links ]
CHERRY, A.; WILLIAMS, T. 2001. Control de insectos plaga mediante baculovirus, pp. 389-452. En: Caballero, P.; López- Ferber, M.; Williams, T. (Eds.). Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Phytoma-España, S. L., Valencia, España. p. 518. [ Links ]
CHERRY, A. J.; PARNELL, M. A.; GRZYWACZ, D.; JONES, K. A. 1997. The optimization of in vivo nuclear polyhedrosis virus production in Spodoptera exempta (Walker) and Spodoptera exigua (Hubner). Journal of Invertebrate Pathology 70: 50-58. [ Links ]
CUADRADO, I. M.; VIÑUELA, E. 1998. Resistencia a los Pesticidas en los Cultivos Hortícolas. Fundación para la Investigación Agraria en la Provincia de Almería, La Cañada, Almería, España. 212 p. [ Links ]
EUROPEAN COMMISSION. 2006. Annual EU-wide pesticide residues monitoring report. DG ealth and consumers, Bruselas, Bélgica. Disponible en: http://europa.eu.int/comm/food/fvo/specialreports/pesticides_index_en.htm. Fecha última revisión: 02 marzo 2009. [ Links ]
FUXA, J. R. 2004. Ecology of insect nucleopolyhedroviruses. Agriculture, Ecosystems and Environment 103: 27-43. [ Links ]
GRANADOS, R. R.; WILLIAMS, K. A. 1986. in vivo infection and replication of baculoviruses, pp. 89-127. En: Granados, R. R.; Federici, B. A. (Eds.). The biology of baculoviruses. Volumen I. CRC Press, Boca Raton, Florida. 275 p. [ Links ]
GRÖNER, A. 1986. Specificity and safety of baculoviruses, pp. 177-202. En: Granados, R. R.; Federici, B. A. (Eds.). The biology of baculoviruses. Volumen I. CRC Press, Boca Raton, Florida. 275 p. [ Links ]
HAMM, J. J. 1999. Interactions in entomology: enhanced infectivity of entomopathogenic viruses by fluorescent brighteners. Journal of Entomological Science 34: 8-16. [ Links ]
IJKEL, W. F.; VAN STRIEN, E. A.; HELDENS, J. G.; BROER, R.; ZUIDEMA, D.; GOLDBACH, R. W.; VLAK, J. M. 1999. Sequence and organization of the Spodoptera exigua multicapsid nucleopolyhedrovirus genome. Journal of General Virology 80: 3289-3304. [ Links ]
JAQUES, R. P. 1985. Stability of insect viruses in the environment, pp. 285-369. En: Maramorosch, K.; Sherman, K. E. (Eds.). Viral Insecticides for Biological Control. Academic Press, New York. p. 809. [ Links ]
JEHLE, J. A.; BLISSARD, G. W.; BONNING, B. C.; CORY, J. S.; HERNIOU, E. A.; ROHRMANN, G. F.; THEILMANN, D. A.; THIEM, S. M.; VLAK, J. M. 2006. On the classification and nomenclature of baculoviruses: a proposal for revision. Archives of Virology 151: 1257-1266. [ Links ]
JONES, K. A.; BURGES, H. D. 1998. Technology of formulation and application, pp. 7-30. En: Burges, H. D. (Ed.). Formulation of microbial biopesticides: beneficial microorganisms, nematodes and seed treatments. Kluwer, Dordrecht, Países Bajos. 496 p. [ Links ]
JUNTA DE ANDALUCÍA. 2006. Anuario de estadísticas agrarias y pesqueras del año 2006. Consejería de Agricultura y Pesca, Junta de Andalucía, España. Disponible en: http://www.juntadeandalucia.es/agriculturaypesca/portal/opencms/portal/DGPAgraria/Estadisticas/estadisticasagrarias?entrada=servicios&servicio=201 Fecha última revisión: 02 marzo 2009. [ Links ]
KILLICK, H. J.; WARDEN, S. J. 1991. Ultraviolet penetration of pine trees and insect virus survival. Entomophaga 36: 87-94. [ Links ]
KOLODNY-HIRSCH, D. M.; SITCHAWAT, T.; JANSARI, J.; CHENRCHAIVACHIRAKUL, A.; KETUNUTI, U. 1997. Field evaluation of a commercial formulation of the Spodoptera exigua (Lepidoptera: Noctuidae) nuclear polyhedrosis virus for control of beet armyworm on vegetable crops in Thailand. Biocontrol Science and Technology 7: 475-488. [ Links ]
LACASA, A. 2004. Manejo de plagas en el cultivo de pimiento en invernaderos mediterráneos, pp. 279-292). En: Fernández, J. M. (Ed.). Producción Hortícola y Seguridad Alimentaria. Ediciones Agrotecnológicas, Madrid, España. 432 p. [ Links ]
LARA, L.; URBANEJA, A. 2002. Control biológico de plagas en pimiento en la provincia de Almería. Horticultura 165: 86-90. [ Links ]
LASA-COVARRUBIAS, R. 2007. Formulation and efficacy of Spodoptera exigua nucleopolyhedrovirus as a biological insecticide for beet armyworm control in the greenhouses of southern Spain. Tesis doctoral, Departamento de Producción Agraria, Universidad Pública de Navarra, Pamplona, España. [ Links ]
LASA, R.; CABALLERO, P.; WILLIAMS, T. 2007a. Juvenil hormone analogs greatly increase the production of a nucleopolyhedrosis. Biological Control 41: 389-396. [ Links ]
LASA, R.; PAGOLA, I.; IBAÑEZ, I.; BELDA, J. E.; WILLIAMS, T.; CABALLERO, P. 2007b. Efficacy of Spodoptera exigua multiple nucleopolyhedrovirus as a biological insecticide for beet armyworm control in greenhouses of southern Spain. Biocontrol Science and Technology 17: 221-232. [ Links ]
LASA, R.; RUIZ-PORTERO, C.; ALCÁZAR, D.; BELDA, J. E.; CABALLERO, P.; WILLIAMS, T. 2007c. Efficacy of optical brightener formulations of Spodoptera exigua multiple nucleopolyhedrovirus (SeMNPV) as a biological insecticide in greenhouses in southern Spain. Biological Control 40: 89- 96. [ Links ]
LASA, R.; WILLIAMS, T.; CABALLERO, P. 2008. Insecticidal properties and microbial contaminants in Spodoptera exigua nuclopolyhedrovirus (Baculoviridae) stored at different temperatures. Journal of Economic Entomology 101: 42-49. [ Links ]
MASCARENHAS, V. J.; GRAVES, J. B.; LEONARD, B. R.; BURRIS, E. 1998. Susceptibility of field populations of beet armyworm (Lepidoptera: Noctuidae) to commercial and experimental insecticides. Journal of Economic Entomology 91: 827-833. [ Links ]
MOSCARDI, F. 1999. Assessment of the application of baculoviruses for control of Lepidoptera. Annual Review of Entomology 44: 257-289. [ Links ]
MOULTON, J. K.; PEPPER, D. A.; DENNEHY, J.; DUGGER, P.; RICHTER, D. 1999. Studies of resistance of beet armyworm (Spodoptera exigua) to spinosad in field populations from the southern USA and southeast Asia. Proceedings of the Beltwide Cotton Conferences. Orlando, Florida 2: 884-887. [ Links ]
MOULTON, J. K.; PEPPER, D. A.; JANSSON, R. K.; DENNEHY, T. J. 2002. Pro-active management of beet armyworm (Lepidoptera: Noctuidae) resistance to tebufenozide and methoxyfenozide: baseline monitoring risk assessment, and isolation of resistance. Journal of Economic Entomology 95: 414-424. [ Links ]
MUÑOZ, D.; CABALLERO, P. 2000. Persistence and effects of parasitic genotypes in a mixed population of the Spodoptera exigua nucleopolyhedrovirus. Biological Control 19: 259-264. [ Links ]
MUÑOZ, D.; CABALLERO, P. 2001. Diversidad natural de los baculovirus, pp. 95-118. En: Caballero, P.; López-Ferber, M.; Williams, T. (Eds.). Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Phytoma-España, Valencia, España. 518 p. [ Links ]
MUÑOZ, D.; CASTILLEJO, J. I.; CABALLERO, P. 1998. Naturally occurring deletion mutants are parasitic genotypes in a wildtype nucleopolyhedrovirus population of Spodoptera exigua. Applied and Environmental Microbiology 64: 4372-4377. [ Links ]
MUÑOZ, D.; MURILLO, R.; KRELL, P. J.; VLAK, J. M.; CABALLERO, P. 1999. Four genotypic variants of a Spodoptera exigua nucleopolyhedrovirus (Se-SP2) are distinguishable by a hypervariable genomic region. Virus Research 59: 61-74. [ Links ]
MURILLO, R.; MUÑOZ, D.; CABALLERO, P. 2003a. Host range and biological activity of three Spodoptera nucleopolyhedrovirus genotypic variants and the effect of Tinopal LPW on the most active variant. International Journal of Pest Management 49: 147-153. [ Links ]
MURILLO, R.; LASA, R.; GOULSON, D.; WILLIAMS, T.; MUÑOZ, D.; CABALLERO, P. 2003b. Effect of Tinopal LPW on the insecticidal properties and genetic stability of the nucleopolyhedrovirus of Spodoptera exigua (Lepidoptera: Noctuidae). Journal of Economic Entomology 96: 1668-1674. [ Links ]
MURILLO, R.; ELVIRA, S.; MUÑOZ, D.; WILLIAMS, T.; CABALLERO, P. 2006a. Genetic and phenotypic variability in Spodoptera exigua nucleopolyhedrovirus isolates from greenhouse soils in southern Spain. Biological Control 38: 157-165. [ Links ]
MURILLO, R.; MUÑOZ, D.; WILLIAMS, T.; MUGETA, N.; CABALLERO, P. 2006b. Application of the PCR-RFLP method for the rapid differentiation of Spodoptera exigua nucleopolyhedrovirus genotypes. Journal of Virological Methods 135: 1-8. [ Links ]
MURILLO, R.; RUIZ-PORTERO, C.; ALCÁZAR, D.; BELDA, J. E.; WILLIAMS, T.; CABALLERO, P. 2007. Abundance and genetic structure of nucleopolyhedrovirus populations in greenhouse soil reservoirs. Biological Control 42: 216-552. [ Links ]
PINNOCK, D. E.; BRAND, J. R. 1981. A quantitative approach to the ecology of the use of pathogens for insect control, pp. 655-665. En: Burges, H. D. (Ed.). Microbial Control of Pests and Diseases. Academic Press, New York. 949 p. [ Links ]
RODGERS, P, B. 1993. Potential of biopesticides in agriculture. Pesticide Science 39: 117-129. [ Links ]
SHAPIRO, M. 1986. in vivo production of baculovirus, pp. 31-62. En: Granados, R. R.; Federici, B. A. (Eds.). The Biology of Baculoviruses. CRC Press, Boca Raton, Florida. 1424 p. [ Links ]
SHAPIRO, M.; ROBERTSON, J. L. 1992. Enhancement of gypsy moth (Lepidoptera: Lymantriidae) baculovirus activity by optical brighteners. Journal of Economic Entomology 85: 1120-1124. [ Links ]
SMAGGHE, G.; AUDA, M.; VANLAECKE, K.; DEGHEELE, D. 1997. Significance of penetration and metabolism on topical toxicity of diflubenzuron in Spodoptera littoralis and Spodoptera exigua. Entomologia Experimentalis et Applicata 82: 255-260. [ Links ]
SMAGGHE, G.; PINEDA, S.; CARTON, B.; DEL ESTAL, P.; BUDIA, F.; VIÑUELA, E. 2003. Toxicity and kinetics of methoxyfenozide in greenhouse-selected Spodoptera exigua (Lepidoptera: Noctuidae). Pest Management Science 59: 1203-1209. [ Links ]
SMITS, P. H. 1987. Nuclear polyhedrosis virus as biological control agent of Spodoptera exigua., Tesis doctoral, Wageningen Agricultural University, Wageningen, Países Bajos. [ Links ]
SMITS, P. H.; VLAK, J. M. 1988. Biological activity of Spodoptera exigua nuclear polyhedrosis virus against S. exigua larvae. Journal of Invertebrate Pathology 51: 107-114. [ Links ]
SMITS, P. H.; VLAK. J. M. 1994. Registration of the first viral insecticide in the Netherlands: the development of Spod-X based on Spodoptera exigua nuclear polyhedrosis virus. Mededelingen Faculteit Landbouwkundige en Toegepaste Biologische Wetenschappen Universiteit Gent 59/2A: 385-392. [ Links ]
SMITS, P. H.; VAN DE VRIE, M.; VLAK, J. M. 1987. Nuclear polyhedrosis virus for control of Spodoptera exigua larvae in glasshouse crops. Entomologia Experimentalis et Applicata 43: 73-80. [ Links ]
STANSLY, P. A.; CALVO, F. J.; URBANEJA, A. 2005. Augmentative biological control of Bemisia tabaci biotype "Q" in Spanish greenhouse pepper production using Eretmocerus spp. Crop Protection 24: 829-835. [ Links ]
TORRES-VILA, L. M.; RODRIGUES MOLINA, M. C.; LACASA, A.; PALO, E.; MEJÍAS, M.; GUERRERO, M. 1998. Susceptibilidad de 20 insecticidas de Helicoverpa armigera y Spodoptera exigua en la vega del Guadiana (Extremadura). Boletín de Sanidad Vegetal Plagas 24: 353-362. [ Links ]
THEILMANN, D. A.; BLISSARD, G. W.; BONNING, B.; JEHLE, J. A.; O'REILLY, D. R.; ROHRMANN, G. F.; THIEM, S.; VLAK, J. M. 2005. Baculoviridae, pp. 177-185. En: Fauquet, C. M.; Mayo, M. A.; Maniloff, J.; Desselberger, U.; Ball, L. A. (Eds.). Eighth Report of the International Committee on Taxonomy of Viruses, Elsevier, San Diego, California. 1259 p. [ Links ]
WANG, P.; GRANADOS, R. R. 2000. Calcofluor disrupts the midgut defense system in insects. Insect Biochemistry and Molecular Biology 30: 135-143. [ Links ]
WILLIAMS, T.; CISNEROS, J. 2001. Formulación y aplicación de los baculovirus bioinsecticidas, pp. 313-372. En: Caballero, P.; López-Ferber, M.; Williams, T. (Eds.). Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Phytoma-España, S. L., Valencia, España 518 p. [ Links ]