Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.2 Bogotá July/Dec. 2009
Efecto del pH y de la actividad de agua sobre el desarrollo de Nomuraea rileyi (Hyphomycetes)
Effect of pH and water activity over Nomuraea rileyi (Hyphomycetes) development
Natalia Aguirre1, Laura Villamizar R.2, Carlos Espinel C.3 y Alba Marina Cotes P.4
1 Microbióloga Industrial. naguita2001@yahoo.com
2 Investigadora. D. Sc. Ciencias Farmacéuticas. Corpoica. A.A 240142 Parque Central Bavaria Las Palmas, Bogotá, D.C. lvillamizar@corpoica.org.co Autor para correspondencia.
3 Investigador. M. Sc. Entomología. Corpoica. A.A. 240142 Parque Central Bavaria Las Palmas, Bogotá, D.C. cespinelc@corpoica.org.co.
4 Investigadora. Ph. D. Fitopatología. Corpoica. A.A. 240142 Parque Central Bavaria Las Palmas, Bogotá, D.C. amcotes@corpoica.org.co.
Recibido: 29-ene-2007 - Aceptado: 11-sep-2009
Resumen: El gusano cogollero del maíz Spodoptera frugiperda causa importantes pérdidas económicas en cultivos de maíz, sorgo y algodón. Una alternativa de control es el uso del hongo entomopatógeno Nomuraea rileyi que causa epizootias naturales en campo. En el laboratorio de Control Biológico de Corpoica se desarrollaron dos micoinsecticidas a base de un aislamiento nativo de este hongo, formulados como un concentrado emulsionable y un granulado dispersable. La actividad insecticida de los productos fue significativamente menor a la obtenida con el hongo sin formular, posiblemente por un efecto de la formulación, considerando la susceptibilidad de este hongo a factores abióticos. Por tal razón, el objetivo del presente trabajo fue evaluar el efecto del pH y de la actividad de agua (Aw) sobre la germinación, esporulación, crecimiento diametral y actividad insecticida de N. rileyi. Estos parámetros se evaluaron utilizando medio de cultivo YM ajustado a valores de pH de 4 a 9 y a valores de Aw de 0.950 a 0.998. Los resultados mostraron que tanto el desarrollo como la actividad insecticida del microorganismo se vieron afectados por el pH, obteniéndose los mejores resultados dentro del rango de pH de 5 a 7. El microorganismo necesitó altos valores de Aw (> 0.99) para germinar, crecer, esporular y desarrollar la infección en el insecto. Los resultados permitirán optimizar las formulaciones, ajustando condiciones más adecuadas para el desarrollo y la eficacia del microorganismo.
Palabras clave: Micoinsecticida. Entomopatógeno.
Abstract: The armyworm Spodoptera frugiperda causes important economical losses in corn, cotton and sorghum crops. An alternative for its control is the use of the entomopathogenic fungus Nomuraea rileyi, which causes natural epizootics in the field. At the Biological Control Laboratory of Corpoica, two mycopesticides were developed based on a native isolate of this fungus, formulated as an emulsifiable concentrate and as a dispersible granule. The insecticidal activity of the products was significantly lower than that obtained with the unformulated fungus, possibly due to the formulation, considering the high susceptibility of this fungus to abiotic factors. For this reason, the main objective of the present work was to evaluate the effect of pH and water activity (WA) on the germination, sporulation, radial growth and insecticidal activity of N. rileyi. These parameters were evaluated by using YM culture media adjusted to pH values from 4 to 9 and WA values from 0.950 to 0.998. Results showed that both development and insecticidal activity of the microorganism were affected by pH, the best results being obtained with a pH range from 5 to 7. The microorganism needed high values of WA (> 0.99) for germinating, growing and developing an infection in the insect. Results will allow the optimization of formulations, adjusting to the most adequate conditions for development and efficacy of the microorganism.
Key words: Mycoinsecticide. Entomopathogen.
Introducción
El “gusano cogollero del maíz” Spodoptera frugiperda (J.E. Smith, 1797) (Lepidoptera: Noctuidae) es considerado la plaga más importante del cultivo de maíz en muchas regiones de América, incluyendo Colombia, donde este insecto afecta además del maíz, cultivos como sorgo, arroz, caña de azúcar, algodón y pastos (García et al. 2002). El control químico es el método comúnmente empleado para su control, utilizándose en muchas ocasiones por parte de los agricultores, el doble o triple de las dosis recomendadas (García y del Pozo 1999). Una alternativa promisoria para el control de esta plaga es el uso de hongos entomopatógenos como Metarhizium spp., Beauveria spp., Lecanicillium spp. y Nomuraea rileyi (Farlow) Samson, 1974 , los cuales actúan por contacto, invaden el cuerpo del insecto y causan su muerte (Villamizar et al. 2004). Su uso presenta varias ventajas frente a los insecticidas químicos, debido a que su espectro de acción es menor, su producción masiva puede realizarse sobre sustratos económicos y su aplicación en campo no representa riesgo toxicológico para otros seres vivos como aves, peces y mamíferos (Bosa et al. 2004). Nomuraea rileyi es un hongo imperfecto y dimórfico de crecimiento lento que ataca con gran especificidad los lepidópteros de la familia Noctuidae. Es altamente sensible a las condiciones nutricionales y ambientales comparado con otros hongos entomopatógenos, lo que limita su producción masiva y formulación (Trumper et al. 2004).
En el laboratorio de Control Biológico de Corpoica, se ha trabajado en los últimos años en el desarrollo de un micoinsecticida a base de este microorganismo. Mediante bioensayos con varios aislamientos se seleccionó un aislamiento de N. rileyi producido en larvas de S. frugiperda con un porcentaje de mortalidad del 100% y los menores tiempos letales TL50 y TL90 que correspondieron a 6,2 y 7,9 días, respectivamente. Posteriormente se determinaron las concentraciones letales (CL) para este aislamiento, obteniéndose una Cl50 de 9,8x103 conidios.mL-1 y una CL90 de 2,2x105 conidios.mL-1 (Bosa et al. 2004).
masiva de conidios mediante fermentación sólida, con un rendimiento de 3,0x108 conidios.g-1. A partir de los conidios se desarrollaron dos sistemas de entrega para el micoinsecticida, un concentrado emulsionable con una concentración de 1x1011conidios.g-1 y un granulado dispersable con una concentración de 1x109 conidios.g-1, con germinaciones del 92% y 87% y una actividad insecticida del 64% y 31% respectivamente. Las dos formulaciones afectaron negativamente la actividad insecticida del microorganismo posiblemente debido al proceso de formulación, puesto que el hongo sin formular presentó un porcentaje de mortalidad del 95% (Villamizar et al. 2004).
Debido a la disminución en la actividad insecticida se inició una etapa de optimización del producto ajustando la composición del mismo, las operaciones unitarias del proceso y evaluando el comportamiento ecofisiológico del microorganismo con miras a brindarle al hongo, las condiciones óptimas de desarrollo durante su producción masiva y cuando se encuentre formulado. Dentro de dicha caracterización ecofisiológica, el presente estudio pretendió evaluar el efecto del pH y el Aw sobre el crecimiento, esporulación y actividad insecticida del hongo.
Materiales y Métodos
Se utilizó el aislamiento de N. rileyi codificado como Nm006, aislado de larvas de S. frugiperda infectadas naturalmente en campo. El hongo se encuentra crioconservado en el Banco de Germoplasma de Microorganismos del Laboratorio de Control Biológico de Corpoica, y los subcultivos se realizaron en agar Extracto de Levadura - Extracto de Malta (YM) ajustado a pH 5,5 y Aw 0.998.
Efecto del pH
Se evaluaron seis valores de pH: 4, 5, 6, 7, 8 y 9, los cuales se ajustaron en medio YM. Se prepararon 20 cajas de Petri con cada tratamiento y se evaluaron los parámetros: germinación, crecimiento diametral, esporulación y eficacia.
Para la germinación se tomaron 0,1 g de conidios de un cultivo puro de ocho días de edad y se llevaron a un volumen de 10 mL con Tween 80 al 0,1%. A partir de esta suspensión se realizó una dilución decimal y las dos diluciones se sembraron por triplicado en las cajas de Petri con medio YM ajustado a cada valor de pH en evaluación. Las cajas se incubaron a 23ºC y transcurridas 24, 32 y 41 horas de incubación se cortaron tres fragmentos de un cm2 de medio de cada tratamiento y se les agregó una gota de azul de lactofenol. Se evaluaron 10 campos ópticos seleccionados aleatoriamente de cada fragmento de agar, los cuales fueron fotografiados en un microscopio con una cámara digital Nikon Coolpix 995 8,4 v-0,94 con aumento de 5,1X. En cada imagen se determinó el porcentaje de conidios germinados evaluando una población de 100 conidios por unidad experimental (caja de Petri) (García et al. 2007a). El diseño experimental fue completamente al azar con medidas repetidas en el tiempo. Las imágenes además fueron procesadas con el programa Image J, con el cual se determinó el área de 30 conidios germinados, expresada como pixeles.cm-2. Mediante un análisis de regresión se estableció si estas áreas se ajustaron a una cinética de primera orden, representada por la ecuación:
Log A = 2,303 log Ao + kt (Ecuación 1)
Donde, A: área del conidio al tiempo t Ao: área del conidio sin germinar k: velocidad de elongación del tubo germinal (pendiente) t: tiempo
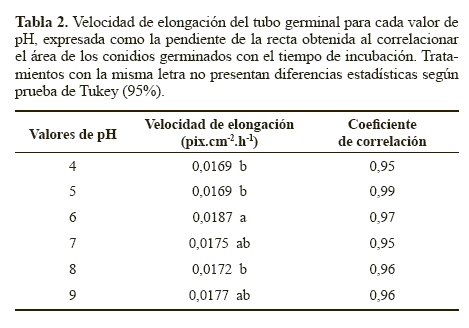
Las pendientes de las rectas, correspondientes a la velocidad de elongación del tubo germinal, fueron comparadas mediante un análisis de varianza (ANAVA) y una prueba de comparación múltiple de medias de Tukey (95%).
Crecimiento diametral. Se utilizaron tres cajas de Petri con medio ym ajustado a cada valor de ph. Con un sacabocados de cinco mm de diámetro, se extrajo un disco del medio de cultivo, de la parte central de la caja. posteriormente, éste se reemplazó por un trozo de agar del mismo tamaño crecido con el hongo, de ocho días de edad. a los tres, seis, nueve y 12 días de incubación, se midió con un calibrador el diámetro de la colonia (garcía et al. 2007b). el diseño experimental fue completamente al azar con medidas repetidas en el tiempo y tres repeticiones por tratamiento.
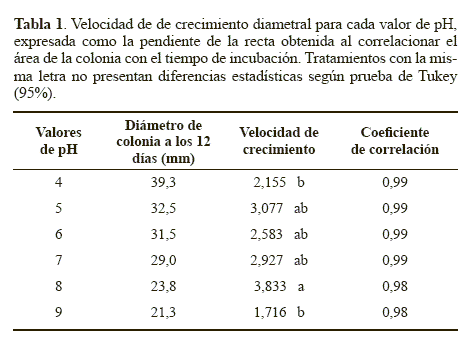
Los diámetros obtenidos en los diferentes tiempos fueron sometidos a un análisis de regresión, obteniéndose coeficientes de correlación >0,98 para todos los tratamientos (Tabla 1), los cuales sugirieron una correlación lineal entre el diámetro de la colonia y el tiempo de incubación, siguiendo una cinética de orden cero representada por la ecuación 2:
D = Do +kt (Ecuación 2)
Donde,
D: diámetro de la colonia al tiempo
t t: tiempo
Do: diámetro inicial de la colonia
k: velocidad de crecimiento diametral (pendiente)
Las pendientes de las rectas de cada tratamiento, correspondientes a velocidad del crecimiento diametral del hongo, fueron sometidas a un ANAVA y una prueba de comparación de medias de Tukey (95%).
Esporulación. Se preparó una suspensión de conidios ajustada a una concentración de 106 conidios.mL-1, a partir de un cultivo del hongo de ocho días de edad. Posteriormente, se sembraron por triplicado 100 μL de dicha suspensión en cajas de Petri con cada uno de los tratamientos y se incubaron a 23ºC. La lectura se realizó después de 12 días de incubación. Para ello se tomaron tres muestras de un cm2 del medio de cultivo de cada unidad experimental. Los tres fragmentos se llevaron a un volumen de 10 mL con Tween 80 al 0,1% y se realizaron diluciones decimales. Posteriormente, se evaluó la concentración de conidios por mL mediante recuento en cámara de Neubauer (BOECO 1/10 mm) y el resultado se expresó como conidios.cm2 (García et al. 2007b). Cada evaluación se realizó por triplicado, utilizando tres unidades experimentales (caja de Petri) por tratamiento y el diseño experimental fue completamente al azar.
Eficacia. Se realizó un bioensayo bajo condiciones de laboratorio a 25ºC y a 70% humedad relativa. El hongo fue cultivado en agar YM durante ocho días. El cultivo se utilizó para preparar las suspensiones de conidios correspondientes a cada tratamiento (valores de pH). Los conidios se suspendie ron en soluciones de Tween 80 al 0,1% ajustadas a los valores de pH 4, 5, 6, 7, 8 y 9. La concentración de conidios se ajustó a la CL90 previamente determinada para este aislamiento y correspondiente a 1x106 conidios.mL-1 (Bosa et al. 2004). Un volumen de 1,2 mL de cada tratamiento se aplicó por aspersión en el haz y en el envés de 30 hojas de higuerilla (Ricinus communis L., 1753), previamente desinfectadas en una solución de hipoclorito de sodio al 0,5%. En el fondo de cubetas plásticas de 16 onzas se colocó una servilleta húmeda estéril, una hoja de higuerilla inoculada y una larva de segundo ínstar de S. frugiperda, proveniente de una cría mantenida en el Laboratorio de Control Biológico de Corpoica. Los insectos se mantuvieron bajo condiciones controladas a 25ºC y 55% de humedad relativa. El diseño fue completamente al azar, cada recipiente constituyó una unidad experimental y se utilizaron treinta repeticiones por tratamiento. Para el testigo absoluto se utilizaron hojas desinfectadas sin ninguna aplicación y para el testigo tratado las hojas se asperjaron con Tween 80 al 0,1%. El registro de mortalidad se realizó cada dos días desde el cuarto día posterior al montaje del bioensayo y hasta obtener el 100% de mortalidad en alguno de los tratamientos. Las larvas muertas se colocaron en cámaras húmedas para confirmar la infección fúngica.
Se calculó el porcentaje de eficacia mediante la fórmula de Abbott (Abbott 1925):
% Eficacia = (b - k /100 - k) x 100 (Ecuación 3)
Donde,
b: % individuos muertos en el tratamiento
k: % individuos muertos en el testigo
Los resultados se analizaron mediante un ANAVA y una comparación de Diferencias Mínimas Significativas (95%).
Efecto de la actividad de agua (Aw)
Para evaluar el efecto de la actividad de agua sobre el desarrollo del hongo se preparó el medio YM al cual se le adicionaron diferentes concentraciones de glicerol para modificar el Aw. Se utilizaron: 2,67; 15,85; 31,70; 43,59 y 55,48 g.L-1 de glicerol, para obtener valores de actividad de agua de 0,990; 0,980; 0,970; 0,960 y 0,950 respectivamente (Hallsworth y Magan 1997) los cuales fueron ajustados con un termoconstanter Novasina R1 SM. Como tratamiento control se utilizó el medio YM sin glicerol el cual tuvo una actividad de agua de 0,998. Se prepararon 30 cajas de Petri para cada tratamiento y se evaluó el porcentaje de conidios germinados, el crecimiento diametral, la esporulación y la eficacia siguiendo las metodologías previamente descritas.
Para el determinar la velocidad de elongación del tubo germinal, se analizó el área de los conidios como se mencionó previamente para el efecto del pH. La correlación lineal entre el área de los conidios germinados y el tiempo de evaluación, en este caso presentó una cinética de orden cero, representada por la ecuación:
A = Ao + kt (Ecuación 4)
Donde, A: área del conidio germinado al tiempo t
Ao: área de un conidio sin germinar
k: velocidad de elongación del tubo germinal (pendiente)
t: tiempo
El crecimiento de las colonias con respecto al tiempo se ajustó entonces a una cinética de orden cero, representada por la ecuación 2.
El hongo se cultivó en medio YM durante ocho días y los conidios producidos se suspendieron en soluciones de Tween 80 al 0,1% ajustadas a valores de Aw de 0.998; 0.990; 0.980; 0.970; 0.060 y 0.950, con una concentración final de 1x106 conidios.mL-1. El tratamiento control consistió en una suspensión de conidios en solución de Tween 80 al 0,1% sin glicerol. Con estas suspensiones se llevó a cabo el bioensayo siguiendo la metodología descrita previamente.
Resultados y Discusión
Efecto del pH
Germinación. El hongo germinó rápidamente en todos los valores de pH superiores al 95%. El análisis de varianza ANAVA no detectó diferencias estadísticas (P > 0,05) entre las germinaciones, indicando que el potencial de iones hidronio entre el rango de 4 a 9 no tuvo un efecto significativo en la germinación de N. rileyi Nm006. Dicho resultado sugiere que dentro de este rango no hay un valor óptimo para dicho proceso fisiológico; por el contrario, para un gran número de hongos se define un valor exacto o un estrecho intervalo de pH óptimo para la germinación (Moore 1996), por lo general de carácter ácido, como lo describió Sautour et al. (2001) para los conidios de Penicillium chrysogenum (Thom., 1910), cuyo pH óptimo está en el rango de 3,5 a 6,5.
De otra parte, como otra variable de evaluación, a las 0, 24 y 41 horas de incubación se midió el área de los conidios germinados en cada uno de los valores de pH, lo que permitió estimar la velocidad de elongación del tubo germinal (Tabla 2). Para esta variable, la comparación de medias de Tukey detectó diferencias estadísticas en las velocidades de elongación del tubo germinal obtenidas con los tratamientos. La mayor velocidad de crecimiento se obtuvo con el pH 6, aunque no fue estadísticamente diferente de la velocidad obtenida a pH 7 y 9, pero si fue estadísticamente superior (P < 0.05) a las obtenidas con los valores de pH 4, 5 y 8 (Tabla 2). Esta mayor velocidad de elongación del tubo germinal sugiere que este factor si tuvo un efecto sobre la velocidad de crecimiento apical después de la germinación. Este resultado coincide con lo reportado por García y Del Pozo (1999), quienes determinaron que el pH óptimo para el crecimiento de N. rileyi se encuentra entre 5 y 8. Sin embargo, el hongo presentó crecimiento en todos los valores de pH, lo que coincide con lo descrito por Hallsworth y Magan (1997) quienes mencionan el amplio rango de pH (entre 2,9 y 11,1) en el cual pueden crecer hongos entomopatógenos como Metarhizium flavoviride Gams, Roszypal, 1973, M. anisopliae (Metschnikoff), Paecilomyces farinosus (Holmsk.) A.H.S.Br. & Sm., 1957 y Beauveria bassiana (Balsamo Vuillemin).
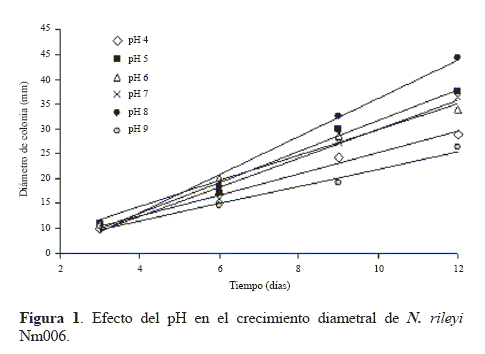
Crecimiento diametral. El comportamiento de los diámetros de colonia obtenidos cuando el hongo se cultivó en medio YM ajustado a diferentes valores de pH se observan en la Figura 1. Los diámetros finales de las colonias después de 12 días oscilaron entre 21,3 y 39,3 mm para todos los tratamientos y se presentan en la tabla 1. La mayor velocidad de crecimiento de la colonia se obtuvo dentro del rango de pH entre 5 y 8 (Tabla 1), siendo estadísticamente inferior (P < 0.05) cuando el pH se ajustó a los valores de 4 y 9. Este resultado sugiere que el crecimiento de la colonia de N. rileyi Nm006 se reduce cuando el valor de pH se torna muy ácido o muy básico, siendo recomendables valores de pH más cercanos a la neutralidad.
El crecimiento de N. rileyi Nm006 en el amplio rango de pH evaluado y la mayor velocidad de crecimiento a pH 8, el cual es ligeramente alcalino con respecto a lo normalmente reportado como óptimo para este hongo, podrían estar relacionados con las características propias de esta cepa, la cual podría tener proteínas reguladoras de pH, como el factor de transcripción PacC. Este factor activa la expresión de genes implicados en la regulación del pH en Aspergillus nidulans (G. Winter, 1884) cuando crece en un medio alcalino y en el caso contrario, reprime la expresión de estos genes en un medio ácido. La presencia de esta proteína ha sido descrita en otros hongos como las levaduras Saccharomyces cerevisiae Meyen ex E.C.Hansen y Candida albicans (C.P. Robin) Berkhout, 1923 (Mingot et al. 2001).
Esporulación. Cuando se evaluó el efecto del pH sobre la producción de conidios de N. rileyi Nm006 se obtuvieron rendimientos que oscilaron entre 7,53 x 105 conidios.cm-2 y 4.60 x 106 conidios.cm-2 (Tabla 3), no encontrándose diferencias estadísticas entre los tratamientos (P > 0.05). Este resultado indica que el pH no tuvo un efecto significativo en el proceso de conidiación. Sin embargo, la mayor esporulación del microorganismo se obtuvo a pH 6, condición en la que también se obtuvo la mayor velocidad de elongación del tubo germinal, sugiriendo que este valor de pH favorece el desarrollo del microorganismo.
La conidiación implica la diferenciación del compartimento apical en una estructura reproductiva especializada llamada fiálide, la cual experimenta divisiones mitóticas que permiten la producción del conidio. Este evento está regulado por diferentes estímulos ambientales que inducen la expresión de más de 80 genes implicados (Roncal et al. 2002; Roncal y Ugalde 2003), algunos de los cuales podrían ser inducidos por cambios en el pH. Sin embargo, en el presente estudio no se observó un efecto significativo de este factor sobre la esporulación de N. rileyi Nm006.
Los resultados permiten sugerir que para la inducción de la germinación, el crecimiento y la esporulación de N. rileyi Nm006, el rango de pH óptimo debe estar entre 5 y 8, siendo posiblemente un pH de 6 el más adecuado.
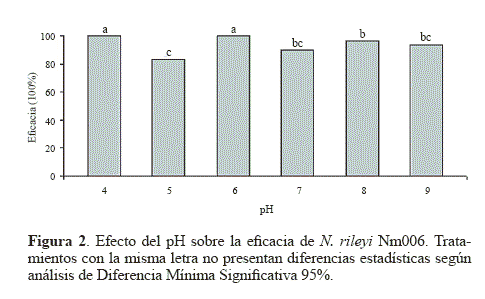
Eficacia. Los porcentajes de eficacia oscilaron entre el 83,33% y el 100% (Fig. 2), siendo los valores obtenidos a pH 4 y 6 estadísticamente superiores (P < 0.05). Este comportamiento podría deberse a que la actividad óptima de las proteasas Pr1 y Pr2, enzimas producidas por varios entomopatógenos para penetrar la cutícula del hospedero, es óptima a pH cercano a la neutralidad, disminuye a pH por debajo de 5 y se inhibe totalmente a pH 3. Además, luego de la degradación de las proteínas de la cutícula, el microorganismo produce quitinasas cuyo pH óptimo está entre 5 y 8 (St. Leger et al. 1998).
Los resultados sugieren que posiblemente este valor de 6 en pH permitió una adecuada actividad de las enzimas con actividad proteasa y quitinasa involucradas en los eventos de penetración del insecto. Además, se observó una mayor velocidad en la elongación del tubo germinal, que podría permitir que el apresorio se formara más rápido sobre la cutícula del hospedero y el proceso de penetración también iniciara en menos tiempo que con los otros tratamientos, lo que generaría mayores porcentajes de mortalidad.
Efecto de la actividad de agua (Aw)
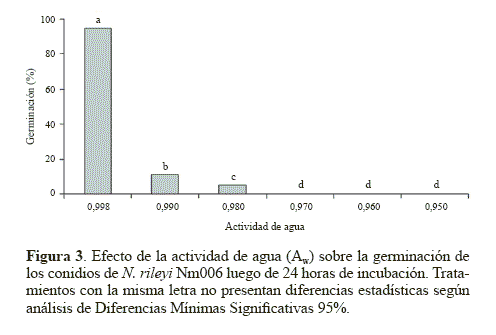
Germinación. El hongo germinó rápidamente en el tratamiento control (Aw 0.998) con un 95,7% de germinación a las 24 horas de incubación. Para las actividades de agua de 0.990; 0.980; 0.970; 0.960 y 0.950 se obtuvieron porcentajes de germinación del 11,3%, 5,2%, 0%, 0% y 0%, respectivamente a las 24 horas de incubación (Fig. 3). La germinación obtenida en el medio YM sin glicerol fue estadísticamente superior (P < 0.05), Al reducir el Aw del medio de 0.998 a 0.990 se produjo un efecto drástico en la germinación del microorganismo, la cual se redujo siete veces. Este resultado sugiere que un mínimo cambio en el Aw puede producir una significativa reducción en la germinación de los conidios, posiblemente porque para N. rileyi, el agua disponible es un factor crítico durante la germinación (Ypsilos y Magan 2004).
El agua es una importante fuente de hidrógeno y oxígeno, elementos requeridos para la síntesis de moléculas orgánicas como las proteínas (Moore 1996), la activación metabólica (Madigan et al. 1999) y procesos bioquímicos importantes durante la germinación (Schmit y Brody 1975). Los resultados coinciden con los descritos en trabajos realizados con otros microorganismos, como la investigación de Ypsilon y Magan (2004), quienes encontraron un mayor número de blastosporas germinadas en M. anisopliae, luego de 36 horas de incubación en el medio agar agua con un Aw de 0.998, con respecto a los obtenidos en tratamientos con menores actividades de agua. De igual manera Lazzarini et al. (2006) obtuvieron un mayor número de conidios germinados de B. bassiana y M. anisopliae en un medio mínimo líquido con un Aw mayor a 0.990 luego de 24 horas de incubación, en comparación con los obtenidos a valores inferiores de actividad de agua.
Con Aw inferiores a 0.990, los porcentajes de germinación fueron menores al 12% y llegando a detenerse con Aw inferiores a 0.980, posiblemente por la mínima cantidad de agua disponible. En contraste con los resultados del presente trabajo, Hallsworth y Magan (1995) reportaron germinaciones mayores al 80% para los hongos entomopatógenos B. bassiana, M. anisopliae y P. farinosus en agar Saboureaud con una actividad de agua de 0.989, y germinaciones mayores al 61% cuando la actividad de agua se ajustó a 0.951 en el mismo medio de cultivo.
En el presente estudio se utilizó el glicerol para disminuir el agua disponible en el medio YM, éste puede actuar como un soluto compatible y de esta manera entra en la célula reduciendo el impacto fisiológico de procesos de estrés como la desecación (Hallsworth y Magan 1995). Las células responden al estrés hídrico produciendo o acumulando polihidroxialcoholes (polioles) generalmente de bajo peso molecular. El mecanismo por el cual sintetizan los polioles opera a nivel genético. La expresión de genes implicados involucra la liberación de agua asociada al DNA, relajando su estructura superenrollada, permitiendo la trascripción y la traducción (Hallsworth y Magan 1997).
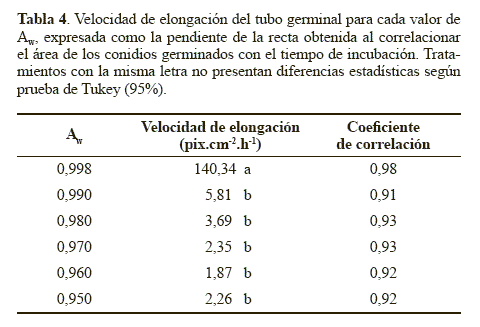
A partir de la comparación en distintos momentos de las áreas de los conidios germinados se pudo estimar la velocidad de elongación del tubo germinal mediante un modelo matemático una línea recta, con coeficientes de correlación mayores a 0.91 (Tabla 4). La pendiente fue estadísticamente superior con el medio control correspondiente a una actividad de agua de 0.998 (P < 0.05). Este resultado indica que la actividad de agua además de afectar la germinación, tiene un efecto determinante en el proceso de elongación del tubo germinal. Este efecto fue descrito por Hallsworth y Magan (1995), quienes observaron que a mayor actividad de agua mayor crecimiento del tubo germinal en los hongos entomopatógenos B. bassiana, M. anisopliae y P. farinosus. En dicho estudio se obtuvo una longitud del tubo germinal de los conidios del hongo B. bassiana de 61,20 μm en el tratamiento con glicerol ajustado a un Aw de 0.989 luego de 14 horas de incubación, mientras que con un Aw de 0.951 se obtuvo un menor desarrollo con una longitud del tubo germinal de 60,48 μm a las 44 horas de incubación. Cuando el Aw se redujo a 0.923 se detuvo el crecimiento del tubo germinal. El mismo comportamiento se observó en los otros dos hongos entomopatógenos. Además, los autores mencionan que generalmente la extensión del tubo germinal es proporcional a la germinación de los conidios. Lo que concuerda con lo observado en el presente estudio, en donde el tratamiento control que presentó la mayor actividad de agua (0.998), produjo la mayor elongación del tubo germinal y el mayor porcentaje de germinación y estos parámetros disminuyeron considerablemente a menores actividades de agua, demostrando la sensibilidad de N. rileyi a valores de Aw por debajo de 0.998.
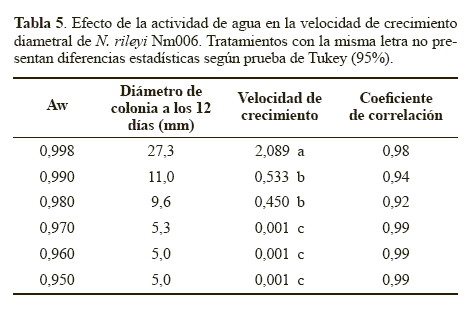
Crecimiento diametral. La velocidad de crecimiento, correspondiente a la pendiente de la línea de regresión, obtenida con el medio control (Aw 0.998), fue significativamente superior (P < 0.05) con respecto a la obtenida con los demás tratamientos (Tabla 5). Se observó que a medida que se redujo el Aw, la velocidad de crecimiento de la colonia también disminuyó. Estos resultados indican que el Aw tuvo un efecto significativo sobre el desarrollo micelial de N. rileyi, lo que podría deberse a que el agua es una fuente de hidrógeno y oxígeno, elementos necesarios para la síntesis de moléculas orgánicas durante el crecimiento hifal. Además, la disponibilidad de agua permite la degradación extracelular de nutrientes, la actividad enzimática óptima y el transporte de nutrientes a través del micelio fúngico (Moore 1996). Resultados similares obtuvieron Hallsworth y Magan (1999) al evaluar la tasa de crecimiento diametral por día (mm.d-1) del hongo B. bassiana, el cual creció más rápido a la mayor actividad de agua utilizada (0.998) con una velocidad de 1,5 mm.d-1. Sin embargo, los microorganismos M. anisopliae y P. farinosus crecieron más rápido en el medio con Aw entre 0.970 y 0.980, pero cuando la disponibilidad de agua se redujo a un Aw de 0.950 el crecimiento micelial de los tres hongos se redujo en un 50%.
Esporulación. Cuando se estudió la producción de conidios de N. rileyi Nm006 en diferentes actividades de agua se observó que el microorganismo sólo esporuló en el tratamiento control (Aw 0.998) con un rendimiento de 5,0 x 106 conidios. cm-2. Este resultado indica que el microorganismo requiere de una actividad de agua superior a 0,990 para realizar el proceso de conidiación. Este efecto fue reportado por Ypsilos y Magan (2004) quienes observaron que la producción de blastosporas de M. anisopliae se vio afectada significativamente por la actividad de agua, modificada con solutos como KCL, NaCL y PEG 200. Humphreys et al. (1989) también observaron que actividades de agua entre 0.986 y 0.980 causaron un incremento en la producción de blastosporas de los hongos P. farinosus, B. bassiana y en especial de M. anisopliae.
Eficacia. Al evaluar el efecto del Aw sobre la actividad insecticida del hongo se obtuvieron porcentajes de eficacia que oscilaron entre el 83,3% y el 100%. Los porcentajes de eficacia cuando la actividad de agua se ajustó a 0.998 y a 0.990 fueron estadísticamente superiores (P < 0.05) con respecto a los obtenidos con los demás tratamientos, lo que sugiere que la actividad de agua tiene un efecto directo sobre la virulencia del microorganismo. Este efecto podría deberse a que los conidios de N. rileyi requieren de una disponibilidad de agua alta para llevar a cabo la síntesis de moléculas orgánicas como las proteínas (Moore 1996) y para la activación metabólica (Madigan et al. 1999), procesos biológicos requeridos durante la germinación sobre el hospedero (Schmit y Brody 1975). Asimismo, el agua permite una actividad óptima de las enzimas del microorganismo facilitando la degradación de los compuestos presentes en la cutícula del hospedero, como lipoproteínas y quitina (Clarkson y Charnley 1996), además de facilitar el transporte de nutrientes del hospedero a través del micelio fúngico (Moore 1996).
Literatura citada
ABOT, W. 1925. A method of computing the effectiveness of an insecticide. Journal of Economic Entomology 18:265-267. [ Links ]
BOSA, C.; CHAVEZ, D.; TORR ES, L.; PAR ÍS, A.; VILAMIZAR, L.; COTES, A. 2004. Evaluación de aislamientos nativos de Nomuraea rileyi para el control de Spodoptera frugiperda (Lepidoptera: Noctuidae). Revista Colombiana de Entomología 30 (1): 93-97. [ Links ]
CLARCKSON, J.; CHARNLEY, K. 1996. New insights into the mechanisms of fungal pathogenesis in insects. Trends in Microbiology 4 (5): 197-203. [ Links ]
GARCÍA, I.; DEL POZO, E. 1999. Aislamiento y producción de conidios de Nomuraea rileyi (Farlow) Samson y su virulencia en larvas de Spodoptera frugiperda (J. E. Smith). Revista Protección Vegetal 14 (2): 95 -100. [ Links ]
GARCÍA, F.; MOSQUERA, M.; VARGAS, C.; ROJAS, L. 2002. Control biológico, microbiológico y físico de Spodoptera frugiperda (Lepidoptera: Noctuidae) plaga del maíz y otros cultivos en Colombia. Revista Colombiana de Entomología 28 (1): 53-60. [ Links ]
GARCIA, M.; VILAMIZAR, L.; COTES, A. 2007a. Compatibility of Trichoderma koningii with chemical fungicides. IOBC/ wprs Bulletin 30 (6): 441-445. [ Links ]
GARCIA, M.; VILAMIZAR, L; TORR ES, L.; COTES, A. 2007b. Efecto de subcultivos sucesivos de Beauveria bassiana sobre sus características y actividad contra Premnotrypes vorax. Revista Manejo Integrado de Plagas y Agroecología 77: 50-56 [ Links ]
HALSWORT H, J.; MAGAN, N. 1995. Manipulation of intracellular glycerol and erythritol enhances germination of conidia at low water availability. Microbiology 141: 1109-1115. [ Links ]
HALSWORT H, J.; MAGAN, N. 1997. Culture age, temperature and pH affect the polyol and trehalose contents of fungal propagules. Applied and Environmental Microbiology 62 (7): 2435-2442. [ Links ]
HALSWORT H, J.; MAGAN, N. 1999. Water and temperature relations of growth of the entomogenous fungi Beauveria bassiana, Metarhizium anisopliae, and Paecilomyces farinosus. Journal of Invertebrate Pathology 74 (3): 261-266. [ Links ]
HUMPHREYS, A.; MAT EWELE, P.; TRINCI, A. 1989. Effects of water activity on morphology, growth and blastospore production of Beauveria bassiana, Metarhizium anisopliae and Paecilomyces farinosus in batch and fed-batch culture. Mycological research 92 (3): 257-264. [ Links ]
LAZARINNI, G.; NUNES, F.; LUZ, C. 2006. Impact of moisture on in vitro germination of Metarhizium anisopliae and Beauveria bassiana and their activity on Triatoma infestans. Mycological Research 110: 485-492. [ Links ]
MADIGAN, M.; MARTINKO, J.; PARKER, J. 1999. Brock Biología de los microorganismos. Octava Edición. Prentice Hall. 984p [ Links ]
MINGOT, J.; ESPESO, E.; ELÍECER, D.; PEÑALVA, M. 2001. Ambient pH signaling regulates nuclear localization of the Aspergillus nidulans PacC Transcription Factor. Molecular and Cellular Biology 21 (5): 1688-1699. [ Links ]
MORE, E. 1996. Fundamentals of the fungi. Cuarta Edición. Prentice Hall. New Jersey. 574 p. [ Links ]
RONCAL, T.; CORDOBE, S.; STERNER, O.; UGALDE, U. 2002. Conidiation in Penicillium cycloium induced by conidiogenone, an endogenous diterpene. Eukaryotic cell 1: 823-829. [ Links ]
RONCAL, T.; UGALDE, U. 2003. Conidiation induction in Penicillium. Research in Microbiology 154: 539-546. [ Links ]
SAUTOUR , M.; ROUGET, A.; DANTIGNY, P.; DIVIES, C.; BENSOUSAN, M. 2001. Prediction of conidial germination of Penicillium chrysogenum as influenced by temperature, water activity and pH. Letters in Applied Microbiology 32: 131-134. [ Links ]
SCHMIT, J.; BRODY, S. 1975. Neurospora crassa conidial germination: role of endogenous aminoacids pools. Journal of Bacteriology 124: 232-242. [ Links ]
St. LEGER, R.; JOSHI, L.; ROBERTS , D. 1998. Ambient pH is a major determinat in the expression of cuticle - degrading enzymes and hydrophobin by Metarhizium anisopliae. Applied and Environmental Microbiology 64 (2): 709-713. [ Links ]
TRUMPER, E.; EDELSTEIN, J.; LECUONA, R. 2004. Selection of culture media and in vitro assessment of temperature-dependent development of Nomuraea rileyi. Neotropical Entomology 33 (6): 737-742. [ Links ]
VILAMIZAR, L.; ARIERO, C.; BOSA, C.; COTES, A. 2004. Desarrollo de preformulados a base de Nomuraea rileyi para el control de Spodoptera frugiperda (Lepidoptera: Noctuidae). Revista Colombiana de Entomología 30 (1): 99-105. [ Links ]
YPSILOS, K.; MAGAN, N. 2004. Impact of water- stress and washing treatments on production, synthesis and retention of endogenous sugar alcohols and germinability of Metarhizium anisopliae blastospores. Mycological Research 108 (11): 1337-1345. [ Links ]