Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.35 no.2 Bogotá July/Dec. 2009
Ciclo de vida de Rhyacionia buoliana (Lepidoptera: Tortricidae) y días grados acumulados en Chile
Life-cycle of Rhyacionia buoliana (Lepidoptera: Tortricidae) and degree-day accumulations in Chile
AMANDA HUERTA F.1, y PATRICIO JORQUERA M.2
1 Doctora. Departamento de Silvicultura, Facultad de Ciencias Forestales, Universidad de Chile. Av. Santa Rosa 11315, La Pintana. Casilla 9206 Santiago- Chile. ahuertaf@gmail.com. Autora para correspondencia.
2 Corporación Nacional Forestal, Av. Bulnes 285, Santiago-Chile. pjorquer@conaf.cl.
Resumen: La polilla europea del brote, Rhyacionia buoliana (Lepidoptera: Tortricidae), es la plaga de mayor relevancia que afecta a las plantaciones de Pinus radiata en Chile. Aún cuando no causa la muerte de los árboles, reduce su valor comercial. Para estudiar el ciclo de vida de este insecto se muestrearon brotes atacados cada 10 días desde septiembre 2000 hasta mayo 2002, en rodales de P. radiata ubicados en la Comuna de Paredones, Región del Libertador Bernardo O’Higgins, Chile. Paralelamente se monitoreó el vuelo de los machos de R. buoliana mediante trampas de feromonas. Los días grado (DG) acumulados se calcularon a través del método del rectángulo, con una temperatura umbral mínima de -2.2ºC. Cada estado del ciclo de vida se asoció con los DG acumulados. El ciclo de vida de R. buoliana fue univoltino. Se requirió una acumulación aproximada de 5.780 DG para completar una generación. Para propósitos de control de la plaga, el vuelo del 50 y 80% de los adultos machos, según la captura del primer adulto en las trampas de feromona, se produjo a 877 y 1.207 DG, respectivamente. La información sobre el ciclo de vida, periodos de actividad de las orugas y la acumulación de los DG presentada en este estudio puede ser utilizada en los programas de manejo para hacer más eficiente los monitoreos y controles de las poblaciones de esta plaga.
Palabras clave: Polilla europea del brote. Pinus radiata. Manejo de plagas.
Abstract: The European pine shoot moth, Rhyacionia buoliana (Lepidoptera: Tortricidae), is the most important pest affecting plantations of Pinus radiata in Chile. Even when it does not cause tree death, the commercial value is reduced. In order to study the life cycle of this insect, attacked shoots were sampled every 10 days from September 2000 to May 2002, in P. radiata stands located in the commune Paredones, Region of Libertador Bernardo O’Higgins, Chile. The flight of male R. buoliana was monitored at the same time through pheromone traps. Degree-day (DD) accumulations were computed using the rectangle method, with a minimum temperature threshold of -2.2°C. Every stage of the life cycle was associated with DD accumulations. R. buoliana life cycle was univoltine. Approximately 5,780 DD were required to complete one generation. For pest control purposes, the 50 and 80% flight of adult males, based on capture of the first adult in pheromone traps, were reached at 877 and 1,207 DD, respectively. Information on the life cycle, periods of caterpillar activity, and DD accumulations presented in this study can be used in management programs to improve the efficiency of monitoring and controlling populations of this pest.
Key words: European pine shoot moth. Pinus radiata. Pest management.
Introducción
La polilla del brote del pino, Rhyacionia buoliana (Denis & Schiffermüller, 1775) (Lepidoptera: Tortricidae) ha sido una plaga importante de los pinos (Pinus spp.) por varios siglos en Europa. La larva consume las yemas y brotes, reduciendo el crecimiento de los árboles y causando deformaciones en las ramas y fustes (Dajoz 2001; Romanyk y Cadahía 2002).
La biología de este insecto fue estudiada inicialmente por Friend y West (1933) en los Estados Unidos y por Brooks y Brown (1936) en Reino Unido. Posteriormente, Pointing (1961, 1963) profundizó en la biología de R. buoliana con estudios exhaustivos sobre las distintas fases de desarrollo de esta especie. Green (1962a, b) completó diversos aspectos biológicos de su ciclo. En España, los estudios de Agenjo (1961, 1963) contribuyeron a la divulgación de su taxonomía. Asimismo, los trabajos de Robredo (1970, 1975, 1978) permitieron incrementar el conocimiento referente a su bioecología y daños que causa.
En verano las hembras oviponen preferentemente en las acículas del año, las orugas de los primeros estadios se alimentan de la base de las acículas y luego en el segundo estadio penetran en las yemas nuevas y se alimentan en su interior construyendo un tubo sedoso. Cuando la yema ha sido ahuecada, la oruga se dirige a otra yema y continúa alimentándose hasta el invierno, donde entra en quiescencia en su tercer o cuarto estadio. Cuando la temperatura asciende durante tres o cuatro días consecutivos las larvas reanudan su actividad; migran hacia el tercio superior de la copa y continúa alimentándose en el interior de la yema hasta alcanzar el sexto estadio. El daño más importante es consecuencia de la actividad en primavera de las orugas. La crisalidación ocurre en el interior de la yema en primavera y la emergencia de los adultos se inicia a fines de esta temporada y se extiende hasta el verano, dependiendo de las condiciones climáticas (Robredo 1975, 1978).
En Chile, R. buoliana se detectó por primera vez en 1985 en plantaciones de Pinus radiata D. Don, colonizando en algunos años prácticamente la totalidad de la superficie de esta especie (1.461.212 ha) (INFOR 2009), desde la Región de Valparaíso hasta la de Los Lagos, a pesar de la presencia del endoparasitoide de orugas Orgilus obscurator Nees, [1814] (Hymenoptera: Braconidae). El establecimiento de O. obscurator en terreno puede llevarse a cabo mediante el implante de las orugas parasitadas o por medio de la liberación de hembras adultas (Baldini et al. 2005). Si bien los resultados alcanzados con este parasitoide han sido exitosos (Baldini et al. 2005; Ide et al. 2007), aún no han sido muy efectivos en las zonas más septentrionales de su distribución. Dado el impacto económico causado por R. buoliana (Alzamora et al. 2002), las empresas forestales chilenas enfrentaron las altas densidades de población de la plaga usando una combinación de estrategias y tácticas a través del uso de productos químicos en los primeros años de la plantación y luego introdujeron a O. obscurator (Ide et al. 2007). Este programa de control biológico ha sido el más estable. Se ha complementado con medidas mecánicas, técnicas silvícolas y recuperación de la forma del fuste de los árboles atacados (Baldini et al. 2005).
Los insectos requieren de una cierta temperatura para pasar de un punto de desarrollo a otro dentro de su ciclo biológico (tiempo fisiológico). Este tiempo provee de un patrón común para el desarrollo de un organismo, el cual no sufre grandes variaciones. Este tiempo fisiológico se expresa en unidades de calor o días grado (DG). Los modelos de DG son herramientas prácticas para predecir eventos fenológicos contribuyendo con la eficiencia en los controles (Higley et al. 1986; Regan et al. 1991). Existen diversos métodos de cálculo de los DG, basados en sistemas lineales debido a que se supone que la tasa de desarrollo es lineal respecto de la temperatura (Wilson y Barnett 1983). Uno de los métodos más usados es el propuesto por Arnold (1960), conocido como el método del rectángulo o de la media, el cual considera las temperaturas extremas diarias sobre un umbral de desarrollo inferior. El umbral de desarrollo inferior para un organismo es la temperatura bajo la cual detiene su desarrollo (Wilson y Barnett 1983). Para R. buoliana se ha estimado un umbral de desarrollo inferior de -2,2ºC (Regan et al. 1991). La estimación del ciclo de vida mediante los DG constituye una herramienta práctica y de fácil elaboración, pues requiere sólo del conocimiento de las temperaturas extremas diarias para asociarse con los periodos de desarrollo del insecto. La utilidad de los modelos de los DG ha sido demostrada para varias especies (Pruess 1983; Mitchell y Sower 1991; Regan et al. 1991; Heeley et al. 2003).
Los programas de manejo integrado de plagas requieren el conocimiento de la biología del insecto en el hábitat donde se encuentra, permitiendo la aplicación en forma eficiente y eficaz de los métodos de control de acuerdo con sus estados de desarrollo. R. buoliana es un insecto que pasa gran parte de su desarrollo dentro de las yemas o brotes, por lo que resulta fundamental saber el momento en que se encuentra vulnerable, es decir fuera del brote, para emprender medidas de control. En este sentido, sólo bastaría conocer la acumulación de DG, a través de las temperaturas mínimas y máximas diarias, para predecir el momento biológico vulnerable en campo de la plaga.
En Chile se ha estudiado el ciclo de vida de esta especie asociado a los DG en la Región de los Lagos (Artigas 1994) y más al norte en la Región del Maule (Huerta y Pérez 1997), corroborando su ciclo univoltino, al igual que en las regiones situadas hacia el sur, pero hasta ahora no se había estudiado el comportamiento del ciclo de vida de R. buoliana hacia el área norte de distribución, en la Región del Libertador Bernardo O’Higgins. Dicha región presenta temperaturas más altas y precipitaciones más bajas que las del sur por lo que esta investigación abordó la caracterización del ciclo de vida de este insecto en la zona representativa en la Comuna de Paredones; por otro lado, asoció los DG acumulados, como una herramienta que facilite la predicción del momento óptimo de aplicación de medidas de control del insecto según su estado de desarrollo, contribuyendo con su manejo integrado.
Materiales y Métodos
El estudio se hizo en tres localidades de la Comuna de Paredones, Región del Libertador Bernardo O’Higgins, Chile: Panilongo (6.157.420 N, 232.230 E), Los Briones (6.152.200 N, 232.350 E) y San Pedro de Alcántara (6.150.120 N, 241.260 E). Los tres sectores presentaron condiciones similares de suelo, pendiente, exposición y altitud. Se muestrearon árboles de P. radiata de cinco y seis años de edad, revisando al azar 30 brotes atacados de R. buoliana de árboles distintos en cada sector con una periodicidad aproximada de 10 días, contándose el número de orugas, crisálidas y exuvias. Estos muestreos se hicieron entre el 6 septiembre 2000 y el 22 mayo 2002.
Dado que este estudio no contempló el muestreo de huevos para la construcción del diagrama del ciclo de vida de R. buoliana en Paredones, se consideró lo señalado por Robredo (1978) y se determinó como punto de inicio de la presencia de las orugas 12 días después de las primeras oviposiciones. La fecha de término igualmente se estimó en 12 días después del período de huevo.
Como complemento al muestreo de brotes, se instalaron trampas de feromona tipo delta biolure para los adultos (EPSM Lures, Point International Ltd., UK). Las trampas se colocaron a entre 1 y 2 m de altura, en grupos de a cuatro por sector en una ordenación rectangular, separadas 25-30 m entre sí (Regan et al. 1991). Las trampas se colgaron en los árboles a inicios de septiembre, un mes antes del comienzo del periodo de vuelo. Se renovaron cada 30 días durante el periodo del adulto para asegurar la atracción sobre los machos. Las trampas se evaluaron entre septiembre de 2000 y mayo de 2002, cada 10 días aproximadamente hasta que no aparecieron más adultos.
Las temperaturas máximas y mínimas se obtuvieron de los registros de la Estación Meteorológica de Paredones, a cargo de la Corporación Nacional Forestal, en convenio con la Dirección Meteorológica de Chile. Su ubicación geográfica corresponde a UTM: 6.163.750 N y 235.650 E. Para el cálculo de los DG se usó el método propuesto por Arnold (1960), cuya fórmula es la siguiente:
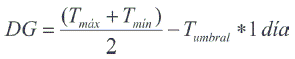
Donde, Tmáx: Temperatura máxima diaria (°C), Tmín: Temperatura mínima diaria (°C), Tumbral:Temperatura umbral inferior (°C).
La temperatura base o umbral inferior que se utilizó en este estudio fue de -2,2°C (Regan et al. 1991). Se calcularon los DG para cada una de las fases de desarrollo de R. buoliana detectadas en los muestreos de campo. Se identificó, cuando fue posible, el comienzo y el final de cada una de las etapas de desarrollo del insecto y su asociación con los DG acumulados. También se relacionaron los DG con las fechas en que la presencia relativa era máxima para cada estado en particular. Para determinar la fecha de comienzo de acumulación de los DG se utilizó la captura del primer macho en las trampas de feromona para la temporada 2000/2001 y la presencia de la primera exuvia, en la temporada 2001/2002.
Se determinó la participación porcentual respecto del total de ejemplares recolectados en cada estado de desarrollo del insecto: oruga, crisálida y adultos (exuvias y captura de machos) y se asoció, mediante gráficos con las fechas de presencia de cada uno de los estados de desarrollo y DG. Además, se diseñó un gráfico con las emergencias de adultos de R. buoliana obtenidas en las dos temporadas considerando como inicio del conteo de los DG cuando apareció el primer exuvia. Con estos antecedentes de las dos temporadas se construyó un modelo de regresión sigmoidea 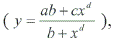 asociados a los DG acumulados. Finalmente, con los datos de las capturas de machos en las trampas de feromona, se construyó la curva correspondiente, identificando aquellos porcentajes de interés para la aplicación de las medidas de control y se relacionó con la acumulación de DG.
asociados a los DG acumulados. Finalmente, con los datos de las capturas de machos en las trampas de feromona, se construyó la curva correspondiente, identificando aquellos porcentajes de interés para la aplicación de las medidas de control y se relacionó con la acumulación de DG.
Resultados y Discusión
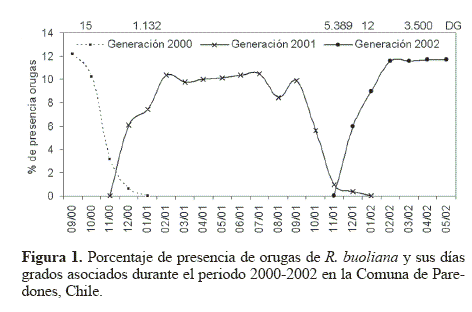
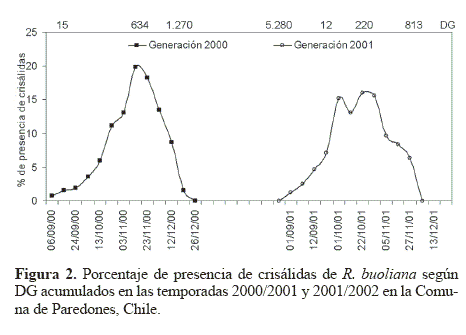
El ciclo de vida univoltino de R. buoliana en la Comuna de Paredones se inició con la aparición de los primeros huevos en la segunda quincena de octubre, y continuó hasta la primera quincena de enero del año siguiente. El periodo de oruga se inició una semana después con la presencia de orugas de primeros estadios y se extendió por todo el año hasta completar el sexto estadio (Fig. 1), para dar lugar a las crisálidas durante la primera semana de septiembre hasta terminar en diciembre (Fig. 2). Finalmente, el periodo de adulto comenzó a mediados de octubre y se prolongó hasta la primera quincena de enero (Fig. 3). Este comportamiento univoltino de R. buoliana ocurre también en las zonas más al sur del país como en las regiones del Maule (Huerta y Pérez 1997), de los Lagos (Artigas 1994) y también en la región andino patagónica de Argentina (Gómez 2003).
El ciclo de vida de R. buoliana es más corto con respecto a la Región de los Lagos siendo los períodos de huevo, oruga, crisálida y adulto más cortos (Artigas 1994). Es así como en la zona de estudio la aparición de los huevos ocurrió un mes y medio antes, a mediados de octubre, y sólo se prolongó hasta mediados de enero. Esto podría explicarse por el aumento de la temperatura y baja en la humedad relativa en comparación con las zonas más al sur del país, lo que aceleró los procesos fisiológicos de la plaga. Similar situación aconteció con los otros estados de desarrollo del insecto.
Si se comparan los resultados con los de la Región del Maule (Huerta y Pérez 1997), colindante al sur, estas diferencias son menos marcadas. Por ejemplo, el inicio de la ocurrencia del período de huevo en la Región del Maule se produce un mes después, a mediados de noviembre, y se extiende hasta fines de febrero. Esta reducción en las diferencias se explica por la mayor similitud en las condiciones climáticas de estas regiones. No obstante, no se evidenció una segunda generación del insecto.
Se encontraron orugas durante todo el año en sus distintos estadios (Fig. 1). Se detectaron orugas en sus últimos estadios a inicios de septiembre de 2000 cuando había una acumulación de 15 DG, calculados a partir de las capturas de los primeros adultos machos a través de las trampas de feromona; esa generación terminó en la segunda semana de diciembre cuando se acumularon 1.132 DG. La generación de orugas de 2001 apareció en la primera semana de diciembre de 2000, existiendo una sobreposición con las orugas de últimos estadios de la generación anterior. Las orugas de la generación 2001 se extendieron hasta enero de 2002, con sus últimos estadios, cuando había una acumulación de 5.389 DG. La última generación de orugas comenzó en enero de 2002 cuando se acumularon 12 DG y se muestreó hasta fines de mayo de 2002, con 3.500 DG acumulados.
Con respecto al periodo de las crisálidas en la temporada 2000/2001, este se presentó el 6 septiembre 2000, con una acumulación de 15 DG. Su máximo se dio durante la segunda semana de noviembre de 2000 (634 DG) con una presencia del orden de 20% y desapareció a partir del 19 diciembre 2000 (1.270 DG). En la temporada siguiente (2001/2002) las crisálidas aparecieron el 12 septiembre 2001 (5.280 DG) y su máximo se produjo a partir de la primera semana de noviembre (219,5 DG) con una presencia de un 16,3%, finalizando el 13 diciembre 2001 cuando se habían acumulado 813 DG (Fig. 2).
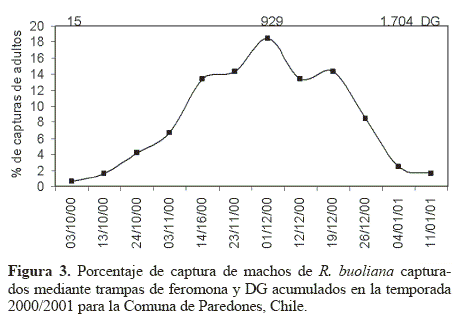
El periodo de adultos identificado mediante la captura de machos en las trampas de feromona en la temporada 2000/2001 se inició el 3 octubre 2000, con una acumulación de 15 DG. Este evento se dio primero que la detección de exuvias, aproximadamente unos diez días antes. El máximo de presencia de adultos se observó el 1 diciembre 2000 con 929 DG acumulados. La temporada de adultos se prolongó hasta el 11 enero 2001 con 1.704 DG acumulados (Fig. 3).
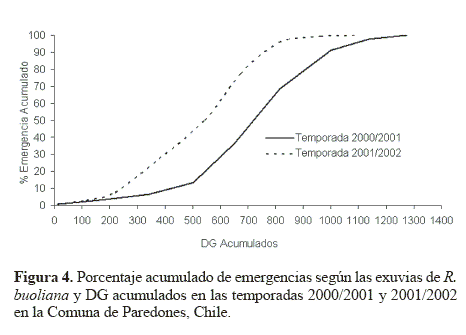
Se observó un desplazamiento de las curvas de los porcentajes de emergencia acumulada obtenidas mediante exuvias de R. buoliana vs DG acumulados de ambas temporadas debido a que en la temporada 2000/2001 la acumulación de DG se inició con la aparición del primer adulto en las trampas de feromona, mientras que en la temporada siguiente (2001/2002) la acumulación comenzó con la aparición de la primera exuvia, suceso que ocurrió con posteridad (Fig. 4).
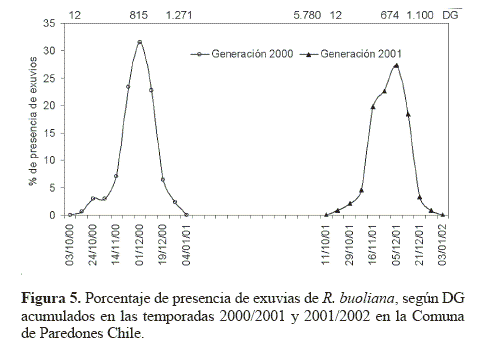
Las exuvias en la temporada 2000/2001 se detectaron por primera vez el 13 octubre 2000 con 12 DG acumulados con un máximo de presencia de 32 % (815 DG acumulados) y por última vez el 26 diciembre de 2000 con 1.271 DG acumulados. En tanto que para la temporada siguiente, las exuvias aparecieron el 22 octubre 2001 con 12 DG, con un máximo de 27% de participación (674 DG) y terminaron el 28 diciembre 2001 con 1.100 DG (Fig. 5).
Para completar el desarrollo de una generación de R. buoliana en la Comuna de Paredones se requiere una acumulación de aproximadamente 5.780 DG, considerando como fecha de partida del conteo cuando se atrapó el primer adulto macho en las trampas de feromona y como término, el día anterior a la detección del primer exuvia en la temporada siguiente (Fig. 5).
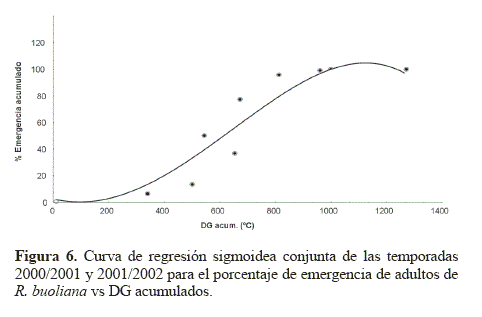
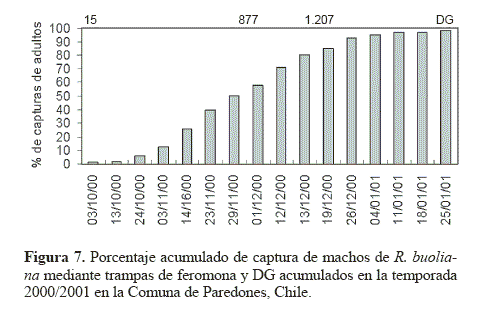
El modelo de regresión sigmoideo para el porcentaje de emergencia acumulado y los DG demostraron que ambas variables de las dos temporadas de estudio estaban correlacionadas. El modelo expresado como 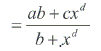 tuvo un r2 = 0,8947, siendo y el porcentaje de emergencia acumulado y x los DG acumulados. Los valores de los parámetros correspondieron a α = –9,78046; b = 4273,331; c = 9102,112 y d = –3,06597 (Fig. 6). Este carácter sigmoideo de las curvas de emergencia de adultos de R. buoliana coincide con las elaboradas por Gómez (2003), en un estudio de la relación de los DG y el vuelo estacional de este insecto en la Ciudad de Esquel, Provincia de Chubut en la región andino patagónica de Argentina. Respecto a los porcentajes de captura de machos acumulados de R. buoliana (Fig. 7) en la temporada 2000/2001, el 50 % de vuelos de machos se observó cuando había una acumulación de 877 DG. El 80% de las capturas acumuladas se produjo el 19 diciembre 2000, con una acumulación de 1.207 DG.
tuvo un r2 = 0,8947, siendo y el porcentaje de emergencia acumulado y x los DG acumulados. Los valores de los parámetros correspondieron a α = –9,78046; b = 4273,331; c = 9102,112 y d = –3,06597 (Fig. 6). Este carácter sigmoideo de las curvas de emergencia de adultos de R. buoliana coincide con las elaboradas por Gómez (2003), en un estudio de la relación de los DG y el vuelo estacional de este insecto en la Ciudad de Esquel, Provincia de Chubut en la región andino patagónica de Argentina. Respecto a los porcentajes de captura de machos acumulados de R. buoliana (Fig. 7) en la temporada 2000/2001, el 50 % de vuelos de machos se observó cuando había una acumulación de 877 DG. El 80% de las capturas acumuladas se produjo el 19 diciembre 2000, con una acumulación de 1.207 DG.
La información sobre el ciclo de vida, periodos de actividad de las larvas y la acumulación de los DG presentada a través de este estudio puede ser utilizada en los programas de manejo para hacer más eficientes los monitoreos y controles de las poblaciones de esta plaga. Por ejemplo, para combatir adultos de R. buoliana monitoreados mediante las trampas de feromona con aplicación de insecticidas por vía aérea, corresponde al momento en que se presenta una acumulación que fluctúe entre 877 y 1.207 DG, con el 50 y 80% de la población de machos, respectivamente. Con este procedimiento también es factible optimizar las acciones de liberación de hembras del parasitoide O. obscurator, las cuales se distribuyen cuando R. buoliana está entre los estadios dos y tres; es decir, entre diciembre y la primera semana de febrero, dependiendo de la región. No obstante, en la Región del Libertador Bernardo O’Higgins se han liberado ejemplares incluso en mayo (Baldini et al., 2005), por lo que podría distribuirse cuando se alcancen hasta 3.000 DG.
Conclusiones
Esta investigación contribuye con el manejo integrado de plagas, aportando con el conocimiento del ciclo de vida de R. buoliana en la Comuna de Paredones en la costa de la Región del Libertador Bernardo O´Higgins de Chile y su asociación con los DG, mediante su uso potencial como herramienta en el control biológico con el endoparasitoide de orugas de O. obscurator, optimizando el control selectivo de esta plaga. Se recomienda continuar con al menos otra temporada de evaluaciones a fin de construir un modelo más sólido de pronóstico de vuelo de esta plaga.
Agradecimientos
Este trabajo fue financiado por la Corporación Nacional Forestal, Región de Libertador Bernardo O’Higgins, Chile.
Literatura citada
AGENJO, R. 1961. Datos sobre la dispersión, bionomía y morfología de Rhyacionia buoliana (Schiff., 1776) (Lep.: Tortricidae) en España. Boletín del Servicio de Plagas e Inspección Fitopatológica 4 (8): 21-31. [ Links ]
AGENJO, R. 1963. Tres razas españolas nuevas de Rhyacionia buoliana (Schiff., 1776) (Lep. Tortricidae). Boletín del Servicio de Plagas 6 (12): 149-153. [ Links ]
ALZAMORA, M.; APIOLAZA, L.; IDE, S. 2002. Evaluación física y económica de pérdidas en volumen debido al daño de Rhyacionia buoliana (Schiff.) en plantaciones de Pinus radiata (D. Don) en la Novena y Décima Regiones de Chile. Bosque 23 (2): 29-42. [ Links ]
ARNOLD, C. 1960. Maximum-minimum temperatures as a basis for computing heat units. American Society for Horticultural Science 78: 682-692. [ Links ]
ARTIGAS, J. 1994. Entomología económica: Insectos de interés agrícola, forestal, médico y veterinario. Vol. 2. Ediciones Universidad de Concepción, Concepción, Chile. 943 p. [ Links ]
BALDINI, A.; COGOLLOR, G.; SARTORI, A.; AGUAYO, J. 2005. Control biológico de plagas forestales de importancia económica en Chile. Gobierno de Chile, Corporación Nacional Forestal y Fundación para la Innovación Agraria, Santiago, Chile. 205 p [ Links ]
BROOKS, C.; BROWN, J. 1936. Studies on the Pine shoot moth (Evetria buoliana Schiff.). Forestry Commission Bulletin 16: 1-46. [ Links ]
DAJOZ, R., 2001. Entomología Forestal: los insectos y el bosque. Ediciones Mundi Prensa, Madrid. 548 p. [ Links ]
FRIEND, R.; WEST, A. 1933. The European pine shoot moth (Rhyacionia buoliana Schiff.) with special reference to its occurrence in the Eli Whitney Forest. School Forestry Bulletin Yale University 37: 1-65. [ Links ]
GÓMEZ, C. 2003. Relación entre la acumulación de DG y el vuelo estacional de la mariposa europea del brote del pino en Esquel, Argentina. Bosque 24 (3): 57-63. [ Links ]
GREEN, G.W. 1962 a. Flight and dispersal of the European pine shoot moth, Rhyacionia buoliana Schiff. I. Factors affecting flight and flight potential of the females. The Canadian Entomologist 94: 282-313. [ Links ]
GREEN, G.W. 1962 b. Low winter temperatures and the European pine shoot moth, Rhyacionia buoliana Schiff., in Ontario. The Canadian Entomologist 94: 314-336. [ Links ]
HEELEY, T.; ALFARO, R.; HUMBLE, L.; STRONG, W. 2003. Distribution and life cycle of Rhyacionia buoliana (Lepidoptera: Tortricidae) in the interior of British Columbia. Journal of the Entomological Society of British Columbia 100: 19-25. [ Links ]
HIGLEY, G.; PEDIGO, P.; OSTLE, R. 1986. DEGDAY. A program for calculating degree-days, and assumptions behind the degreesays approach. Environmental Entomology 15 (5): 999-1016. [ Links ]
HUERTA, A; PÉREZ, C. 1997. Ciclo de vida de la polilla del brote de pino Rhyacionia buoliana Den.et Schiff) en la VII Región de Chile. Boletín de Sanidad Vegetal-Plagas 23(3): 385-391. [ Links ]
IDE, S.; LANFRANCO, D.; RUIZ, C. 2007. Detección de superparasitismo y multiparasitismo sobre larvas de Rhyacionia buoliana (Lepidoptera-Tortricidae) en las Regiones VIII y IX de Chile. Bosque 28 (1): 57-64. [ Links ]
INFOR (Instituto Forestal). 2009. Superficie de Plantaciones Forestales 2007 web site. Disponible en: http://www.infor.cl/estadisticas_mercado/super_plantaciones_forest.htm Fecha último acceso: [9 marzo 2009]. [ Links ]
MITCHELL, G.; SOWER, L. 1991. Life history of the western pine shoot borer (Lepidoptera: Olethreutidae) and effects on lodgepole pine in Central Oregon. Journal of Economic Entomology 84 (1): 206-211. [ Links ]
POINTING, P. J. 1961. The biology and behavior of the European pine shoot moth (Rhyacionia buoliana Schiff.) in Southern Ontario. I. Adult. The Canadian Entomologist 93: 1098-1112. [ Links ]
POINTING, P. J. 1963. The biology and behaviour of the European pine shoot moth (Rhyacionia buoliana Schiff.) in Southern Ontario. II. Egg, larva and pupa. The Canadian Entomologist 95: 884-863. [ Links ]
PRUESS, P. 1983. Day-degree methods for pest management. Environmental Entomology 12: 613-619. [ Links ]
REGAN, R.; DE ANGELIS, J.; GREDLER, G. 1991. Predicting seasonal flight of European Pine Shoot Moth (Lepidoptera: Tortricidae) in Western Oregon. Environmental Entomology 20 (5): 1403-1406. [ Links ]
ROBREDO, F. 1970. Contribución al conocimiento de la bioecología de Rhyacionia buoliana Schiff. y sus daños. Primera reunión del grupo de trabajo de lucha integrada en pinares Mediterráneos. Boletín del Servicio de Plagas Forestales 13 (26): 181-186. [ Links ]
ROBREDO, F. 1975. Contribución al conocimiento de la bioecología de Rhyacionia buoliana Den. et Schiff., 1776 (Lep.: Tortricidae). I. Estudio del adulto. Boletín del Servicio de Defensa contra Plagas e Inspección Fitopatológica 1 (1): 69-81. [ Links ]
ROBREDO, F. 1978. Contribución al conocimiento de la bioecología de Rhyacionia buoliana Den. et Schiff., 1776 (Lep., Tortricidae). II. Estudio de los estados inmaturos: puesta, oruga y crisálida. Boletín del Servicio de Plagas 4 (1): 69-88. [ Links ]
ROMANYK, N.; CADAHÍA, D. 2002. Plagas de insectos en las masas forestales. Editorial Mundi-Prensa, Madrid. 336 p. [ Links ]
WILSON, L.; BARNETT, W. 1983. Degree-Days: An aid in crop and pest Management. California Agriculture 37: 4-7. [ Links ]