Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.36 no.1 Bogotá Jan./June 2010
Susceptibilidad y mecanismos de resistencia de Tetranychus urticae (Acariformes: Tetranychidae) en rosal de invernaderos
Susceptibility and resistance mechanisms of Tetranychus urticae (Acariformes: Tetranychidae) in greenhouse roses
JERÓNIMO LANDEROS1, CARLOS ENRIQUE AIL1, ERNESTO CERNA1, YISA OCHOA2, LUIS GUEVARA1 y LUIS ALBERTO AGUIRRE1
1 Universidad Autónoma Agraria Antonio Narro. Departamento de Parasitología. C.P. 25315. Buenavista, Saltillo, Coahuila, México. jlanflo@uaaan.mx. Autor para correspondencia.
2 Universidad Autónoma de Aguascalientes, Centro de Ciencias Agropecuarias, Departamento de Fitotecnia, Posta Zootécnica. CP 20900. Jesús María, Aguascalientes, México.
Recibido: 23-ene-2009 - Aceptado: 27-feb-2010
Resumen: Se determinó el grado de resistencia de una población de Tetranychus urticae, proveniente de rosales de invernaderos en producción a cinco acaricidas de diferente grupo toxicológico mediante la comparación con una línea de laboratorio. Se evaluó también la presencia de enzimas relacionadas con dicha resistencia. Se realizaron varios bioensayos en la línea de laboratorio para determinar la inclinación de la relación concentración-mortalidad. Posteriormente se seleccionó el valor de la CL90 y se duplicó para así obtener una concentración diagnóstico, de tal forma que al aplicarla a la línea de campo se determinó el grado de resistencia. Por último se realizaron pruebas bioquímicas para detectar las enzimas relacionadas con la resistencia. En la población de campo se presentaron los mayores niveles de α y β-esterasas y oxidazas. Estos resultados sugieren que las α y β-esterasas y oxidazas están involucradas en la resistencia de la población estudiada.
Palabras clave: Ácaro de dos manchas. Esterasas. Pruebas bioquímicas.
Abstract: The degree of resistance of a Tetranychus urticae population, from production greenhouse roses, was determined for five miticides from different toxicological groups in comparison to a laboratory line. The presence of enzymes related to that resistance was also evaluated. Several bioassays were conducted on the laboratory line to establish the slope of the concentration /mortality relationship. Afterwards, the value of LC90 was selected and doubled to obtain a diagnostic concentration, in such a way that applying it to the field line would determine the degree of resistance. Lastly, biochemical tests were conducted to detect enzymes related to the resistance. The highest levels of α and β-esterase and oxidases were presented in the field population. These results suggest that α and β-esterase and oxidases are involved in the resistance of the population studied.
Key words: Two-spotted spider mite. Esterases. Biochemical test.
Introducción
La arañita roja Tetranychus urticae Koch, 1836 (Acariformes: Tetranychidae) afecta a muchas especies de plantas en el mundo, incluyendo cultivos agrícolas y ornamentales. Se le ha reportado en 180 especies de plantas en invernadero y en condiciones de campo (Kim et al. 2004) causando marchitamiento, desecación del follaje y la muerte de las plantas (Gould 1987). Además son capaces de desarrollar resistencia a muchos acaricidas en un período relativamente corto (uno a cuatro años) e inducir un alto grado de resistencia cruzada (Saito et al. 1983). Por lo mismo, este ácaro ha desarrollado resistencia a la mayoría de los productos que se utilizan para su control (Devine et al. 2001). Esta habilidad de T. urticae para desarrollar resistencia, cuando se usan intensivamente acaricidas ha causado problemas resultando en una exigencia de acaricidas con nuevos modos de acción (Suh et al. 2006). De acuerdo con Georghiou (1965) la resistencia fisiológica es la más importante en artrópodos, debido a la acción de mecanismos detoxificadores enzimáticos que provocan una mayor degradación o excreción del insecticida o acaricida (Lagunes Tejada y Villanueva-Jiménez 1994). Yang et al. (2001) mencionan que en artrópodos la detoxificación de los xenobióticos se debe principalmente a esterasas, citocromo P-450 dependiente de las monooxigenasas y glutation Stransferasas. La resistencia a organofosforados está asociada a varias enzimas. Hemingway y Karunaratne (1998) mencionan a las esterasas; Matsumura y Voss (1964) a las carboxiesterasas y fosfatasas y Yu (1982) menciona que las enzimas glutation S-transferasas intervienen en la detoxificación de compuestos organofosforados en Spodoptera frugiperda (J. E. Smith, 1797), alimentado en diferentes hospederos. La enzima acetilcolinesterasa insensible constituye el mecanismo principal de resistencia de T. urticae a los organofosforados (Voss y Matsumura 1964), las oxidazas intervienen en la detoxificación de los piretroides (Bisset et al. 1998). Lagunes- Tejada y Villanueva-Jiménez (1994) mencionan que las enzimas que degradan al DDT y sus derivados son las oxidazas y la DDT-asa.
Para establecer un programa de manejo efectivo contra T. urticae dado el uso intensivo de acaricidas de diferentes grupos toxicológicos para su control en cultivos de rosal de invernadero, es importante conocer la susceptibilidad y las causas de resistencia fisiológica hacia los acaricidas en esta especie. Por lo anterior, la presente investigación tuvo como objetivo detectar el grado de resistencia y los mecanismos fisiológicos de ésta en una población de T. urticae procedente de invernaderos productores de rosas del Estado de México.
Materiales y Métodos
Material biológico. Se emplearon una línea de referencia de T. urticae mantenida bajo condiciones controladas a una temperatura de 25 ± 2ºC, humedad relativa de 60-70% y luz constante, sobre plantas de Phaseolus vulgaris L, durante más de dos años (Narro susceptible LNS) y una línea de campo recolectada en invernaderos de producción de rosal variedad Royalty en Villa Guerrero, México, con manejo basado en rotación de acaricidas.
Bioensayos (línea de referencia). Se realizaron una serie de bioensayos para determinar las líneas de regresión entre concentración y mortalidad con la población de laboratorio. Se emplearon formulaciones comerciales de los acaricidas avermectina (Agrimec 1,8% CE), bifentrina (Capture 100 12,1% CE), dicofol (AK 20 18,5% CE), naled (Naled 60% CE) y óxido de fenbutatin (Torque 500 44,64% SC), y el método de bioensayo de película residual en caja Petri (Dennehy et al. 1987). Se prepararon seis concentraciones de cada producto y un testigo absoluto, se incluyeron tres repeticiones por cada concentración. Las diferentes concentraciones se elaboraron utilizando como solvente etanol al 95%, a excepción del óxido de fenbutatin el cual se diluyó en agua. Se depositó 1 mL de la solución del acaricida en cada caja Petri, posteriormente se transfirieron 20 ácaros hembra adultos y las cajas fueron selladas con papel aluminio. Se registró el porcentaje de mortalidad a las 24 h, seleccionando como criterio de muerte cuando los ácaros presentaron síntomas de ataxia o un desplazamiento menor, al menos una vez el largo de su cuerpo. Se cuantificó la mortalidad a las 24 h. Se utilizó la fórmula de Abbott (1925) para corregir la mortalidad y los resultados se analizaron por el método de Probit (Finney 1971).
Determinación de la susceptibilidad de la población de campo. Se empleó la técnica de concentración-diagnóstico reportada por McCutchen et al. (1989) que resulta del doble del valor de la CL90 obtenido de cada acaricida en la línea de laboratorio, dicho valor se utilizó para exponer a los ácaros de la colonia de campo a los acaricidas en estudio; para esta fase se utilizaron 400 ácaros distribuidos en 20 cajas Petri. Para el testigo se emplearon tres cajas Petri tratadas con etanol o agua según el caso. Para determinar la susceptibilidad de la población de campo a los acaricidas se utilizó el criterio propuesto por Dennehy et al. (1987), el cual indica que si la población en estudio supera al 80% de mortalidad se le considera como una población susceptible
Pruebas bioquímicas para estimar niveles de enzimas. Seis pruebas bioquímicas se utilizaron en las dos colonias de T. urticae para la determinación de los niveles de las enzimas α-esterasas, β-esterasas, oxidazas, glutation S-transferasas, acetilcolinesterasas y acetilcolinesterasas insensibles, implicadas en la resistencia a los diferentes acaricidas. Todas las pruebas se hicieron por triplicado en placas de 96 pozos y leídas mediante el lector de microplacas Stat fax-2100®. Se utilizaron los reactivos: tampón fosfato de potasio a 0.05 M y pH 7.2 (Tfos), α o β-naftil acetato (naf), dianisidina (did), albúmina sérica bovina (alb), homogeneizado de ácaros (hac), dihidrocloruro de 3, 3’, 5, 5’-tetrametil-bencidina (dtb), metanol (met), acetato de sodio (ace) a 0.25 M, pH 5, peróxido de hidrógeno an 3% (per), fitocromo c (citc), glutatión reducido (glr), 1-cloro-2, 4’ dinitrobenzeno (cdb), yoduro de acetilcolina (yac), 5, 5’-ditiobis-2-ácido nitrobenzoico (dan).
Fuente de enzima. Se homogenizó 0.1 mg de hac en 100 μL de Tfos y se diluyó a 1 mL (Brogdon 1984). Se prepararon 90 muestras para cada una de las líneas. La concentración de proteína de la muestra fue de 4,9 μg de proteína/ 0,1 mg de ácaros, determinada por el método de Bradford (1976) modificado por Brogdon (1984) utilizando albúmina sérica bovina como referencia.
Estimación de los niveles de esterasas. Para determinar los niveles de α y β-esterasas se empleó el método Brogdon-Dickinson (1983). Colocando 100 μL de hac en cada pozo de la placa de Elisa, enseguida se depositaron 100 μL de una solución preparada al disolver 56 mg de naf en 20 mL de acetona y llevar 100 mL con Tfos. La mezcla se incubó a temperatura ambiente por 10 min y se le adicionaron 100 μL de did, disuelta en agua a una concentración de 1mg / mL, se mantuvo la mezcla por 2 min y se leyó la absorbancia en un lector de ELISA a 545 nm. Finalmente, se utilizaron las soluciones de naf como control positivo y el Tfos como control negativo.
Estimación de los niveles de oxidazas. Los niveles de oxidazas se determinaron con la metodología propuesta por Brogdon et al. (1997). Para ello, se colocaron 100 μL del hac en cada pozo, luego se depositaron 200 μL de una solución de 50 mg de dtb, diluida con 25 mL de met y aforada con 75 mL de ace; enseguida se colocaron 25 μL de per, la mezcla se incubó por 5 min a temperatura ambiente y se realizó la lectura de la placa con un filtro de 630 nm. Utilizando como control positivo una solución de citc y como control negativo Tfos.
Estimación de los niveles de glutatión S-transferasas. Para determinar los niveles de estas enzimas se utilizó la metodología de Brogdon y Barber (1990). Colocando 100 μL de hac a cada placa, luego se adicionó 100 μL de una solución de 61 mg de glr / 100 mL de Tfos, inmediatamente después se colocaron 100 μL de una solución de 20 mg de cdb diluida en 10 mL y aforada con 90 mL de Tfos. Se tomó la lectura de la placa con un filtro de 340 nm (T0), posteriormente se incubó por 5 min y se tomó una nueva lectura con el mismo filtro (T5). La diferencia entre las lecturas se empleó para el análisis de los resultados.
Estimación de los niveles de acetilcolinesterasa y acetilcolinesterasa insensible. Los niveles de acetilcolinesterasa se determinaron con el método de Brogdon (1988). Para esto se colocaron 100 μL de hac en cada pozo, enseguida se depositaron 100 μL de una solución de 75 mg de yac/ 100 mL de Tfos, luego se adicionó 100 μL de una solución de 13 mg de dan/100 mL de Tfos. La lectura se realizó con un filtro de 405 nm (T0), se dejó incubar la mezcla por 10 min y se tomó una nueva lectura con el mismo filtro (T10), la diferencia entre lecturas se empleó para el análisis de los resultados. Para determinar los niveles de acetilcolinesterasa insensible se empleó la metodología antes descrita, con la diferencia que en la solución de yac se agregaron 21 mg de naled 90 como inhibidor.
Umbral de tolerancia. Con los datos de las pruebas bioquímicas en las 90 muestras de cada enzima se estableció un umbral de tolerancia para cada una de ellas. Para esto se tomó el valor máximo de absorbancia de cada una de las pruebas enzimáticas de la línea de campo y se comparó con los resultados de la línea de laboratorio, los valores mayores a este umbral se toman como resistentes y los menores como susceptibles.
Resultados y Discusión
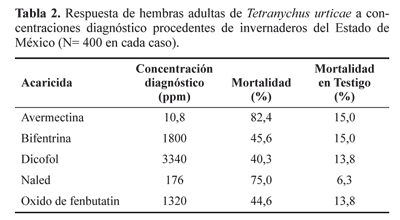
En la línea de laboratorio el menor valor de CL90 fue para el acaricida avermectina seguido por naled, óxido de fenbutatin, bifentrina y dicofol en su orden (Tabla 1). Con estos resultados se elaboraron las concentraciones diagnóstico con la línea de campo.
En la línea de campo el mayor porcentaje de mortalidad se obtuvo con el acaricida avermectina seguido por naled, bifentrina, óxido de fenbutatin y dicofol en su orden (Tabla 2). En relación con la avermectina, el resultado de mortalidad obtenido (82,4%) con 10,8 ppm, difirió del descrito por Grafton- Cardwell y Hoy (1983) quienes registraron un 95% de mortalidad con una concentración de 4 ppm, después de 24 h de exposición. Lo anterior indica que la población utilizada en este estudio es menos susceptible. Por otro lado, Landeros et al. (2002) reportan, 100% de mortalidad de T. urticae con una concentración de 10 ppm de avermectina después de 72 h de exposición. En estudios realizados con el dicofol Dennehy et al. (1983) realizaron comparaciones de mortalidad a 24 de h de exposición en varias poblaciones de T. urticae, utilizando 1000 ppm como concentración diagnóstico, se obtuvieron porcentajes de mortalidad entre 2,5 y 68,6%.
Dennehy et al. (1987) indican que cualquier población es resistente si al exponer la población a una concentración diagnostico (el doble del valor de CL90 obtenido de una línea susceptible) el resultado de mortalidad es menor a 80%; en esta investigación podríamos indicar que la línea de campo utilizada en este estudio resultó susceptible para avermectina con un 82,4% de mortalidad y resistente para los demás productos. Este resultado probablemente es debido a que en los cultivos de rosal, donde se recolectó el material para los bioensayos, se realiza una rotación de acaricidas y los productores de estos cultivos indicaron que únicamente realizan dos aplicaciones de avermectina por año. Sobre este mismo acaricida Clark et al. (1994) no detectaron resistencia en poblaciones de T. urticae recolectadas en California, Florida e Islas Canarias después de seis aplicaciones de avermectina por año. Así mismo Hoy y Conley (1987) no encontraron diferencias en susceptibilidad en cinco poblaciones de T. urticae después de 6-8 aplicaciones con abamectina en condiciones de laboratorio.
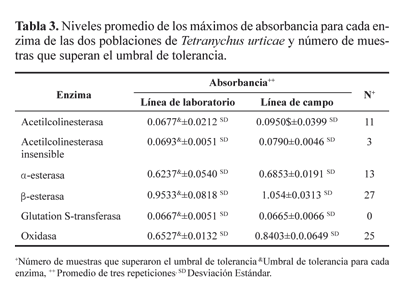
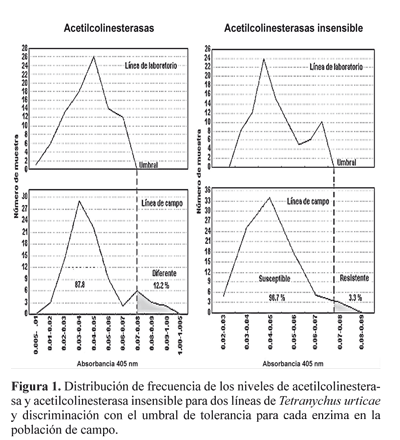
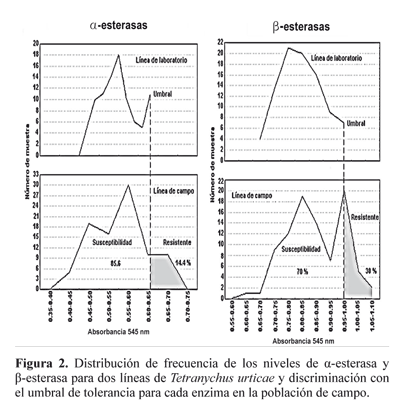
Niveles enzimáticos. La presencia de la enzima glutation Stransferasa de la línea de laboratorio fue superior en todas las muestras en comparación con la línea de campo (Tabla 3). Mientras que en las demás enzimas, algunas de sus muestras superaron el umbral de tolerancia al comparar los valores del número de muestras que superaron el umbral de tolerancia en relación al total de muestras evaluadas (90) lo que indica que la población de campo presenta resistencia posiblemente debido a estas enzimas. En relación con la enzima acetilcolineterasa insensible, solo el 3,3% de la población de campo presentó esta enzima (Fig. 1), lo que indica que en este experimento al parecer no fue un factor importante.
Al comparar los resultados con el acaricida organofosforado naled en el cual el 25% de la población sobrevivió con la exposición a la dosis diagnóstico y la detección de las enzimas α y β esterasas en la población estudiada (Figura 2) podemos determinar que estas enzimas fueron las directamente responsables de la resistencia al acaricida organofosforado. Al respecto Matsumura y Voss (1964) y Herne y Brown (1969) reportan resistencia de T. urticae a organofosforados por incremento de la actividad de las enzimas carboxiesterasas.
Para el caso de los insecticidas piretroides (bifentrina) también se presentó una alta relación entre el porcentaje de supervivencia de la población a la concentración diagnostico (Tabla 2) y las enzimas esterasas (Fig. 2), por lo que también se consideran responsables de la resistencia en esta investigación; al respecto Yang et al. (2002) registraron que el principal mecanismo de resistencia a bifentrina en T. urticae está relacionado con una alta actividad de esterasas. Los mismos autores (Yang et al. 2001) reportan a las enzimas esterasas y en menor grado a las glutation S-transferasas como los principales causantes de la resistencia a bifentrina y λ-cyhalotrina.
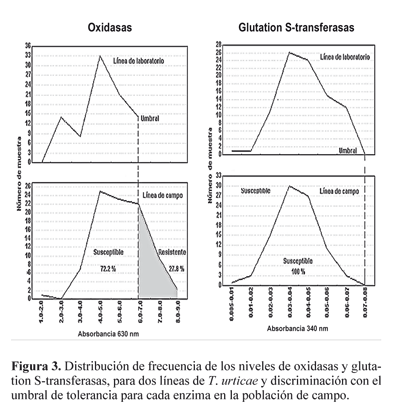
Como ya se señaló en este estudio se observó que los niveles de glutation S-transferasas fueron inferiores a los de la línea de laboratorio lo que permite deducir que no intervienen en la resistencia a bifentrina, ya que la población de campo resultó susceptible para esta enzima (Fig. 3). Por otro lado, Riley et al. (2000) reportan a las α-esterasas como el principal mecanismo de resistencia a bifentrina en mosca blanca, aunque también involucran al sistema oxidativo, que como se muestra en la misma figura, es un factor importante como causa de resistencia.
En relación con las enzimas oxidazas (presentes en el proceso de resistencia a dicofol), en esta investigación no se presentó una relación contundente ya que solo el 27,8% de la población de campo resultó con altos niveles de oxidasa (Fig. 3), mientras el 59,7% de la población, sobrevivió a la concentración diagnostico utilizada para el acaricida dicofol (Tabla 2). Motoyama y Dauterman (1980) y Clark y Shaman (1984) reportan a las enzimas glutation S-transferasas como causa de resistencia a organoclorados, sin embargo en el presente estudio este sistema no resultó relevante (Fig. 3), al respecto Narahashi (1983) menciona que la resistencia a clorados (DDT y sus análogos) se debe a insensibilidad en el sistema nervioso de los insectos.
Al relacionar el porcentaje de individuos vivos después de la aplicación de la concentración diagnóstico del acaricida óxido de fenbutatin con la presencia de esterasas (44,4%) y oxidazas (27,8%), se nota una marcada diferencia. Estos porcentajes nos sugieren que posiblemente otro mecanismo de resistencia está involucrado. Al respecto Carbonaro et al. (1986) indican que una de las enzimas encargada de la liberación de energía (ATPasa) puede cambiar de forma de tal manera que el acaricida no afecta su función, lo que hace resistente a su portador.
La presencia de individuos que sobrevivieron al exponerlos a la concentración diagnóstico del acaricida avermectina (17,6%) sugiere la acción de algunas de las enzimas estudiadas. Clark et al. (1994) precisan que las esterasas están involucradas en el mecanismo de resistencia a este acaricida. Por su parte Argentine y Clark (1992) mencionan que líneas de insectos resistentes a avermectina no presentan niveles significativos de resistencia cruzada para otros insecticidas.
Literatura citada
ABBOTT, W. S. 1925. A method of computing the effectiveness of an insecticide. Journal of Economic Entomology 18: 265-267. [ Links ]
ARGENTINE, J. A.; CLARK, J. M. 1990. Selection for abamectin resistance in Colorado potato beetle (Coleoptera: Chrysomelidae). Pesticide Science 28: 17-24. [ Links ]
BISSET, J. A.; RODRÍGUEZ, M. M.; SOCA, A. 1998. Cross-resistance to malathion in cuban Culex quinquefasciatus induced by larval selection with deltamethrin. Journal American Mosquito Control Association 12: 109-12. [ Links ]
BRADFORD, M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Annals of Biochemistry 72: 248-254. [ Links ]
BROGDON, W. G. 1984. Mosquito protein microassay-I, protein determinations from small portions of single-mosquito homogenates. Comparative Biochemistry Physiology 79: 457-459. [ Links ]
BROGDON, W. G. 1988. Microassay of acetylcholinesterase activity in small portions of single mosquito homogenates. Comparative Biochemistry and Physiology 90: 145-150. [ Links ]
BROGDON, W. G.; DICKINSON, C. M. 1983. A microassay system for measuring esterase activity and protein concentration in small samples and in high-pressure liquid chromatography eluate fractions. Analytical Biochemistry 131: 499-503. [ Links ]
BROGDON, W. G.; BARBER. 1990. Microplate assay of glutathione S-transferase activity for resistance detection in singlemosquito triturates. Comparative Biochemistry and Physiology 96: 339-342. [ Links ]
BROGDON, W. G.; MCALLISTER, J. C.; VULULE, J. 1997. Hemeperoxidase activity measured in single mosquitoes identifies individuals expressing an elevated oxidase for insecticide resistance. Journal of the American Mosquito Control Association 13: 233-237. [ Links ]
CARBONARO, M. A.; MORELAND, D. E.; EDGE, V. E.; MOTOYAMA, N.; ROCK G. C.; DAUTERMAN, W. 1986. Studies on the mechanisms of cyhexatin resistance in the twospotted spider mite, Tetranychus urticae (Acari: Tetranychidae). Journal of Economic Entomology 79: 576-579. [ Links ]
CLARK, A. G.; SHAMAN, N. A.1984.Evidence that DDT-dehydrochlorinase from the house fly is a glutathione S-transferase. Pesticide Biochemistry and Physiology 22: 249-261. [ Links ]
CLARK, J. M.; SCOTT, J. G.; CAMPOS, F.; BLOOMQUIST, J. R. 1994. Resistance to avermectins: extent, mechanisms and management implications. Annual Review of Entomology 40: 1-30. [ Links ]
DENNEHY, T. J.; GRANETT, J.; LEIGH, T. F. 1983. Relevance of slide-dip and residual bioassay comparisons to detection of resistance in spider mites. Journal of Economic Entomology 76: 1225- 1230. [ Links ]
DENNEHY, T. J.; GRAFTON-CARDWELL, E. E.; GRANETT, J.; BARBOUR, K. 1987. Practitioner assessable bioassay for detection of dicofol resistance in spider mites (Acari: Tetranychidae). Journal of Economic Entomology 80: 998-1103. [ Links ]
DEVINE, G. J.; BARBER, M.; DENHOLM, I. 2001. Incidence and inheritance of resistance to meti-acaricides in European strains of the two-spotted spider mite (Tetranychus urticae) (Acari: Tetranychidae). Pest Management Science 57: 443-448. [ Links ]
FINNEY, D. J. 1971. Probit analysis. 3rd ed. Cambridge University Press.Cambridge [ Links ]
GRAFTON-CARDWELL, E. E.; HOY, M. A. 1983. Comparative toxicity of avermectina B1 to the predator Metaseiulus occidentalis (Nesbitt) (Acari: Phytoseiidae) and the spider mites Tetranychus urticae Koch and Panonychus ulmi (Koch) (Acari: Tetranychidae). Journal of Economic Entomology 76: 1216- 1220. [ Links ]
GEORGHIOU, G. P. 1965. Genetics studies on insecticide resistance. Advanced Pest Control Resesarch 6: 171. [ Links ]
GOULD, H. J. 1987. Protected crops, pp: 404-405. In: Burn, A. J.; Croaker, T. H.; Jepson P. (Eds.). Integrated Pest Management. Academic Press, New York, USA. [ Links ]
HEMINGWAY, J.; KARUNARATNE, S. 1998. Mosquito carboxylesterases: A review of the molecular biology and biochemistry of a major insecticide resistance mechanism. Medical and Veterinary Entomology 12: 1-12. [ Links ]
HERNE, D. H. C.; BROWN, A. W. A. 1969. Inheritance and biochemistry of OP-resistance in a New York strain of the twospotted spider mite. Journal of Economic Entomology 62: 205- 209. [ Links ]
HOY, M. A.; CONLEY, J. 1987. Selection for abamectin resistance in Tetranychus urticae and T. pacificus (Acari: Tetranychidae). Journal of Economic Entomology 80: 221-225. [ Links ]
KIM, M.; SHIN, D.; CHO, K. 2004. An assessment of the chronic toxicity of fenpyroximate and pyridaben to Tetranychus urticae using a demographic bioassay. Applied Entomology 39 (3): 401-409. [ Links ]
LAGUNES-TEJADA, A.; VILLANUEVA-JIMÉNEZ, J. A. 1994. Toxicología y manejo de insecticidas. Colegio de Postgraduados en Ciencias Agrícolas, Montecillo Estado de México, México. 264 p. [ Links ]
LANDEROS, J.; MORA, N.; BADII, M.; CERDA, P. A.; FLORES, A. E. 2002. Effect of subletal concentrations of avermectina on population parameters of Tetranychus urticae on strawberry. Southwestern. Entomologist 27: 283-289. [ Links ]
MATSUMURA, F.; VOSS, G. 1964. Mechanism of malathion and parathion resistance in the twospotted spider mite, Tetranychus urticae. Journal of Economic Entomology 57: 911-917. [ Links ]
MCCUTCHEN, B. F.; PLAPP, F. W., NEMIC, S. J.; CAMPANHOLA, C. 1989. Developmente of diagnostic monitoring techniques for larval pyrethroid resistance in Heliothis spp. (Lepidoptera: Noctuidae) in cotton. Journal of Economic Entomology 82: 1502-1507. [ Links ]
MOTOYAMA, N.; DAUTERMAN, W. C. 1980. Glutathione Stransferase: their role in the metabolism of organophosphorous insecticides. Reviews in Biochemical Toxicology 2: 49-69. [ Links ]
NARAHASHI, T. 1983. Resistance to insecticides due to reduced sensitivity of the nervous system, pp: 333-351. In: Georghiou, G.; Saito, T. (Eds.). Pest resistance to pesticides. Plenum press New York and London. [ Links ]
RILEY, D. G.; TAN, W. J.; WOLFENBARGER, D. 2000. Activities of enzymes associated with inheritance of bifenthrin resistance in the silverleaf whitefly, Bemisia argentifolii. Southwestern Entomologist 25: 201-211. [ Links ]
SAITO, T.; TABATA, K.; KOHNO, S. 1983. Mechanisms of acaricide resistance with emphasis on dicofol, pp: 429-444. In: Georghiou, G; Saito, T. (Eds.). Pest resistance to pesticides. Plenum press New York and London. [ Links ]
SUH, E.; KOH, S.; LEE, J.; SHIN, K.; CHO, K. 2006. Evaluation of resistance pattern to fenpyroximate and pyridaben in Tetranychus urticae collected from greenhouses and apple orchards using lethal concentration-slope relationship. Experimental and Applied Acarology 38: 151-165. [ Links ]
VOSS, G.; MATSUMURA, F. 1964. Resistance to organophosphorus compounds in the two spotted spider mite: two different mechanisms of resistance. Nature 202: 319-320. [ Links ]
YANG, X.; MARGOLIES, D. C.; ZHU, K. Y.; BUSCHMAN, L. L. 2001. Host plant-induced changes in detoxification enzymes and susceptibility to pesticides in the twospotted spider mites (Acari: Tetranychidae). Journal of Economic Entomology 94: 381-387. [ Links ]
YANG, X.; BUSCHMAN, L. L.; ZHU, K. Y.; MARGOLIES, D. C. 2002. Susceptibility and detoxifying enzyme activity in two spider mite species (Acari: Tetranychidae) after selection with three insecticides Journal of Economic Entomology 95 (2): 399-406. [ Links ]
YU, S.; J. 1982. Host plant induction of glutathione S-transferase in the fall armyworm. Pesticide Biochemistry and Physiology 18: 101-106. [ Links ]