Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.36 no.1 Bogotá Jan./June 2010
Altitud y tablas de vida de poblaciones de Culex quinquefasciatus (Diptera Cucilidae)
Altitude and life tables of Culex quinquefasciatus (Diptera Cucilidae) populations
CAROLINA GARCÍA G.1, JESÚS ESCOVAR2 C., YESICA LONDOÑO B.3 y LIGIA MONCADA A.4
1 Médico Veterinario. Universidad de La Salle. Facultad de Medicina Veterinaria.
2 M.Sc., Candidato a Ph.D. Universidad de La Salle. Departamento de Ciencias Básicas. Cr 2 No. 10 70 Bogotá, Colombia. jeescobar@unisalle.edu.co. Autor para correspondencia.
3 Médico Veterinario. Universidad de La Salle.
4 M.Sc., Universidad Nacional de Colombia, sede Bogotá. Departamento de Salud Pública. Facultad de Medicina.
Recibido: 9-jul-2009 - Aceptado: 13-mar-2010
Resumen: Se determinaron las diferencias en desarrollo, sobrevivencia y mortalidad de tres poblaciones del mosquito Culex quinquefasciatus procedente de tres pisos térmicos del departamento de Cundinamarca: Mosquera (2516 msnm, 15°C), Fusagasugá (1728 msnm, 22°C) y Girardot (269 msnm, 28°C). Las larvas y adultos de cada población se mantuvieron en el laboratorio en condiciones similares a los sitios de origen. Se registraron diariamente la supervivencia y mortalidad en cada colonia. Para el análisis estadístico se utilizó la prueba de Kruskal Wallis con la modificación de Bonferroni. Los tiempos de desarrollo por sitio fueron así: Mosquera 15,05 días, Fusagasugá 10,62 días y Girardot 7,72 días. Se encontraron diferencias significativas solamente entre Mosquera y Girardot, pero al analizar el tiempo de desarrollo solo de las larvas hubo diferencias significativas entre las tres poblaciones. Las diferencias intrapoblacionales en las tres cohortes no fueron significativas. La supervivencia y la mortalidad de los estadios pre-reproductivos no mostraron diferencias significativas en las tres cohortes y la supervivencia muestra una curva tipo I. La expectativa de vida de un huevo recién ovipositado procedente de Girardot fue 26,06 días, de Fusagasugá fue de 24,12 días y de Mosquera 40,77 días; las diferencias entre ellos no fueron significativas. Estos datos muestran que Culex quinquefasciatus se ha ido adaptando a zonas más altas con temperaturas menores sin detrimento en los parámetros de la tabla de vida.
Palabras clave: Tablas de vida. Expectativa de vida. Supervivencia. Mortalidad.
Abstract: The differences in development time, survival, mortality and life expectancy were determined for three populations of the mosquito Culex quinquefasciatus from three temperature zones in the Cundinamarca department of Colombia: Mosquera (2516 m, 15°C), Fusagasugá (1728 m, 22°C) and Girardot (269 m, 33°C). The larvae and adults from each population were kept in laboratory conditions similar to those of their place of origin. Survival and mortality for each colony were recorded daily. For the statistical analysis, the Kruskal Wallis test was used with Bonferroni´s modification. Development times by site were as follows: Mosquera 15.05 days, Fusagasugá 10.62 days and Girardot 7.72 days. Significant differences were only found between Mosquera and Girardot, but by analysis of the development time for larvae separately, were significant differences among all three populations. Intrapopulation differences in the three cohorts were not significant. Survival and mortality of the pre-reproductive stages showed no significant differences in the three cohorts and survival showed a type-1 curve. The life expectancy for a recently oviposited egg from Girardot was 26.06 days, from Fusagasugá it was 24.12 days and from Mosquera it was 40.77 days. These data show that Culex quinquefasciatus has been adapting to higher elevation zones with lower temperatures without detriment to life table parameters.
Key Words: Life tables. Life expectancy. Survival. Mortality.
Introducción
Culex quinquefasciatus (Say, 1823) es un díptero tropicopolita y frecuentemente es el mosquito más abundante en zonas urbanas (Sarmiento et al. 1999; Antunes et al. 2006; Emgesa 2006; Calhoun et al. 2007). Se desarrolla en colecciones de agua estancada o de baja corriente, rica en materia orgánica o inorgánica incluidos elementos pesados, En muchos casos estos criaderos son producto de deficiencias sanitarias durante procesos de urbanización no controlados (Ribeiro et al. 2004). Dentro del género Culex se considera a C. quinquefasciatus como el de comportamiento más antropofílico y endofágico (Jupp 1978). Su importancia en salud pública radica en que es considerado vector de Wuchereria bancrofti Cobbold, 1877 y Dirofilaria immitis (Leidy, 1856) (Zagaria et al. 2002), y se ha relacionado con la transmisión de varios virus, incluidos el de la Encefalitis del Este, la Encefalitis Equina Venezolana y la Encefalitis Japonesa (Goddard 2000; Goddard et al. 2002).
Las molestias ocasionadas por las altas densidades y la alergia a la picadura también se han convertido en un problema de salud pública (Sarmiento et al. 1999).
El estudio de parámetros poblacionales: supervivencia, fecundidad, longevidad y los requerimientos ambientales asociados al desarrollo de los insectos, contribuyen en forma significativa al conocimiento epidemiológico de las enfermedades transmitidas por vectores, porque influyen directamente en su capacidad vectorial (Cárdenas et al. 1999; Castellanos et al. 2001; Dye 1992; Hashim et al. 2008). Por lo tanto, la determinación de la edad del vector se usa para evaluar el éxito de las medidas de control (Maciá 1997).
Begon et al. (2006) y Maharaj (2003) postulan que la historia de vida varía en respuesta a las condiciones ambientales prevalentes, lo que se conoce como plasticidad genotípica. Un ejemplo de ello es que un aumento de 0,5°C en la temperatura global, puede traducirse en un incremento del 30 al 100% en abundancia de mosquitos (Pascual et al. 2006).
C. quinquefasciatus tiene una distribución altitudinal muy amplia; en Colombia se ha registrado desde alturas cercanas a los 0 msnm hasta los 2600 msnm (Salazar 2004; González 2007; Carvajal et al. 2009). Se asume que el factor climático más importante ligado a la distribución altitudinal y que influye en la distribución y parámetros poblacionales es la temperatura, aunque también otro tipo de factores como la nutrición y la densidad larval, tienen una influencia considerable. Costa et al. (1994), encontraron que la temperatura limitante mínima para la ovipostura de C. quinquefasciatus fue de 5°C y la máxima de 40°C. Los estudios que se han hecho hasta el momento sobre la influencia de la temperatura en el desarrollo de C. quinquefasciatus han sido con cepas procedentes de laboratorio, sometidas a diferentes temperaturas. El objetivo del presente trabajo fue comparar las tablas de vida de tres poblaciones de C. quinquefasciatus procedentes de tres pisos térmicos.
Métodos
Área de estudio. Las formas adultas e inmaduras, del mosquito C. quinquefasciatus se recolectaron en los siguientes sitios: Centro Agropecuario Marengo, Mosquera, Km 12 Vía Bogotá-Mosquera, 2548 msnm, temperatura promedio 14°C (4º43´;N, 74°12´;W); la ciudad de Fusagasugá, 1728 msnm, temperatura promedio 22°C (4°21´;00"N, 74°24´;00"W) y la ciudad de Girardot, 289 msnm, y temperatura promedio 28°C (4°18´;00"N, 59°66´;00"W).
Recolección de mosquitos. Los mosquitos adultos parentales fueron capturados con trampa Shannon y aspirador bucal en los sitios de reposo, durante tres días, en cuatro ocasiones. A medida que los adultos se capturaban, se depositaban en vasos plásticos recubiertos con cartón para minimizar los posibles traumatismos. Posteriormente, los ejemplares se colocaron en jaulas Gerberg. Las formas inmaduras se recolectaron con cucharones plásticos, la mayoría de las veces en los floreros de los cementerios. Las larvas capturadas se colocaron en tubos de plástico de 50 ml. con el agua de origen, para su transporte al laboratorio. Todos los ejemplares se llevaron al laboratorio de entomología de la Universidad de La Salle.
Identificación de adultos. Los adultos se identificaron con las claves de Forattini (1965), La Casse y Yamaguti (1950), con base en las características morfológicas determinantes del género y especie, especialmente los genitales externos del macho.
Mantenimiento de estados reproductivos y oviposición. En el insectario de la Universidad de La Salle, los adultos se mantuvieron en jaulas Gerberg de 30x30x30 cm. Como fuente de carbohidratos se les proporcionó sacarosa al 10% mediante una esponja de algodón impregnada. Las hembras se alimentaron por un período promedio de dos horas, sobre un cobayo anestesiado (0,8 ml de pentotal / Kg peso del animal) e inmovilizado dentro de la jaula. Las condiciones de temperatura y humedad, monitoreadas permanentemente, fueron similares a las de los sitios de recolección: (Mosquera: 15°C, Fusagasugá: 21°C, Girardot: 28°C). Con el fin de lograr temperaturas estables se utilizaron cámaras climatizadas y separadas, una por cada colonia. Para la oviposición se colocaron recipientes plásticos con agua destilada reposada dentro de las jaulas, con el fin de simular el agua estancada del ambiente natural del mosquito.
Mantenimiento de estados pre-reproductivos. Las balsas con huevos depositadas en los recipientes, se llevaron a cubetas plásticas de 20x10x20 cm, con agua destilada reposada. Los estadíos inmaduros se alimentaron con concentrado molido para perro, bajo en grasa (0,5 mg/ml de H2O). Diariamente se verificaba el estado general de las larvas teniendo en cuenta su movilidad, la reacción a estímulos como la luz, el exceso o defecto de alimento, y la presencia de microorganismos parásitos como Vorticella sp. Los individuos que pasaban al estadío pupa, se trasferían a recipientes con agua y se transportaban a otra jaula Gerberg para su eclosión.
Ciclo de vida. Se tomaron aleatoriamente cuatro balsas de huevos, separando cuidadosamente 100 unidades de cada una. Los huevos se mantuvieron en recipientes individuales con agua destilada reposada. A medida que las larvas fueron eclosionando, se trasladaron a recipientes individuales (vasos de cría de 10x10x10 cm). Para cada prueba, se utilizaron 10 vasos de cría, y en cada vaso se depositaron 10 larvas hasta completar 100 larvas. Diariamente se registró el número de individuos en cada estadío, y el número de individuos muertos y sobrevivientes. A medida que los adultos eclosionaban, los imagos se trasladaban a jaulas independientes hasta completar 100 hembras y 100 machos. De igual forma, cada día se registró el número de adultos muertos y sobrevivientes. Se tomaron datos de estadíos reproductivos y prereproductivos de las generaciones F1, F2 y F3. Con estos datos, se elaboró para cada colonia una tabla de vida vertical, se calculó mortalidad, curva de supervivencia y curva de expectativa de vida.
Análisis estadístico. Para comparar los ciclos de vida de las poblaciones en estudio y determinar si había diferencias significativas, se aplicó el test no paramétrico Kruskal-Wallis, con la corrección de Bonferroni. Se utilizó el programa estadístico SPSS13 para el análisis de la homogeneidad de varianzas entre las diferentes poblaciones. Los datos de sobrevivencia se transformaron con base en log10, con el fin de minimizar la influencia de valores extremos. Las fórmulas utilizadas para el análisis de la tabla de vida fueron las planteadas por Southwood (1978), Begon et al. (2006) y Hashim et al. (2008).
Resultados
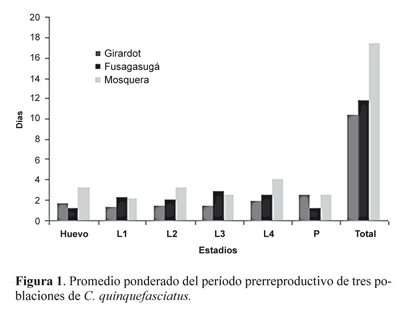
El promedio ponderado del total del período de desarrollo de los estadios inmaduros de la población procedente de Mosquera es más prolongado que el de Fusagasugá y éste mayor que el de Girardot (Fig. 1); sin embargo, cuando se observa por separado cada estadío, no se conserva ese mismo patrón en ninguna de los estadíos de las tres cohortes. La duración del ciclo de vida de la población de Mosquera y Girardot muestra diferencias significativas (Girardot vs. Mosquera Hc = 5.026, P = 0.024), mientras que la de Fusagasugá no presenta diferencias significativas con las otras dos poblaciones (Fusagasugá vs. Girardot, Hc = 0.4103, P = 0.52. Fusagasugá vs. Mosquera, Hc = 3.692, P = 0.054). La diferencia en los promedios (de las tres generaciones), de la duración de los ciclos de vida de las tres poblaciones es significativa P = 0.02 (Hc = 7.064).
En la cohorte de las hembras silvestres de Girardot, el tiempo de desarrollo total de los estadíos prereproductivos fue de 7,72 días, mientras que en la población de Fusagasugá fue de 10,62 días y en Mosquera de 15,05 días. El tiempo de desarrollo larval aumenta en dos días a la temperatura de 22°C, con relación al de Girardot, mientras que a 15°C. hay un aumento de seis días. Al comparar los períodos de desarrollo de los estadíos prerrepoductivos entre la F1, la F2 y la F3 para cada una de las poblaciones, no se encontraron diferencias significativas intrapoblacionalmente (para Girardot Hc = 0.162, P = 0,92; Fusagasugá Hc = 0.6068, P = 0.73; Mosquera Hc = 0.9864, P = 0.61). Teniendo en cuenta solamente el período de desarrollo larval se aprecia un aumento de dos días de la población de Fusagasugá y de seis días de la población de Mosquera, con respecto a la población de Girardot. La diferencia en los promedios (de las tres generaciones), de la duración de los ciclos de vida de las tres poblaciones es significativa P = 0.02 (Hc = 7.064).
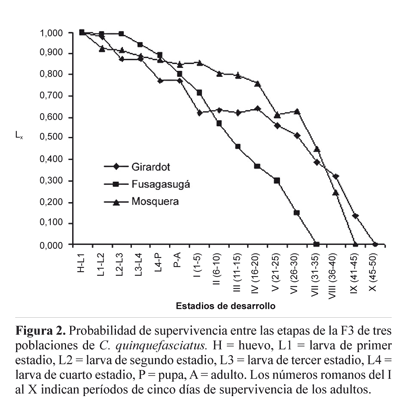
En la tabla 1 se muestran los resultados de los diferentes parámetros de vida de las cohortes-edad específica correspondientes a la generación F3 de cada una de las poblaciones. En las poblaciones de Fusagasugá y Girardot la proporción de sobrevivientes es igual hasta que alcanzan la edad de 1-5 días como adulto, en contraste con Mosquera, en la cual la proporción de sobrevivencia es diferente a las otras dos poblaciones para todas la edades. La edad en la que un individuo tiene la misma probabilidad de sobrevivir que de morir (Lx =0,5), se alcanza en las tres poblaciones en el estado adulto: Mosquera en el período 26 a 35 días, Fusagasugá de 11 a 15 días, y de Girardot de 16 a 25 días. El mayor valor de qx para los estadíos inmaduros en las poblaciones de Girardot y Fusagasugá correspondió al período de edad de pupa a adulto; en esta última población, el valor sobrepasa aún al de los adultos mas longevos. En Mosquera el mayor valor de qx corresponde a los adultos de 41-45 días.
En los análisis de los parámetros de tablas de vida (tabla 1), de los estadios prereproductivos utilizando Kruskal- Wallis, con la modificación de Bonferroni, se encontró que no hay diferencias significativas en el número de individuos: (Hc = 4,62, P = 0.10), sobrevivientes en cada etapa: (Hc=2.02, P = 0.36), en el número de individuos que mueren entre las etapas (dx): (Hc = 0.729, P = 0.69), y en la media de probabilidad de supervivencia (Hc = 2.047, P = 0.35).
La mayor supervivencia la muestra la población de Mosquera, seguida por la de Fusagasugá hasta el V período (entre 21 y 25 días) y finalmente la de Girardot (Fig. 2). Sin embargo, los adultos de la población de Fusagasugá tienen una menor longevidad que la de las otras dos poblaciones. En esta misma curva se aprecia que la tasa de supervivencia de los estadios inmaduros (lx) es alta (> 0,7) mientras que en el estado adulto la curva tiene un descenso notorio, por lo tanto se puede decir que la curva de supervivencia de las tres poblaciones de C. quinquefasciatus corresponde a una curva tipo I (Rabinovich 1980). No obstante, en la población de Girardot el patrón de supervivencia de los estadios inmaduros es muy irregular con un período crítico en el paso de pupa a adulto.
La mortalidad aparente se expresa en el porcentaje de individuos muertos en un estadio particular, en relación con los sobrevivientes del mismo estadio. Se utiliza para hacer comparaciones simultáneas entre factores de mortalidad independientes (Southwood 1978). En cuanto a este parámetro, la F1 de Girardot tiene un patrón ascendente; la población de Fusagasugá presenta el valor más alto en la larva L2, mientras que en la población de Mosquera se presenta en el estado de pupa.
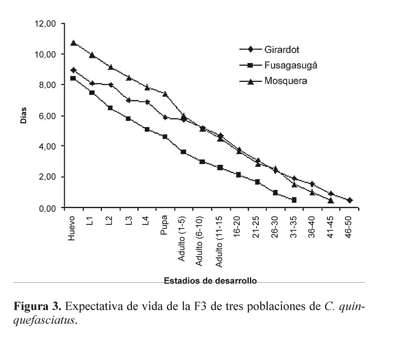
De igual forma a lo acontecido con la curva de supervivencia, las poblaciones de Fusagasugá y Mosquera exhiben una tendencia similar en su expectativa de vida, mientras que la de Girardot muestra un patrón irregular (Fig. 3). No obstante, hay periodos principalmente en la edad adulta, en los cuales las curvas de las poblaciones de Girardot y Mosquera se sobrelapan. La expectativa de vida de C. quinquefasciatus de un huevo recién puesto de la población de Girardot fue de 8,9 períodos, en la de Fusagasugá fue de 8,4 y en la de Mosquera 10,9 períodos. Si se suman los promedios del tiempo de desarrollo de cada uno de los estadíos prereproductivos, la expectativa de vida de la población de Girardot fue de 26,06 días, de Fusagasugá 24,12 días y de Mosquera 40,77 días.
Discusión
A diferencia de otros trabajos donde cepas de referencia de laboratorio son sometidas a diferentes temperaturas (Oda et al. 1980; Rueda et al. 1990; Ribeiro et al. 2004), en este estudio se usaron cepas capturadas en tres sitios del departamento de Cundinamarca, incluyendo datos de la cohorte de huevos obtenidos a partir de hembras silvestres, que se mantuvieron en las condiciones de temperatura promedio de las regiones de origen. En este sentido, las tablas de vida obtenidas en este trabajo podrían representar mejor la respuesta en parámetros de tablas de vida a las condiciones de temperatura de las localidades de origen y no ser únicamente la respuesta a un cambio inducido en el laboratorio.
Como ya ha sido planteado por otros autores, a mayor temperatura se disminuye el tiempo de duración del ciclo de vida (Clements 1992; Forattini 1965). Salazar y Moncada (2004) informan que en dos experimentos con la población de Mosquera bajo condiciones no controladas de laboratorio, en las que la temperatura, la humedad relativa y el fotoperíodo correspondían a las oscilaciones naturales, los ciclos duraron en promedio 15,8 días y 22,6 días. En este trabajo se obtuvo una duración del ciclo de vida que concuerda más con lo reportado por los mencionados autores. Como ha sido registrado por Rueda et al. (1990) y Ribeiro et al. (2004), a medida que aumenta la temperatura disminuye la duración del ciclo de vida; sin embargo, las diferencias observadas en esta investigación fueron menores, posiblemente porque las poblaciones de este estudio se mantuvieron en las condiciones de temperatura y humedad similares a los sitios en los que fueron capturadas las hembras progenitoras.
Al desglosar la información del ciclo de vida en sus estadíos se presentaron diferencias que no siguieron el mismo patrón que las exhibidas al analizar el ciclo en su totalidad. Las causas de estas desigualdades han sido controvertidas por diferentes autores; Hashim et al. (2008), informan que en un estudio con Aedes albopictus (Skuse, 1895) el tiempo de desarrollo de los estadíos se correlaciona principalmente con la temperatura. Por otra parte, Clements (1992), sugiere que en insectos holometábolos y en mosquitos en particular, hay tres aspectos básicos que afectan el crecimiento y desarrollo: temperatura, nutrición y densidad larval. Cualquier cambio en alguno de estos parámetros podría tener importante efecto en el ciclo de vida del mosquito. En este trabajo, debido a que la temperatura y humedad fueron controladas, indicaría que, al igual de lo manifestado por Clements (1992), hay otras condiciones extrínsecas e intrínsecas, como respuesta a factores diferentes a la temperatura ya sean tipo de alimentación, turbidez del agua, exposición a la luz, presión atmosférica, que están influenciando no sólo la variación de los estadíos de vida, sino también la mortalidad.
Según Costa et al. (1994), temperaturas menores a 5°C y mayores a 35°C inhiben el desarrollo de los estadíos inmaduros de C. quinquefasciatus; los autores sugieren que el rango de temperaturas en las que se desarrolla el insecto oscila entre 15 y 35°C, pero su temperatura óptima de desarrollo está entre 20 y 25°C. Esta idea también es soportada por los hallazgos de Oda et al. (1999), quienes informan que las tasas de pupación y de emergencia de adultos, fueron superiores a 21 y 25°C, que a 30°C. Lo anterior concuerda con las datos del presente estudio en los que la mortalidad del paso de pupa a adulto, de la población de Fusagasugá (22°C) es baja, lo cual puede indicar que las condiciones óptimas para el desarrollo de C. quinquefasciatus son aquellas de la población de Fusagasugá.
Al igual que lo reportado en otras especies como Ae. aegypti L., 1762, en temperaturas más altas (Girardot = 28°C) el ciclo de vida es más corto, pero la mortalidad es mayor, mientras que en las otras dos poblaciones (Fusagasugá y Mosquera) la mortalidad de pupas es nula; por lo tanto, el índice de pupas en poblaciones con temperaturas similares a Girardot no sería un indicador adecuado para conocer la productividad de los criaderos, al contrario de poblaciones que se crían con temperaturas medias y bajas como Fusagasugá y Mosquera en las que la cantidad de pupas es similar a la de adultos emergentes.
Con este estudio se puede concluir que las condiciones macroclimáticas de temperatura de las tres poblaciones estudiadas permiten el desarrollo de C. quinquefasciatus y que como ha sido informado por otros autores (Costa et al. 1994; Ribeiro 2004), si se dan las condiciones de acumulaciones de agua que tengan alto contenido de materia orgánica, se convierten en ambientes propicios para lograr las densidades de población que se han reportado en diferentes sitios de Colombia. Como lo exponen Vianna et al. (1994), debido a que la temperatura en estas tres poblaciones es propicia para el desarrollo y supervivencia del vector, solamente controlando las condiciones de contaminación orgánica de las aguas de los criaderos se podrá controlar el vector.
Cuando se analiza la importancia de la temperatura frente a la supervivencia de las tres poblaciones se puede pensar que frente al calentamiento global C. quinquefasciatus se podría adaptar mejor a altitudes mayores, porque a pesar de las leves variaciones, se observa que la temperatura no tiene un impacto fuerte en la supervivencia de las formas inmaduras de este mosquito.
Como los índices de mortalidad y la supervivencia no fueron diferentes y la duración del ciclo de vida entre Girardot y Mosquera si mostró diferencias significativas, se puede inferir que puede haber migraciones pasivas (transporte humano u otras) o activas, entre las poblaciones estudiadas. No obstante, este fenómeno debe ser abordado con mayor profundidad, se debe estudiar si realmente existe un flujo genético entre poblaciones de diferentes altitudes.
Teniendo en cuenta que Tesh et al. 2004, informan que el límite inferior temperatura para la transmisibilidad de patógenos en el intervalo de 14-18°C, el cual coincide con las temperaturas promedio de la sabana de Bogotá; que este mosquito se ha convertido en una molestia sanitaria y un problema de salud pública para la población por las densidades tan altas que alcanza (Emgesa 2006), y que los resultados de esta investigación, en los que no se hallaron diferencias estadísticamente significativas en los parámetros de tablas de vida en las temperaturas de las tres poblaciones estudiadas, se evidencia la necesidad de una vigilancia entomológica del insecto en poblaciones con altitud similar a la de la sabana de Bogotá.
Agradecimientos
A La Universidad de La Salle por la financiación del proyecto y a la Universidad Nacional de Colombia.
Literatura citada
Antunes, S.; Toledo, M.; Natal, D. 2006. Aspectos da distribuicao de Culex (Culex) quinquefasciatus Say (Diptera, Culicidae) na regiao do Rio Pinheiros, na cidade de Sao Paulo, Brasil. Revista Brasilera de Entomologia 50 (3): 413-418. [ Links ]
Begon, M.; Townsend, C. R.; Harper, J. L. 2006. Life, death and life histories. Chapter IV, pp. 89-131. In: Ecology, from individuals to ecosystems. Fourth Edition. Blackwell Publishing. 738 p. [ Links ]
Calhoun, L. M.; Avery , M.; Jones, L. A.; Grunarto , K.; King, R.; Roberts , J.; Burkort , T. R. 2007. Combined sewage overflows (CSO) are major urban breeding sites for Culex quinquefasciatus in Atlanta Georgia. American Journal of Tropical Medicine and Hygiene 77 (3): 428-484. [ Links ]
Cárdenas, E.; Romo, G.; Santamaría , E.; Bello, F.; Ferro, C. 1999. Lutzomyia longiflocosa (Diptera: Psychodidae) posible vector en el foco de Leishmaniasis cutánea del municipio de Planadas, zona cafetera del Tolima. Biomédica 19: 239- 244. [ Links ]
Castellanos, S.; Bello, F. j.; Escovar , J.; Morales, A.; Olano, V. a. 2001. Estudio del ciclo de vida del mosquito Psorophora ferox (Diptera: Culicidae) en condiciones de laboratorio. Revista de Investigación de la Universidad de La Salle 1 (1): 59-67. [ Links ]
Carvajal , J. J.; Moncada, L. I.; Rodríguez, M. H.; Pérez, L. P.; Olano, V. A. 2009. Caracterización preliminar de los sitios de cría de Aedes (Stegomyia) albopictus (Skuse, 1894) (Diptera: Culicidae) en el municipio de Leticia, Amazonas, Colombia. Biomédica 29 (3): 413-423. [ Links ]
Clements, A. N. 1992. The biology of mosquitoes. Development, Nutrition and Reproduction. Chapman and Hall, London, 509 p. [ Links ]
Costa , P. R. P.; Vianna, E. E. S.; Silveria , P.; Ribeiro, P. B. 1994. Influencia de temperatura na longevidade e viabilidade do ciclo aquatico de Culex quinuqefasciatus Say, 1823 (Diptera: Culicidae) em condicoes de laboratorio. Revista Brasileira de Parasitologia Veterinaria 3 (2): 87-92. [ Links ]
Dye, C. 1992. The analysis of parasite transmission by bloodsucking insects. Annual Review of Entomology 37:1-19. [ Links ]
Emgesa. 2006. Embalse de El Muña, un reto para Emgesa. Disponible en: http://www.emgesa.com.co/eContent/newsdetail. asp?id=64&idcompany=3. Fecha última revisión: 7 mayo 2007. Fecha último acceso: [20 mayo 2009]. [ Links ]
Forattini , OP. 1965. Entomología médica. Culicini: Culex, Aedes e Psorophora. São Paulo: editora da Universidade de São Paulo. 506 p. [ Links ]
Goddard, J. 2000. Infectious Disease and Arthropods. Humana Press Inc. 229 p. [ Links ]
Goddard, L. b.; Roth, A. e.; Reisen, W. k.; Scott, T. w. 2002. Vector competence of California mosquitoes for West Nile Virus. Emerging Infectious Diseases 8 (12): 1385-1391. [ Links ]
González, R.; Gamboa, F., Perafán, O.; Suárez, M. F.; Montoya -Lerma, J. 2007. Experiencia de un análisis entomológico de criaderos de Aedes aegypti y Culex quinquefasciatus en Cali, Colombia. Revista Colombiana de Entomología 33 (2): 148-156. [ Links ]
Hashim, N. A.; Ahmad, A. H.; Md, Rawl , C. S.; Tahir, N. A.; Basari, N. 2008. Life tables study of immature Aedes albopictus (Skuse) (Diptera: Culicidae) during the wet and dry seasons in Penang, Malaysia. Southeast Asian Journal of Tropical Medicine and Public Health 39 (1): 1-9. [ Links ]
Jupp, P. G. 1978. Culex (Culex) pipiens pipiens Linnaeus and Culex (Culex) pipiens quinquefasciatus Say in South Africa: morphological and reproductive evidence in favor of their status as two species. Mosquito Systematics 10: 461-473. [ Links ]
La Casse W. J.; Yamaguti, S. 1950. Mosquito Fauna of Japan and Korea. Office of the Surgeon Hqs. 8th Army, APO 343. USAF School of Aviation Medicine Air University. Third revision. [ Links ]
Maciá, A. 1997. Age structure of Adult Mosquito (Díptera: Culicidae) Populations from Buenos Aires, Province, Argentina. Memorias do Instituto Oswaldo Cruz, Río de Janeiro 92 (2): 143-149. [ Links ]
Maharaj, R. 2003. Life table characteristics of Anopheles arabiensis (Diptera: Culicidae) under simulated seasonal conditions. Journal of Medical Entomology 40 (6): 737-742. [ Links ]
Oda, T.; Mori, A.; Ueda, M.; Kurokawa , K. 1980. Effects of Temperatures on the Oviposition and Hatching of Eggs in Culex pipiens molestus and Culex pipiens quinquefasciatus. Tropical Medicine 22 (3): 167-172. [ Links ]
Oda, T.; Uchida, K.; Mori, A.; Mine, M.; Eshita, Y.; Kurokawa, K.; Kato, K.; Tahara, H. 1999.Effects of high temperature on the emergence and survival of adult Culex pipiens molestus and Culex quinquefasciatus in Japan. Journal of American Mosquito Control Association 15(2): 153-156. [ Links ]
Pascual, M.; Ahumada, J. A.; Chaves , L. F.; Rodo, X.; Bouma, M. 2006. Malaria resurgence in the East African highlands temperature trends revisited. Proceedings of the National Academy of Sciences USA 103 (15): 5829-5834. [ Links ]
Rabinovich, J.E. 1980. Introducción a la Ecología de Poblaciones Animales. Compañía Ed. Continental, México City, México, 313 p. [ Links ]
Ribeiro, P. B.; Costa , P. R.; Loeck, A. E.; Vianna, E. E. S.; Silveira , Jr. P. 2004. Exigencias térmicas de Culex quinquefasciatus (Diptera: Culicidae) em Pelotas, Rio Grande do Sul, Brasil. Iheringia, Serie Zoologia, Porto Alegre 94 (2): 177-180. [ Links ]
Rueda, L. M.; Patel , K. J.; Axtell, R. C.; Stinner, R. E. 1990. Temperature-Dependente Developtment and Survival Rates of Culex quinquefasciatus and Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology 27 (5): 892 - 898. [ Links ]
Salazar, M. J.; Moncada, L. I. 2004. Ciclo de vida de Culex quinquefasciatus Say, 1826 (Diptera: Culicidae) bajo condiciones no controladas en Bogotá. Biomédica 24 (4): 385-392. [ Links ]
Sarmiento, M. I.; Idrovo, A. J.; Restrepo, M.; Díaz, M. P.; González, A. 1999. Evaluación del Impacto de la Contaminación del Embalse del Muña sobre la Salud Humana. Revista de Salud Pública 1 (2): 159-171. [ Links ]
Southwood, T. R. E.1978. Ecological Methods, with particular reference to the study of insect populations. Chapman and Hall, London, 524 p. [ Links ]
Tesh, R.; Parson, R; Siirin, M.; Randle, Y.; Sargent, C.; Guzmán, H.; Wuithiranyagool , S.; Higgs, S.; Vanlandimgham, D., Bala, H. A.; Haas, K. 2004. West Nile Virus activity, Gulf Coast Region, Texas and Louisiana. Emerging Infectious Diseases 10 (9): 1649-1652. [ Links ]
VIANNA, E.; COSTA, P. R. P.; RIBEIRO, P. B. 1994. Ovoposicão e longevidade de adultos do Culex quinquefasciatus (Say, 1826) (Diptera Culicidae) em condições ambientais, em Pelotas, RS. Revista Brasilera de Parasitología Veterinaria São Paulo 5 (1): 47-52. [ Links ]
Zagaria, N.; Savioli, L. 2002. Elimination of lymphatic filariasis: a public-health challenge. Annals of Tropical Medicine and Parasitology 96 (Suppl. 2): S3-S13. [ Links ]