Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.36 n.1 Bogotá jan./jun. 2010
Análisis morfológico y molecular evidencia problemas al identificar Anopheles nuneztovari (Diptera: Culicidae) por claves dicotómicas
Morphological and molecular analyses demonstrate identification problems of Anopheles nuneztovari (Diptera: Culicidae) using dichotomous keys
GIOVAN F. GÓMEZ1,2, ASTRID V. CIENFUEGOS1,3, LINA A. GUTIÉRREZ1,4, JAN E. CONN5 y MARGARITA M. CORREA1,6
1 Grupo de Microbiología Molecular, Escuela de Microbiología, Universidad de Antioquia. Calle 67 No. 53-108, 5-437. A.A. 1226, Medellín, Colombia.
2 Est. de Doctorado en Ciencias Básicas Biomédicas. Universidad de Antioquia. giovan_fernando@yahoo.com.ar.
3 M.Sc. Universidad de Antioquia. vanessa.cienfuegos@gmail.com.
4 Ph.D. Universidad de Antioquia. liangutibui@gmail.com.
5 Ph.D. Griffin Laboratory, Wadsworth Center, New York State Department of Health, USA. jconn@wadsworth.org.
6 Ph.D. mcorrea@quimbaya.udea.edu.co. Autor para correspondencia.
Recibido: 18-may-2009 - Aceptado: 20-feb-2010
Resumen: El Grupo Oswaldoi, subgénero Nyssorhynchus (Diptera: Culicidae), incluye 16 especies. Algunas de estas especies presentan una alta variabilidad morfológica intraespecífica y similitud interespecie; lo anterior puede ocasionar dificultad en la identificación de la hembra al usar las claves morfológicas, como ocurre con Anopheles nuneztovari, considerado vector primario de malaria en Colombia. En este trabajo se comparó la utilidad de cinco claves morfológicas para la identificación de especímenes A. nuneztovari recolectados en la localidad de Puerto Anchica, Montelibano, Córdoba, Colombia. Se analizaron tres relaciones morfométricas y se confirmó la identificación morfológica utilizando la técnica PCR-RFLP basada en secuencias ITS2. El análisis de 41 hembras usando las claves, mostró que los especímenes A. nuneztovari presentaron sobrelapamiento morfológico con otras especies del Grupo Oswaldoi, como: A. rangeli, A. oswaldoi, A. evansae y A. benarrochi. El análisis molecular confirmó que todos los especímenes corresponden a A. nuneztovari. Dado que el uso de claves morfológicas continúa siendo la estrategia de elección para la identificación de anofelinos, los resultados sugieren que en caso de especies problemáticas, es conveniente confirmar la identificación mediante herramientas moleculares desarrolladas con el respaldo de la identificación de estadios inmaduros.
Palabras clave: Identificación morfológica. Identificación molecular. Variación intraespecie. PCR-RFLP. Mosquitos.
Abstract: The Oswaldoi Group, subgenus Nyssorhynchus (Diptera: Culicidae), includes 16 species. Some of these species exhibit high intraspecific morphological variability and interspecific similarity; this can lead to difficulty in the identification of females by using morphological keys, as is the case with Anopheles nuneztovari, considered a primary malaria vector in Colombia. In this study we compared the usefulness of five morphological keys for the identification of A. nuneztovari specimens collected in the locality of Puerto Anchica, Montelibano, Córdoba, Colombia. Three morphometric ratios were analyzed and morphological identification results were confirmed using the PCR-RFLP technique based on ITS2 sequences. The analysis of 41 females using the keys showed that A. nuneztovari specimens presented overlap with other species of the Oswaldoi Group, such as A. rangeli, A. oswaldoi, A. evansae and A. benarrochi. Molecular analysis confirmed that all of the specimens corresponded to A. nuneztovari. Because the use of morphological keys continue to be a strategy of choice for the identification of anophelines, the results suggest that in the case of problematic species, it is convenient to confirm identification using molecular methods developed with the support of the identification of immature stages.
Key words: Morphological identification. Molecular identification. Intraspecific variation. PCR-RFLP. Mosquitoes.
Introducción
La malaria continúa siendo un problema de salud pública en Colombia con un registro de 110.480 casos durante el año 2007 (INS 2007). Mosquitos hembra del género Anopheles Meigen, 1818 son los responsables de la transmisión del Plasmodium Laveran, 1880 causante de la enfermedad. En el país, se han registrado 43 especies de Anopheles, once de éstas pertenecen al subgénero Nyssorhynchus Blanchard, 1902 (Diptera: Culicidae), en el cual se incluyen las especies consideradas vectores primarios de malaria: A. albimanus Wiedemann, 1821, A. darlingi Root, 1926, A. nuneztovari (Gabaldón, 1940) (Olano et al. 2001). Este subgénero contiene especies crípticas y hermanas (Faran 1980), que al presentarse en simpatría, dificultan su identificación. En algunos casos, la identificación correcta puede lograrse mediante la observación de todos los estadios de vida del mosquito o del análisis de los genitales de los machos, sin embargo, esto implica procedimientos más complejos y prolongados (Fritz et al. 2004) al punto que los caracteres externos pueden no ser suficientes para una adecuada identificación debido a la gran variabilidad fenotípica intraespecífica y similitud interespecífica (Fernández et al. 2004).
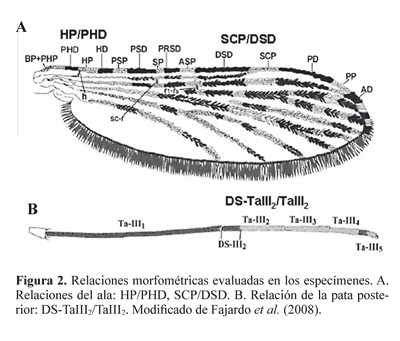
La correcta identificación de las especies anofelinas es esencial para lograr una mejor comprensión de la dinámica de transmisión de la malaria y para el desarrollo satisfactorio de los estudios de resistencia a insecticidas y de incriminación vectorial (Brochero y Quiñones 2008). La información obtenida permite el diseño, monitoreo y evaluación de medidas integradas y selectivas de control vectorial a nivel local y regional, como ha sido recomendado por la Organización Mundial de la Salud (Collins et al. 2000; WHO 2003). Los métodos empleados actualmente para la identificación de las especies anofelinas incluyen estrategias de tipo morfológico (Sallum et al. 2002; Fajardo et al. 2008) y molecular (Fritz et al. 2004; Zapata et al. 2007; Cienfuegos et al. 2008). El estudio de la quetotaxia de las larvas de cuarto instar y de los caracteres morfológicos de los genitales de los machos han sido los caracteres recomendados para la determinación de especies (Faran 1980; Flores-Mendoza et al. 2004), sin embargo, la estrategia usada frecuentemente en los estudios entomológicos de campo en Colombia es la identificación de las hembras anofelinas utilizando claves morfológicas (Quiñones et al. 1987; Pérez et al. 1999). En particular, para las hembras del subgénero Nyssorhynchus, Grupo Oswaldoi, tres relaciones morfométricas, entre otras características, han sido utilizadas a menudo para identificar las especies (Faran y Linthicum 1981; Suárez et al. 1988; Rubio-Palis 2000; González y Carrejo 2007; Fajardo et al. 2008). Estas tres relaciones comprenden: la longitud del área oscura del tarsómero II de la pata posterior / longitud total del tarsómero II (DS-TaIII2/TaIII2), la longitud de la mancha subcostal clara / la longitud de la mancha sectorial oscura distal (SCP/ DSD) y la longitud de la mancha clara humeral / la longitud de la mancha prehumeral oscura (HP/PHD) (Wilkerson y Peyton 1990).
Aunque los caracteres morfológicos se utilizan comúnmente en la identificación de anofelinos, éstos pueden presentar serias limitaciones durante la identificación de especies similares o indistinguibles morfológicamente (Norris 2002). En los últimos años, el desarrollo de metodologías moleculares ha permitido la correcta identificación de especies problemáticas (Van Bortel et al. 2001; Alam et al. 2007; Zapata et al. 2007; Cienfuegos et al. 2008). En particular, el análisis por PCR-RFLP (Polymerase Chain Reaction - Restriction Fragment Length Polymorphism: Reacción en Cadena de la Polimerasa - Polimorfismo del Tamaño de los Fragmentos de Restricción) del espaciador interno transcrito 2 (ITS2) del ADN ribosomal ha sido una de las metodologías más utilizadas para la diferenciación de numerosas especies de Anopheles, especialmente para aquellas que presentan sobrelapamiento en los caracteres de la hembra (Sallum et al. 2002; Garros et al. 2004; Li y Wilkerson 2005; Ruiz et al. 2005; Chen et al. 2006; Zapata et al. 2007; Matson et al. 2008). El análisis de secuencias ITS2 ha demostrado poseer una baja variabilidad intraespecie y mayor variabilidad interespecie, característica importante para lograr la correcta discriminación de las especies anofelinas (Marrelli et al. 2006; Zapata et al. 2007; Matson et al. 2008) y de otros insectos (Collins y Paskewitz 1996).
Anopheles (Nyssorhynchus) nuneztovari Gabaldón, 1940 es reconocido vector primario de malaria en Colombia (Olano et al. 2001; Gutiérrez et al. 2009) y ha sido incriminado en la transmisión de esta enfermedad en Perú (Hayes et al. 1987), Venezuela (Rubio-Palis 2000) y Brasil (Arruda et al. 1986; Tadei et al. 1998). Varios estudios han sugerido que esta especie es un complejo de especies hermanas y crípticas (Sallum et al. 2008), debido a la alta variabilidad morfológica intraespecífica observada en la hembra de A. nuneztovari (Hribar 1995; Fajardo et al. 2008), similitud interespecífica (Calle et al. 2008), diferencias ecológicas (Elliot 1972), variación fenotípica de los genitales masculinos (Hribar 1994) y diferencias genéticas entre poblaciones (Scarpassa et al. 1999; Mirabello y Conn 2008). Investigaciones realizadas con anofelinos de Colombia han dado cuenta de la posibilidad de una identificación errada de los especímenes A. nuneztovari debido al sobrelapamiento morfológico con otras especies (Zapata et al. 2007; Cienfuegos et al. 2008; Gutiérrez et al. 2008), por lo que en estas investigaciones se ha sugerido el uso de la prueba molecular PCR-RFLP-ITS2 para lograr una adecuada identificación de la especie. Con el fin de determinar la utilidad de caracteres morfológicos específicos en la identificación de especímenes A. nuneztovari usando las claves disponibles, en el presente trabajo se analizaron los rangos de las tres relaciones morfométricas, HP/PHD, SCP/DSD, DS-TaIII2/TaIII2, en comparación con los rangos reportados por varios autores y se utilizó la técnica molecular PCR-RFLP-ITS2 para confirmar la identificación de los mosquitos A. nuneztovari recolectados en la localidad de Puerto Anchica, Montelibano, departamento de Córdoba, Colombia.
Materiales y Métodos
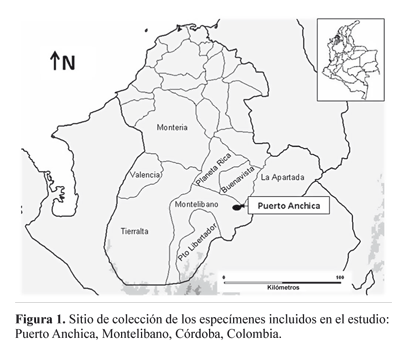
Área de estudio y recolección de mosquitos. Montelibano es el tercer municipio más extenso de Córdoba y tiene características de selva húmeda tropical, una temperatura promedio anual de 28°C y se encuentra ubicado a una altitud de 50 msnm (IGAC 2002). Reportes del IDEAM (2008) para los últimos cinco años, muestran que este municipio ha presentado una precipitación promedio anual de 2500 mm y humedad relativa del 78% en tiempo de sequía y de 81% en períodos de lluvia (mayo-septiembre). La malaria en este municipio constituye un problema grave de salud pública, para el año 2007 se presentó un IPA (Índice Parasitario Anual) de 101,9 y un registro durante el periodo 2001-2007 de 49.998 casos, lo cual representa el 20,4% del total de casos reportados en el departamento de Córdoba (Gobernación de Córdoba 2008). Los mosquitos hembra se recolectaron entre julio y noviembre de 2007, mediante cebo humano, usando un aspirador bucal (WHO 2003). La recolección se realizó entre las 18:00-06:00 horas en el intra y peridomicilio, en el corregimiento de Puerto Anchica (PA) (7°52’42"N, 75°51’51"W), Montelibano, Córdoba (Fig. 1). El protocolo de investigación fue aprobado por el Comité de Bioética del Centro de Investigaciones Médicas la Universidad de Antioquia (código CIM 0520 ADV).
Identificación morfológica. Se seleccionaron 41 mosquitos en buen estado y con un patrón de manchas del ala intacto para evaluarlos con respecto a las tres relaciones morfométricas (HP/PHD, SCP/DSD, DS-TaIII2/TaIII2) reportadas en las claves. Los mosquitos seleccionados se identificaron independientemente, utilizando cinco claves morfológicas: Faran y Linthicum (1981), Suárez et al. (1988), Delgado y Rubio- Palis (1993), Rubio-Palis (2000), González y Carrejo (2007). Adicionalmente, se evaluaron los rangos reportados por Calle et al. (2002) para estas tres relaciones morfométricas. Se realizó el montaje de las alas y una pata posterior de cada especimen como soporte de la identificación morfológica; el material restante se almacenó en etanol al 95%. Se utilizó un estereoscopio modelo BTB-3A (BOECO, Alemania) con ocular 20X con micrómetro (100 div= 10mm) y zoom 4,5X para medir la longitud de las siguientes manchas en la vena costa (Wilkerson y Peyton 1990): prehumeral oscura (PHD), humeral clara (HP), sectorial oscura distal (DSD), subcostal clara (SCP). Se midió la longitud total del tarsómero dos (TaIII2) y de su mancha oscura (DS-TaIII2). Las medidas se realizaron por duplicado y los valores reportados corresponden a la Media de estas mediciones. Para cada especimen se establecieron las tres relaciones más importantes que ayudan en la diferenciación de las especies del Grupo Oswaldoi: HP/ PHD, SCP/DSD y DS-TaIII2/TaIII2 (Fig. 2). Se realizó un análisis comparativo entre las relaciones para cada hembra y los rangos reportados en las claves morfológicas para determinar la especie.
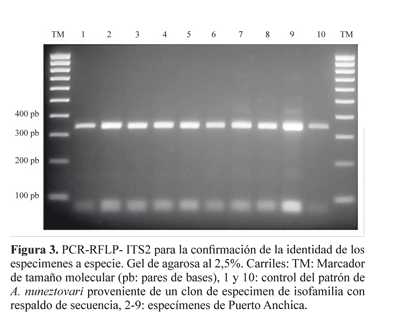
Identificación molecular. Se realizó una PCR-RFLP de la región ITS2 para confirmar la asignación de especie de los mosquitos identificados previamente usando las diferentes claves morfológicas. La región ITS2 se amplificó a partir de una pata agregada directamente a la reacción de amplificación y se utilizaron los cebadores reportados por Beebe y Saul (1995) y las condiciones de PCR y RFLP descritas por Zapata et al. (2007) y Cienfuegos et al. (2008).
Análisis estadístico. Los datos de las relaciones morfométricas, la identificación morfológica y molecular para cada individuo fueron tabulados utilizando el programa Microsoft Excel (Microsoft Corporation, Redmond, WA, USA). Los análisis estadísticos se realizaron usando el paquete GraphPad (GraphPad Prism versión 4.00 para Windows, San Diego, CA, USA).
Resultados
La identificación morfológica de los 41 especímenes varió dependiendo de la clave utilizada; según algunas de éstas, entre los individuos evaluados se presentaban varias de las especies del Grupo Oswaldoi: A. nuneztovari, A. rangeli Gabaldón, Cova García & López, 1940, A. oswaldoi (Peryassú, 1922), A. evansae (Brèthes, 1926) y A. benarrochi Gabaldón, Cova & López, 1941 (Tabla 1). Sin embargo, la identificación usando el marcador molecular mediante la PCR-RFLP de la región ITS2, reveló que todos los especímenes correspondían a A. nuneztovari (Fig. 3).
Uno de los caracteres discriminatorios definido en las claves taxonómicas para Anopheles de la Sección Albimanus, es la relación en la pata posterior de la mancha oscura del segundo tarsómero, respecto a la longitud del segmento DSTaIII2/ TaIII2. En los especímenes analizados se encontró un rango de 0,13-0,34 para esta relación, diferente a lo descrito por varios autores (Tabla 2); ninguno de estos rangos comprende los valores mínimo y máximo hallados en el presente estudio, excepto por el rango de 0,11-0,44 registrado por Delgado y Rubio-Palis (1993). Es importante resaltar que el valor más bajo encontrado para la relación DS-TaIII2/TaIII2 (0,13), es inferior a los valores reportados previamente (Tabla 2), lo que puede conducir a la identificación errónea de algunos mosquitos como A. oswaldoi, mientras que con la clave propuesta por Delgado y Rubio-Palis (1993), que reporta un límite inferior menor, si se logra una mejor aproximación a la identificación correcta de A. nuneztovari en esta localidad. Con respecto al límite superior, el valor establecido por Faran y Linthicum (1981) de 0,32, aunque próximo, es menor al encontrado de 0,34, lo cual también podría llevar a una identificación incorrecta del especimen.
Las manchas de la vena Costa del ala presentaron gran variabilidad. La relación HP/PHD varió entre 0,64-2,60, cuyo límite inferior es menor a lo señalado por Faran y Linthicum (1981), Suárez et al. (1988), Rubio-Palis (2000), Calle et al. (2002), y mayor a lo registrado en las claves de Delgado y Rubio-Palis (1993) y González y Carrejo (2007) (Tabla 2). Igualmente, la relación SCP/DSD presentó un rango de 0,28- 0,68, evidenciando que el límite inferior es menor al reportado por Calle et al. (2002) de 0,36, pero cercano a lo reportado por los otros autores previamente citados. El 63% de los mosquitos analizados presentaron una relación SCP/DSD mayor a 0,49 y se confirmaron por PCR-RFLP-ITS2 como A. nuneztovari, pero se identificaron erróneamente como A. rangeli cuando se usaron como guías las claves de Suárez et al. (1988) y Rubio-Palis (2000), que establecen una relación SCP/DSD menor a 0,49 para A. nuneztovari.
En general, el análisis de las tres relaciones morfométricas para cada mosquito utilizando cada una de las claves, mostró sobrelapamiento entre las relaciones morfométricas consideradas diagnósticas de especie en A. nuneztovari, con varias de las especies pertenecientes al Grupo Oswaldoi, y en todas las claves se encontraron casos donde no fue posible definir la identidad de algunos especímenes, presentándose el valor máximo de 73% con la clave de Rubio-Palis (2000) y el mínimo de 5% con la clave de Delgado y Rubio-Palis (1993) (Tabla 1); esto se debió a que no se encontró una correlación con los rangos propuestos en la literatura (Tabla 2). Los resultados mostraron que el porcentaje de individuos de A. nuneztovari identificados adecuadamente utilizando las claves morfológicas es variable dependiendo de los rangos de las relaciones morfométricas y características cualitativas definidas por el autor de cada clave; mientras que las claves de Delgado y Rubio-Palis (1993) y la de González y Carrejo (2007) permiten identificar adecuadamente un 78% y 63% de los individuos respectivamente, algunas claves como la de Suárez et al. (1988) señalan como A. nuneztovari sólo el 12%.
Discusión
La determinación de la distribución geográfica de las especies del subgénero Nyssorhynchus en el territorio Colombiano se ha basado principalmente en la identificación de la hembra utilizando las claves morfológicas, las cuales han sido diseñadas con especímenes recolectados en Centroamérica y otros países de Suramérica. Por este hecho, es importante la realización de trabajos como el presente, que evalúen las relaciones morfométricas consideradas diagnósticas de especies, sobre todo en aquellos anofelinos que como A. nuneztovari, presentan una alta variabilidad morfológica y sobrelapamiento con otras especies relacionadas filogenéticamente.
La alta variabilidad morfológica encontrada en especímenes A. nuneztovari de Puerto Anchica es similar a lo reportado en otras localidades de Antioquia (Calle et al. 2002), Córdoba (Fajardo et al. 2008), Venezuela (Delgado y Rubio-Palis 1992; Rubio-Palis 2000) y otras regiones de Latinoamérica (Faran y Linthicum 1981). Esta variabilidad intraespecífica y similitud interespecífica conlleva a los problemas de identificación reportados para esta especie.
El análisis comparativo de los especímenes de Puerto Anchica utilizando los patrones definidos por Fajardo et al. (2008) para mosquitos A. nuneztovari recolectados en Tierralta, municipio vecino a Montelibano (datos no mostrados), proporcionaron un panorama orientador de las variaciones que podrían estar presentes en los especímenes de Puerto Anchica. De acuerdo con ello, el 90% de los mosquitos corresponderían a A. nuneztovari, y el 10% restante posiblemente se identificarían erróneamente como otras especies del Grupo Oswaldoi. Fajardo et al. (2008) también definieron siete patrones morfológicos para la hembra de A. nuneztovari, basándose fundamentalmente en la presencia o ausencia de manchas claras y oscuras en la vena Costa del ala y con ellos establecieron los rangos para las tres relaciones en cada uno de los patrones descritos. Basados en la descripción de estos patrones, el 80% de los especímenes de Puerto Anchica identificados como A. nuneztovari, corresponderían al patrón I, que los autores definieron como el patrón estándar definido por Faran (1981) y Wilkerson y Peyton (1990), y el 20% restante corresponderían al patrón III, caracterizado por una mancha proximal de mayor tamaño que el patrón I, dado que corresponde a la fusión de las manchas Sectorial Clara (SP), Sectorial Oscura Proximal (PRSD) y el Sector Claro Accesorio (ASP); fusión que se denomina Sectorial Oscura Distal (DSD). Lo anterior, demuestra una vez más, la utilidad de la caracterización de las variaciones morfológicas para permitir una identificación más precisa.
La identificación de los especímenes usando caracteres morfológicos indicó la presencia de varias especies del Grupo Oswaldoi, sin embargo, el análisis molecular permitió la confirmación de todos los especímenes como A. nuneztovari, así, los resultados concuerdan con los problemas de identificación reportados con frecuencia en la literatura. Ruiz et al. (2005), al confirmar con datos moleculares las identificaciones de especímenes designados como A. evansae en el departamento del Putumayo, determinaron la presencia de una nueva especie, denominada A. benarrochi B. También, Zapata et al. (2007) en la localidad de San Pedro de Urabá, Antioquia, utilizando una prueba molecular, lograron la asignación correcta a especie de especímenes que por claves taxonómicas se identificaban como A. oswaldoi, A. rangeli, y A. strodei Root, 1926, pero su patrón molecular correspondió a A. nuneztovari. Esto se presenta en parte porque A. rangeli y A. nuneztovari son especies hermanas con alta similitud morfológica en la hembra (Faran 1980), lo cual ha conducido a que frecuentemente especímenes de A. nuneztovari sean reportados como A. rangeli.
Calle et al. (2008) implementaron un análisis de morfometría geométrica para diferenciar especies del subgénero Nyssorhynchus, entre ellas a A. nuneztovari, sin embargo, concluyen que las hembras de A. oswaldoi y A. benarrochi B sólo pueden ser separadas usando una prueba molecular. Lo anterior, demuestra la pertinencia de conducir análisis moleculares para confirmar la identificación de especies con caracteres morfológicos altamente variables o con similitud morfológica; es posible incluso, que con el uso de estas técnicas en inventarios de especies anofelinas se pueda determinar especies del subgénero Nyssorhynchus aún no descritas en el país, como ya se ha demostrado (Ruiz et al. 2005). Por el contrario, también es posible descubrir que la diversidad de especies de Anopheles es menor a la reportada.
En general, para Colombia se conocen las áreas de distribución de A. nuneztovari (Olano et al. 2001), y en ellas se presentan diferencias ambientales y ecológicas, como la altitud, precipitación, humedad relativa, vegetación, entre otras (IGAC 2002). Estos factores influyen en la plasticidad fenotípica de los organismos (Anyanwu et al. 1997), lo que podría facilitar cambios en su fenotipo como ha sido documentado en los anofelinos (Whitman y Ananthakrishnan 2009; Dujardin et al. 2008; Jirakanjanakit et al. 2008; Leisnham et al. 2008). Caracteres morfométricos como los de alas, pueden evolucionar distintamente: tamaño, proporciones y posiblemente hasta la coloración sufren plasticidad dependiente del microambiente; mientras que la forma (sin deformación alométrica), está ampliamente determinada por herencia genética cuantitativa (Dujardin et al. 2008). Al respecto, Le Sueur et al. (1992), encontraron que A. merus Donitz, 1902, una especie del complejo Gambiae, presentó variación alométrica entre las manchas claras y oscuras dependiendo de la temperatura.
Adicionalmente, es posible que la significancia evolutiva y taxonómica de los tamaños de las manchas en el ala no sean proporcionales a su conformación geométrica ya que estas estructuras son efecto directo del número de células y posiblemente tienen una determinación embriológica más controlada, mientras que las manchas son producto de la distribución de pigmentos (Edwards et al. 2007). Datos preliminares indican que en A. nuneztovari las coloraciones alares y tarsales varían entre generaciones próximas (Trujillo et al. 2005), lo cual sugiere que estas manchas no son caracteres muy confiables para la identificación de A. nuneztovari. Otro aspecto que puede influir, es el efecto de procesos microevolutivos, según los cuales, el tamaño, la forma y quizás la coloración pueden cambiar en pocos años (Jirakanjanakit et al. 2008); por lo tanto, las claves morfológicas que fueron de utilidad años atrás, en la actualidad pueden ser no válidas.
Teniendo en cuenta que los vectores de malaria en Colombia, entre ellos A. nuneztovari, tienen una amplia distribución en regiones con diferentes condiciones climáticas y ambientales (Gutiérrez et al. 2009; Olano et al. 2001), el entendimiento de los factores que influencian la plasticidad fenotípica de mosquitos Anopheles sería de gran relevancia para establecer la utilidad y el valor predictivo que posee la caracterización de relaciones morfométricas para la identificación taxonómica de especies altamente relacionadas.
Conclusiones
Este trabajo, basado en el análisis de las relaciones morfométricas de especímenes de A. nuneztovari y de una estrategia de identificación molecular, permitió mostrar la alta variacolombiana. Es importante realizar trabajos futuros usando herramientas como la morfometría geométrica y estrategias moleculares para analizar el grado de variabilidad morfológica y genética de los especímenes de A. nuneztovari a lo largo de su rango de distribución.
Los resultados sugieren que las claves morfológicas propuestas por Delgado y Rubio-Palis (1993) y González y Carrejo (2007) son las más convenientes para lograr la identificación correcta de los especímenes de A. nuneztovari. Así mismo, cuando se encuentren dentro de los ejemplares muestreados especímenes del Grupo Oswaldoi, se sugiere recurrir a las pautas reportadas por Fajardo et al. (2008). El problema que se ha presentado durante años, relacionado con la identificación de los miembros del subgénero Nyssorhynchus y en particular aquellos del Grupo Oswaldoi, podría reducirse con el desarrollo de estudios en los que se apliquen herramientas como la morfometría geométrica, la cual ha demostrado ser exacta y precisa en la asignación de especie, e inclusive se propone que a futuro se utilicen "claves métricas" y programas informáticos para facilitar su determinación. Igualmente, se plantea la implementación de herramientas moleculares debidamente estandarizadas que permitan confirmar la especie en casos problemáticos.
Agradecimientos
Agradecemos a J.J. González y M.I. Castro de la Unidad de Entomología, Laboratorio de Salud Pública, Secretaría de Salud Departamental, Córdoba, por la cooperación que hizo posible la recolección de especímenes. Este trabajo fue derivado de proyectos financiados por el Comité para el Desarrollo de la Investigación - CODI, Universidad de Antioquia (códigos 8700-1416 y 8700-039, a MMC). Se agradece al Programa Jóvenes Investigadores CODI-UdeA por el apoyo a GFGG.
Literatura citada
ALAM, M. T.; DAS, M. K.; DEV, V.; ANSARI, M. A.; SHARMA, Y. D. 2007. Identification of two cryptic species in the Anopheles (Cellia) annularis complex using ribosomal DNA PCRRFLP. Parasitology Research 100: 943-948. [ Links ]
ANYANWU, G. I.; DAVIES, D. H.; MOLYNEUX, D. H.; PHILLIPS, A. 1997. Variation in cuticular hydrocarbons among strains of Anopheles (Cellia) stephensi Liston possibly related to prior insecticide exposure. Annals of Tropical Medicine and Parasitology 91:649-659. [ Links ]
ARRUDA, M.; CARVALHO, M. B.; NUSSENZWEIG, R. S.; MARACIC, M.; FERREIRA A. W.; COCHRANE, A. H. 1986. Potential vectors of malaria and their different susceptibility to Plasmodium falciparum and Plasmodium vivax in northern Brazil identified by inmuno-assay. American Journal of Tropical Medicine and Hygiene 35: 873-881. [ Links ]
BEEBE, N. W.; SAUL, A. 1995. Discrimination of all members of the Anopheles puntulatus complex by polymerase chain reaction- restriction fragment length polymorphism analysis. American Journal of Tropical Medicine and Hygiene 53:478-481. [ Links ]
BROCHERO, H.; QUIÑONES, M. L. 2008. Retos de la entomología medica para la vigilancia en salud pública en Colombia: reflexión para el caso de malaria. Biomédica 28 (1): 18-24. [ Links ]
CALLE, D. A.; QUIÑONES, M. L.; ERAZO, H. F.; JARAMILLO, N. 2002. Morphometric discrimination of females of .ve species of Anopheles of the subgenus Nyssorhynchus from southern and northwest Colombia. Memórias do Instituto Oswaldo Cruz 97:1191-1195. [ Links ]
CALLE, D. A; QUIÑONES, M. L; ERAZO, H. F.; JARAMILLO, N. 2008. Discriminación por morfometría geométrica de once species de Anopheles (Nyssorhynchus) presentes en Colombia. Biomédica 28: 371-385. [ Links ]
CHEN, B.; BUTLIN, R. K.; PEDRO, P. M.; WANG, X. Z.; HARBACH, R. E. 2006. Molecular variation, systematics and distribution of the Anopheles fluviatilis complex in southern Asia. Medical and Veterinary Entomology 20 (1):33-43. [ Links ]
CIENFUEGOS, A.; CÓRDOBA, L.; GÓMEZ, G.; LUCKHART, S.; CONN, J.; CORREA, M. 2008. Diseño y evaluación de metodologías basadas en PCR-RFLP de ITS2 para la identificación molecular de mosquitos Anopheles spp. (Diptera: Culicidae) de la Costa Pacífica de Colombia. Revista Biomédica 19 (1): 35-44. [ Links ]
COLLINS, F. H.; PASKEWITZ, S. M. 1996. A review of the use of ribosomal DNA (rDNA) to differentiate among cryptic Anopheles species. Insect Molecular Biology 5 (1): 1-9. [ Links ]
COLLINS, F. H.; KAMAU, L.; RANSON, H. A.; VULULE, J. M. 2000. Molecular entomology and prospects for malaria control. Bulletin of the World Health Organization 78 (12):1412-1423. [ Links ]
DELGADO, N.; RUBIO-PALIS, Y. 1992. Morphometric characterization of the malaria vector Anopheles nuneztovari (Diptera: Culicidae) from western Venezuela. Mosquito Systematics 24:231-241. [ Links ]
DELGADO, N.; RUBIO-PALIS, Y. 1993. Identification of Anopheles (Nyssorhynchus) (Diptera:Culicidae) occurring in Western Venezuela. Mosquito Systematics 25 (3):222-230. [ Links ]
DUJARDIN, J. P. 2008. Morphometrics applied to medical entomology. Infection, Genetics and Evolution 8: 875-890. [ Links ]
EDWARDS, K. A.; DOESCHER, L. T.; KANESHIRO, K. Y.; YAMAMOTO, D. 2007. A database of wing diversity in the Hawaiian Drosophila. PLoS One 2 (5): 487. [ Links ]
ELLIOT, R. 1972. The influence of vector behavior on malaria transmission. American Journal of Tropical Medicine and Hygiene 21: 755-763. [ Links ]
FAJARDO, M.; GONZÁLEZ, R.; FIDEL, M.; LÓPEZ, D.; WILKERSON, R.; SALLUM, M. A. 2008. Morphological analysis of three populations of Anopheles (Nyssorhynchus) nuneztovari Gabaldón (Diptera: Culicidae) from Colombia. Memórias do Instituto Oswaldo Cruz 103 (1): 85-92. [ Links ]
FARAN, M. E. 1980. Mosquito studies (Diptera: Culicidae) XXXIV. A revision of the Albimanus section of the subgenus Nyssorhynchus of Anopheles. Contributions of the American Entomological Institute 15:1-214. [ Links ]
FARAN, M. E.; LINTHICUM, K. J. 1981. A handbook of the Amazonian species of Anopheles (Nyssorhynchus) (Diptera: Culicidae). Mosquito Systematics 13: 1-81. [ Links ]
FERNÁNDEZ, R.; SCHOELER, G.; STANCIL, J. 2004. Presencia de Anopheles (Nyssorhynchus) benarrochi en áreas de selva con transmisión malárica. Revista Peruana de Medicina Experimental y Salud Pública 21 (4):217-222. [ Links ]
FLORES-MENDOZA, C.; PEYTON, E.; WILKERSON, R.; LOURENÇO- DE-OLIVEIRA, R. 2004. Anopheles (Nyssorhynchus) konderi Galvão and Damasceno: neotype designation and resurrection from synonymy with Anopheles (Nyssohynchus) oswaldoi (Diptera: Culicidae). Proceedings of the Entomological Society of Washington 106:118-132. [ Links ]
FRITZ, G.; ENGMAN, S.; RODRIGUEZ, R.; WILKERSON, R. 2004. Identification of four vectors of human Plasmodium spp. by multiplex PCR: Anopheles rangeli, An. strodei, An. triannulatus, and An. trinkae (Diptera: Culicidae: Nyssorhynchus). Journal of Medical Entomology 41:1111-1115. [ Links ]
GARROS, C; KOEKEMOER, L. L.; KAMAU, L.; AWOLOLA, T. S.; VAN BORTEL, W.; COETZEE, M.; COOSEMANS, M.; MANGUIN, S. 2004. Restriction fragment length polymorphism method for the identification of major African and Asian malaria vectors within the Anopheles funestus and An. minimus groups. American Journal of Tropical Medicine and Hygiene 70 (3): 260-265. [ Links ]
GOBERNACIÓN DE CÓRDOBA. 2008. Situación epidemiológica del programa de enfermedades transmitidas por vectores. Secretaría de desarrollo de la salud, Montería, Córdoba, Colombia. 19 p. [ Links ]
GONZÁLEZ, R.; CARREJO, N. 2007. Introducción al estudio taxonómico de Anopheles de Colombia: claves y notas de distribución. Universidad del Valle, Cali, Colombia. 237 p. [ Links ]
GUTIÉRREZ, L. A; NARANJO, N.; JARAMILLO, L. M.; MUSKUS, C. M.; LUCKHART, S.; CONN J. E.; CORREA M. M. 2008. Natural infectivity of Anopheles species from the Pacific and Atlantic Regions of Colombia. Acta Tropica 107: 99-105. [ Links ]
GUTIÉRREZ, L. A; GONZÁLEZ, J. J.; CASTRO, M. I.; GÓMEZ, G. F.; ROSERO, D. A.; LUCKHART, S.; CONN, J. E.; CORREA, M. M. 2009. Species composition and natural infectivity of anthropophilic Anopheles (Diptera: Culicidae) in states of Córdoba and Antioquia, Northwestern Colombia. Memórias do Instituto Oswaldo Cruz 104 (8): 1117-1124. [ Links ]
HAYES, J.; CALDERON, G.; FALCON, R.; ZAMBRANO, V. 1987. Newly incriminated anopheline vectors of human malaria parasites in Junin Department, Peru. Journal of American Mosquito Control Association 33: 418-422. [ Links ]
HRIBAR, L. J. 1994. Geographic variation of male genitalia of Anopheles nuneztovari (Diptera: Culicidae). Mosquito Systematics 26: 132-144. [ Links ]
HRIBAR, L. J. 1995. Costal wing spot variations within and among progeny of single female Anopheles nuneztovari (Diptera: Culicidae). Mosquito Systematics 27: 1-10. [ Links ]
INSTITUTO DE HIDROLOGÍA, METEOROLOGÍA Y ESTUDIOS MEDIOAMBIENTALES (IDEAM). 2008. Disponible en: http://www.ideam.gov.co. Fecha última revisión: 1 octubre 2008. [ Links ]
INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI (IGAC). 2002. Atlas de Colombia. Bogotá. Diccionario geográfico de Colombia. Bogotá, Colombia. 342 p. [ Links ]
INSTITUTO NACIONAL DE SALUD - INS. SIVIGILA. 2007. Boletín Epidemiológico. Semana Epidemiológica 52. Subdirección de Vigilancia y Control en Salud Pública. Disponible en: http://www.ins.gov.co/vigilancia/nivel2.php?seccion=34. Fecha última revisión: 2 septiembre 2008. [ Links ]
JIRAKANJANAKIT, N.; LEEMINGSAWAT, S.; DUJARDIN J. P. 2008. The geometry of the wing of Aedes (Stegomyia) aegypti in isofemale lines through successive generations. Infection, Genetics and Evolution 8: 414-421. [ Links ]
LE SUEUR, D.; SHARP, B. L.; APPLETON, C. C. 1992. Dark-scaled areas on adult Anopheles mosquitoes are selectively affected by temperature-related size variation. Medical and Veterinary Entomology 6: 396-398. [ Links ]
LEISNHAM, P. T.; SALA, L. M.; JULIANO, S. A. 2008. Geographic variation in adult survival and reproductive tactics of the mosquito Aedes albopictus. Journal of Medical Entomology 45 (2): 210-221. [ Links ]
LI, C; WILKERSON, R. C. 2005. Identification of Anopheles (Nyssorhynchus) albitarsis complex species (Diptera:Culicidae) using rDNA ITS2-based PCR primers. Memórias do Instituto Oswaldo Cruz 100: 495-500. [ Links ]
MARRELLI, M. T.; SALLUM, M. A.; MARINOTTI, O. 2006. The second internal transcribed spacer of nuclear ribosomal DNA as a tool for Latin American anopheline taxonomy: a critical review. Memórias do Instituto Oswaldo Cruz 101: 817-832. [ Links ]
MATSON, R.; RIOS, C. T.; CHAVEZ, C. B.; GILMAN, R. H.; FLORIN, D.; SIFUENTES, V. L.; GREFFA, R. C.; YORI, P. P.; FERNANDEZ, R.; PORTOCARRERO, D. V.; VINETZ, J. M.; KOSEK, M. 2008. Improved molecular technique for the differentiation of neotropical anopheline species. American Journal of Tropical Medicine and Hygiene 78 (3): 492-498. [ Links ]
MATSON, R.; RIOS, C. T.; CHAVEZ, C. B.; GILMAN, R. H.; FLORIN, D.; SIFUENTES, V. L.; GREFFA, R. C.; YORI, P. P.; FERNANDEZ, R.; PORTOCARRERO, D. V.; VINETZ, J. M.; KOSEK, M. 2008. Improved molecular technique for the differentiation of neotropical anopheline species. American Journal of Tropical Medicine and Hygiene 78 (3): 492-498.
MIRABELLO, L.; CONN, J. E. 2008. Population analysis using the nuclear white gene detects Pliocene/Pleistocene lineage divergence within Anopheles nuneztovari in South America. Medical and Veterinary Entomology 22: 109-119. [ Links ]
NORRIS, D. E. 2002. Genetic markers for study of the anopheline vectors of human malaria. International Journal for Parasitology 32 (13): 1607-1615. [ Links ]
OLANO, V.; BROCHERO, H.; SÁENZ, R.; QUIÑONES, M.; MOLINA, J. 2001. Mapas preliminares de la distribución de especies de Anopheles vectores de malaria en Colombia. Biomédica 21: 402-408. [ Links ]
PÉREZ, L.; SUÁREZ, M.; MURCIA, L.; DE LA HOZ, F.; OLANO, V. A.; BROCHERO, H. 1999. La malaria en el Amazonas conocimientos, prácticas, prevalencia de parasitemia y evaluación entomológica en mayo de 1997. Biomédica 19: 93-102. [ Links ]
QUIÑONES, M. L; SUÁREZ, M. F; FLEMING, G. A. 1987. Distribución y bionomía de los anophelinos en la Costa Pacífica de Colombia. Colombia Médica 16: 19-24. [ Links ]
RUBIO-PALIS, Y. 2000. Anopheles (Nyssorhynchus) de Venezuela: taxonomía, bionomía, ecología e importancia médica. Escuela de Malariología y Saneamiento Ambiental "Doctor Arnoldo Gabaldon". Maracay, Venezuela. 118 p. [ Links ]
RUIZ, F.; QUIÑONES, M. L.; ERAZO, H.; CALLE, D.; ALZATE, J.; LINTON, Y. M. 2005. Molecular differentiation of Anopheles (Nyssorhynchus) benarrochi and An. (N.) oswaldoi from Southern Colombia. Memórias do Instituto Oswaldo Cruz 100: 155-160. [ Links ]
SALLUM, M. A.; BERGO, E. S.; FLORES, D. C.; FORATTINI, O. P. 2002. Systematic studies on Anopheles galvaoi Causey, Deane & Deane from the subgenus Nysssorhynchus blanchard (Diptera: Culicidae). Memórias do Instituto Oswaldo Cruz 97 (8): 1177-1189. [ Links ]
SALLUM, M. A.; MARRELLI, M. T.; NAGAKI S. S.; LAPORTA G. Z.; DOS SANTOS, C. L. 2008. Insight into Anopheles (Nyssorhynchus) (Diptera: Culicidae) species from Brazil. Journal of Medical Entomology 45 (6): 970 -981. [ Links ]
SCARPASSA, V. M.; TADEI, W. P.; SUÁREZ, M. F. 1999. Population structure and genetic divergence in Anopheles nuneztovari (Diptera: Culicidae) from Brazil and Colombia. The American Journal of Tropical Medicine and Hygiene 60 (6): 1010-1018. [ Links ]
SUÁREZ, M. F.; QUIÑONES, M. L.; ROBAYO, M. A. 1988. Clave para la determinación taxonómica de larvas y adultos hembras de los principales anofelinos de Colombia. Ministerio de Salud, Bogotá, Colombia. 49 p. [ Links ]
TADEI W. P.; DUTARY, T. B.; SANTOS, J.; SCARPASSA, V.; RODRIGUES, I. B.; SILVA, R. M. 1998. Ecologic observations on anopheline vectors of malaria in the Brazilian Amazon. American Journal of Tropical Medicine and Hygiene 59 (2): 325-335. [ Links ]
TRUJILLO, A.; AGUDELO, O.; MOLINA, P.; MORENO, M.; ZAPATA, M; LUCKHART, S.; CORREA, M. 2005. Análisis de PCR-RFLP del espaciador interno transcrito ITS1 y caracterización de las variaciones morfológicas de isofamilias de Anopheles nuneztovari, San Pedro de Urabá, 2004. Laboratorio Actual 38: 81. [ Links ]
VAN BORTEL, W; HARBACH, R. E; TRUNG, H. D; ROELANTS, P; BACKELJAU, T; COOSEMANS, M. 2001. Confirmation of Anopheles varuna in Vietnam previously misidentified and mistargeted as the malaria vector Anopheles minimus. American Journal of Tropical Medicine and Hygiene 65: 729-732. [ Links ]
WHITMAN, D. W.; ANANTHAKRISHNAN, T. N. 2009. Phenotypic plasticity of insects: mechanisms and consequences. Science Publishers, Enfield, NH, USA. 904 p. [ Links ]
WILKERSON, R. C.; PEYTON, E. L. 1990. Standardized nomenclature for the costal wing spots of the genus Anopheles and other spotted-wing mosquitoes (Diptera: Culicidae). Journal of Medical Entomology 27: 207-224. [ Links ]
WORLD HEALTH ORGANIZATION. 2003. Malaria entomology and vector control. Learner´s guide. Geneva: WHO. 109 p. [ Links ]
ZAPATA, M. A.; CIENFUEGOS, A. V.; QUIRÓS, O. I.; QUIÑONES, M. L.; LUCKHART, S.; CORREA, M. M. 2007. Discrimination of seven Anopheles species from San Pedro de Urabá, Antioquia, Colombia, by polymerase chain reaction-restriction fragment length polymorphism analysis of ITS sequences. American Journal of Tropical Medicine and Hygiene 77 (1): 67-72. [ Links ]