Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.36 no.1 Bogotá Jan./June 2010
Sección Básica
Diversidad de invertebrados de musgos corticícolas en la región del volcán Iztaccíhuatl, Estado de México
Invertebrate diversity from corticolous moss in the Iztaccíhuatl Volcano region, Mexico State
LEOPOLDO Q. CUTZ-P.1, ARTURO GARCÍA-G., GABRIELA. CASTAÑO-M. y JOSÉ G. PALACIOS-V.
1 Técnico, Ecología y Sistemática de Microartrópodos. Departamento de Ecología y Recursos Naturales, Facultad de Ciencias, UNAM. 04510 México, D. F. 56 22 49 02. cutzpool@yahoo.com
Resumen: Se comparó la diversidad de los invertebrados en musgos corticícolas a través de un gradiente altitudinal en la ladera NorOriental del Volcán Iztaccíhuatl, en el centro de México. Se registraron 16 taxa de invertebrados de musgos corticícolas, de ellos, los Mesostigmata, Prostigmata, Astigmata y Cryptostigmata presentaron la mayor abundancia, con el 81%. Los Mesostigmata mostraron su máxima abundancia relativa (45%) a los 3.020 m, los Prostigmata a los 2.830 m (44%), Astigmata a los 2.750 m (12%), y Cryptostigmata (75%) a los 3.250 m. Existe una variación espacial en la densidad de los invertebrados; la mayor densidad se registró a los 3.250 m. y la menor a los 2.750 m. La diversidad presentó sus mayores valores entre los 2.750 m y los 2.930 m. La mayor similitud se presentó entre los 2.750 m y los 2.930 m. En Opilionida, Cryptostigmata y Psocoptera se encontró una correlación positiva entre altitud y su densidad mientras que las densidades de los taxones Oligochaeta, Aranaea y Hemiptera mostraron una correlación negativa con la altitud.
Palabras clave: Diversidad. Collembola. Astigmata. Prostigmata. Cryptostigmata. Psocoptera.
Abstract: The diversity of invertebrates in corticolous moss was compared along an altitudinal gradient on the NW slope of the Iztaccíhuatl Volcano, in the central part of Mexico. Sixteen taxa of invertebrates from corticolous moss were recorded, among which the Mesostigmata, Prostigmata, Astigmata and Cryptostigmata were the most abundant, making up 81%. The Mesostigmata showed their maximum abundance (45%) at 3.020 m elevation, Prostigmata at 2.830 m (44%), Astigmata at 2.750 m (12%) and Cryptostigmata (75%) at 3,250 m. There was spatial variation in the density of invertebrates; the highest density was found at 3.250 m and the lowest at 2.750 m. The highest diversity was recorded between 2.750 and 2.930 m. The highest similarity was observed between 2.750 and 2.930 m. For the Opilionida, Cryptostigmata and Psocoptera there was a positive correlation between altitude and density while the density of Oligochaeta, Araneae and Hemiptera was negatively correlated with altitude.
Key words: Diversity. Collembola. Astigmata. Prostigmata. Cryptostigmata. Psocoptera.
Introducción
Los invertebrados y los musgos son elementos muy importantes en la función de los ecosistemas forestales, ya que contribuyen al aumento de la estabilidad del suelo. En el caso particular de los musgos éstos poseen una alta capacidad de retención de agua y por tanto son activos moderadores de la humedad ambiental. Además, los musgos pueden ser fundamentales en la captura y ciclado de los nutrientes, así como sustrato para germinación de las semillas de varios grupos vegetales (Matteri 1998; Ilkiu-Borges et al. 2004). Es común que ellos constituyan un hábitat de gran relevancia para distintos grupos de invertebrados (Andrew et al. 2003; Hoyle y Harborne 2005). La estabilidad que poseen los musgos ante variaciones microclimáticas (Kidron et al. 2000) les permite sobrevivir a condiciones ambientales extremas, por ejemplo en ambientes áridos o bien a grandes altitudes (Franks y Bergstrom 2000), por lo que son ocupados por diversos organismos como refugio o bien hábitat permanente (Ilkiu-Borges et al. 2004). La asociación invertebrado-musgo ha sido abordada por autores como Gadea (1964) y Gerson (1969) investigando la zoocenosis y la dependencia de invertebrados y musgo respectivamente; Bonet et al. (1975) tratan la ecología de ciertos artrópodos muscícolas; Deharveng y Travé (1981) sobre la ecología de los ácaros oribátidos y colémbolos; Goran (1991) relaciona los efectos de alteración de los musgos sobre la estructura de la comunidad de los invertebrados, mientras que Hoyle y Harborne (2005) estudian los efectos de la fragmentación de hábitats sobre la riqueza de especies y la estructura de la comunidad en microecosistemas.
Dentro de los factores que influyen de manera considerable sobre la distribución de los organismos la altitud es uno de los más relevantes y en particular para la distribución de la biocenosis muscícola resulta decisivo principalmente por los cambios climáticos que determina y el papel trascendental que juega en la individualización de las comunidades (Hodkinson 2005).
Los patrones de distribución de los invertebrados con respecto a la altitud han mostrado tendencias variables; en suelos montañosos del Tibet por ejemplo, pueden encontrarse en un rango altitudinal de 3.800 m a 5.050 m (Shen et al. 2005). En comunidades de briofitas en Australia y Nueva Zelanda, con un rango altitudinal de los 1.130 a 2.000 m, la abundancia tiende a disminuir con la altitud (Andrew et al. 2003), mientras que para comunidades de musgos corticícolas en México se ha detectado un aumento en la densidad de los invertebrados con respecto a la altitud (Cutz-Pool et al. 2006).
A escala local, se ha demostrado que existe un cambio en la composición de artrópodos para diferentes composiciones de especies vegetales (Medianero et al. 2007), así como también una disminución en la diversidad (Jiménez-Valverde et al. 2004). Tanto a nivel mundial como en México, pocos estudios abordan el tema del efecto del gradiente altitudinal sobre la riqueza específica de invertebrados (Palacios- Vargas 1981, 1982, 1985; Morón-S. 1988; Lobo y Halffter 2000; Huerta-Paniagua et al. 2004; Escobar et al. 2005; Cutz-Pool et al. 2006; Mejía-Recamier y Cutz-Pool 2007). El objetivo del presente trabajo es comparar la densidad y diversidad de los invertebrados habitantes en musgos corticícolas en un gradiente altitudinal de un bosque templado en la vertiente noroeste del Volcán Iztaccíhuatl, Estado de México, México.
Materiales y métodos
Área de estudio: El estudio se realizó en la vertiente noroeste del Volcán Iztaccíhuatl (19º12’66’’ - 19º12’31’’ N, 98º44’03’’ - 98º41’55’’ W). El clima es templado subhúmedo con lluvias en verano, Cb (Cw) (w) de acuerdo con la clasificación de Köppen modificada por García (2004) y Vidal-Zepeda (2005), con temperatura media anual que oscila entre los 14ºC y una precipitación promedio anual de 1.200 mm (García 2004). Los tipos de suelos presentes en la zona son regosol, litosol, endosol y cambisol. La zona de estudio abarcó un gradiente altitudinal desde los 2.750 a los 3.440 msnm. La vegetación predominante a lo largo del gradiente se muestra en la Tabla 1. Para el muestreo, se seleccionaron siete altitudes.
Muestreo: En cada sitio, el área de recolección se ubicó en un transecto de 500 m de largo, en donde se seleccionaron 10 árboles, separados cada uno por una distancia de 50 m. En cada árbol, se tomó una muestra de musgos de un área de 15 x 15 cm, y a una altura de 1,5 m de la base del árbol. Así, se obtuvieron 10 muestras por sitio, para un total de 70 muestras en el gradiente, recolectadas en agosto de 2005. Las muestras fueron trasladadas en cajas de plástico al Laboratorio de Ecología y Sistemática de Microartrópodos de la Facultad de Ciencias de la Universidad Nacional Autónoma de México, para extraer la fauna, mediante el método del embudo de Berlesse-Tullgren, donde permanecieron durante seis días a temperatura ambiente.
Análisis de datos: Los invertebrados fueron contabilizados y clasificados. La identificación taxonómica se efectuó con un microscopio estereoscópico. En dichas identificaciones, apoyadas con claves de Choate (2006) y Dindal (1998), se llegó a Phylum (Gastropoda y Oligachaeta), y para el caso de los artrópodos, a Orden. Se estimó la abundancia relativa (%), así como también la densidad de los invertebrados (ind./ m2). Para determinar las diferencias en las densidades de invertebrados en los distintos rangos altitudinales, se realizó un análisis de varianza (ANDEVA) de una vía, y las diferencias fueron evaluadas mediante una prueba post hoc de Tukey. La relación entre la abundancia y la altitud, se evaluó mediante regresiones lineales simples (Zar 1984). Se obtuvieron los índices de diversidad de Shannon (H’), de dominancia de Simpson (λ), y equitatividad de Pielou (J’). Se determinaron las diferencias significativas entre las diversidades para muestras pareadas aplicando una prueba de t student (Zar 1984; Magurran 1988).
Para ver la similitud entre las comunidades de los siete sitios se efectúo un análisis de conglomerados utilizando el coeficiente de correlación de Pearson y como método de amalgamación se usaron las medias aritméticas no pareadas (UPGMA) (Sokal y Michener 1958; Pearson 1977). Los datos de abundancia fueron normalizados utilizando una corrección mediante √ X + 0.5 (Zar 1984). Las pruebas estadísticas se realizaron en el programa STATISTICA, versión 6.0 (StatSoft 1995).
Resultados
Se recolectó un total de 5.173 invertebrados, distribuidos en 17 taxones. El 47,39% fueron ácaros (Cryptostigmata 19,50%, Mesostigmata 12,70%, Prostigmata 11,85%, y Astigmata 3,34%). Los Collembola ocuparon el segundo grupo en abundancia, con el 43,10% (Tabla 2); en tercer lugar se encuentran los insectos, con el 4,29%, y dentro de ellos, los Coleoptera fueron los de mayor representación, seguidos de Psocoptera, Thysanoptera, Hemiptera e Hymenoptera; en cuarto lugar se encuentra Gastropoda (2,42%), seguido de Arachnida (1,76%), donde Opilionida resultó el más abundante; posteriormente se encuentran Myriapoda (0,52%) y Oligochaeta (0,46%) (Tabla 2). Los taxones restantes representan menos del 11% de la abundancia con respecto al total de los organismos (Tabla 2).
A los 3.440 m los Collembola muestran su máxima abundancia relativa (60%), mientras que los Cryptostigmata se presentaron en mayor abundancia (55%) a los 3.250 m, los Mesostigmata a los 2.750 m, con un 20%, Prostigmata es más abundante a los 2.830 m con el 21%, y por último Astigmata, a los 2.750 m con el 8% (Tabla 2). Existe una variación espacial en la densidad de los invertebrados, la mayor densidad se registró a los 3.440 m y la menor a los 2.750 m (Tabla 2).
Altitud y diversidad. El análisis de varianza no mostró diferencias significativas en las densidades de los invertebrados en el gradiente altitudinal (F(6,63) = 0.29; p>0,05). Sin embargo, al considerar los grupos por separado, en los casos de Gasteropoda, Oligochaeta, Opilionida, Cryptostigmata (Fig. 1A), Araneae (Fig. 1B), Diplopoda, Psocoptera, Thysanoptera, Hemiptera e Hymenoptera, se encontró un efecto estadísticamente significativo de esta variable sobre la densidad de los grupos. La prueba de Tukey mostró que las diferencias más claras, en el caso de Opilionida y Cryptostigmata (Fig.1A) se encuentran entre las altitudes de 3.440 y 3.250 m. En el caso de Gasteropoda, Psocoptera y Hemiptera, las diferencias se encuentran entre las altitudes 3.250 y 3.440 m, mientras que en Thysanoptera e Hymenoptera, se presentan entre los 2.750 y 3.440 m; los Diplopoda indican desigualdades en sus densidades a los 3.020 m, frente a las altitudes restantes; para Araneae las variaciones se encuentran entre las altitudes 2.750 y 2.830 m (Fig. 1B).
El mayor índice de diversidad (H´ = 2,06), se registró a los 2.930 m y el menor (H´ = 1,01) a los 3.250 m. La dominancia (λ) es mayor a los 3.250 m con dos taxa muy abundantes, Cryptostigmata y Collembola. En cuanto a la equitatividad, a los 3.440 m se presentó el valor más alto (J’ = 0,80), con respecto a las otras altitudes (Tabla 2). Se registraron diferencias significativas en los valores de diversidad de taxa para los 2.830 vs. 3.015 m (t1547 = -2,66, p<0,05), los 2.830 vs. 3.115 m (t1135 = -3,26, p<0,05), y los 2.830 vs. 3.440 m (t1478 = 2,49, p<0,05).
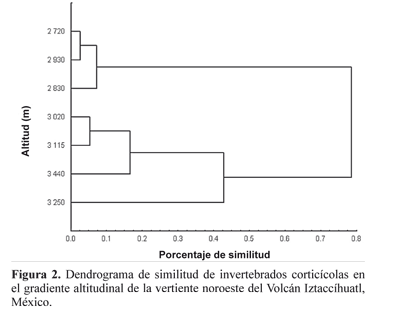
El dendrograma de similitud entre altitudes (Fig. 2), muestra dos grupos, el primero que incluye las altitudes menores a 3.000 m y el segundo que comprende las altitudes mayores a 3.000 m. Este agrupamiento indica claramente que la altitud para algunos grupos como Gastropoda, Oligochaeta, Araneae, Pseudoscorpionida, Diplopoda y Hemiptera resulta una barrera limitante en su distribución. Los dos grupos mostraron, además, diferencias significativas en sus valores de diversidad (t1360=2,69, p<0,05). En el grupo formado por las altitudes de los 3.020 – 3.440 m las altas abundancias están representadas por los taxones Mesostigmata, Cryptostigmata y Collembola. Opilionida sólo está presente en las altitudes mayores de 3.020- 3.440 m. De acuerdo con los resultados, a mayores altitudes, Cryptostigmata y Collembola son los más dominantes.
La densidad total de los invertebrados no mostró correlación con la altitud. Por otro lado, considerando cada taxón (en todos los casos: gl = 68, p<0,05), se encontró una correlación positiva entre la abundancia y la altitud para Opilionida (r = 0,9, p = 0,004), Cryptostigmata (r = 0,40, p = 0,04) (Fig.3A) y Psocoptera (r = 0,33, p = 0,03). En cuanto a la relación entre densidad y altitud, se detectó una correlación negativa para Oligochaeta (r = -0,41, p = 0,02), Araneae (r = -0,51, p=0,04) (Fig. 3B) y Hemiptera (r = -0,43, p = 0,04).
Discusión
Los resultados muestran que la diversidad disminuye mientras que la densidad aumenta conforme se incrementa la altitud lo que concuerda con otros estudios como los realizados por Palacios-Vargas y Castaño-Meneses (2002) en un bosque de Quercus-Abies, y por Shen et al. (2005) para las montañas del Tibet en China. Esto es posible debido a que cuando se incrementa la altitud, las condiciones del clima se vuelven más extremas, lo que afecta a la riqueza y diversidad (Hodkinson 2005). Por lo que las bajas temperaturas podrían ser una limitante en la distribución de las mismas especies. Estudios en zonas tropicales, muestran que en altitudes intermedias (1.500 m), la densidad y riqueza de especies presenta valores máximos, problamente asociado a que en tales altitudes se tienen una mayor productividad en la comunidad vegetal, y las condiciones ambientales permiten un menor costo para mantener las funciones en dichas altitudes (Janzen 1973).
En nuestro estudio, se observó una reducción significativa en el número de taxones, conforme se incrementó la altitud. Este patrón en la disminución de la riqueza de taxones, ha sido registrado para suelos en una montaña del Tibet (Shen et al. 2005), para diferentes hábitats en una montaña de Alemania Central (Perner et al. 2005), en briofitas en montañas de Nueva Zelanda y Australia (Andrew et al. 2003), y para México, en musgos corticícolas (Cutz-Pool et al. 2006; Mejía- Recamier y Cutz-Pool 2007).
Los dos principales factores que han sido propuestos para explicar tales patrones son el tipo de vegetación (Richardson et al. 2005), y las condiciones climáticas, particularmente humedad y temperatura. Para nuestro estudio, la temperatura, más que el tipo de vegetación (con mayor homogeneidad y dominada por Quercus spp. en los pisos inferiores, y por Abies religiosa (Kunth Schltdl. et Cham.) en los superiores), podría resulta el factor límite para distribución de los taxones, particularmente en las altitudes de 3.250 m y 3.440 m, donde las temperaturas resultan menores que las observadas en los pisos inferiores. Para los invertebrados, se ha encontrado que las temperaturas bajas determinan indirectamente la reducción en la riqueza de los taxones, debido a la reducción en recursos y nichos explotables (Hodkinson 2005).
Sin embargo, no ocurre lo mismo con respecto a la densidad de los taxones, ya que este parámetro aumentó con relación a la altitud. Este patrón se ha documentado en ciertos mesostigmados, en las montañas del Tibet (Shen et al. 2005), y para cryptostigmados y astigmados en musgos corticícolas mexicanos (Cutz-Pool et al. 2006). Los aumentos en la densidad pueden deberse a que en tales condiciones, las especies están sometidas a una menor competencia, puesto que sólo determinadas especies pueden desarrollarse, aumentando así sus poblaciones significativamente.
Los índices de diversidad fueron mayores para las altitudes de 2.840 y 2.930 m (Tabla 2). Esto indica una distribución más equitativa de los taxones en las unidades muestreadas en dichas áreas. La menor diversidad entre los 3.250 m y los 3.440 m está determinada por Cryptostigmata y Collembola, quienes incrementaron su densidad en dichos pisos. Estos organismos poseen una amplia adaptación a una gran variedad de hábitats, lo que les permite sobrevivir a las condiciones microclimáticas cuando son críticas (Prinzing 2005). Tienden a adaptarse a un hábitat como el musgo para protegerse de los cambios abióticos en las diferentes altitudes (Gadea 1964; Gerson 1969; Prinzing 2005). En particular, los Cryptostigmata se han encontrado en musgos saxícolas y corticícolas en un rango de altitud que va desde los 120 m a los 950 m (Travé 1963; Deharveng y Travé 1981), por lo tanto, en este trabajo la distribución altitudinal se amplía para este taxón. Por otra parte, Mejía-Recamier y Cutz-Pool (2007) registran prostigmados en musgos corticícolas, entre las altitudes de los 2.750 a los 3.440 m, por lo tanto, se observa que los prostigmados mantienen el patrón de distribución altitudinal.
La agrupación de taxones entre los 2.750 – 2.930 m (Fig.2), indica que estas zonas son áreas que comparten una alta diversidad vegetal y muscícola, la cual sirve a los diversos grupos de invertebrados que tienen los mayores valores de riqueza. El segundo grupo, formado entre los 3.020-3.440 m, tiene una menor variedad de grupos.
La heterogenidad del hábitat determina que cada área presente una composición particular de taxones (Willig et al. 2003; Medianero et al. 2007), lo que explica la poca similitud entre los sitios más alejados, que son las zonas a 2.750 m y las que están a 3.440 m. Existen también fluctuaciones espaciales y temporales de sus riquezas y abundancias que responden a las variaciones en el ambiente y disponibilidad de recursos. De tal forma que la diversidad vegetal y muscícola permite a los invertebrados cambiar su distribución en respuesta a las condiciones ambientales (Halffter y Moreno 2005; Mejía-Recamier y Cutz-Pool 2007).
Conclusión
En nuestro trabajo es manifiesto que el comportamiento de la densidad y la riqueza de artrópodos en bosques templados, difiere sustancialmente de lo que ocurre en los bosques tropicales, ya que en estos últimos, el comportamiento general indica que las altitudes intermedias soportan los valores máximos en tales parámetros (Janzen 1973; Wolda 1987), mientras que en bosques templados, las mayores densidades se registran en las altitudes mayores, y la riqueza se concentra en las altitudes intermedias. Este patrón diferencial puede explicarse como consecuencia de las condiciones extremas de temperatura que pueden presentarse en bosques templados ya que así sólo algunos grupos de animales pueden explotar tales ambientes, y debido a la reducción en la competencia intraespecífica, sus poblaciones aumentan de manera considerable. Se encontró que el tipo de bosque podría ser determinante para la composición de las comunidades de los invertebrados, ya que ciertos taxones están más relacionados con el bosque que se encuentra a través del gradiente altitudinal, y con las características de la hojarasca que produce cada uno, tal como lo mencionan Richardson et al. (2005).
La altitud es un factor relacionado con la composición de los invertebrados, así como la riqueza y la diversidad de las comunidades. El patrón general en nuestro estudio muestra que estos parámetros disminuyen conforme se asciende en el gradiente altitudinal, mientras que ocurre lo contrario para el caso de la densidad. Grupos como Opilionida, Cryptostigmata y Psocoptera, que se correlacionaron positivamente con la mayor altitud, podrían indicar afinidad a ambientes con temperaturas bajas, mientras que aquellos como Oligochaeta, Araneae y Hemiptera, indicarían una preferencia por condiciones más templadas de temperatura.
Estudios considerando la composición específica de las comunidades de artrópodos, pueden aportar información valiosa no sólo para entender la distribución local de los organismos, sino también sobre la biogeografía de los mismos (Lobo y Halffter 2000). Con nuestro estudio se sientan las bases para entender la compleja dinámica de las comunidades que se distribuyen en un gradiente altitudinal de un bosque templado.
Agradecimientos
Los autores agradecen a las personas que participaron en el trabajo de campo, Aldo Bernal, Carmen Maldonado y Ricardo Iglesias. Se agradecen las valiosas sugerencias de un revisor anónimo que permitieron enriquecer sustancialmente el trabajo. Luís Parra (ENAP-UNAM) realizó la revisión gramatical del abstract.
Literatura citada
ANDREW, N.; RODGERSON, L.; DUNLOP, M. 2003. Variation in invertebrate-bryophyte community structure at different spatial scales along altitudinal gradients. Journal of Biogeography 30: 731-746. [ Links ]
BONNET, L.; CASSAGNAU, P.; TRAVE, J. 1975. L´écologie des arthropodes muscicoles à la lumière de l´analyse des correspondances: Collemboles et Oribates Sidobre (Tarn, France). Oecología 21: 359-373. [ Links ]
CHOATE, P. M. 2006. Introduction to the identification of insects and related arthropods. Disponible en: http://entnemdept.ifas.ufl.edu/choate/insect_orders_06b.pdf. Fecha revisión: 15 Junio 2008. [ Links ]
CUTZ-POOL, L. Q.; GARCÍA-GÓMEZ, A.; BERNAL-ROJAS, A. 2006. Variación estacional de los invertebrados asociados a musgos corticícolas en la parte NW del Volcán Iztaccíhuatl, Estado de México, México. Entomología Mexicana 5: 227-232. [ Links ]
DINDAL, D. L. 1998. Soil biology guide. Wiley Interscience Publication, New York, USA. 1349 p. [ Links ]
DEHARVENG, L.; TRAVÉ, J. 1981. Écologie des oribates (Acariens) et des collemboles (Insectes) de Kerguelen. Biologie des Sols 48: 109-140. [ Links ]
ESCOBAR, F.; LOBO, J. M.; HALFFTER, G. 2005. Altitudinal variation of dung beetle (Scarabaeidae: Scarabaeinae) assemblages in the Colombian Andes. Global Ecology and Biogeography 14: 327-337. [ Links ]
FRANKS, A. J.; BERGSTROM, D. M. 2000. Corticolous bryophytes in microphyll fern forests of South-east Queensland: distribution on Antarctic beech (Nothofagus moorei). Austral Ecology 25: 386-393. [ Links ]
GARCÍA, E. 2004. Modificaciones al sistema de clasificación climática de Köppen. Instituto de Geografía, UNAM. 90 p. [ Links ]
GADEA, E. 1964. La zoocenosis muscícola en los biotopos altimontanos. Publicaciones del Instituto de Biología Aplicada 36: 113-120. [ Links ]
GERSON, U. 1969. Moss-arthropod associations. Bryologist 72: 495-500. [ Links ]
GORAN, E. 1991. Effects of disturbance on stream moss and invertebrate community structure. Journal of the North American Benthological Society 10: 143-153. [ Links ]
HALFFTER, G.; MORENO, C. 2005. Significado biológico de las diversidades alfa, beta y gama. En: Halffter, G.; Soberón, J.; Koleff, P.; Melic, A. (Eds.). Sobre la diversidad biológica: el significado de las diversidades alfa, beta gama. Monografías Tercer Milenio, Boletín S.E.A., CONABIO, CONACYT, DIVERSITAS.Zaragoza, España. 5-18. [ Links ]
HODKINSON, I. D. 2005. Terrestrial insects along elevation gradients: species and community responses to altitude. Biological Reviews 80: 489-513. [ Links ]
HOYLE, M.; HARBORNE, A. 2005. Mixed effects of habitat fragmentation on species richness and community structure in a microarthropod microecosystem. Ecological Entomology 30: 684-691. [ Links ]
HUERTA-PANIAGUA, R. A.; BAUTISTA MARTÍNEZ, N.; BRAVO MOJICA, H.; CARROLLA SÁNCHEZ, J. L.; DÍAZ GÓ- MEZ, O. 2004. Distribución altitudinal de Trichobaris championi Barber (Coleoptera: Curculionidae) y observaciones de campo sobre su biología. Agrociencia 38: 97-106. [ Links ]
ILKIU-BORGES, A. L.; CALDEIRA-TAVAREZ, A. C.; LOBATO- LISBOA, R. C. 2004. Briófitas da Ilha de Germoplasma, reservatório de Tucuruí, Pará, Brasil. Acta Botánica Brasilica 18: 689-692. [ Links ]
JANZEN, D. H. 1973. Sweep samples of Tropical foliage insects: effects of seasons, vegetation types, elevation, time of day, and insularity. Ecology 54: 687-708. [ Links ]
JIMÉNEZ-VALVERDE, A.; MARTÍN-CANO, J.; MUNGUIRA, M. L. 2004. Patrones de diversidad de la fauna de mariposas del Parque Nacional de Cabañeros y su entorno (Ciudad Real, España central) (Lepidoptera, Papilionoidea, Hesperioidea). Animal Biodiversity and Conservation 27: 15-24. [ Links ]
KIDRON, G. J.; BARZILAY, E.; SACHS, E. 2000. Microclimate control upon sand micobiotic crusts, Western Negew Desert, Israel. Geomorphology 36: 1-18. [ Links ]
LOBO, J. M.; HALFFTER, G. 2000. Biogeographical and ecological factors affecting the altitudinal variation of mountainous communities of coprophagous beetles (Coleoptera: Scarabaeiodea): a comparative study. Annals of the Entomological Society of America 93: 115-127. [ Links ]
MAGURRAN, A. E, 1988. Ecological diversity and its measurement. Princeton University Press, New Jersey. USA. 179 p. [ Links ]
MATTERI, C. M. 1998. La diversidad briológica (o sobre cómo y por qué proteger los musgos). Ciencia hoy, 46: mayo/junio. Disponible en: http://.cienciahoy.org/hoy46/musgos01.htm. Fecha de revisión: 22 junio 2001. [ Links ]
MEDIANERO, E.; CASTAÑO MENESES, G.; TISHECHKIN, A.; BASSET, Y.; BARRIOS, H.; ØDEGAARD, F.; CLINE, A. R.; BAIL, J. 2007. Influence of local illumination and plant composition on the spatial and seasonal distribution of litter-dwelling arthropods in a tropical rainforest. Pedobiologia 51: 131-145. [ Links ]
MEJÍA-RECAMIER, B. E.; CUTZ-POOL, L. Q. 2007. Diversidad altitudinal de Bdelliodea (Prostigmata) de musgos corticícolas en el este de México. Entomología Mexicana 6: 54-59. [ Links ]
MORÓN-S, R. A. 1988. Distribución altitudinal y estacional de los insectos necrófilos en la Sierra Norte de Hidalgo, México. Acta Zoológica Mexicana 3: 1-47. [ Links ]
PALACIOS-VARGAS, J. G. 1981. Collembola asociados a Tillandsia Bromeliaceae en el Derrame Lávico del Chichinautzin, Morelos, México. Southwestern Entomologist 6: 87-98. [ Links ]
PALACIOS-VARGAS, J.G. 1982. Microartrópodos asociados a Bromeliáceas. En: Salinas P. J. (Ed.). Zoología Neotropical. Actas del VIII Congreso Latinoamericano de Zoología, I: 535-545. [ Links ]
PALACIOS-VARGAS, J. G. 1985. Microartropodos del Popocatépetl (aspectos ecológicos y biogeográficos de los ácaros e insectos colémbolos). Tesis de doctorado, Universidad Nacional Autónoma de México, D. F., México. 132 p. [ Links ]
PALACIOS-VARGAS, J.G. ; G. CASTAÑO-MENESES. 2002. Collembola associated with Tillandsia violacea (Bromeliaceae) in Mexican Quercus-Abies forests. Pedobiologia 46: 395-403. [ Links ]
PEARSON, D. L. 1977. A practical comparison of bird community structure on six lowland forest sites. The Condor 79: 232-244. [ Links ]
PERNER, J.; WYTRYKUSH, C.; KAHMEN, A.; BUCHMANN, N.; EGERER, I.; CREUTZBURG, S.; ODAT, N.; AUDORFF, V.; WIESSER, W. W. 2005. Effects of plant diversity, plant productivity and habitat parameters on arthropod abundance in montane European grasslands. Ecography 28: 429-442. [ Links ]
PRINZING, A. 2005. Corticolous arthropods under climatic fluctuations: compensation is more important than migration. Ecography 28: 17-28. [ Links ]
RICHARDSON, B. A.; RICHARDSON, M. J.; SOTO-ADAMES, F. N. 2005. Separating the effects of forest type and elevatión on the diversity of litter invertebrate communities in a humid tropical forest in Puerto Rico. Journal of Animal Ecology 74: 926-936. [ Links ]
SHEN, J.; SOLHØY, T.; HUIFU, W.; VOLLANT, T. I.; RUMEI, X. 2005. Differences in soil arthropod communities along a high altitude gradient at Shergyla Mountain, Tibet, China. Arctic, Antarctic, and Alpine Research 37: 261-266. [ Links ]
SOKAL, R. R.; MICHENER, C. D. 1958. A statistical method for evaluating systematic relationships. University of Kansas Science Bulletin 38: 1409-1438. [ Links ]
STATSOFT INC. 1995. Statistical user guide. Complete Statistical System StatSoft. Oklahoma., U.S.A. [ Links ]
TRAVÉ, J. 1963. Écologie et biologie des Oribates (Acariens) saxicoles et arboricoles. Publications du laboratoire Arago, Université de Paris, France 14: 1-267. [ Links ]
VIDAL-ZEPEDA, R. 2005. Las regiones climáticas de México. Temas selectos de geografía de México. Instituto de Geografía- UNAM, México, D. F. 212 p. [ Links ]
WILLIG, M. R.; KAUFMAN, D. M.; STEVENS, R. D. 2003. Latitudinal gradients of biodiversity: pattern, process, scale, and synthesis. Annual Review of Ecology, Evolution, and Systematics 34: 273-309. [ Links ]
WOLDA, H. 1987. Altitude, habitat and tropical insect diversity. Biological Journal of the Linnean Society 30: 313-323. ZAR, H. J. 1984. Biostatistical Analysis. Segunda Edición. Prentice Hall, Engelwood Cliffs, New Jersey. 605 p. [ Links ] [ Links ]