Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.36 no.1 Bogotá Jan./June 2010
¿Bajan de los árboles las hormigas que depredan en potreros y cafetales colombianos?
Do ants predating in Colombian pastures and coffee plantations come down from the trees?
MÓNICA RAMÍREZ1,2, JANINE HERRERA1,3 e INGE ARMBRECHT1,4
1 Departamento de Biología, Universidad del Valle. Apartado Aéreo 25360. Cali, Colombia.
2 M. Sc. Universidad del Valle. moramire73@hotmail.com.
3 Estudiante Maestría. Universidad del Valle. jahera@gmail.com.
4 Ph. D. Universidad del Valle. inge@univalle.edu.co, ingeparallel@gmail.com. Autora para correspondencia.
Recibido: 3-feb-2009 - Acveptado: 20-feb-2010
Resumen: Los árboles aislados en agroecosistemas favorecen la biodiversidad asociada y pueden promover funciones como la depredación. Se examinó si la presencia de los árboles afecta la presencia y actividad de depredación de las hormigas en potreros y cafetales en dos regiones del suroccidente Andino colombiano. Además, se exploró si durante la estación seca las hormigas arbóreas descienden de los árboles hacia el sistema productivo para depredar. Durante las épocas seca y lluviosa del año 2006 se realizaron muestreos intensivos de hormigas forrajeras de suelo en 16 lotes de Pescador y Dagua. En cada lote se instalaron 10 trampas de caída por 96 h. Por otra parte, se ofrecieron adultos de Drosophila melanogaster como presa, adheridas en papel o Cinta de enmascarar, colocadas a 1m y 5m de distancia de un árbol y, sobre éste, a 1.5 m de altura. Se encontraron diferencias significativas en la riqueza e identidad de hormigas en cada localidad, indicando como mayor factor la barrera geográfica de la cordillera Occidental. Generalmente las presas fueron consumidas en 24 h; sin embargo, el consumo estuvo influenciado por la presencia de árboles, pues la depredación fue mayor a 1 m que a 5 m del árbol. Las hormigas concentraron su actividad sobre el suelo en la época seca. Linepithema neotropicum, reclutadora masiva, depredó activamente en ambas localidades. Los resultados apuntan a que los árboles pueden favorecer la fauna de hormigas y la depredación.
Palabras clave: Agroforestería. Control Biológico. Formicidae. Suroccidente colombiano. Cauca.
Abstract: Isolated trees in agroecosystems promote the associated biodiversity and can provide functions such as predation. This study examined whether presence of the trees affects the presence and predation activity of ants in pastures and coffee plantations in two regions of the southwest Colombian Andes. We also explored whether in the dry season the ants descend trees toward the production system in order to predate. During the dry and rainy seasons in 2006, intensive samplings of ground foraging ants were made in 16 plots at Pescador and Dagua. Ten pitfall traps were placed in each plot for 96 h. Separately, Drosophila melanogaster adults were offered as prey, adhered to paper or tape, placed 1 and 5 m away from the tree and on the tree at a height of 1.5 m. There was a significant difference in ant richness and identity between regions, indicating the geographical barrier of the western mountain range to be an important factor. Prey were generally consumed within 24 h; nevertheless, consumption was influenced by the presence of trees as predation was higher at 1 m than 5 m from the trees. Ants concentrated their activity on the ground during the dry season. Linepithema neotropicum, a mass recruiter, actively predated in both localities. The results point to a positive influence of trees for ant fauna and predation.
Key words: Agroforestry. Biological Control. Cauca. Colombian Southwest. Formicidae.
Introducción
Los sistemas agrícolas manejados ecológicamente pueden sostener mayor biodiversidad que los convencionales. Esta diversidad podría prestar servicios ecológicos como el control de la erosión, secuestro de carbono, polinización y depredación; además los agroecosistemas diversificados aumentan la incidencia de fauna benéfica asociada (Vandermeer y Perfecto 2000). Existe un cúmulo de evidencia científica que demuestra que la intensificación en sistemas agroforestales como café y cacao, está estrechamente ligada a pérdidas significativas de la biodiversidad asociada (Borrero 1986; Perfecto et al . 1996; Greenberg et al . 1997; Moguel y Toledo 1999; Armbrecht et al . 2004, 2005) y por tanto se ha considerado la importancia de esta diversidad en agroecosistemas para el mantenimiento de depredadores que actúen en el control de plagas (Swift y Anderson 1993). Si fuera posible aprender a manejar y mantener esta biodiversidad beneficiosa, se podrían buscar caminos hacia el manejo sostenible de plagas en agroecosistemas diversos (Altieri et al . 2003; Perfecto y Armbrecht 2003).
Una fuente de biodiversidad estructural y taxonómica en agroecosistemas perennes y semiperennes son los árboles. Se ha encontrado que los árboles aislados en agroecosistemas no solo proveen fuentes de ingresos adicionales a los agricultores (Philpott y Dietsch 2003), sino que además promueven la biodiversidad de los agroecosistemas (Majer y Delabie 1999). Se hipotetizó que la presencia de árboles también puede promover funciones ecológicas como la depredación sobre plagas potenciales (Van Mele y Cuc 2001), debido a que atraen fauna asociada como aves (Greenberg et al . 2000; Perfecto et al . 2004) y hormigas (Armbrecht y Perfecto 2003; Gallego y Armbrecht 2005).
Las hormigas (Hymenoptera: Formicidae) han demostrado ser un grupo valioso como indicador biológico (Andersen y Majer 2004) y como agentes funcionales en los sistemas biológicos (Folgarait 1998). El empleo de hormigas como agentes de control biológico en sistemas agroforestales se ha practicado desde muchos siglos atrás. Se considera que el primer caso conocido de control biológico fue realizado en el siglo IV antes de Cristo por los chinos empleando hormigas (Vandermeer 1999). También se han usado mosaicos de hormigas para el manejo de plagas y enfermedades fitosanitarias en Ghana (Majer 1972; Leston 1973; Majer 1976), Asia con Dolichoderus thoracicus (Smith, 1860) (Way y Khoo 1992; Perfecto y Castiñeiras 1998) y Brasil (Delabie 1990; Medeiro et al . 1995). Way y Khoo (1992) discutieron las características valiosas que tienen las hormigas como grupo benéfico para el control de plagas y consideraron que algunas mezclas de cultivos pueden estimular las especies benéficas de control biológico en cultivos de palmas, coco y cacao.
Se debe resaltar que no todas las hormigas depredadoras son amantes de la sombra o son hormigas arbóreas. Varios estudios han mostrado que la hormiga de fuego, Solenopsis geminata (Fabricius, 1804), propia de áreas abiertas (Risch y Carroll 1982; Perfecto 1991) y que anida en suelo, es dominante en manejos agrícolas poco diversos y perturbados. Aunque es muy efectiva como depredadora e importante controlador biológico (Risch y Carroll 1982; Perfecto y Sediles 1992) podría constituirse en plaga si se asocia con hemípteros (Perfecto 1994). En Colombia, la hormiga cazadora Ectatomma ruidum (Roger, 1860) (Formicidae: Ectatomminae), conocida como “hormiga cachona”, es muy abundante tanto en zonas perturbadas como en conservadas y es excelente depredadora de insectos (Medina 1994). Podría ser que el manejo agrícola, que depende de las decisiones del agricultor, influyera sobre el rol que estas hormigas cumplan, ya sea como controladores biológicos o como plagas.
En un estudio en Brasil, se propuso la hipótesis que las hormigas arbóreas conforman un mosaico fluido, en donde las depredadoras arbóreas descienden a depredar en el suelo cuando los recursos escasean en los árboles durante la estación seca (Delabie et al . 2000). Esto significa que la presencia de árboles en agroecosistemas podría beneficiar el control biológico de las plantas o arbustos bajo el dosel, además de proveer madera, sombra, control de erosión y otros servicios (Rice y Drenning 2003).
Colombia ha sido considerado como un país megadiverso (Terborgh y Winter 1983; IAvH 2006; Benavides et al . 2006), pero esta diversidad está vulnerada y sujeta a numerosos factores de riesgo, entre los que se citan la fragmentación de los bosques y la ampliación de la frontera agrícola (IAvH 2006). Se conoce que los agroecosistemas se comportan como matrices de diferentes calidades afectando la biota silvestre y su función (Vandermeer y Carvajal 2001). Dado que todavía no se ha determinado claramente cuál es el papel de los árboles como agentes promotores de control biológico por parte de la fauna asociada de hormigas, se desarrolló el presente estudio en dos agroecosistemas colombianos. Como base se plantea que el manejo ecológico de potreros y cafetales no solo beneficia a la biodiversidad sino también al agricultor, a través de la función o servicios ecológicos que dicha biodiversidad asociada presta (e.g. polinización, parasitismo, depredación, descomposición). En la búsqueda de una agricultura sustentable, es prioritario explorar dichas funciones benéficas que promuevan una agricultura productiva y más sostenible.
Sin embargo, el grueso de los estudios realizados entre la biodiversidad de los agroecosistemas y su funcionamiento han sido enfocados en la microfauna del suelo, poco se sabe de cómo los cambios en los sistemas agrícolas afectan otros grupos de organismos, en este caso las hormigas. Así, nos propusimos examinar si la presencia de los árboles afecta la presencia de hormigas que presentan actividad depredadora en potreros y cafetales, tanto arbolados como sin árboles en dos zonas del paisaje Andino (montañoso) colombiano. Además se explora si durante la estación seca las hormigas arbóreas descienden para depredar en las zonas productivas adyacentes (cafetos o pastizales).
Materiales y Métodos
Área de estudio. El estudio se realizó en dos regiones cafeteras de los Andes Colombianos: (1) Dagua, departamento del Valle del Cauca, a 1450 m de elevación, con promedios de temperatura y precipitación de 22°C y 1450 mm, respectivamente y (2) Pescador, departamento de Cauca, a 1440 m de elevación, temperatura y precipitación 20ºC y 1400 mm (Tabla 1). De acuerdo con estas características se catalogan en la zona de vida bosque húmedo premontano. Dagua (3°38’45”N, 76°41’30”W) se encuentra ubicada en el flanco occidental de la cordillera occidental y Pescador (2°48’49”N, 76°32’71”W) al sur, se encuentra en un nudo montañoso centro occidente separado de la cordillera occidental. Ambas localidades presentan precipitación bimodal. En cada localidad se escogieron de forma casual, cuatro cultivos de café (dos de sol y dos con sombra de árboles) y cuatro potreros (dos de sol y dos con sombra), para un total de 16 parcelas de estudio codificadas de la siguiente manera: la primera letra indica la localidad, D: Dagua, P: Pescador, el número después de la letra indica la finca nombrada según su dueño, la tercera letra significa si es cafetal o potrero, y el número uno sol y dos sombra (Tabla 1).
Captura de hormigas en el estrato epígeo. Se realizaron muestreos intensivos de hormigas forrajeras de suelo correspondientes a época seca (agosto-septiembre 2006) y lluviosa (noviembre-diciembre 2006 y mayo 2007). En cada parcela se instalaron diez trampas de caída (pitfall) separadas en intervalos de 10 m. Las trampas consistieron en un vaso desechable de 70 mm de diámetro, semilleno con una solución de glicerina y alcohol etílico en proporción aproximada 1:1, enterrado a ras de suelo. Cada trampa se ubicó a 1 m de distancia de un árbol, si había, en sentido norte y se dejó actuar por 96 horas. Si no había árbol, las trampas se instalaban cada 10 m. Cada muestra se preservó en bolsas herméticas con alcohol etílico al 70% y glicerina, para ser separados e identificados en el laboratorio. A medida que se separaron las morfoespecies, se montó simultáneamente una colección de referencia en alcohol etílico.
Disposición de los cebos. Los cebos para atraer las hormigas, consistieron de moscas vivas de Drosophila melanogaster (Meigen, 1830) (Diptera: Drosophilidae) (N=10 moscas/ estación) que fueron adormecidas previamente con éter etílico y adheridas por el dorso a un cuadrado de papel bond forrado con papel adhesivo de 7 x 7 cm para el suelo y una tira de cinta de enmascarar adherida al árbol por dos taches (Fig. 1). Los cebos se revisaron a los 15, 30, 60, 90, 120 min y 24 h de haber sido instalados. Se dispusieron en tres puntos: árbol, cafeto y suelo. Durante las observaciones sólo se recolectaron las hormigas cuando habían reclutado dos o más individuos y únicamente si se observaron directamente depredando.
Selección de las hormigas depredadoras. Se asignó el estatus de “depredadoras” a aquellas hormigas que atacaron, picaron o retiraron las moscas de los cebos, es decir, por su comportamiento en condiciones de campo. Los datos de depredación para los cafetales fueron suministrados por Henao (2008) en un estudio simultáneo con las coautoras, en el cual se ofrecieron adultos vivos de moscas de la fruta.
Análisis de datos. Previa comparación de homogeneidad de varianzas y normalidad de los datos, se realizaron pruebas De Kruskall Wallis para comparar la densidad de hormigas por unidad muestral (trampa de caída). Teniendo en cuenta la identidad de las hormigas en actividad depredadora, se evaluó la similitud entre pares de sitios los cuales fueron a su vez confrontados entre si con el resto de los sitios mediante un análisis de aglomeración con correlación de Pearson (Hanneman 2002). Se realizó un análisis de componentes principales (ACP) se realizó con las variables vegetales mediante el programa Statistica (STATSOFT 1995).
Resultados
Se registraron 1.674 hormigas en las trampas de caída y 912 en actividad de depredación, distribuidas en 101 morfoespecies pertenecientes a siete subfamilias. Se encontraron 39 morfoespecies en común para ambos procedimientos (ver anexo). En el estrato epígeo (pitfall), los usos de la tierra con sombra presentaron mayor número de morfoespecies exclusivas (26) frente a los de sol (8). Los potreros presentaron más especies de hormigas (20) frente a los cafetales (9), los cuales presentaron diferencias significativas en riqueza para Dagua (Kruskal Wallis, P << 0.001; g.l. = 7; F = 6.59) y para Pescador (Kruskal Wallis, P << 0.001; g.l. = 7; F = 7). Ambos métodos de muestreo coincidieron en que el uso de suelo más rico fue el potrero de sombra; el más pobre fue el potrero de sol (pitfall) y café de sombra (depredación) (Tabla 2).
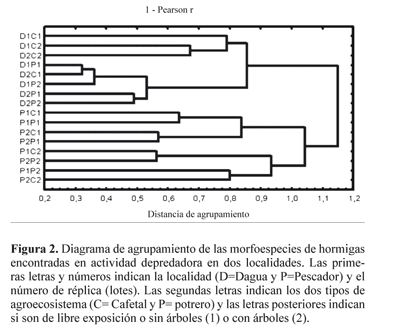
Actividad de depredación. Un total de 17 morfoespecies depredadoras han sido catalogadas en la literatura como tal (Silvestre et al . 2003), las restantes se encuentran dentro de gremios como generalistas, omnívoras o de reclutamiento masivo. De los estratos muestreados, 8,7% de los eventos fueron atribuidos a hormigas exclusivas del estrato arbóreo, 27,3% fueron exclusivas de suelo, mientras que el 63,92% de los eventos de depredación ocurrió por especies que usaban ambos estratos. De acuerdo con el análisis de aglomeración, se encontró que la identidad de la mirmecofauna depredadora tuvo una marcada separación entre localidades. Los usos se agruparon de manera cercana entre cafetales vs. potrero para Dagua y sol vs sombra para Pescador (Fig. 2).
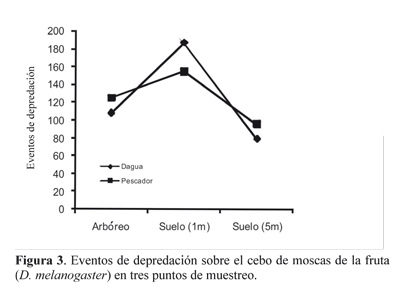
El papel de los árboles: ¿bajan las hormigas depredadoras? La distancia horizontal desde los árboles al cebo está relacionada con la actividad depredadora de las hormigas. Se observó que a medida que se alejó el cebo del árbol, el número de eventos de depredación disminuyó (Fig. 3).
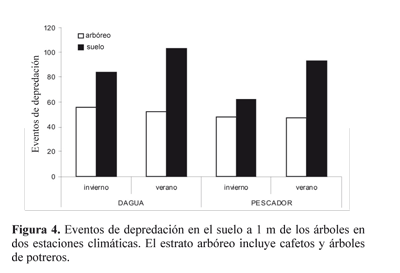
En cuanto a la época climática, se detectó que la actividad de depredación se acentuaba sobre el suelo en la época seca. Es decir, la diferencia entre suelo y árbol en la época seca se hizo más marcada, debido al descenso de las hormigas arbóreas a depredar en las zonas adyacentes (a 1 m de la estación de muestreo). Se observaron caminos de forrajeo del árbol hasta el suelo de hormigas pertenecientes al género Crematogaster en el potrero de sombra de la finca Don Célimo. La actividad depredadora fue mayor en el suelo y ésta tendió a aumentar en la época seca (Fig. 4).
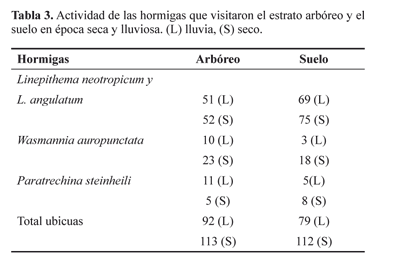
Para aquellas especies de hormigas compartidas entre estratos, las que visitaron tanto los árboles como el suelo, también se encontró que en general hubo una tendencia a mayor depredación en época de verano en el suelo. Solo Wasmannia auropunctata (Roger, 1863) se comportó contrariamente a esta tendencia, i.e. posiblemente subiendo a los árboles o permaneciendo entre la corteza y entre ramas (Tabla 3).
Discusión
En este estudio se implementó el uso de las trampas de caída con el fin de obtener un estimado de la composición de especies (Bestelmeyer et al . 2000), que a la vez sirviera como punto de referencia a la evaluación realizada con los cebos de moscas. El uso simultáneo de estos métodos, mostró que fueron complementarios, pues cada uno aportó en la caracterización de la mirmecofauna, además de reflejar la misma tendencia en cuanto a riqueza y actividad depredadora en su orden: (1) potrero sombra, (2) café de sol, (3) café de sombra y (4) potrero de sol.
La diversidad planeada por el agricultor, en este caso, la adición de un estrato arbustivo o arbóreo en el agroecosistema, puede estar influenciando positivamente la diversidad y actividad de las hormigas, especialmente en época seca, donde podrían escasear recursos. Esto se evidenció en los potreros a libre exposición y de sombra. Se sugiere que la presencia de árboles podría favorecer de manera indirecta las funciones ecológicas presentes en los agroecosistemas. Es notable que la riqueza de hormigas fuese similar en los cafetales de sol y de sombra, pues se ha encontrado mayor diversidad en los sistemas de sombra en Colombia (Armbrecht et al . 2005; Gallego-Ropero 2005). Es razonable que, siendo lotes vecinos y de tamaños tan pequeños, se comporten, bajo el punto de vista de la biodiversidad asociada, como retazos en medio de un paisaje altamente heterogéneo. Esto significaría que, en un contexto donde la matriz es tan variada, el efecto de borde puede ser más importante de lo supuesto, pues en este estudio los transectos se separaron 10 m de los bordes. Tanto los cafetales de sol y de sombra como los potreros de sol y de sombra estaban cerca a guaduales y cañaduzales con signos de regeneración, aunque no se detectaron bosques naturales estructurados cerca de los lotes.
El análisis de agrupamiento mostró una separación marcada entre localidades (Fig. 2), esto indica que, aunque ambos sitios se encuentren en altitudes similares, la interposición de una barrera geográfica importante como es la cordillera occidental, demarcó una identidad de las hormigas en actividad depredadora bien diferenciada (Fig. 1).
Hormigas en actividad depredadora. De acuerdo con la literatura confrontando los géneros hallados en el presente estudio, solamente 17 morfoespecies serían catalogadas como número pequeño frente a todo el grupo de hormigas que se encontró en este estudio. Sin embargo, los resultados deben interpretarse con cautela, ya que algunas especies de hormigas solo se capturaron activamente depredando unas pocas veces, y no podrían catalogarse por esto como depredadoras. El consumir moscas Drosophila puede ser solo una parte de lo que incluyen en su dieta y pueden incluir otros recursos alternos como detritos, sustancias azucaradas provenientes de hemípteros y nectarios extraflorales. En el caso de Cyphomyrmex, probablemente este individuo estaba removiendo pedazos de una mosca muerta. Los miembros de este género utilizan pedazos de insectos muertos y de frutos como sustrato para cultivar su hongo (Hölldobler y Wilson 1990).
Por otro lado, existen especies que están clasificadas en otros gremios, como es el caso de Linepithema neotropicum (Wild, 2007) la cual es una reclutadora masiva, que en este caso fue muy versátil y conspicua en los cebos de ambas localidades. No obstante, la mayoría de hormigas encontradas en este estudio en actividad depredadora no son propias de este gremio pero muestran un potencial muy importante en la función ecológica de la depredación que se podría estar subestimando en la literatura.
Las hormigas capturadas en trampas de caída y catalogadas como depredadoras (géneros Strumigenys y Tatuidris) no llegaron a los cebos de moscas de la fruta, posiblemente por sus hábitos especializados, o porque el cebo no es el adecuado.
El papel de los árboles como soportes favorables para la depredación. La importancia del estrato arbustivo no deriva necesariamente de lo que ocurre en el árbol, sino el efecto que genera sobre el suelo y su alrededor (Fig. 4). El punto de muestreo a 1 m del suelo presentó la mayor actividad depredadora y a medida que se alejó del árbol (a 5 m) disminuyó dicha actividad, esto apoya la idea que las presas más cercanas al árbol son más vulnerables, por estar en el punto de confluencia del forrajeo de las hormigas, que bajan de los árboles o que suben a ellos. Existen características dentro del agroecosistema que pueden influenciar la actividad de forrajeo de las hormigas y por consiguiente su eficiencia como depredadoras sobre insectos plaga (Saks y Carroll 1980; Way y Khoo 1992; Chacón de Ulloa 1994; Philpott y Ambrecht 2006).
¿Bajan las hormigas del estrato arbóreo en época seca? La actividad depredadora en el estrato arbustivo se mantiene en ambas estaciones climáticas, pero en la estación seca la actividad en el suelo aumenta. Esto puede ser explicado por el mayor número de eventos de depredación (63,92%) de hormigas ubicuas encontradas, en especial por el grupo de Linepithema spp.; es decir que éstas realmente incrementan su número de visitas al suelo.
Philpott y Armbrecht (2006) propusieron que los enemigos naturales generalistas y especialistas son más abundantes en policultivos donde son más eficientes reduciendo poblaciones de herbívoros. El presente estudio sugiere esta tendencia, pero no es conclusivo, ni puede generalizarse, puesto que los cafetales de sombra y de sol fueron muy similares (Tabla 2). Por otro lado, Henao (2008) encontró que no hubo diferencia en la tasa de depredación en los cafetales de sombra comparados con los de sol, y en ocasiones fue mayor en zonas abiertas.
El presente estudio pudo comparar simultáneamente la depredación en lotes vecinos de sombra y de sol, pero el efecto del pequeño tamaño de los lotes pasó a influir en el resultado final. Es posible que estos pequeños cafetales de sol alrededor de cañadas de guadua a estas escalas permitan una fauna itinerante que se desplaza entre el cafetal de sol y de sombra. No obstante, los potreros presentaron una fuerte influencia de los árboles. Por tanto, interpretamos que la evidencia es mucho más sólida para este tipo de uso del suelo, es decir, los árboles favorecen la biodiversidad de hormigas.
Se concluye que, aunque la identidad de las hormigas pudo cambiar entre regiones, el comportamiento de depredación fue consistente en las dos zonas de los Andes colombianos; las hormigas ubicaron y depredaron rápidamente a las presas, poniendo en evidencia la eficacia y la alta capacidad de depredación. Además, los resultados apoyaron que la influencia de los árboles favorece la depredación por hormigas en el suelo.
Agradecimientos
Las autoras agradecen a Héctor Henao por compartir información, a Carlos Santamaría, James Montoya, María Cristina Gallego, Levi Emmanuel Ortiz por colaboración en el campo, a CIPAV, a los propietarios de las fincas, especialmente Don Célimo, Doña Ernestina por su hospitalidad en sus fincas, y por permitirnos realizar el trabajo de investigación. A Roberto José Guerrero (Universidad del Atlántico) por la identificación de Linepithema. La presente investigación fue financiada por el programa de Programa Nacional de Ciencias y Tecnologías Agropecuarias, a cargo de IA, código de Colciencias 1106-07-17808 de Colciencias y cofinanciación de la Universidad del Valle, Cali, Colombia.
Literatura citada
ALTIERI, M. A.; SILVA, E. N.; NICHOLLS, C. I. 2003. O papel da biodiversidade no manejo de pragas. Holos, Editora Ltda-ME. Ribeirao Preto SP. Brazil. 227 p. [ Links ]
ANDERSEN, A. N.; MAJER., J. D. 2004. Ants show the way down under: invertebrates as bioindicators in land management. Frontiers in Ecology and Environment 6: 291-298. [ Links ]
ARMBRECHT, I.; PERFECTO, I. 2003. Litter-twig dwelling ant species richness and predation potential within a forest fragment and neighboring coffee plantations of contrasting habitat quality in México. Agriculture Ecosystems and Environment 97: 107-115. [ Links ]
ARMBRECHT, I.; VANDERMEER, J.; PERFECTO, I. 2004. Enigmatic biodiversity correlations: leaf litter ant biodiversity respond to biodiverse resources. Science 304: 284-286. [ Links ]
ARMBRECHT, I.; RIVERA, L.; PERFECTO, I. 2005. Reduced diversity and complexity in the leaf litter ant assemblage of Colombian coffee plantations. Conservation Biology 19 (3): 897- 907. [ Links ]
BENAVIDES, J.; CASTIBLANCO, J.; VIVAS, A. J. 2006. Biodiversidad en cifras, pp. 21-39. En: Chaves, M. E.; Santamaría, M. (Eds.). Informe sobre el avance en el conocimiento y la información de la biodiversidad 1998-2004. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D.C., Colombia. [ Links ]
BESTELMEYER, T. B., AGOSTI, D.; ALONSO, L. E.; BRANDAO, C. R. F.; BROWN, W. L. JR.; DELABIE, J. H. C; SILVESTRE, R. 2000. Field techniques for the study of grounddwelling ants: an overview, description and evaluation, pp. 122- 144. En: Agosti, D.; Majer, J. D.; Alonso, L. E.; Schultz, T. R. (Eds.). Ants. Standard methods for measuring and monitoring biodiversity. Smithsonian Institution, EE.UU. [ Links ]
BORRERO, J. I. 1986. La substitución de cafetales de sombrío por caturrales y su efecto negativo sobre la fauna de vertebrados. Caldasia 15: 725-732. [ Links ]
CHACON DE ULLOA, P. 1994. Biología e impacto económico de las hormigas. Palmas 15 (4): 25-30. [ Links ]
DELABIE, J. H. C. 1990. The ant problems of cocoa farms in Brasil, pp. 555-569. En: Vandermeer, R. K.; Jaffee, K.; Cedeno, A. (Eds.). Applied myrmecology: a world perspective. Westview, Boulder. [ Links ]
DELABIE, J. H.; AGOSTI, D.; DO NASCIMENTO, I. C. 2000. Litter ant communities of Brazilian Atlantic rain forest region, pp. 1-17. En: Agosti, D.; Majer, J. D.; Alonso, L. E.; Schultz, T. R. (Eds.). Sampling ground-dwelling ants: case studies from the world´s rain forests. Curtin University School of Environmental Biology Bulletin. No. 18. Perth, Australia. [ Links ]
FOLGARAIT, P. J. 1998. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity Conservation 7: 1221-1244. [ Links ]
GALLEGO-ROPERO, M. C. 2005. Intensidad del manejo del agroecosistema del café (Coffea arabiga L.) (monocultivo y policultivo) y riqueza de especies generalistas. Boletín del Museo de Entomología de la Universidad del Valle 6 (2): 16-29. [ Links ]
GALLEGO, M. C.; ARMBRECHT, I. 2005. Depredación por hormigas sobre la broca del café en cafetales cultivados bajo dos niveles de sombra en Colombia. Revista Manejo Integrado de Plagas, Costa Rica 76: 1-9. [ Links ]
GREENBERG, R.; BICHIER, P.; CRUZ-ANGON, A.; REITSMA, R. 1997. Bird populations in shade and sun coffee plantations in central Guatemala. Conservation Biology 11: 448-459. [ Links ]
GREENBERG, R.; BICHIER, P.; CRUZ, A.; MACVEAN, C.; PEREZ, R.; CANO, E. 2000. The impact of avian insectivory on arthropods and leaf damage in some Guatemalan coffee plantations. Ecology 81: 1750-1755. [ Links ]
HENAO, H. H. 2008. Análisis de la actividad depredadora por hormigas en cafetales con y sin sombra de árboles de Cauca y Valle. Tesis de Maestría. Universidad del valle. Cali, Colombia. 76 p. [ Links ]
HANNEMAN, R. A. 2002. Introducción a los métodos del análisis de redes sociales. Universidad de California Riverside. California. E.U. En: http://wizard.ucr.edu/~rhannema/networks/text/textindex.html). Fecha último acceso: [29 octubre 2008]. [ Links ]
HÖLLDOBLER, B.; WILSON, E. 1990. The ants. Harvard University press. USA. 732 p. [ Links ]
IAvH. Instituto Alexander von Humboldt. 2006. Informe sobre el avance en el conocimiento y la información de la biodiversidad 1998-2004. Chaves, M. E.; Santamaría, M. (Eds.). Publicado por Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D.C., Colombia. 2 Tomos. [ Links ]
LESTON, D. 1973. The ant mosaic-tropical tree crops and the limiting of pest and diseases. PANS 19: 311-341. [ Links ]
MAJER, J. D. 1972. The ant mosaic in Ghana cocoa farms. Bulletin of Entomological Research 62: 151-160. [ Links ]
MAJER, J. D. 1976. The influence of ants and ant manipulation on the cocoa farm fauna. Journal of Applied Ecology 13: 157-175. [ Links ]
MAJER, J. D.; DELABIE, J. H. C. 1999. Impact of tree isolation on arboreal and ground ant communities in cleared pasture in the Atlantic rain forest region of Bahia, Brazil. Insectes Sociaux 46: 281-290. [ Links ]
MEDEIRO, M. A. D.; FOWLER, H. G.; DELABIE, J. H. 1995. The ant mosaic (Hymenoptera: Formicidae) of cocoa plantations in southern Bahia. Cientifica (Jaboticabal) 23: 291-300. [ Links ]
MEDINA, C. A. 1994. Nidificación y patrones de distribución espacial de nidos de hormigas en una sabana tropical, Carimagua: llanos orientales de Colombia. Boletín del Museo de Entomología de la Universidad del Valle 2: 31-42. [ Links ]
MOGUEL, P.; TOLEDO, V. M. 1999. Biodiversity conservation in traditional coffee systems of México. Conservation Biology 13: 11-21. [ Links ]
PERFECTO, I. 1991. Dynamics of Solenopsis geminata in a tropical fallow field after ploughing. Oikos 62: 139-144. [ Links ]
PERFECTO, I. 1994. Foraging behavior as a determinant of asymmetric competitive interaction between two ant species in a tropical agroecosystem. Oecología 98: 184-192. [ Links ]
PERFECTO, I.; ARMBRECHT, I. 2003. The coffee agroecosystem in the Neotropics: combining ecological and economic goals, pp. 159-194. En: Vandermeer, J. (Ed.). Tropical agroecosystems. CRC Press, Boca Raton, Florida. EE.UU. [ Links ]
PERFECTO, I.; CASTIÑEIRAS, A. 1998. Deployment of the predaceous ants and their conservation in agroecosystems, pp. 269- 289. En: Barbosa, P. (Ed.). Conservation Biological Control. Academic Press. San Diego, CA. EE.UU. [ Links ]
PERFECTO, I.; SEDILES, A. 1992. Vegetational diversity, ants (Hymenoptera: Formicidae), and herbivorous pests in a Neotropical agroecosystem. Environmental Entomology 21: 61-67. [ Links ]
PERFECTO, I.; RICE, R. A.; GREENBERG, R.; VAN DER VOORT, M. E. 1996. Shade coffee: a disappearing refuge for biodiversity. BioScience 46: 598-608. [ Links ]
PERFECTO, I.; VANDERMEER, J.; LÓPEZ-BAUTISTA, G.; IBARRA-NÚÑEZ, G.; GREENBERG, R.; BICHIER, P.; LANGRIDGE, S. 2004. Greater predation in shaded coffee farms: the role of resident neotropical birds. Ecology 85: 2677-2681. [ Links ]
PHILPOTT, S. M.; DIETSCH, T. V. 2003. Coffee and conservation: a global context and the value of farmer involvement. Conservation Biology 17: 1844-1846. [ Links ]
PHILPOTT, S. M.; ARMBRECHT, I. 2006. Biodiversity in tropical agroforests and the ecological role of ants and ant diversity in predatory function. Ecological Entomology 31: 369-377. [ Links ]
RICE, R. A.; DRENNING, J. 2003. Manual de café bajo sombra. Smithsonian Migratory Bird center (bird friendly). National Zoological Park, Washington, Smithsonian Migratory Bird Center. EE.UU. 63 p. [ Links ]
RISCH, S. J.; CARROLL, R. 1982. Effect of a keystone predaceous ant, Solenopsis geminata on arthropods in a tropical Agroecosystem. Ecology 63: 1979-1983. [ Links ]
SAKS, M. E.; CARROLL, R. 1980. Ant foraging activity in tropical agroecosystems. Agro-Ecosystems 6: 177-188. [ Links ]
SILVESTRE, R.; BRANDAO, C. R. F.; ROSA DA SILVA, R. 2003. Grupos funcionales de hormigas: el caso de los gremios del Cerrado, pp.113-148. En: Fernández, F. (Ed.). Introducción a las hormigas de la región Neotropical. Bogotá, Colombia. [ Links ]
STATSOFT, 1995. CSS: Statistica handbook. Vol.II. Statsoft Inc., Tulsa, Oklahoma [ Links ]
SWIFT, M. J.; ANDERSON, J. M. 1993. Biodiversity and Ecosystem Function in Agricultural Systems, pp. 15-42. En: Schulze, E. D.; Mooney, A. H. (Eds.). Biodiversity and Ecosystem Function. Springer, Berlin. [ Links ]
TERBORGH, J.; WINTER, B. 1983. A method for sitting parks and reserves with special reference to Colombia and Ecuador. Biological Conservation 27: 45-58. [ Links ]
VAN MELE, P.; CUC, N. T. T. 2001. Farmers´ perceptions and practices in use of Dolichoderus thoracicus (Smith) (Hymenoptera: Formicidae) for biological control of pests of sapodilla. Biological Control 20: 23-29. [ Links ]
VANDERMEER, J. 1999. (Unpublished) Ecological Foundations for the new agriculture. Ecology of agroecosystems. Ann Arbor, 441 p. [ Links ]
VANDERMEER, J.; PERFECTO, I. 2000. La biodiversidad y el control de plagas en sistemas agroforestales. Manejo Integrado de Plagas (Costa Rica) 55: 1-5. [ Links ]
VANDERMEER, J.; CARVAJAL, R. 2001. Metapopulation dynamics and the quality of the matrix. The American Naturalist 159: 211-220. [ Links ]
WAY, M. J.; KHOO, K. C. 1992. Role of ants in pest management. Annual Review of Entomology 37: 479-503. [ Links ]