Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.36 no.2 Bogotá July/Dec. 2010
Variación altitudinal en diversidad de Arctiidae y Saturniidae (Lepidoptera) en un bosque de niebla Colombiano
Altitudinal variation in diversity of Arctiidae and Saturniidae (Lepidoptera) in a Colombian Cloud Forest
ANDERSON MUÑOZ1 y ÁNGELA AMARILLO- SUÁREZ2
1 Biólogo, Universidad del Cauca. Carrera 21a No. 6-59 (Popayán, Cauca). ander083q@gmail.com Autor para correspondencia.
2 Ph.D. Profesora Asistente, Departamento de Ecología y Territorio, Facultad de Estudios Ambientales y Rurales, Pontificia Universidad Javeriana, Bogotá. aamarillo@javeriana.edu.co
Recibido: 5-may-2009 • Aceptado: 24-sep-2010
Resumen: La riqueza y diversidad de organismos está asociada a cambios ambientales y a factores como la altitud, determinando el surgimiento de patrones de distribución de grupos y especies. En este estudio se comparó la distribución de la riqueza de Arctiidae y Saturniidae (Lepidoptera) en un gradiente altitudinal (1448-2068 msnm) de un bosque nublado del departamento del Cauca, Colombia. Estos lepidópteros poseen riqueza y características en sus historias de vida marcadamente diferentes. Se seleccionaron tres estaciones altitudinales y en cada caso se realizaron siete sesiones de muestreo de seis días cada una, entre las 6:00p.m. y las 6:00a.m. Se capturaron 70 especies, 55 de Arctiidae y 15 de Saturniidae. La riqueza de Saturniidae disminuyó significativamente con el aumento de la altitud (Kruskal-Wallis P = 0,009), mientras que en Arctiidae la mayor riqueza se presentó en la altitud media (Kruskal-Wallis P = 0,002). La diversidad alfa presentó tendencias similares a las registradas con la riqueza para las dos familias. La diversidad beta para Saturniidae mostró mayor similitud entre estaciones que en Arctiidae. Factores como resistencia a cambios ambientales y la amplitud de plantas hospederas, podrían explicar la diferencia en la distribución altitudinal de la diversidad en estas familias.
Palabras clave: Polillas. Heterocera. Andes.
Abstract: The richness and diversity of organisms is associated with environmental changes and factors such as altitude, determining the configuration of patterns of distribution of groups and species. In this study we compared the distribution and the richness of Arctiidae and Saturniidae (Lepidoptera) along an altitudinal gradient (1448-2068 m elev) in a cloud forest of the Department of Cauca, Colombia. These lepidopterans possess richness and life histories that are considerably different. We selected three altitudinal stations and in each one seven sampling events of six days each were conducted, between 6:00p.m. and 6:00a.m. We captured 70 species, 55 Arctiidae and 15 Saturniidae. The richness of Saturniidae decreased significantly with increasing altitude (Kruskal-Wallis P = 0.009), while the greatest richness of Arctiidae was at the middle altitude (Kruskal-Wallis P = 0.002). Alpha diversity had similar tendencies to that of richness for both families. Beta diversity in Saturniidae showed greater similarity between stations than the Arctiidae. Factors like resistance to environmental changes and the breadth of host plants of each group could explain the difference in the altitudinal distribution of diversity in these families.
Key Words: Moths. Heterocera. Andes.
Introducción
Numerosos estudios muestran la estrecha asociación entre cambios altitudinales y cambios en la composición y diversidad de especies en un área. Al respecto, se han planteado varias hipótesis entre las que se destacan el efecto Rapoport, en donde la riqueza y los rangos de distribución de especies están inversamente ligados a la altitud, presentándose mayor riqueza en altitudes bajas (Fleishman et al. 1998; Stevens 1992; Sanders 2002), y la hipótesis de dominio medio donde la mayor riqueza se presenta en altitudes medias (MacArthur 1969; McCoy 1990; Brown y Lomolino 1998). Sin embargo, algunas objeciones a esta última hipótesis proponen que el patrón observado se debe más a una baja eficiencia de muestreo que a un patrón real de distribución de la riqueza (Camero 2003). Wolda (1987) estudió la distribución de riqueza de especies de insectos a lo largo de gradientes altitudinales en Panamá y sugirió que si además de los gradientes se inspeccionaban las variaciones ambientales a corto y largo plazo se podrían producir diferentes modelos de distribución de riqueza de especies. McCoy (1990) determinó que si la distribución difiere entre elevaciones, entonces la escala temporal empleada influiría fuertemente en la evaluación de estos modelos.
A pesar de la gran diversidad de plantas y animales que se generan por la especial ubicación geográfica de los trópicos, las comunidades de insectos continúan seriamente amenazadas a causa del vertiginoso avance de la frontera agrícola y de la deforestación quienes generan la extinción de gran cantidad de recursos naturales, incluyendo especies aún no descritas y posiblemente de gran importancia económica y ecológica (Camero 2003; Camero y Calderon 2007).
Se estima que una tercera parte del millón de especies de insectos actualmente descritas se localizan en el Neotrópico, en ecosistemas de selvas y bosques (Jaffé 1993). Así mismo, alrededor del 70% del número mundial de vertebrados, plantas superiores y mariposas, se encuentra en doce países "mega diversos" (Carranza 2004), siendo los países más importantes en diversidad de insectos Brasil, Colombia y Perú (Potes 2004). En este contexto, el pacífico colombiano es una de las áreas con mayor número de endemismos a nivel mundial (Pardo 2005; Mosquera et al. 2007).
En este estudio, realizado en La Reserva Natural Tambito, departamento de Cauca, Colombia, se comparó la distribución de la riqueza, diversidad alfa y beta de las familias de Lepidoptera, Arctiidae y Saturniidae en un gradiente altitudinal comprendido entre 1448 y 2068 msnm. Estas familiasse seleccionaron dado que son grupos de amplia distribución y especialmente diversos en zonas tropicales (Scoble 1992; Amarillo 2000). Adicionalmente, se presenta por primera vez para la región un listado de las especies de Saturniidae y de Arctiidae, contribuyendo así al conocimiento para la conservación de la fauna de Insecta del sur-occidente colombiano.
Materiales y Métodos
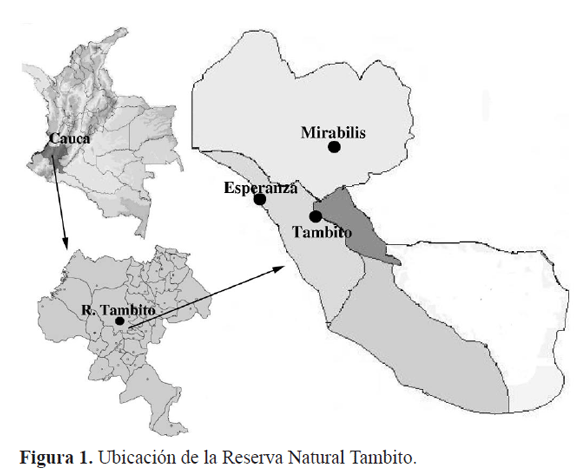
Área de estudio: La Reserva Tambito, se ubica en el municipio de El Tambo, departamento del Cauca, sobre el flanco occidental de la Cordillera Occidental, (2º30´24.1´´N; 76º59´56.6´´O) (Fig. 1). Según Holdridge (1987), está constituida por Bosque muy Húmedo Tropical de pisos premontano y montano bajo. La precipitación y temperatura varían con la altitud: 3500 mm y 12º C promedio en la parte alta (2200 msnm), y 4000 mm y 18º C promedio en la parte media (1400 msnm) (Fernández y Chilíto 1998). En las estaciones seleccionadas para la recolección del material, la flora está dominada en el estrato arbóreo por las familias Clusiaceae, Lauraceae, Rubiaceae, Euphorbiaceae y Meliaceae, y en el estrato arbustivo por las familias Rubiaceae, Moraceae, Lauraceae, Arecaceae y Euphorbiaceae, conformando un bosque secundario bien conservado (Salgado y Alcázar 2004).
Grupos de estudio
Arctiidae. Constituye una familia muy diversa con representantes en todas las regiones zoogeográficas, especialmente en las regiones tropicales donde hay alrededor de 6.000 especies. En algunos países son llamadas polillas tigre, debido a la configuración de sus colores, aunque algunas son de tonalidades castañas o grises. Algunos grupos están compuestos por especies de color blanco puro, a veces con franjas negras y anaranjadas en el cuerpo, o con patas de color naranja. Una gran variedad de especies de vivos colores y diseños se encuentran especialmente en el Neotrópico. Es característico de la familia que las alas posteriores sean bastante estrechas en comparación con las anteriores. Las larvas de esta familia generalmente son pubescentes, con pelos reunidos en penachos que surgen de abultamientos del cuerpo. Son muy poco restringidas en sus dietas alimenticias consumiendo con mayor frecuencia de especies herbáceas, pocas comen hojas de árboles o arbustos (Scoble 1992; Piñas et al. 2000). Los adultos presentan un par de órganos timpánicos a cada lado del metatórax con membranas timpánicas oblicuas y dirigidas hacia atrás, las antenas son bipectinadas, ciliadas en los machos o simples en las hembras. Los palpos maxilares son diminutos, con estructuras de un solo segmento y los palpos labiales son típicamente cortos (Scoble 1992). En este estudio, se siguió la clasificación de Scoble (1992), que incluye las subfamilias Arctiinae, Lithosinae, Ctenuchinae, Thyretinae y Pericopinae.
Saturniidae. Cuenta con una diversidad, de aproximadamente 165 géneros y 1.467 especies (Amarillo 2000), distribuyéndose en todo el mundo excepto en la Antártica (Decaëns et al. 2003). Esta familia se agrupa en siete subfamilias de las cuales cuatro se encuentran en las Américas, y tres se registran en este trabajo (Hemileucinae, Saturniinae, Ceratocampinae). Los miembros de esta familia son en su mayoría de gran envergadura (hasta 30 cm en superficie alar) (Kluts y Kluts 1973). Están representados en el Neotrópico con 850 especies. La región andina posee cerca de 300 especies y aproximadamente 200 casos de endemismos (Lemaire 1978); Mientras que Colombia cuenta con alrededor de 152 especies (Amarillo 2000).
Los adultos de Saturniidae presentan el aparato bucal atrofiado, por lo que no se alimentan en estado adulto, alas generalmente muy escamosas, cuerpos "velludos y lanosos", machos con antenas plumosas, cuadripectinadas o bipectinadas, mientras que en las hembras son normalmente bipectinadas o filamentosas (Amarillo 2000). En muchas especies se presenta una marca en forma de media luna, redondeada u oval en la región central del ala; esta marca en ciertos casos carece de escamas formando una mancha hialina. Algunas especies además, presentan en las alas posteriores un gran ocelo a menudo densamente coloreado (Kluts y Kluts 1973).
Arctiidae y Saturniidae por tener características ecológicas particulares como amplia distribución geográfica en el trópico, características de historias de vida marcadamente diferentes como se menciona en las descripciones previas para cada familia, amplio rango de hábitat, gran cantidad de endemismos y además, una relativa facilidad para su identificación (Heppner 1991; Scoble 1992; Amarillo 2000; Algarin et al. 2008; Contreras 2009), despiertan gran interés en los investigadores, para el desarrollo de estudios como el aquí planteado y para el monitoreo de cambios ambientales.
Métodos de captura. Para la ubicación de la trampa de luz, se eligieron tres estaciones en zonas de bosque, con claros, con el fin de lograr una mayor dispersión de la luz. La estación uno (Tambito) se ubicó a 1.448 msnm (2º30´24"N 76º59´36"W), la estación dos (Esperanza) se ubicó a 1.631 msnm (2º30´30"N 77º0´13"W) y la estación tres (Mirabilis), a 2.068 msnm (2º31´16"N 76º59´36").
Entre los meses de agosto a octubre de 2005 y enero, mayo, junio y julio de 2006, Se llevaron a cabo siete salidas de campo de dos noches por estación. Las capturas iniciaron a las 6:00 p.m. y concluyeron a las 6:00 a.m. Los insectos fueron atraídos empleando una trampa de luz conformada por una tela blanca de 2 m de ancho por 3 m de largo, iluminada por una lámpara Coleman modelo No 288B700 que usaba dos caperuzas emitiendo luz amarilla de aproximadamente 150 W.
Los ejemplares capturados se identificaron con base en los trabajos de Lemaire (1978, 1980 y 1987) y Amarillo (1996, 1997, 1998, 2000) para Saturniidae y Piñas et al (2000) y con la colaboración Bernardo Espinosa (Instituto Nacional de Biodiversidad - INBIO, Costa Rica) para Arctiidae.
Análisis de datos. Se empleó el índice de Chao1 para determinar la eficiencia del muestreo y el número de especies esperadas para las familias. Estos datos se aleatorizaron mediante el Programa Estimates 8.0 y se compararon con lo observado usando las curvas de acumulación de especies. Se emplearon índices de diversidad alfa y beta para evaluar riqueza, abundancia y estructura de los grupos de estudio. La diversidad alfa caracteriza la riqueza de especies en comunidades locales o ensamblajes de especies (Novonty y Weiblen 2005); entre tanto la diversidad beta, representa el grado de reemplazamiento de especies, a lo largo de gradientes ambientales, siendo una indicación de los cambios de composición entre comunidades ecológicas. Como parte de los índices de estructura, se emplearon el índice de Shannon, que evalúa la uniformidad de la muestra y el índice de Margalef, que tiene en cuenta errores de muestreo por efectos ambientales o épocas de captura (Magurran 2004).
Un análisis no paramétrico de Kruskal-Wallis realizado con cada familia, permitió establecer si existían diferencias significativas en la riqueza de especies entre estaciones de muestreo, y posteriormente una prueba de rangos múltiples permitió establecer los pares de estaciones para los cuales estas diferencias eran significativas. Finalmente, se estimó la diversidad beta para cada familia comparando la similitud entre estaciones mediante el índice de distancia de Bray Curtis (Magurran 2004).
Resultados y Discusión
Representatividad de la muestra. Se recolectaron 149 ejemplares de la familia Arctiidae y 56 de la familia Saturniidae, distribuidos en siete subfamilias, Saturniinae (cuatro especies), Hemileucinae (ocho especies) y Ceratocampinae (cuatro especies) para Saturniidae y Arctiinae (24 especies), Lithosinae (siete especies), Ctenuchinae (ocho especies) y Pericopinae (dos especies), para Arctiidae (Tabla 1).
Las curvas de acumulación de especies para Arctiidae (Fig. 2A) muestran pendientes positivas muy marcadas indicando que falta mayor tiempo de muestreo para obtener un inventario representativo de esta familia en el área de estudio. Los datos de Chao son congruentes con esta afirmación, registrándose un total de 130 especies esperadas y una eficiencia de captura de 42%.
Las curvas de acumulación de especies de la familia Saturniidae (Fig. 2B), muestran pendientes positivas marcadas, pero a diferencia de Arctiidae, el número de especies esperadas calculado por Chao 1 es 15 indicando que el inventario de satúrnidos de la zona está casi completo, lo que significa que aunque se recolectó un número reducido de especies, estas constituyen una muestra representativa de la riqueza de esta familia en la Reserva, alcanzando un 98% en la eficiencia de muestreo.
Riqueza. El número de especies de satúrnidos encontrados en Tambito (15 especies) es menor al obtenido en la Reserva Río Ñambí (59 especies) (Amarillo 1997), San José del Palmar (32 especies) (Decaëns et al. 2003) y Albania (29) (Racheli y Racheli 2005). Las diferencias se explican en función del gradiente altitudinal considerado, dado que en el presente estudio se trabajó con altitudes desde 1.448 hasta 2.068 msnm, mientras que en los estudios antes mencionados, no se superaron los 1.000 msnm.
Comparando los satúrnidos recolectados en este trabajo con los registros para Colombia (302 especies aproximadamente), Tambito posee el 5% de los satúrnidos del país en un área no mayor a 1.400 Has. En el caso de Arctiidae (55 especies), el número de especies encontradas no se pudo comparar con otros estudios, dado que este es el único trabajo que se conoce sobre la distribución y riqueza de esta familia en Colombia. En la literatura se encuentran estudios con esta familia para Ecuador (Piñas et al. 2000; Hilt 2005; Padrón 2006), Brasil (Teston y Corseuil 2004; Ferro y Diniz 2007), Perú (Grados 2002) y Nicaragua (Maes et al. 2004; Hernández et al. 2004). Aunque ninguno de ellos compara comunidades en diferentes altitudes, si hacen aportes relevantes sobre el número de especies de árctidos de cada país. Un ejemplo claro es el de Piñas et al. (2000) que registra 532 especies de árctidos en Ecuador; si se considera la extensión del territorio colombiano, este registro puede ser conservador pues los árctidos registrados en Tambito representan el 10% de las especies ecuatorianas registradas por Piñas et al. (2000), y si además se tienen en cuenta los resultados esperados por el índice de Chao 1 (que supera las 130 especies), se estaría hablando aproximadamente del 20% de los árctidos ecuatorianos incluidos en un área que no supera las 1400 Has.
Esta es quizás la primera investigación sobre la familia Arctiidae en ecosistemas naturales colombianos registrando por primera vez 55 especies. Entre tanto para la familia Saturniidae se amplió el rango de distribución de cinco de las 15 especies registradas en este trabajo. Comparando la distribución de las especies de Saturniidae recolectadas con la distribución que registró Amarillo (2000), se amplia el rango de distribución de Automeris oiticiacai, Gamelia kiefferi, Hylesia mimex, Hylesia bouvereti y Citheronia equatorialis (Tabla 1).
Variación altitudinal. La riqueza y diversidad de Saturniidae disminuye con la altitud. Aunque se presenta una tendencia general para la familia, la distribución de la riqueza por subfamilia (Fig. 3A), varía. Las subfamilias Ceratocampinae y Saturniinae, registraron mayores valores de riqueza a 1448 m, conservando la tendencia general de la familia. La subfamilia Hemileucinae presentó mayores valores de riqueza a1631 m, similar a lo presentado por Tomaz y Januz (2002) pues a pesar de tener una distribución general para todo un grupo (subfamilia Satyrinae), se presentaron variaciones dentro del mismo.
La mayor riqueza de Arctiidae se presentó a 1631 m disminuyendo en las restantes altitudes; este patrón de distribución altitudinal se podría explicar en parte, por la versatilidad de sus especies que permiten que la familia pueda resistir cambios bruscos en las condiciones ambientales (Scoble 1992). Igual que con Saturniidae, la variación en la distribución de las subfamilias de Arctiidae, presentó los siguientes resultados: Las especies de Pericopinae se distribuyeron homogéneamente a lo largo del gradiente. Las subfamilias Arctiinae, Lithosinae y las especies no identificadas, registraron valores de riqueza mayores en los 1631 m, conservando la tendencia general de la familia. La subfamilia Ctenuchinae y el género Agylla (Walter, 1984), presentaron mayores valores de riqueza a 1448 m (Fig. 3B). Estos resultados concuerdan con lo presentado por Tomas y Januz (2002), Brehm y Fiedler (2003) y Arvid (2003) quienes encontraron comportamientos similares, con mayores riquezas en altitudes medias y algunas variaciones internas en los grupos de estudio.
Diversidad Alfa. Los índices de diversidad Alfa (Margalef y Shannon) para Arctiidae, presentaron los siguientes valores: estaciones Tambito Dmg= 5,96, H´=2,93, estación Esperanza Dmg=8,83, H´=3,41 y estación Mirabilis Dmg= 3,11, H´=2,09, arrojando las mismas tendencias altitudinales para las variables descritas. Aunque para Colombia no se tienen registros de investigaciones en gradientes altitudinales para esta familia, se encontraron estudios similares en mariposas diurnas (Palacios y Constantino 2006) que muestran patrones similares a los de la familia Arctiidae. Estos valores son el producto de la convergencia o solapamiento de los rangos de distribución altitudinal de las especies en la altitud intermedia. En nuestro caso no se puede asegurar que esta sea la razón única de estos resultados para Arctiidae, pues no se conocen con precisión los rangos de distribución altitudinal y por lo tanto no se tiene certeza sobre la presencia de solapamientos. Por otra parte, estudios como los de Sanders et al. (2003), Jiménez et al. (2004), Abós (2005) y Hilt (2005), mencionan que en áreas de mosaico, es decir en zonas de cultivos contiguas a áreas boscosas, se presenta una mayor riqueza de lepidópteros; esta podría ser una razón que explique el mayor número de especies en las estaciones Tambito y Esperanza que son utilizadas en sus inmediaciones para vivienda y pastoreo.
De igual forma no se encontraron estudios de perfiles altitudinales para Saturniidae. Sin embargo, haciendo una comparación con otros grupos de flora y fauna encontramos distribuciones similares en trabajos como los de Luna y Llorente (2004) para los Rophalocera de la Sierra Nevada (México); Steege (2004) para las plantas de la Guyana; Suárez y Ramírez (2004) para los anuros en Santander (Colombia), todos ellos concordantes con la regla de Rapoport (Sanders 2002); es decir, que la riqueza de especies disminuye uniformemente con el aumento de la elevación. Este modelo se ha registrado en numerosos estudios con mariposas (Fleishman et al. 1998), plantas, mamíferos, reptiles, algunos anfibios y saltamontes entre otros (Stevens 1992).
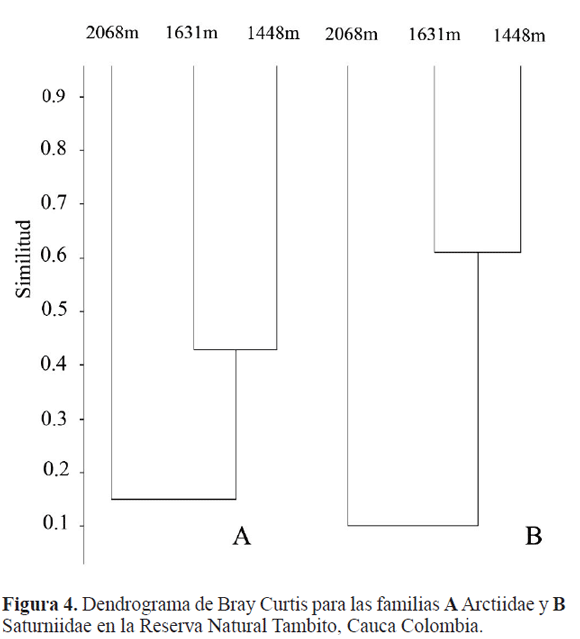
Diversidad Beta: El índice de Bray Curtis para las dos familias arroja resultados similares (Figs. 4A y 4B); el mayor porcentaje de similitud se presenta entre 1.448 y 1.631 m; esto se debe principalmente a que los factores ambientales y composición florística en estas estaciones no varían considerablemente, mientras que en la estación Mirabilis (2068 m) se presentan temperaturas más bajas y cobertura vegetal más densa que la cobertura de las estaciones Tambito y Esperanza que generan la gran diferencia en la estructura de las comunidades de las familias estudiadas.
Los resultados de Kruskal-Wallis indican que existen diferencias significativas en la distribución altitudinal en cada una de las familias (Arctiidae P = 0,0018 y Saturniidae P = 0,0097). La prueba de rangos múltiples mostró que para Arctiidae las diferencias se presentaron entre las estaciones Tambito -Esperanza y Esperanza- Mirabilis respectivamente. Probablemente estas tendencias de distribución se deben a su resistencia a cambios ambientales y a la amplia gama de plantas hospederas que facilitan el acceso de este grupo a gran variedad de recursos.
La familia Saturniidae, también mostró diferencias significativas en su tendencia de distribución altitudinal, pero la prueba de rangos múltiples no pudo determinar entre cuáles pares de altitudes se presentaron tales diferencias; esto debido a que el número de muestras obtenido fue muy pequeño y si bien aportan información valiosa para la definición de latendencia altitudinal de esta familia, no es una muestra ideal para este análisis.
El índice de Bray Curtis también muestra un cambio gradual en la estructura de las comunidades que se da como consecuencia del reemplazo a nivel vegetacional entre los niveles altitudinales estudiados.
En conclusión, las tendencias de distribución altitudinal de Saturniidae están bien definidas adaptándose fácilmente a las características ambientales de las zonas bajas concordando con la regla de Rapoport. Entre tanto, las tendencias de distribución de la familia Arctiidae no se pueden determinar con certeza, pues a pesar de presentar mayor riqueza en la altitud media y rangos de distribución más amplios que los de la familia Saturniidae, la riqueza obtenida está por debajo del 50% según los estimativos utilizados.
Agradecimientos
A la fundación Proselva por el apoyo logístico y financiero del proyecto, al Museo de Historia Natural de la Universidad del Cauca por los materiales suministrados, a la fundación Idea Wild por suministrar parte de los equipos, al Dr. Carlos Sarmiento por el permiso para acceder a la colección de Saturniidae del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, a Bernardo Espinoza de INBIO por su colaboración con la identificación de ejemplares de Arctiidae y a los evaluadores de este documento por sus valiosos aportes.
Literatura citada
ABÓS, F. 2005. Análisis de las Comunidades de Mariposas en los Agroecosistemas en Aragón, España (Lepidoptera: Papilionoidea y Hesperioidea). Revista de Lepidopterología 33 (131). [ Links ]
ALGARIN, C.; MARIN, M.; URIBE, S.; FREITAS, A. 2008. Tabla de vida de Pseudodirphia pallida (Lepidoptera: Saturniidae) en condiciones de laboratorio. Revista Colombiana de Entomología 34 (1): 116-120. [ Links ]
AMARILLO, A. 1996. Nuevos Registros de Saturninos (Lepidoptera: Saturniidae) para Colombia. Entomólogo 24 (81): 12. [ Links ]
AMARILLO, A. 1997. Actividad de Saturninos (Lepidoptera: Saturniidae) en la Reserva Natural Río Ñambí Nariño, Colombia. Boletín Museo de Entomología Universidad del Valle 5 (2): 1-14. [ Links ]
AMARILLO, A. 1998. Nuevos Registros de Satúrnidos (Lepidoptera: Saturniidae) para Colombia. II. Entomólogo 27 (86): 3. [ Links ]
AMARILLO, A. 2000. Polillas Satúrnidas (Lepidoptera: Saturniidae) de Colombia. Biota Colombiana 1 (2): 177-186. [ Links ]
ARVID, J. 2003. Ecological Interpretations of the Mid-Domain Effect. Ecology Letters 6 (10): 883-888. [ Links ]
BREHM, G.; FIEDLER, K. 2003. Faunal Composition of Geometrid Moths Changes with Altitude in an Andean Montane Rain Forest. Journal of Biogeography 30 (3): 431-440. [ Links ]
BROWN, J.; LOMOLINO, M. 1998. Biogeography. 2d ed. Sinauer, Sunderland, Mass. [ Links ]
CAMERO, R. 2003. Caracterización de la Fauna de Carábidos (Coleoptera: Carabidae) en un Perfil Altitudinal de la Sierra Nevada de Santa Marta-Colombia. Revista de la Academia Colombiana de Ciencias 27 (105): 491-516. [ Links ]
CAMERO, E.; CALDERÓN, A. 2007 Comunidad de Mariposas Diurnas (Lepidoptera: Rhopalocera) en un Gradiente Altitudinal del Cañón del Río Combeima - Tolima, Colombia. Acta Biológica Colombiana 12(2): 95-110. [ Links ]
CARRANZA Q. 2004. La Diversidad Biológica de Colombia. Web site. http://www.monografias.com/trabajos12/ladivbio/ladivbio. shtml. Fecha ultima revisión: 15 agosto 2006. Fecha último acceso: 22 noviembre de 2009. [ Links ]
CONTRERAS, A. 2009. Notas sobre Psilopygida walkeri (Grote, 1867) (Lepidoptera: Saturniidae) controlador biológico del jukerí-estero (Mimosa pigra Fabaceae) en la Ecorregión del Ñeembucú. Azariana (Paraguay) 1 (8): 67-74. [ Links ]
DECAËNS, T.; BONILLA, D.; RAMIREZ, L.; AMARILLO, A.; WOLFE, K.; BROSH, U.; NAUMAN, S. 2003. Diversidad de Saturniidae (Lepidoptera) en la Selva Andina de San José del Palmar (Alto Chocó Colombia). Boletín Científico, Centro de Museos, Museo de Historia Natural. Manizales 7: 58-59. [ Links ]
FERNÁNDEZ, A.; CHILÍTO, W. 1998. Composición y Abundancia de la Comunidad de Lepidópteros Diurnos (Rhopalocera), en Tambito Departamento del Cauca. Tesis de grado. Fundación Universitaria de Popayán. 85p. [ Links ]
FERRO, V.; DINIZ, I. 2007. Composição de Espécies de Arctiidae (Insecta: Lepidoptera) em Áreas de Cerrado. Revista Brasileira de Zoología 24 (3): 635-646. [ Links ]
FLEISHMAN, E.; AUSTIN, G.; WEISS, A. 1998. An empirical test of Rapoport´s rule: elevational gradients in montane butterfly communities. Ecology 79: 2472-2483. [ Links ]
GRADOS, J. 2002. Los Arctiidae y Sphingidae (Lepidoptera: Heterocera) del Santuario Histórico de Machu Pichu, Cuzco, Perú: Estudio preliminar. Revista Perú biológico 9 (1): 16-22. [ Links ]
HERNÁNDEZ, F.; MAES, J.; LAGUERRE, M. 2004. Listado Preliminar de los Ctenuchinae (Insecta: Lepidoptera: Noctuoidea: Arctiidae) de Nicaragua. Revista Nicaragüense de Entomología 64: 1-13. [ Links ]
HEPPNER, J. 1991. Faunal Regions and the Diversity of Lepidoptera. Tropical Lepidoptera 2 (1): 1-85. [ Links ]
HILT, N. 2005. Diversity and Species Composition of Two Different Moth Families (Lepidoptera: Arctiidae y Geometridae) Along a Sucessional Gradient in the Ecuadorian Andes. Doctoral Thesis. 251p. [ Links ]
HOLDRIDGE, L. 1987. Ecología Basada en Zonas de Vida. Costa Rica: IICA. 206pp. [ Links ]
JAFFÉ, K. 1993 El Mundo de Las Hormigas. Ediciones de la Universidad Simón Bolívar. Maracay. 190p. [ Links ]
JIMÉNEZ, A.; MARTÍN, J.; MUNGUIRA, M. 2004 Patrones de diversidad de la Fauna de Mariposas del Parque Nacional deCañaberos y su Entorno (Ciudad Real, España central), (Lepidoptera: Papilionoidea y Hesperioidea). Animal Biodiversity and Conservation 27. 2. [ Links ]
KLUTS, A.; KLUTS, E. 1973. Los Insectos. Editorial Seix Barral, S.A. Barcelona. p. 151-157. [ Links ]
LEMAIRE, C. 1978. Les Attacidae Americains. Attacinae. Édition. Neuilly-sur- Seine. 238 p. [ Links ]
LEMAIRE, C. 1980. Les Attacidae Americains. Arsenurinae. Édition. Neuilly-sur- Seine. 199 p. [ Links ]
LEMAIRE, C. 1987. Les Attacidae Americains. Ceratocampinae. Édition. Neuilly-sur- Seine. 416 p. [ Links ]
LUNA, M.; LLORENTE, J. 2004. Papilionoidea (Lepidoptera: Rhopalocera) de la Sierra Nevada, México. Acta Zoológica Mexicana 20 (2): 79-102. [ Links ]
MAES, M.; BARNES, M.; LAGUERRE, M.; CERDA, J. 2004 Fauna Entomológica de Nicaragua, Familia Arctiidae. [ Links ]
MAC ARTHUR, R. 1969. Patterns of Communities in the Tropics. Biological Journal of the Linnean Society 1: 19-30. [ Links ]
MC COY, E. 1990. The Distribution of Insects along Elevational Gradients. Oikos 58: 313-322. [ Links ]
MAGURRAN, E. 2004. Measuring the Biological Diversity. Blackwell Publishing Company. Carleton Australia. 475 p. [ Links ]
MOSQUERA, L.; ROBLEDO, D.; ASPRILLA, A. 2007. Diversidad Florística de dos Zonas de Bosque Tropical Húmedo en el Municipio de Alto Baudó, Chocó-Colombia. Acta biológica Colombiana 12: 75-90. [ Links ]
NOVONTY, V.; WEIBLEN, G. 2005. From Communities to Continents; Beta Diversity of Herbivorous Insects. Annales Zoologici Fennici 42: 463-475. [ Links ]
PADRÓN, S. 2006. Lepidópteros Diurnos y Nocturnos de la Reserva Buenaventura (Piñas -Ecuador). Lyonia 9 (1): 53-65. [ Links ]
PARDO, L. 2005. Sinopsis Preliminar de los Dynastini (Coleoptera: Scarabaeoidea) del Choco Biogeografico, Colombia. Boletín Científico - Centro de Museos - Museo de Historia Natural 9: 206-221. [ Links ]
PALACIOS, M.; CONSTANTINO, L. 2006. Diversidad de Lepidópteros Rhopalocera en un Gradiente Altitudinal en la Reserva Natural el Pangan, Nariño, Colombia. Boletín Científico. Centro de Museos. Museo de Historia Natural 10: 258-278. [ Links ]
POTES, L. 2004. Megadiversidad. Web site. http://www.prodiversitas. bioetica.org/nota63.htm Fecha ultima revisión: junio 2006. Fecha ultimo acceso 22 de noviembre de 2009. [ Links ]
PIÑAS, F.; RAB-GREEN.; MANZANO, I. 2000. Mariposas del Ecuador. Vol. 20. Familia Arctiidae. Subfamilias: Arctiinae y Pericopinae. Pontificia Universidad Católica del Ecuador, Quito, 32p. 84 plates. [ Links ]
RACHELI, L.; RACHELI, T.; 2005. An Update Checklist of the Saturniidae of Ecuador. Part I: Hemileucinae. (Lepidoptera: Saturniidae). Shilap Revista de Lepidopterología 23 (130): 203- 223. [ Links ]
SALGADO, B.; ALCÁZAR, C. 2004. Plan de Manejo, Centro de Estudios Ambientales del Pacífico "Tambito". Componente descriptivo. Popayán. 121 p. [ Links ]
SANDERS, N. 2002. Elevational Gradients in Ant Species Richness: Area, Geometry, and Rapoport´s rule. Ecography 25: 25- 32. [ Links ]
SANDERS, N.; MOSS, J.; WAGNER, D. 2003. Patterns of Ants Species Richness Along Elevational Gradient in Arid Ecosystem. Global Ecology and Biogeography 12: 93-102. [ Links ]
SCOBLE, M. 1992. The Lepidoptera, Form, Function and Diversity. Natural History Museum Publications. Oxford University Press. New York. Pág. 332-336. [ Links ]
STEVENS, G. 1992. The Elevational Gradient in Altitudinal Range: an Extension of Rapoport´s Latitudinal rule to altitude. American Natutalist 140: 893-911. [ Links ]
SUÁREZ, H.; RAMÍREZ, M. 2004. Anuros del Gradiente Altitudinal de la Estación Experimental y Demostrativa el Rasgón (Santander, Colombia). Caldasia 26(2): 395-416. [ Links ]
STEEGE, H. 2004. Flora, Vegetation, Endemism and Altitudinal Gradients in the Guyana Highland Area: a Brief Overview. P. 139-146. En: Steege, H. ter (eds). Plant diversity in Guyana: With recommendations for a Protected Areas Strategy. Tropenbos. Series 18, Tropenbos Foundation, Wageningen, The Netherlands 400 p. [ Links ]
TESTON, J.; CORSEUIL, E. 2004. Diversidade de Arctiinae (Lepidoptera, Arctiidae) Capturados com Armadilha Luminosa, em Seis Comunidades no Rio Grande do Sul, Brasil. Revista Brasileira de Entomología 48 (1): 77-90. [ Links ]
TOMAZ, W.; JANUZ, W. 2002. The Vertical Distribution of Pronophiline Butterflies (Nymphalidae, Satyrinae) Along an Elevational Transect in Monte Zerpa (Cordillera de Mérida, Venezuela) with Remarks on Their Diversity and Parapatric Distribution. Global Ecology and Biogeography 11 (3): 211-221. [ Links ]
WOLDA, H. 1987. Altitude, Habitat and Tropical Insect Diversity. Biological Journal of the Linnean Society 30: 313-323. [ Links ]