Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.1 Bogotá June 2011
Resistencia genética al Virus del Arrugamiento Foliar del Fríjol transmitido por Bemisia tabaci (Hemiptera: Aleyrodidae)
Genetic resistance to Bean Leaf Crumple Virus transmitted by Bemisia tabaci (Hemiptera: Aleyrodidae)
MARÍA ELENA CUÉLLAR J.1, FRANCISCO J. MORALES2 y JAMES MONTOYA LERMA3
1 M.Sc. Centro Internacional de Agricultura Tropical, km 17 recta Cali-Palmira, Palmira, Colombia. Dirección actual, Laboratorio de Salud Pública Departamental, carrera 76 No. 4-30, Cali, Colombia. mariaelenacuellar@graffiti.net. Autor para correspondencia.
2 Ph.D. Centro Internacional de Agricultura Tropical, km 17 recta Cali-Palmira, Palmira, Colombia. fmorales@cgiar.org
3 Ph.D. Universidad del Valle, carrera 100 No. 13-00 Cali, Colombia. james.montoya@correounivalle.edu.co
Recibido: 9-dic- 2009 - Aceptado: 21- ene-2011
Resumen: Desde 2002, los cultivos de fríjol habichuela (Phaseolus vulgaris) de la parte plana del Valle del Cauca han sido afectados por el Virus del Arrugamiento Foliar del Fríjol (Begomovirus: Geminiviridae) agente causal de una nueva y severa enfermedad, transmitido por el biotipo B de la mosca blanca, Bemisia tabaci. Se investigó la relación virus-vector utilizando genotipos de fríjol común seleccionados como posibles fuentes de resistencia. Se determinó la eficiencia de transmisión del virus usando diferente número de insectos adultos, hembras y machos, por planta. En la variedad susceptible Top Crop, se logró la transmisión del virus a partir de un adulto por planta y el porcentaje de plantas infectadas aumentó con el número de adultos por planta. Sin embargo, a partir de 15 individuos, el incremento en la incidencia del virus no fue significativo. Las hembras y machos del biotipo A fueron más eficientes en la transmisión del virus que los del biotipo B. Los genotipos evaluados exhibieron diferentes niveles de resistencia, siendo los materiales de fríjol negro los más resistentes. Se confirma la existencia de fuentes de resistencia al Virus del Arrugamiento Foliar del Fríjol lo que permitiría introducir resistencia genética a este virus en el fríjol habichuela cultivado en el Valle del Cauca.
Palabras clave: Mosca blanca. Begomovirus. Biotipos. Colombia. Eficiencia de transmisión.
Abstract: Since 2002, snap bean (Phaseolus vulgaris) plantings in the Cauca Valley department of Colombia have been severely affected by Bean Leaf Crumple Virus (Begomovirus: Geminiviridae) transmitted by the biotype B whitefly, Bemisia tabaci. The virus-vector relationship was studied using common bean genotypes selected as potential sources of resistance. Transmission efficiency of the virus was determined using different numbers of adult insects, males and females, per plant. In the susceptible variety Top Crop, virus transmission was achieved by a single adult per plant and the proportion of infected plants increased with the number of adults per plant. Above 15 adults per plant, however, increase in the incidence of the virus was not significant. Males and females of B. tabaci biotype A were more efficient in transmission of the virus than those of biotype B. The genotypes evaluated exhibited different levels of resistance, with the black bean materials being the most resistant. The existence of sources of resistance to Bean Leaf Crumple Virus is confirmed, which will permit the introduction of genetic resistance to this virus in snap bean varieties grown in the Cauca Valley.
Key words: Whitefly. Begomovirus. Biotypes. Colombia. Transmission efficiency.
Introducción
La mosca blanca Bemisia tabaci (Gennadius, 1889) (Hemiptera: Aleyrodidae) es una plaga importante que causa grandes daños directos e indirectos en varios cultivos (Brown 1990). Los daños directos obedecen principalmente a desórdenes fisiológicos causados por su alimentación a expensas de los nutrimentos de la planta, y de manera indirecta al crecimiento de hongos sobre la excreción de melaza de la mosca blanca y, más importante aún, debido a su habilidad de transmitir virus (Byrne et al. 1990; Oliveira et al. 2001; Perring 2001).
América Latina es la región del mundo más afectada por la transmisión de Begomovirus por B. tabaci, así como por el número de cultivos atacados, las pérdidas en rendimiento y área agrícola devastada por estos patógenos. Las situaciones más críticas se han presentado en México, Centro América, el Caribe, Venezuela, Argentina y Brasil (Morales y Anderson 2001). No obstante, debido al rango de adaptación climática del insecto vector, los Begomovirus son también importantes en regiones agrícolas tropicales y subtropicales de África y sudeste de Asia (Brown 1994).
En Colombia los Begomovirus se habían presentado en brotes aislados y esporádicos en melón (Cucumis melo L., 1753) y badea (Passiflora quadrangularis L., 1759) en los departamentos de Atlántico y Córdoba, respectivamente; además en tabaco en el Huila y en fríjol y soya en el Valle del Cauca (Morales et al. 2000; Morales y Anderson 2001) sin alcanzar niveles críticos para la producción. Sin embargo, en 2002, se presentaron brotes de Begomovirus, con carácter epidémico, en fríjol habichuela en los municipios de Bugalagrande, Pradera, Rozo y Roldanillo del Valle del Cauca. A este último, se dio el nombre de Virus del Arrugamiento Foliar del Fríjol (VAFF) debido a que las hojas presentan un arrugamiento foliar severo y amarillamiento moderado (Morales et al. 2002). Según estos autores, este virus se presentó con características epidémicas y una alta incidencia (superior al 80%), sin precedentes en la historia del país hecho que fue asociado con la aparición del biotipo B de B. tabaci en esta región y a factores que favorecen su reproducción, como la sequía, acompañados por altas temperaturas diurnas. Además, se ha puesto en evidencia que el biotipo B presenta una mayor ventaja reproductiva con respecto al biotipo A nativo (Bethke et al. 1991; Costa y Brown 1991; Romberg 1998), al punto de desplazarlo (Idris et al. 2001; Rodríguez et al. 2005).
Ante la incidencia de estas nuevas enfermedades, el manejo dado al problema de los Begomovirus en fríjol y otros cultivos ha enfatizado principalmente el desarrollo de variedades resistentes (Morales 2001). En este sentido, las fuentes de resistencia desarrolladas contra el Virus del Mosaico Dorado y el Virus del Mosaico Dorado Amarillo del Fríjol e identificadas en P. vulgaris han resultado efectivas contra otros Begomovirus de fríjol común (Morales 2000a). Consecuentemente, estas fuentes de resistencia se evaluaron por su reacción al nuevo Virus del Arrugamiento Foliar del Fríjol.
En el presente estudio también se determinó la eficiencia relativa de la transmisión del VAFF en la variedad susceptible “Top Crop” por los biotipos A y B de B. tabaci usando diferente número de adultos por planta. Igualmente, se investigó si existían diferencias entre hembras y machos de los dos biotipos, en cuanto a su capacidad vectorial y, finalmente, se determinó la reacción de diferentes genotipos de fríjol al VAFF transmitido por los biotipos A y B de B. tabaci.
Materiales y Métodos
Bemisia tabaci. Los biotipos A y B de B. tabaci se obtuvieron de las crías masivas de la Sección de Entomología del Proyecto Fríjol del CIAT. Los adultos utilizados en los ensayos se criaron en cabinas separadas en plantas de fríjol de la variedad ICA-Pijao en jaulas de tul (1 x 1 x 1cm) en condiciones controladas de 25±2°C, 65±5% HR y 12 horas de fotoperiodo, según la metodología propuesta por Eichelkraut y Cardona (1989).
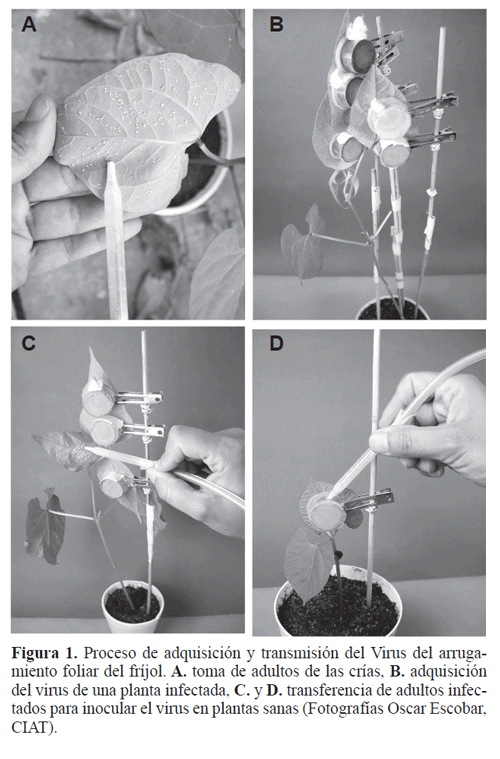
Adquisición e inoculación del Virus por los insectos. El VAFF se aisló en julio de 2003 de plantas de fríjol habichuela de la variedad Lago Azul procedentes del corregimiento de Rozo (3°34’23,8N 76°24’6,2W) a 963 msnm, perteneciente al municipio de Palmira (Valle del Cauca) y fue mantenido en plantas de fríjol de la variedad “Top Crop”, material susceptible a varias especies de virus que infectan fríjol (Morales y Singh 1993). Las plantas fuentes de inóculo se infectaron 13 días antes de los ensayos. Para esto, se dispusieron en los trifolios jaulas pinza (2,5 cm de diámetro y 2 cm de profundidad) que contenían cada una 60 adultos sin discriminar por sexo de B. tabaci de máximo ocho días de edad. (Figs. 1A, B). Pasadas 48 horas, tiempo para adquirir el virus, los insectos se transfirieron a jaulas pinza colocadas en plantas sanas por otras 48 horas para garantizar la transmisión (Figs. 1C, D). Finalmente, los adultos se retiraron y eliminaron.
Con el fin de evitar escapes de adultos infectados, durante los procesos de adquisición y transmisión, las plantas se mantuvieron al interior de jaulas (1,10 x 1,0 x 0,80m) forradas en tul a prueba del escape de moscas blancas. A excepción de las plantas fuente del virus, las de los diferentes tratamientos se retiraron de las jaulas y se distribuyeron en mesas del invernadero de la Unidad de Virología del CIAT para su posterior evaluación. Todos los ensayos se realizaron en el invernadero donde permanecieron a 27°C±5 y 75±5% de humedad relativa.
Efecto del número de adultos y eficiencia de transmisión del virus. Siguiendo el método descrito, las plantas se expusieron al ataque de adultos, sin sexar, putativamente infectivos en un número de uno, tres, cinco, 10, 15, 20 y 25 insectos por planta; para un total de 14 tratamientos. La unidad experimental consistió de cinco plantas por tratamiento. Se evaluó el porcentaje de plantas infectadas hasta un mes después de inoculación. Se realizaron seis repeticiones, con un diseño de parcelas divididas, donde el biotipo fue el bloque principal y el bloque secundario fue el número de adultos.
Se calculó la eficiencia o probabilidad de transmisión de un insecto (p) para cada uno de los tratamientos mediante la fórmula:
Probabilidad de plantas enfermas = 1- (1 - p)n
donde,
p = probabilidad o eficiencia de transmisión
n = número de adultos utilizados para realizar la infección
Esta fórmula, basada en la distribución binomial y propuesta originalmente por Morales y Zattler (1977) para estimar la eficiencia de transmisión de virus por áfidos fue adaptada, en este estudio, para virus transmitidos por B. tabaci por Myriam Cristina Duque, de la Unidad de Biotecnología y Biodiversidad del CIAT (com. pers.).
Transmisión del VAFF por hembras y machos de B. tabaci Los adultos que habían adquirido el virus, se sexaron bajo el estereoscopio y se individualizaron hembras y machos en jaulas pinza ubicando un individuo por planta de los dos biotipos para un total de cuatro tratamientos. La unidad experimental consistió de 20 plantas y se realizaron cinco repeticiones con un diseño de parcelas divididas. Se registró el número de plantas infectadas hasta un mes después de realizado el proceso de inoculación y se calculó el porcentaje de infección.
Reacción de genotipos a la infección viral. Con el objeto de evaluar la respuesta de diferentes genotipos del fríjol al VAFF se emplearon los genotipos: Porrillo Sintético, ICTA Ligero, EAP 9510-77, Red Kloud, BAT 304, Rojo Brasil, Garrapato, Red Mexican 35 (RM-35), Redlands Greenleaf C (RGLC) y Great Northern 31 (GN-31). Estos genotipos fueron desarrollados previamente en la búsqueda de fuentes de resistencia al Virus del Mosaico Dorado y al Virus del Mosaico Dorado Amarillo del Fríjol (Morales 2000b). Algunos de ellos representan la base genética del mejoramiento de las variedades que han sido exitosas para el control de los Begomovirus en fríjol (Morales 2000b).
Los tratamientos consistieron en la inoculación de los genotipos con un número determinado de insectos previamente expuestos al virus. Se realizaron cuatro experimentos, iniciando con 25 insectos por planta para el biotipo A para infectar los 11 genotipos, seguidamente se realizaron dos ensayos con todos los genotipos, disminuyendo a ocho y 15 insectos por planta para el biotipo A y B respectivamente. El último ensayo se realizó con todos los genotipos utilizando seis moscas de los dos biotipos por planta. En todos los casos se usó como material susceptible o control a la variedad Top Crop. La unidad experimental consistió de entre 10 a 12 plantas y se realizaron tres repeticiones para un diseño de parcelas divididas donde el biotipo fue el bloque principal y el secundario el genotipo. Se registró el número de plantas infectadas hasta un mes después de realizado el proceso de inoculación y se calculó el porcentaje de infección.
Análisis de datos. Los datos de porcentaje de infección de virus de ambos biotipos se transformaron con el arcoseno de la raíz cuadrada del porcentaje de infección dividido por cien (Steel y Torrie 1992). Una vez transformados se realizó un análisis de varianza y cuando se presentaron diferencias significativas, la separación de medias se realizó con la prueba de Rayan-Einot-Gabriel-Welsh (SAS Institute 2002).
Resultados y Discusión
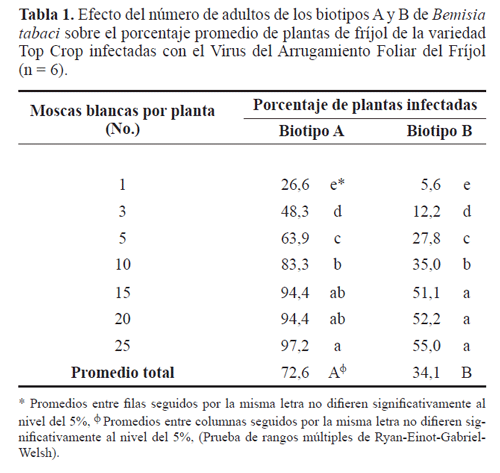
Efecto del número de adultos y eficiencia de transmisión del virus. Aunque los resultados muestran que un individuo de B. tabaci, independiente del biotipo, está en capacidad de transmitir el VAFF a un genotipo susceptible de fríjol, como la variedad Top Crop, el porcentaje de transmisión o incidencia de la enfermedad fue significativamente diferente dependiendo del biotipo de B. tabaci, siendo del 27 y 6% para los biotipos A y B, respectivamente (Tabla 1). Esta diferencia se mantuvo hasta que el aumento de individuos alcanzó 15 y 20 moscas blancas por planta para los biotipos A y B, respectivamente, momento en el cual, independiente del incremento en el número de individuos potencialmente virulíferos, la incidencia del virus no siguió una relación lineal. Al comparar los promedios de los porcentajes de infección (Tabla 1), se encontró que difieren significativamente (P< 0,0001), donde el biotipo A es más eficiente que el B al transmitir el VAFF a plantas de fríjol de la variedad Top Crop. Este resultado coincide con aquellos obtenidos por Idris et al. (2001) quienes registran una mayor eficiencia del biotipo A con respecto del B en la transmisión del Virus del Chino del Tomate, empleando un adulto por planta y, además, da soporte a las observaciones de otros investigadores quienes hacen referencia al biotipo B como un vector menos competente en la transmisión de Begomovirus (Duffus et al. 1992; Duffus y Cohen 1992).
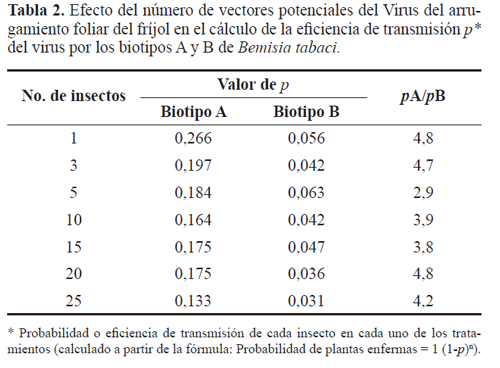
Los valores estimados de p o eficiencia de transmisión del VAFF por un individuo de los biotipos A y B de B. tabaci (Tabla 1), permiten establecer que el biotipo A es por lo menos cuatro veces más eficiente que el B como vector del VAFF (Tabla 2). A pesar de que el cálculo de p en este caso corresponde a un valor observado (e.g. 0,27 para el biotipo A), su estimación a partir de los valores obtenidos con un número mayor (>1) de individuos, muestra una tendencia a subestimar la eficiencia de transmisión p a medida que aumenta el número de vectores potenciales colocados en una planta sana. Este comportamiento sugiere que la incidencia de un virus como el VAFF no es lineal, y que a partir de un cierto número de moscas blancas por planta se genera una curva con una pendiente positiva pero decreciente. Una posible explicación a este resultado recae en el estrés por confinamiento generado por las condiciones experimentales que, posiblemente, incide en la alimentación de las moscas blancas y, en consecuencia, en la transmisión. Por el contrario, en condiciones de campo, los eventos de transmisión del virus serían relativamente independientes, lo que permitiría la inoculación del virus por diferentes individuos en un tiempo relativamente corto.
Transmisión del VAFF por hembras y machos de B. tabaci. Los análisis estadísticos revelaron una interacción biotipo por sexo (P = 0,028), lo cual indica, en primer lugar, que la capacidad de infectar un mayor o menor número de plantas con hembras o con machos puede depender del biotipo y, en segunda instancia, que la eficiencia de transmisión de un biotipo puede depender del sexo (Tabla 3). Al respecto, tanto hembras como machos del biotipo A de B. tabaci transmitieron el VAFF a plantas de Top Crop con la misma eficiencia. Los porcentajes de infección no variaron significativamente y fueron más eficientes para transmitir el patógeno que el biotipo B. Por el contrario, en el caso de este biotipo, el porcentaje de plantas infectadas por las hembras fue significativamente mayor que el causado por los machos (Tabla 3). De otra parte, debido a que por cada planta se utilizó un adulto, el porcentaje de plantas infectadas es equivalente al porcentaje de individuos que infectaron plantas. De este modo, el 92 y 69% de hembras de los biotipos A y B, respectivamente, lograron transmitir el VAFF. En contraste, el 85% de los machos del biotipo A transmitieron el virus, frente a solo el 34% de los machos del B. En ambos casos se presentaron diferencias significativas (Tabla 3).
Aunque en la literatura se reporta que las hembras de B. tabaci son vectores más eficientes que los machos (Cohen y Nitzany 1966; Costa y Bennett 1950; Czosnek et al. 2001; Muniyapa et al. 2000; Nateshan et al. 1996) en nuestro estudio, esto fue válido solo para el biotipo B, en cuanto que no se presentaron diferencias en los porcentajes de transmisión del VAFF entre hembras y machos del biotipo A (Tabla 3). Esto coincide en cierta forma con los estudios de Polston et al. (1990) quienes mostraron que las tasas de detección de ADN (número de insectos con cantidad detectable de acido nucleico viral/ número de insectos evaluados) no fueron diferentes entre hembras y machos de B. tabaci después de la ingestión con el Virus del encrespamiento de la hoja de la calabaza, aunque los machos contenían mayor cantidad de ADN/mg del peso del cuerpo que las hembras. Sin embargo, Costa (1969) sugiere que cuando hay diferencias, la mayor habilidad de las hembras de transmitir virus respecto de los machos se debe a que ellas tienen una mayor actividad metabólica debido a la producción de huevos, lo que conduce a una mayor tasa de adquisición y, por tanto, de transmisión de virus durante el proceso de alimentación en las plantas.
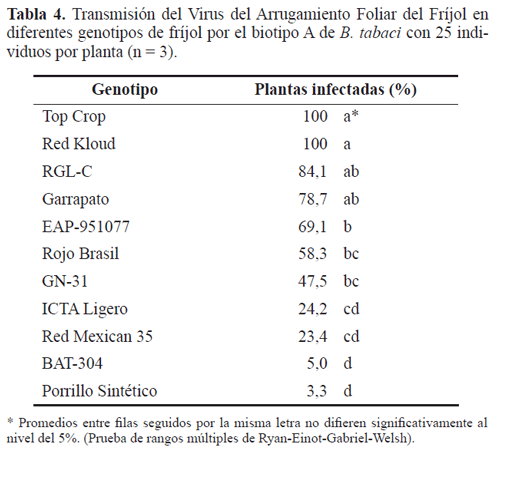
Reacción de genotipos a la infección viral. Con el número de moscas blancas empleadas se logró obtener infección en todos los materiales (Tabla 4) demostrando que ninguno de ellos posee inmunidad. Sin embargo, se presentaron diferencias significativas en el porcentaje de plantas infectadas de acuerdo con el genotipo (P<0,0001), siendo Top Crop y Red Kloud los más susceptibles mientras que los materiales de fríjol negro BAT-304 y Porrillo Sintético fueron los más resistentes. Sin embargo, estos últimos no presentaron diferencias significativas con respecto a ICTA Ligero y Red Mexican-35. Esto sugiere la existencia de diferentes niveles de resistencia al virus en diversos genotipos de fríjol común. Es de destacar que los porcentajes de infección en RGLC y Garrapato no difieren significativamente de otro grupo de genotipos con respuesta moderada o intermedia a la infección como EAP- 951077, Rojo Brasil y GN-31, lo que está indicando que todos estos materiales presentan escapes a la infección del VAFF (Tabla 4).
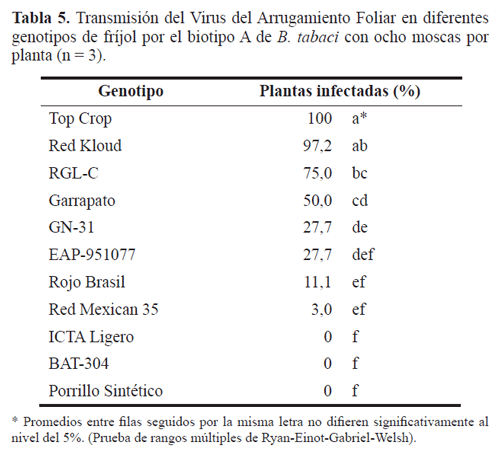
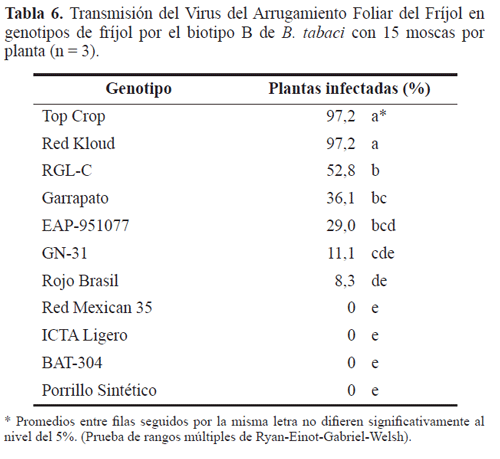
Cuando los genotipos se sometieron a la infección con el virus utilizando ocho adultos por planta del biotipo A y 15 del B, se presentaron diferencias significativas en el porcentaje de infección de acuerdo con el genotipo (P<0,0001). Los porcentajes más altos se obtuvieron con el material susceptible Top Crop, seguido de Red Kloud. A diferencia del ensayo con 25 moscas por planta, con ocho y 15 moscas de los biotipos A y B no se obtuvo infección en los genotipos de fríjol negro ICTA Ligero, BAT-304 y Porrillo Sintético y, además, con Red Mexican -35 para el biotipo B (Tablas 5 y 6). Los valores más bajos de incidencia (29,0-3,0%) en estos ensayos se presentaron para GN 31, EAP-951077, Rojo Brasil con los dos biotipos y Red Mexican-35 para el biotipo A.
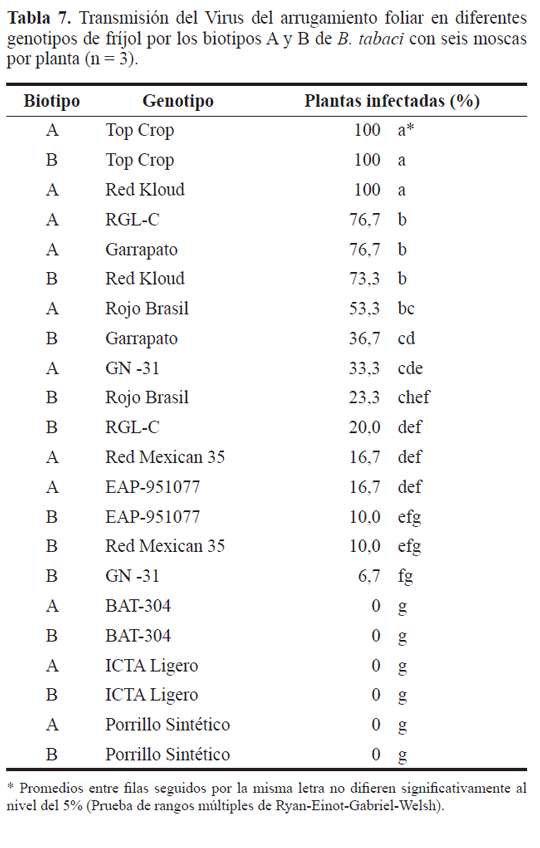
En los resultados de infección de los once genotipos con el VAFF por los biotipos A y B, usando seis moscas por planta, se presentó interacción biotipo por genotipo (P<0,0002) (Tabla 7). Lo anterior significa que los diferentes niveles de resistencia de los genotipos afectan la capacidad de infección de los biotipos. A su vez, dependiendo del biotipo, las plantas de un genotipo dado tienen mayor o menor probabilidad de ser infectadas. Es así como Top Crop por ser un material susceptible, fue infectado por los dos biotipos contrastando con los genotipos de fríjol negro que no se infectaron conel mismo número de moscas blancas utilizadas. Sin embargo, materiales como Red Kloud, RGLC, Garrapato y GN-31 presentaron valores de infección significativamente más altos con el biotipo A que con el B.
Teniendo en cuenta que la totalidad de las plantas de Top Crop fueron infectadas por el VAFF transmitido por los dos biotipos, al igual que la variedad Red Kloud utilizando el biotipo A, estos materiales se constituyeron en los genotipos de fríjol más susceptibles entre los seleccionados en esta investigación, presentando diferencias significativas con respecto de los otros materiales (P<0,0001). Los valores más bajos de infección fueron para EAP-951077 y RM-35 inoculados con los dos biotipos, y RGL-C y GN-31 inoculados mediante el biotipo B. Se obtuvieron valores desde intermedios a altos de infección en los genotipos Rojo Brasil, Garrapato y RGLC infectados con el biotipo A y Red Kloud con el biotipo B. Los resultados con el resto de materiales se pueden ubicar en un nivel de infección bajo (Tabla 5).
Considerando que EAP-951077 es un cultivar que combina diferentes fuentes de resistencia (MD3075 x DICTA 105) contra el Virus del Mosaico Dorado Amarillo del Fríjol, a diferencia de otros evaluados en esta investigación y que se constituyen por sí mismos en fuentes de resistencia (Morales y Niessen 1988), se decidió establecer la eficiencia de transmisión p de un individuo y el número de insectos requeridos para obtener valores esperados del 25, 50, 75 y 95% de plantas infectadas con los biotipos A y B de B. tabaci con esta variedad. Es necesario aclarar que los ensayos con genotipos no fueron diseñados para poner en ejercicio la fórmula de probabilidad. Los resultados de este ensayo se presentan en el anexo 1. En contraste con lo ocurrido con Top Crop (Tabla 2), la eficiencia de transmisión p de un individuo de ambos biotipos fue proporcional al aumento en número de moscas empleadas para inocular las plantas (Anexo). En este caso particular, parece ser que el aumento de individuos por planta no afectó la transmisión del VAFF, lo que pone en duda la hipótesis del estrés inducido en las moscas blancas a medida que se aumenta el número de individuos por planta. De otra parte, haciendo una proyección a partir de la fórmula de probabilidad, se observa que los adultos requeridos para lograr valores esperados del 25 y 50% de plantas infectadas de EAP-951077, están dentro de un rango más estrecho para los dos biotipos, en relación con los requeridos para alcanzar un 75 y 95%. Lo que significa que es más factible acercarse al número requerido de insectos que puede infectar el 50% de las plantas o menos. Es interesante observar cómo, a diferencia de lo que ocurre con un genotipo altamente susceptible como Top Crop, EAP-951077 se ubica entre los materiales que responden con una infección baja al VAFF y, por la misma razón, el número de moscas blancas que podrían requerirse para lograr porcentajes de infección del 75 y 95% son bastante altos, lo que demuestra la existencia de un nivel importante de resistencia en este material (Anexo).
Vale la pena reiterar que cuando se habla de “resistencia” a los Begomovirus que afectan el fríjol en América Latina, se hace en el sentido amplio de la palabra e incluye un rango de niveles de resistencia (Morales 2000b). En este sentido, los materiales que se usaron en este trabajo, habían sido evaluados previamente en condiciones de campo para el VAFF en el corregimiento de La Tupia, municipio de Pradera, Valle del Cauca, Colombia (CIAT 2004). Dichos ensayos revelaron que genotipos como ICTA Ligero, Porrillo Sintético y BAT-304 presentaban niveles altos de resistencia al virus, mientras que, EAP-951077 presentó un nivel de resistencia intermedia y que materiales como Garrapato, Rojo Brasil y RM-35 registraron niveles bajos. RGLC fue catalogado como un material susceptible y Red Kloud y GN-31 se evaluaron una sola vez pues no presentaron una respuesta aceptable en el campo.
Para el Virus del Arrugamiento Foliar del Fríjol, es evidente que, con excepción del genotipo susceptible Top Crop, y en el caso particular de Red Kloud cuando es infectado con el biotipo A, todos los materiales evaluados exhibieron diferentes niveles de resistencia contra el patógeno. Estos resultados corroboran aquellos obtenidos en La Tupia (CIAT 2004), en los cuales los materiales de fríjol negro como ICTA Ligero, BAT-304 y Porrillo Sintético presentaron los más altos niveles de resistencia. Aunque, en el caso de esta investigación, no solamente EAP-951077 presentó niveles de resistencia intermedia, sino también Rojo Brasil, GN-31 y RM-35. Interesantemente, RGLC no se comportó como un material susceptible, sino de baja resistencia a la infección.
Garrapato fue ambivalente en su respuesta a la infección con el virus, presentando bajos niveles de resistencia cuando se evaluó con el biotipo A y niveles intermedios con el B. Según Morales y Niessen (1988) y Morales (2000b) Porrillo sintético ha sido la fuente de resistencia más usada en América Latina para el desarrollo del 95% de las líneas de resistencia al mosaico dorado. Es en este tipo de materiales negros que se encuentra típicamente un porcentaje relativamente bajo de plantas infectadas por el virus y otro porcentaje que ha escapado a la infección especialmente cuando ésta se retrasa bajo condiciones de incidencia tardía o moderada de mosca blanca. En la presente investigación, la infección de los materiales negros solo se logró con el biotipo A, lo que sugiere un mejor desempeño de estos materiales cuando son expuestos a la infección con el biotipo B. No obstante, de acuerdo con lo mencionado por Morales (2000b), la presión de las poblaciones de la mosca blanca en el campo determinan la incidencia del virus.
Morales y Niessen (1988) y Singh (1989), indican que genotipos como GN-31, RGLC y RM-35 fueron desarrollados para zonas de climas templados y crecen mejor en condiciones de invernadero (Morales y Niessen 1988). En este estudio, estos materiales presentaron un mejor desempeño en su respuesta al virus, que lo presentado antes en condiciones de campo (CIAT 2004). Lo anterior es importante en cuanto que estos genotipos presentan resistencia a otros virus de fríjol común que han sido empleados en el mejoramiento de materiales contra el Virus del Mosaico Dorado y el Virus del Mosaico Dorado Amarillo (Morales 2000b). Además porque, al igual que los genotipos de fríjol negro, GN-31 y RM-35 presentan una tendencia al escape especialmente cuando se retrasa la infección con el virus (Morales y Niessen 1988; Morales 2000b). En el caso de RGLC a pesar infectarse sistémicamente, produce vainas con poca deformación (Morales y Niessen 1988), a este material se le ha descubierto el gen Bgp asociado a esta característica (Blair y Beaver 1993).
De otra parte, Morales y Niessen (1988) indican que Garrapato y Red Kloud son genotipos que se infectan sistémicamente con el Virus del Mosaico Dorado Amarillo del Fríjol. Sin embargo, los autores mencionan que cuando estos materiales fueron usados como parentales incluyendo a Porrillo Sintético, los descendientes presentaron niveles de resistencia más altos que sus padres. Este es el caso de A429, un material con color de semilla diferente al negro, que demostró poseer un alto nivel de resistencia al Virus del Mosaico Dorado Amarillo en condiciones de campo y en el cual uno de sus parentales es Garrapato. En consecuencia, así Garrapato presente niveles bajos e intermedios de resistencia continúa, según Morales (2000b), es una de las mejores fuentes de resistencia descubiertas hasta el presente. Se ha descrito el gen recesivo bgm-1 como responsable de la resistencia al amarillamiento de este genotipo y sus descendientes (Blair y Beaver 1993; Singh et al. 2000).
Individuos de B. tabaci del biotipo B fueron colectados en campos de fríjol infectados con el VAFF, en el corregimiento de La Tupia (municipio de Candelaria, Valle del Cauca) y determinados por RAPDs (PCR) (Unidad de Virología- CIAT, datos sin publicar). Esto sugiere que el virus es transmitido en condiciones naturales por el biotipo B, ya que el biotipo A aparentemente fue desplazado (Rodríguez et al. 2005). Es posible que como vector, el biotipo B no sea tan eficiente como el A en transmitir Begomovirus (Duffus et al. 1992; Idris et al. 2001; Markham y Bedford 1993), tal como se pone en evidencia en la presente investigación. Sin embargo, la alta fecundidad de este biotipo (Cuellar et al. en preparación), se refleja en las grandes poblaciones del biotipo B en campo. Según Morales (2006), se han encontrado poblaciones que exceden 2000 individuos de mosca blanca por planta en fríjol común, hecho que compensa lejos las diferencias en la eficiencia de transmisión presentada en los biotipos. Adicionalmente, en este trabajo se demostró que en condiciones experimentales cuando el biotipo B comienza a adquirir y a transmitir Begomovirus, su capacidad de infectar un mayor número de plantas incrementa con el tiempo.
Este trabajo permite concluir que existen fuentes de resistencia al Virus del Arrugamiento Foliar del Fríjol que pueden ser usadas para implementar un programa de mejoramiento genético de fríjol habichuela por su resistencia a este virus en el Valle del Cauca.
Agradecimientos
Al Proyecto de Mosca Blanca Tropical por la financiación del trabajo; a Myriam Cristina Duque, Unidad de Biotecnología y Biodiversidad del CIAT, por el análisis estadístico; al personal del Proyecto Fríjol del CIAT por el suministro de los insectos procedentes de las crías para los ensayos.
Literatura citada
BETHKE, J. A.; PAINE, T. D.; NUESSLY, G. S. 1991. Comparative biology, morphometrics and development of two populations of Bemisia tabaci (Homoptera: Aleyrodidae) on cotton and poinsettia. Annals of the Entomological Society of America 84: 407- 411. [ Links ]
BLAIR, M.W.; BEAVER, J.S. 1993. Inheritance of bean golden mosaic resistance from bean genotype A429. Pag. 143 en: Annual Report Beam Improvement. Centro Internacional de Agricultura Tropical, Cali, Colombia. [ Links ]
BROWN, J. K. 1990. An update on the whitefly-transmitted geminivirus in the Americas and the Caribbean basin. FAO Plant Protection Bulletin 39: 5-23. [ Links ]
BROWN, J. K. 1994. Current status of Bemisia tabaci as a plant pest and virus vector in agroecosystems worldwide. FAO Plant Protection Bulletin 42: 3-32. [ Links ]
BYRNE, D.; BELLOWS, T.; PARRELLA, M. 1990. Whiteflies in agricultural systems. Págs. 227-251 en: D. Gerling (ed.). Whiteflies: Their Bionomics, Pest Status and Management. Intercept, Andover UK. [ Links ]
CIAT, 2004. Annual Report Project IP-1 Bean Improvement for the tropics. Centro Internacional de Agricultura Tropical, Cali, Colombia. [ Links ]
COHEN, S.; NITZANY, F.E. 1966. Transmission and host range of the tomato yellow leaf curl virus. Phytopathology 56(10): 1127- 1131. [ Links ]
COSTA, A.S.; BENNETT, C.W. 1950. White-fly-transmitted mosaic of Euphorbia prunifolia. Phytopathology 40(3): 266-283. COSTA, A.S. 1969. Whiteflies as virus vectors. Pags. 95-119. En K. Maramorosch: Viruses, Vectors and Vegetation. Interscience Press. New York. [ Links ] [ Links ]
COSTA, H.S.; BROWN, J. K. 1991. Variation in biological characteristics and esterase patterns among populations of Bemisia tabaci, and the association of one population with silverleaf symptom induction. Entomologia Experimentalis et Aplicatta 61: 211-219. [ Links ]
CZOSNEK, H.; GHANIM, M.; GHANIM, M. 2001. The circulative pathway of Begomoviruses in the whitefly vector Bemisia tabaci - insights from studies with Tomato yellow leaf curl virus. Annals of Applied Biology 140: 215-231. [ Links ]
DUFFUS, J.E. 1992. Whitefly vectors: increasing threat to world agriculture. Proceedings XIX International Congress of Entomology, Beijing. China. 352 p. [ Links ]
DUFFUS, J.E. ; COHEN, S. 1992. Whitefly-borne viruses and their vectors in the sub-tropical environment. Proceedings 5th International Plants Virus Epidemiology Symposium: Viruses, Vectors and the Environment. Valenzano (Bari). Italia. Pp. 7-8. [ Links ]
EICHELKRAUT, K.; CARDONA, C. 1989. Biología, cría masal y aspectos ecológicos de la mosca blanca Bemisia tabaci (Gennadius) (Homoptera: Aleyrodidae), como plaga de fríjol común. Turrialba 39(1): 51-55. [ Links ]
IDRIS, A. M.; SMITH S. E.; BROWN J. K. 2001. Ingestion, transmission, and persistence of Chino del tomate virus (CdTV), a New World Begomovirus, by Old and New World biotypes of the whitefly vector Bemisia tabaci. Annals of Applied Biology 139(1):145-154. [ Links ]
MORALES, F.J.; ZETTLER, F.W. 1977. Aphid transmission characteristics of dasheen mosaic virus. Revista Colombiana de Fitopatología 6(2):141. [ Links ]
MARKHAM, P. G.; BEDFORD, I. D. 1993. Comportamiento y modos de acción de Bemisia tabaci (Gennadius): capacidad de transmitir virosis. 4º Symposium, Las Virosis en los Cultivos Hortícolas Mediterráneos. Phytoma España 50: 47-52. [ Links ]
MORALES, F. J.; SINGH., S. P. 1993. Breeding for resistance to bean golden mosaic virus in an interracial population of Phaseolus vulgaris L. Euphytica 67: 59-63. [ Links ]
MORALES, F.J.; NIESSEN, A. 1988. Comparative responses of selected Phaseolus vulgaris germplasm inoculated artificially and naturally with bean golden mosaic virus. Plant Disease 72(12): 1020-1023. [ Links ]
MORALES, F. J. 2000a. El Mosaico Dorado y otras enfermedades del fríjol común causadas por geminivirus transmitidos por mosca blanca en la América Latina. Palmira, Valle del Cauca, Colombia, Centro Internacional de Agricultura Tropical (CIAT). 169 p. [ Links ]
MORALES, F. J. 2000b. Métodos de control de Begomovirus del fríjol. Págs. 133-154 en F. J. Morales (ed.). El Mosaico Dorado y otras enfermedades del fríjol común causadas por geminivirus transmitidos por mosca blanca en la América Latina. Palmira, Valle del Cauca, Colombia, Centro Internacional de Agricultura Tropical (CIAT). 169 p. [ Links ]
MORALES, F. J.; MUÑOZ, C.; CASTAÑO, M.; VELASCO, A. C. 2000. Geminivirus transmitidos por mosca blanca en Colombia. Fitopatología Colombiana 24(2): 95-98. [ Links ]
MORALES, F.J. 2001. Conventional breeding for resistance to Bemisia tabaci-transmited geminiviruses. Crop Protection 20: 825-834. [ Links ]
MUNIYAPPA V.; VENKATESH, H.M.; RAMAPPA, H.K.; KULKARNI, R.S.; ZEIDAN, M.; TARBA C.Y.; GHANIM, M.; CZOSNEK H. 2000. Tomato leaf curl virus from Bangalore (ToLCV-Ban4): sequence comparison with Indian ToLCV isolates, detection in plants and insects, and vector relationships. Archives of Virology 145: 1583-1598. [ Links ]
NATESHAN, H.M.; MUNIYAPPA, V.; SWANSON, M.M.; HARRISON, BD. 1996. Host range, vector relations and serological relationships of cotton leaf curl virus from southern India. Annals of Applied Biology 1289: 233-244. [ Links ]
OLIVEIRA, M. R.V.; HENNEBERRY, T. J.; ANDERSON, P. 2001. History, current status, and collaborative research projects. Crop Protection 20: 709-723. [ Links ]
PERRING, T. M. 2001. The Bemisia tabaci species complex. Crop Protection 20: 725-737. [ Links ]
POLSTON, J.E.; AL-MUSA, A.; PERRING, T.M.; DODDS, J.A. 1990. Association of the nucleic acid of squash leaf curl geminivirus with the whitefly Bemisia tabaci. Phytopathology 80: 850-856. [ Links ]
RODRIGUEZ, I.; MORALES, H.; BUENO, J. M.; CARDONA, C. 2005. El biotipo B de Bemisia tabaci (Homoptera: Aleyrodidae) adquiere mayor importancia en el Valle del Cauca. Revista Colombiana de Entomología 31(1): 21-28. [ Links ]
ROMBERG, M. 1998. Caracterización biológica de dos biotipos de la mosca blanca Bemisia tabaci (Genn) (Homoptera: Aleyrodidae). Tesis de Grado en Biología. Pontificia Universidad Javeriana, Bogotá. 80 p. [ Links ]
SAS (Statistical Analytical Institute). 2002. Version 8.2. SAS Institute Inc. Cary, N.C. [ Links ]
SINGH, S.P. 1989. Patterns of variation in cultivated common bean (Phaseolus vulgaris, Fabaceae). Economic Botany 43: 39-57. [ Links ]
SINGH, S.P.; MORALES, F.J.; MIKLAS, P.N.; TERAN, H. 2000. Selection for bean golden mosaic resistance in intra and interracial bean populations. Crop Science 40: 1565-1572. [ Links ]
STEEL R.G.D.; TORRIE J.H. 1992. Bioestadística: Principios y Procedimientos. McGraw-Hill. México. 622 p. [ Links ]