Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.1 Bogotá June 2011
Estabilidad de formulaciones a base de granulovirus para controlar Tecia solanivora (Lepidoptera: Gelechiidae) en campo
Stability of formulations based on granulovirus for controlling Tecia solanivora (Lepidoptera: Gelechiidae) in the field
ISABEL QUIROGA1, MARTHA GÓMEZ A.2 y LAURA VILLAMIZAR R.3
1 Microbióloga Industrial, Laboratorio de Control Biológico, Centro de Biotecnología y Bioindustria, Corpoica. isabelqh@hotmail.com
2 Investigadora, Ph.D. Farmacia, Laboratorio de Control Biológico, Centro de Biotecnología y Bioindustria, Corpoica, mgomeza@corpoica.org.co
3 Investigadora, Ph.D. Ciencias Farmacéuticas, Laboratorio de Control Biológico, Centro de Biotecnología y Bioindustria, Corpoica, lvillamizar@corpoica.org.co. Autora para correspondencia.
Recibido: 8-jun 2010 - Aceptado: 12-abr-2011
Resumen: Uno de los principales problemas del cultivo de la papa en Colombia es la polilla guatemalteca Tecia solanivora, que causa daños en campo y durante el almacenamiento de los tubérculos. Para su control biológico en condiciones de almacenamiento se han desarrollado productos a base de granulovirus como el denominado “Baculovirus Corpoica”, único registrado en Colombia. Sin embargo, con el aislamiento nativo de granulovirus codificado como VG003 se desarrollaron dos prototipos de bioplaguicida formulados como un granulado dispersable (WG) y un concentrado emulsionable (EC), diseñados para el control del insecto en condiciones de campo. Considerando que la estabilidad de los bioplaguicidas en almacenamiento es un parámetro determinante para su registro y comercialización, el objetivo del presente estudio fue evaluar la estabilidad fisicoquímica, microbiológica y biológica de los productos, durante seis meses de almacenamiento a 6ºC, 20ºC y 28ºC. La actividad insecticida de las dos formulaciones se mantuvo estable a 6ºC y 20ºC, con eficacias que oscilaron entre el 60% y el 70%. El contenido de contaminantes aumentó durante el almacenamiento, pero se mantuvo dentro de los límites de aceptación establecidos. Sin embargo, las características fisicoquímicas fueron afectadas por el paso del tiempo y las altas temperaturas, por lo que se recomienda el almacenamiento de los dos productos a 20ºC, ésto por otra parte reduciría los costos durante la comercialización, ya que se elimina la necesidad de la cadena de frío para el transporte y comercialización.
Palabras clave: Baculovirus. Polilla guatemalteca. Control biológico.
Abstract: One of the principal problems of potato cultivation in Colombia is the Guatemalan moth Tecia solanivora, which causes damage in the field and during tuber storage. For its biological control under storage conditions, products have been developed based on the granulovirus denominated “Baculovirus Corpoica”, the only one registered in Colombia. However, with the isolation of a native granulovirus known as VG003, two biopesticide prototypes were formulated as a dispersible granular (WG) and as an emulsifiable concentrate (EC), designed for control of the insect under field conditions. Considering that the stability of biopesticide under storage is a determining parameter for their registration and commercialization, the objective of the present study was to evaluate the physicochemical, microbiological and biological stability of the products over six months of storage at 6ºC, 20ºC and 28ºC. Insecticidal activity of both formulations remained stable at 6ºC and 20ºC, with efficacies that ranged between 60% and 70%. Contaminant content increased during storage but was maintained within the established acceptance limits. However, physicochemical characteristics were affected by elapsed time and high temperature, which is why storage at 20ºC is recommended, and which would also reduce costs during commercialization since it would eliminate the necessity for refrigeration during transport and commercialization.
Key words: Baculovirus. Guatemalan moth. Biological control.
Introducción
Uno de los mayores problemas sanitarios que presenta el cultivo de papa es el ataque del tubérculo por parte de la polilla guatemalteca de la papa Tecia solanivora (Povolny, 1973) (Lepidoptera; Gelechiidae); insecto oriundo de América Central que se reportó por primera vez en Colombia (Norte de Santander) en el año 1985 (Herrera 1998) que se ha adaptado a diferentes condiciones agroecológicas, favoreciendo su diseminación por todo el país y causando grandes pérdidas económicas (Araque y García 1999). Con el fin de controlar este insecto plaga, a nivel mundial se han usado de forma indiscriminada una gran cantidad de plaguicidas químicos que a menudo presentan altos niveles de toxicidad y en muchos casos son aplicados sin el uso de protección. El resultado es un alarmante nivel de intoxicación en las comunidades campesinas y la contaminación ambiental (FAO 2008).
Como alternativa “ambientalmente amigable” para el control de este insecto plaga, se encuentra la aplicación de agentes como los granulovirus. Este virus de la familia Baculoviridae ha sido hallado en forma natural afectando larvas de las polillas Phthorimae operculella (Zeller, 1873) (Lepidoptera: Gelechiidae) y T. solanivora en varios países de América y África (Zeddam et al. 1999). Todos los granulovirus sintetizan al final del proceso infeccioso grandes cantidades de granulina, proteína que cristaliza formando una matriz o cuerpo de inclusión (CI) con forma de gránulo. Durante su morfogénesis, queda incluido un virión dentro del CI, lo que les permite preservar su capacidad infecciosa. Los CIs son insolubles en agua y resistentes a la putrefacción y desintegración por agentes químicos y también a tratamientos físicos como la congelación, la desecación o la liofilización, características que les confieren persistencia en el ambiente (Caballero et al. 2001).
La producción de estos virus se realiza normalmente en su hospedero, lo que genera contaminación microbiana en la suspensión viral, proveniente de la microflora normal de los cadáveres de los insectos (Lasa et al. 2008). Esta contaminación puede afectar la estabilidad fisicoquímica y las propiedades insecticidas del producto, e incluso representar riesgos para la salud si se presentan patógenos humanos dentro del formulado (Grzywacz et al. 1997).
Dos productos de origen latinoamericano han sido registrados para el control de esta plaga en papa almacenada; uno de ellos desarrollado por el Centro Internacional de la Papa (CIP) en Perú, formulado como un polvo para espolvoreo cuyo ingrediente activo es un granulovirus aislado de P. operculella llamado “Baculovirus de la polilla de la papa” (Alcázar y Raman 1992) y el producto colombiano denominado “Baculovirus Corpoica”, formulado también como un polvo para espolvoreo (Chaparro et al. 2010). Recientemente se desarrollaron dos prototipos de bioplaguicida a base de un granulovirus colombiano aislado de larvas de T. solanivora y codificado como VG003, que según el trabajo de Barrera et al. (2009) corresponde a un granulovirus de P. operculella (PhopGV). Estos productos se diseñaron para el control de la polilla en campo y fueron formulados como un granulado dispersable (WG) y un concentrado emulsionable (EC), los cuales incluyen en su formulación un filtro ultravioleta del grupo de los abrillantadores ópticos y deben ser reconstituidos en agua para su posterior aplicación por aspersión dirigida al suelo (Chaparro et al. 2010).
Teniendo en cuenta que las características fisicoquímicas, microbiológicas y la actividad insecticida de los formulados pueden afectarse negativamente durante el almacenamiento y que la estabilidad de los productos puede verse influenciada por la temperatura y el tipo de formulación; el objetivo del presente trabajo fue realizar un estudio de estabilidad acelerada para determinar características susceptibles de optimización en los dos productos que permitan avanzar en el desarrollo de los prototipos y seleccionar las condiciones óptimas de almacenamiento para los mismos.
Materiales y Métodos
Propagación viral. Para obtener la cantidad requerida de inóculo viral, se tomaron huevos de T. solanivora provenientes de la cría del insecto de Corpoica. Éstos se inocularon con el aislamiento PhopGV nativo (VG003) proveniente de la región de Cundinamarca, Colombia y previamente seleccionado por presentar alta actividad insecticida contra T. solanivora (Espinel et al. 2009). Los huevos ubicados sobre un disco de papel toalla fueron inoculados aplicando la suspensión viral con un pincel. En cubetas de plástico de 4 litros de capacidad se ubicaron seis tubérculos de papa pastusa previamente lavados. Sobre ellos se ubicaron trozos de papel, cada uno con aproximadamente 40 huevos inoculados. Los recipientes se cerraron e incubaron a 25±2°C por 20 días. Pasado este tiempo, las larvas fueron extraídas y clasificadas. Aquellas larvas con síntoma típico de la enfermedad causada por granulovirus (color blanco), se colocaron en cajas de Petri estériles, las cuales fueron selladas y almacenadas a -4±2°C.
Purificación y cuantificación viral. El virus fue obtenido a partir de un proceso de purificación mediante centrifugaciones diferenciales. Para tal fin, las larvas infectadas se maceraron en SDS al 0,1% y la suspensión se filtró en tres capas de velo suizo estéril, para una posterior centrifugación a 800 rpm durante 5 minutos. El sobrenadante se recuperó y centrifugó a 15.000 rpm durante 1 hora y el sedimento obtenido se resuspendió en 2 mL de tampón Tris-HCl (pH 6,0) y se centrifugó nuevamente sobre un gradiente de glicerol de 30% - 80% (v/v) a 15.000 rpm durante 10 minutos. Se recuperó la banda blanca que contenía el virus y ésta se lavó dos veces con tampón Tris-HCl. La concentración de todas las suspensiones de virus purificado utilizadas para todos los ensayos se cuantificó mediante la lectura de la absorbancia a 450 nm en un espectrofotómetro, usando una curva de calibración previamente estandarizada adaptando la metodología descrita por Matthiessen et al. (1978).
Elaboración de las formulaciones. Las formulaciones se elaboraron empleando virus purificado y diferentes componentes como aceites vegetales y tensoactivos no iónicos para el concentrado emulsionable (EC) y silicatos, almidón y azúcares para el granulado dispersable (WG). Además, los dos productos incluyeron un filtro ultravioleta del grupo de los abrillantadores ópticos (Chaparro et al. 2010).
Preparación de las muestras. Muestras de 3 Kg de producto formulado como WG se empacaron en bolsas metalizadas que fueron selladas al calor. Por otra parte, se almacenaron muestras de 140 mL del EC en recipientes plásticos con tapa a rosca de color blanco, con una capacidad de 150 mL. Como tratamiento control para utilizar en los bioensayos se empacaron muestras de 0,1 mg de virus liofilizado (sin formular) en bolsas metalizadas de 1 g de capacidad.
Estudio de estabilidad en almacenamiento. Dos muestras de cada tratamiento (WG, EC y virus liofilizado) se almacenaron en un cuarto frío a 6±2°C, el mismo número de muestras se almacenó en una incubadora digital a 20±2°C y otro grupo igual de muestras se almacenó en otra incubadora digital a 28±2°C. Antes de iniciar el almacenamiento y pasados dos, cuatro y seis meses se analizaron tres submuestras de cada bolsa o frasco de cada prototipo almacenado a las tres temperaturas, determinando el contenido de contaminantes y las características fisicoquímicas. Adicionalmente, la actividad insecticida se determinó antes y después de los seis meses de almacenamiento utilizando una submuestra de cada bolsa o frasco.
El estudio contó con un diseño experimental completamente al azar, con medidas repetidas en el tiempo y todas las mediciones se realizaron por triplicado. Los resultados del estudio de estabilidad de las características fisicoquímicas, microbiológicas y biológicas se sometieron a un análisis de varianza y posteriormente a comparaciones de medias mediante la prueba de Tukey (95%). En el caso de la estabilidad de la densidad apisonada, los resultados se analizaron mediante una prueba no paramétrica de Kruskal-Wallis ya que los datos no cumplieron con los principios de normalidad y homogeneidad de varianzas.
Estabilidad fisicoquímica
Tamaño de partícula por granulometría: Se pesaron 100 g de WG, los cuales se adicionaron a un tamiz con un tamaño de poro de 2,8 mm, el cual fue ensamblado en una columna de tamices con orificios de 2 mm, 850, 500, 150 y 38 μm. Posteriormente, la muestra se sometió a tamizado en máquina durante 10 minutos y pasado este tiempo, se pesó el material retenido en cada uno de los tamices. Los resultados se expresaron como el porcentaje de material con un tamaño entre el del poro del tamiz anterior y el del poro del tamiz en el que quedó retenida la mayor cantidad de producto (Villamizar et al. 2005).
pH: Se tomaron muestras de 10 g de granulado o 10 mL de EC y posteriormente se mezclaron con 100 mL de agua destilada desionizada. El pH se midió con ayuda de un potenciómetro calibrado (Villamizar et al. 2005).
Humedad: En una balanza de humedad halógena OHAUS MB 45 se ubicaron 0,5 g de WG en el plato de la misma y se inició el secado de la muestra a 100°C. Después de 10 minutos se leyó el porcentaje de humedad en la pantalla del equipo.
Mojabilidad: Se vertieron 100 mL de agua destilada en un vaso de precipitados de 250 mL de capacidad, y se adicionaron 5 g del WG sin agitación. Inmediatamente, con un cronómetro se contó el tiempo en segundos necesario para que todo el producto se humedeciera completamente (Voight y Bornschein 1982).
Densidad apisonada: Se pesaron 40 g del producto granulado y se introdujeron en una probeta de 250 mL de base plástica ubicada dentro de un soporte de madera. La probeta se levantó 5 cm y se dejó caer lentamente sobre la base del soporte. Este proceso se repitió 50 veces. Al finalizar, se registró el volumen (V) de la muestra apisonada y se determinó la densidad apisonada (D) aplicando la fórmula correspondiente (Voight y Bornschein 1982):
D = 40 g/ V
Estabilidad de la suspensión del WG reconstituido en agua basado en la norma MT 168 (CIPAC 1989): Se pesaron 2,5 g del WG se vertieron en un vaso de precipitados de 200 mL que contenía 50 mL de agua destilada previamente calentada a 30±1°C. El sistema se mezcló durante dos minutos a 120 rpm utilizando un agitador magnético. Posteriormente, la suspensión se llevó a un volumen de 250 mL con agua destilada en una probeta y se selló con un tapón de caucho. A continuación la probeta se invirtió 30 veces (180°) durante un minuto y se ubicó en un baño termostatado a 30±1°C durante 30 minutos. Con ayuda de una pipeta de 10 mL, la cual estaba sostenida en un soporte universal, a la altura de la marca de 25 mL de la probeta y conectada a una bomba peristáltica, se extrajeron 225 mL de la suspensión a 600 rpm. Posteriormente el sedimento fue transferido con ayuda de agua destilada a una caja de Petri previamente tarada. Ésta se secó hasta peso constante durante 18 horas a 90°C en un horno y con el peso final de los sólidos de la muestra (a), se determinó la estabilidad (E) de la suspensión aplicando la fórmula:
E = 111 x (1- (a / 2,5 g))
Estabilidad de la emulsión formada con el EC basado en la norma MT 20 (CIPAC 1989): Se vertieron 70 mL de agua destilada a 25±1°C en un vaso de precipitados de 250 mL y se adicionaron gota a gota con una bureta, 5 mL del producto oleoso. El sistema fue mezclado con una barra de cristal dirigiendo el flujo hacia el centro y no contra las paredes del vaso de precipitados. Posteriormente, el líquido se transfirió a una probeta de 250 mL limpia y seca y se completó el volumen con agua destilada. Finalmente, la emulsión se mantuvo en reposo a 25±1°C durante una hora y se observaron los cambios del sistema relacionados con el volumen y la presencia de material separado.
Estabilidad microbiológica. Este parámetro se determinó mediante el recuento de microorganismos contaminantes. Para tal fin, muestras de cada prototipo y el virus liofilizado sin formular fueron reconstituidas en agua a una concentración de 1x106 CI/mL y se realizaron diluciones seriadas en agua estéril, las cuales se sembraron por triplicado en cajas de Petri con Agar Nutritivo, para determinar la concentración de bacterias y en Agar Saboureaud con Rosa de Bengala para el recuento de mohos y levaduras. Los medios se incubaron a 37±2°C durante 48 horas y a 25±2°C durante ocho días respectivamente. Al finalizar el tiempo de incubación se contaron las colonias formadas por los microorganismos contaminantes y se informó el resultado en unidades Formadoras de Colonia (UFC) por mL o por g para el EC y WG respectivamente.
Estabilidad de la actividad insecticida. Los prototipos de bioplaguicida y el virus liofilizado sin formular se reconstituyeron en agua estéril a una concentración de 1x106 CI /mL. Con cada suspensión se inocularon tres tubérculos de papa pastusa con ayuda de un nebulizador (Carrera et al. 2008), aplicando 2 mL de suspensión por cada lado de éstos. Los tubérculos se dejaron secar y cada uno se ubicó en un vaso plástico de 16 onzas que contenía 60 g de arena estéril en el fondo. Posteriormente, con ayuda de un pincel se ubicaron 10 larvas neonatas de T. solanivora sobre cada tubérculo. Los recipientes se taparon e incubaron en oscuridad constante durante 30 días, a 25±1°C. Se contó con un testigo absoluto en el cual, los tubérculos no recibieron ningún tratamiento. Terminado el tiempo de incubación se realizó un análisis destructivo recuperando todos los individuos y clasificando las larvas en vivas o muertas. Con los resultados de mortalidad en los tratamientos y el testigo se calculó el porcentaje de eficacia según la fórmula de Schneider – Orelly (Gómez et al. 2005):
Eficacia (%) = ((B – K) / (100 – K)) x 100
Donde K es el porcentaje de mortalidad del testigo y B es el porcentaje de mortalidad en el tratamiento.
Resultados y Discusión
Estabilidad fisicoquímica del granulado WG en almacenamiento
Tamaño de partícula: El WG recién manufacturado presentó el mayor porcentaje de material retenido en el tamiz de 850 μm, con un valor del 94,54%. Lo que permite concluir que la mayoría del material tiene un tamaño de partícula que oscila entre 850 y 2000 μm. No hubo diferencias significativas (F=5,31, d.f.=11, P=0,153) entre el porcentaje de granulado retenido en el tamiz de 850 μm antes y después del almacenamiento del producto a las tres temperaturas, lo que sugiere que esta característica se mantuvo estable cuando el producto se almacenó durante seis meses y no fue afectado por la temperatura.
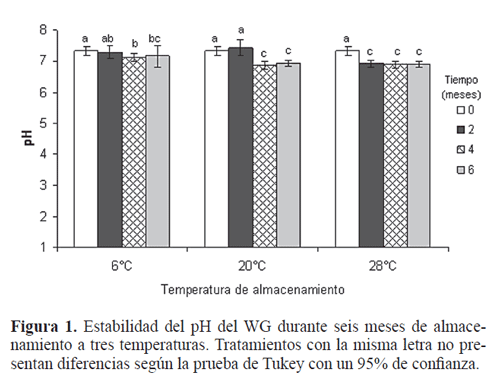
pH: El WG presentó un pH inicial de 7,32 y durante los seis meses de almacenamiento a 6ºC, 20ºC y 28ºC se obtuvieron valores que oscilaron entre 6,56 y 7,50. La prueba de comparación de medias de Tukey detectó diferencias significativas entre los tratamientos (F=34,1, df=11, P<0,005). El pH del producto recién manufacturado no fue diferente de los valores obtenidos a los dos meses de almacenamiento a 6°C y 20°C (Fig. 1). Sin embargo, en el cuarto y sexto mes de almacenamiento a 6ºC y 20ºC, el pH obtenido fue significativamente menor al inicial. Este cambio podría deberse al crecimiento de microorganismos contaminantes que podrían haber degradado algunos componentes de la formulación, generando cambios químicos que afectaron el pH del medio (Burges 1998).
El WG almacenado a 28ºC redujo significativamente su pH desde los dos meses de almacenamiento, es decir que a mayor temperatura, el cambio químico se evidenció más rápido. Sin embargo, el pH del producto durante todo el almacenamiento a las tres temperaturas se mantuvo entre 5 y 8, rango adecuado para el granulovirus utilizado como ingrediente activo. De esta forma se asegura la estabilidad física de los cuerpos de inclusión, ya que se ha establecido que solo valores de pH mayores a 9 y menores a 4 afectan la integridad de los baculovirus (Caballero et al. 2001).
Humedad: El WG recién manufacturado presentó un porcentaje de humedad del 4% y cuando éste se almacenó a 6ºC presentó humedades promedio del 4,75%, 4,97% y 5,97% a los dos, cuatro y seis meses respectivamente. Para el producto almacenado a 20ºC el porcentaje de humedad obtenido fue del 4,60% al segundo mes, del 4,99% al cuarto mes y del 5,69% al sexto mes. Finalmente, cuando el prototipo fue almacenado a 28ºC la humedad fue del 4,35%, 4,69% y 2,40% al segundo, cuarto y sexto mes de almacenamiento respectivamente. El producto sólo presentó un incremento significativo (F=16,9, df=11, P<0,005) de la humedad a los seis meses de almacenamiento a 6ºC y 20ºC.
Cuando el almacenamiento se realizó a 28ºC, no hubo diferencias significativas entre el porcentaje de humedad del producto antes de ser almacenado y el valor obtenido a los dos y cuatro meses de almacenamiento, pero la humedad obtenida a los seis meses fue significativamente inferior a la inicial. Estos resultados podrían sugerir que el sello al calor usado en los empaques no fue totalmente hermético y permitió la entrada de humedad a las dos temperaturas más bajas y posiblemente la salida de ésta cuando se utilizó la temperatura más alta.
Cuando el almacenamiento se realizó a 6ºC y 20ºC, la humedad de los prototipos sobrepasó el valor máximo del 5% recomendado para este tipo de productos (Lawrie et al. 2001; Santos et al. 2008), considerando que humedades altas podrían dar lugar a la compactación de los gránulos, con la consecuente aparición de grumos y aglomerados de difícil dispersión, además de facilitar el crecimiento de microorganismos contaminantes (Salazar 2003). El crecimiento de organismos contaminantes puede afectar la estabilidad del virus, ya que estos pueden degradar los compuestos orgánicos presentes en la cubierta viral y generar radicales libres que podrían afectar la integridad del ingrediente activo (Burges 1998).
Los resultados sugieren la necesidad de revisar el sellado utilizado para los empaques, o de buscar otro sistema que garantice la hermeticidad y de esta forma, la calidad del producto terminado y su estabilidad durante el almacenamiento.
Mojabilidad: Esta característica fisicoquímica osciló entre 56 y 62 segundos, para todos los tratamientos durante seis meses a las tres temperaturas (Tabla 1). No detectaron diferencias significativas entre los valores de mojabilidad obtenidos cuando el producto fue almacenado a 6ºC y 20ºC, lo que sugiere que esta característica fue estable bajo dichas condiciones. Sin embargo, el producto almacenado a 28ºC presentó un incremento significativo (F=2,14, d.f.=11, P=0,048) del tiempo de humectabilidad a partir del segundo mes que podría deberse a que las temperaturas elevadas favorecen fenómenos de compactación de las partículas que modifican la porosidad y por lo tanto el tiempo de humectación (Aulton 2004). La estabilidad de esta característica a 6°C y 20°C podría sugerir que el producto no presentó cambios representativos en su porosidad, ya que la permeabilidad del agua en el granulado y por ende la facilidad para humectarse, depende de la cantidad de poros intra o interarticulares (Vargas 2003).
Densidad apisonada: La densidad del WG osciló entre 606,70 y 631,72 g/L y no se detectaron diferencias significativas a través el tiempo, ni entre temperaturas de almacenamiento (F=1,93, df=11, P=0,086). La estabilidad de esta característica sugiere un adecuado proceso de granulación y una correcta formulación, debido a que los cambios en la densidad están asociados con modificaciones en el tamaño y la porosidad de las partículas, que podrían deberse al empleo de una cantidad inadecuada del agente aglutinante (Aulton 2004). Una cantidad insuficiente del mismo genera fragilidad en los gránulos, los cuales pueden romperse y compactarse aumentando su densidad. Por el contrario, el empleo de una gran cantidad de aglutinante genera un granulado muy duro, que no cambia su densidad pero presenta problemas de disolución y desintegración (Montalvo 1989). Los valores obtenidos durante todo el almacenamiento son similares a los de algunos productos virales registrados ante la Organización de Cooperación y Desarrollo Económicos (OECD), que presentan densidades entre 600 y 800 g/L (OECD 2005).
Estabilidad de la suspensión: Los resultados de estabilidad de la suspensión formada por el producto almacenado durante seis meses a tres temperaturas oscilaron entre 67,80% y 78,88%. Se observó que esta característica no cambió significativamente durante los cuatro primeros meses de almacenamiento a las tres temperaturas evaluadas. Sin embargo, al sexto mes se observó una reducción significativa (F=3,52, d.f.=11, P=0,048) de la estabilidad de la suspensión del producto almacenado a 6°C, 20°C y 28°C.
El porcentaje de estabilidad presentado por el producto recién manufacturado (78,88%) y después del almacenamiento fue superior al límite mínimo recomendado correspondiente al 60% (SENASA 2002; Chemical Regulation Directorate 2009). La alta suspensibilidad del producto posiblemente se debe a que el granulado desintegra completamente al entrar en contacto con el agua y no hay agregación de las partículas en suspensión (Allen et al. 2005), ya que según la ley de Stokes, a mayor tamaño de partícula o mayor diferencia de densidad entre la partícula y el medio dispersante, mayor será la velocidad de sedimentación (Aulton 2004).
Estabilidad fisicoquímica del concentrado emulsionable (EC) en almacenamiento
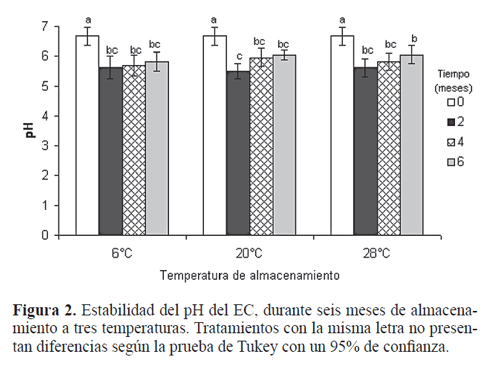
pH: El pH del EC se mantuvo entre 5,49 y 6,67 durante los seis meses de almacenamiento a las tres temperaturas evaluadas (Fig. 2). Los prototipos almacenados a 6ºC, 20ºC y 28ºC mostraron una reducción significativa del pH a partir del segundo mes de almacenamiento (F=22,2, df=11, P<0,005) con respecto al valor presentado por el producto recién manufacturado. La temperatura de almacenamiento no tuvo un efecto sobre la estabilidad del pH del producto mientras que el tiempo de almacenamiento si afectó significativamente el pH de la formulación. La reducción del pH del EC podría deberse al aumento en la concentración de microorganismos contaminantes durante el tiempo de almacenamiento, ya que éstos pueden promover la producción de gas, cambios de color y olor, la hidrólisis de grasas y aceites y cambios de pH, entre otros (Aulton 2004). A pesar de estos resultados, el EC durante los seis meses de almacenamiento a 6°C, 20°C y 28°C presentó valores de pH dentro del rango recomendado para los granulovirus entre 5 y 8.
Estabilidad de la emulsión diluida: La estabilidad de la emulsión formada por el EC no se afectó por el tiempo ni por la temperatura de almacenamiento (F=2,26, df=11, P<0,056) (Tabla 2).
La prueba cualitativa también mostró que la emulsión obtenida al reconstituir el EC fue estable, ya que no se presentaron separación de fases, ni formación de flóculos en los ensayos realizados al prototipo almacenado a 6ºC, 20ºC y 28°C durante seis meses. Lo anterior indica que la temperatura y el tiempo de almacenamiento no afectaron la diferencia de densidad entre las fases (Cubero et al. 2002) y que la estructura química del surfactante que compone la formulación fue estable durante el tiempo, ya que facilitó la extensión de la interfase y estabilizó la emulsión retardando la coalescencia de las gotas de la fase dispersa (Graciani 2006).
El producto reconstituido presentó un cremado de 6 mL fácilmente dispersable, fenómeno de inestabilidad que normalmente es reversible con una pequeña agitación y que se presenta con más frecuencia en emulsiones agua en aceite (O/W) (Nehal et al. 1999). A pesar de esto, el cremado debe evitarse ya que puede originar errores en la dosificación, mal aspecto y mayor proximidad de los glóbulos, lo que puede conducir a una agregación o coalescencia de la emulsión (Allen et al. 2005).
Estabilidad microbiológica en almacenamiento
El WG recién manufacturado presentó un contenido de contaminantes 17 veces mayor que el del EC (Tabla 3). Esto podría deberse a diferencias en la carga microbiana de los auxiliares de formulación empleados en la elaboración de los dos productos, ya que éstos no fueron esterilizados antes de la manufactura. Cabe destacar que el contenido de contaminantes inicial en los dos formulados es bajo (3,00x103 UFC/g para el WG y 1,77x102 UFC/mL para el EC) en comparación con los descritos en la literatura para productos virales como la formulación del nucleopoliedrovirus de Spodoptera exigua (Hübner, 1808) evaluada por Lasa et al. (2008), que mostró un contenido de microorganismos aerobios de 1,4 x107 UFC/mL y el producto comercializado en Estados Unidos con el nombre comercial Elcar, cuyo ingrediente activo es el nucleopoliedrovirus de Helicoverpa zea (Boddie, 1850) que presenta un contenido de contaminantes de 107 UFC/g (Shied 1989).
No se detectaron diferencias significativas entre el contenido de contaminantes del producto recién manufacturado y el de éste durante los seis meses de almacenamiento a 6ºC (F=2,56, df=3, P=0,071), lo que indica que no hubo crecimiento microbiano a temperatura de refrigeración. El uso de temperaturas bajas es un mecanismo utilizado para estabilizar las células, debido a que disminuye su metabolismo y en consecuencia la velocidad de crecimiento de los microorganismos (Rodríguez 1998). Sin embargo, se pudo observar un aumento al sexto mes de almacenamiento que pudo haberse favorecido por un incremento de la humedad del WG.
Cuando la temperatura de almacenamiento fue de 20ºC y 28ºC, se observó un aumento significativo (F=9,66, df=11, P<0,005) en la concentración de contaminantes del WG a partir del cuarto y el segundo mes respectivamente, que en el producto almacenado a 20ºC pudo verse favorecido por el incremento de la humedad del producto. Sin embargo, el incremento de la contaminación fue mayor cuando el bioplaguicida se almacenó a 28ºC, posiblemente debido a que dicha temperatura es adecuada para el crecimiento de diversas bacterias contaminantes (Burges 1998).
El aumento de la población microbiana contaminante podría relacionarse con las propiedades higroscópicas de los productos liofilizados (Voigt y Bornshein 1982), ya que el WG fue sometido a dicho proceso de deshidratación; lo que sumado a un sello no hermético posiblemente favoreció un incremento de la humedad y en consecuencia el crecimiento microbiano. Este tipo de contaminación es muy frecuente ya que los sistemas actuales de producción viral se realizan in vivo, lo que genera una carga importante de bacterias y hongos que naturalmente colonizan las dietas, la superficie del insecto, su intestino y sus heces. La gran mayoría de estos microorganismos son especies comunes de los géneros Pseudomonas, Enterococcus y especies coliformes de la familia Enterobacteriaceae (Jenkins y Grzywacz 2000).
Para el EC, la temperatura y tiempo de almacenamiento no afectaron el contenido de contaminantes a 6ºC. Sin embargo, el análisis estadístico detectó diferencias significativas entre la cantidad de contaminantes presentada por el EC almacenado a 20ºC y 28ºC después de seis meses de almacenamiento, con respecto al contenido de contaminantes presentado por el producto recién manufacturado (F=35,9, df=11, P<0,005).
Dicho comportamiento sugiere que estas temperaturas favorecieron el crecimiento microbiano, posiblemente debido a que algunos componentes de la formulación oleosa podrían ser utilizados como sustrato por los microorganismos (Aulton 2004), especialmente por bacterias de la familia Enterobacteriaceae. Dentro de éstas se destaca Enterobacter gergoviae (Brenner et al. 1980) aislado por Kuzina et al. (2002) en el intestino de Pectinophora gossipiella (Saunders, 1844) (Lepidoptera; Gelechiidae), que también fue encontrada por Pinto et al. (2007) en el tracto digestivo de dos lepidópteros de la familia Saturniidae, Rothschildia lebeau (Rothscild, 1907) y Automeris zugana (Druce, 1886) y además demostraron su actividad lipolítica.
Durante todo el tiempo de almacenamiento a las tres temperaturas los dos prototipos de bioplaguicida (WG y EC) presentaron una concentración de microorganismos contaminantes que estuvo por debajo del límite máximo de calidad establecido previamente en el Laboratorio de Control de Calidad biotécnica de Corpoica, que exige que la concentración de contaminantes sea inferior a 1x106 UFC/g o mL.
Estabilidad biológica en almacenamiento. En todos los casos se encontraron larvas con síntomas de la infección (Fig. 3), como coloración blanca y la pérdida de la turgencia debido a la desintegración de los tejidos y órganos (Caballero et al. 2001). No se detectaron diferencias significativas (F=1,38, df=5, P=0,2663) entre el porcentaje de eficacia que presentó el WG antes y después de seis meses de almacenamiento (Tabla 4). Santos et al. (2009) encontraron resultados similares al evaluar la actividad biocontroladora del producto comercial registrado en Colombia “Baculovirus Corpoica”, después de almacenarlo a 8ºC, 18ºC y 28ºC durante tres meses.
Estos resultados pueden atribuirse a la alta estabilidad que presentan los baculovirus a diferentes temperaturas, ya que existen estudios que demuestran su tolerancia a condiciones de congelamiento por varios años y a temperaturas de hasta 50ºC por varias horas (Ignoffo y García 1992), aunque Támez et al. (2006) observaron una reducción significativa de la eficacia de cuatro granulados a base del NPV de Anagrapha falcifera (Kirby, 1837), almacenados a 25ºC durante ocho meses. Este comportamiento se atribuyó a un incremento en la concentración de contaminantes, debido a un aumento de la humedad desde el tercer mes de almacenamiento, los cuales pudieron degradar la cubierta viral.
La estabilidad del granulovirus formulado como un WG sugiere que los excipientes utilizados en la formulación fueron adecuados y mantuvieron la integridad viral durante el almacenamiento, criterio de gran importancia cuando se seleccionan los auxiliares de formulación (Támez et al. 2002). Sin embargo, es necesario mejorar el sistema de sellado y tomar medidas para reducir la concentración de contaminantes desde el inicio de la producción, ya que la presencia de microorganismos saprófagos, puede afectar severamente la viabilidad del virus a largo plazo (Gipson y Scott 1975). Lo anterior facilitará el almacenamiento del producto a temperatura ambiente y por lo tanto ahorrará costos de producción y transporte, evitando un costo adicional por el uso de una cadena de frío.
En cuanto al EC no se detectaron diferencias significativas entre la eficacia del producto recién manufacturado y la presentada después de seis meses de almacenamiento a 6ºC y 20ºC (Tabla 4), mientras que a 28ºC se presentó una reducción significativa del 20% (F=5,77, df=5, P=0,006). Este comportamiento podría estar relacionado con el aumento en la concentración de contaminantes que se evidenció desde el segundo mes del estudio en el EC almacenado a 28ºC. Estos contaminantes pudieron afectar la estabilidad del virus por efectos de proteólisis de los cuerpos de inclusión o inactivación por la producción de radicales libres (Jones y Burges 1997). Adicionalmente, esta menor actividad insecticida del EC almacenado a 28ºC podría también deberse a la formación de torta o “caking” (sedimento compacto de difícil dispersión) que se produjo en dicho tratamiento. Este sedimento posiblemente atrapó y aglomeró algunas partículas virales impidiendo su homogénea distribución en el momento de la reconstitución y en consecuencia afectando la dosis aplicada.
Batista et al. (2001) obtuvieron resultados similares quienes observaron una reducción de la eficacia del 18,3% para un concentrado emulsionable a base del nucleopolihedrovirus de Anticarsia gemmatalis Hübner, 1818 (AgMNPV) después de 20 meses de almacenamiento a 24,5ºC. En un trabajo similar, se estudió la estabilidad del baculovirus de Spodoptera littoralis (Boisduval, 1833), almacenado en diferentes aceites minerales y vegetales y a bajas temperaturas no se observaron diferencias en la eficacia en los dos grupos de aceites, pero si se presentó una pérdida de la infectividad del virus almacenado durante 15 meses a 26ºC en aceite vegetal, lo que atribuyeron al deterioro de los componentes de la formulación por interacciones con el oxígeno (Cherry 1994).
Para el virus liofilizado sin formular no se detectaron diferencias significativas entre los valores de eficacia obtenidos antes y después de seis meses a las tres temperaturas evaluadas (F=1,77, df=5, p=0,1943) (Tabla 4).
Para muchos autores, los baculovirus son considerados los mejores agentes biológicos para desarrollar bioplaguicidas, ya que pueden ser almacenados en preparaciones secas en oscuridad a temperaturas ambientales de 20ºC y 25ºC durante varios años. Un ejemplo, es el producto comercial llamado TM Biocontrol-1, el cual tiene una vida de almacenamiento de cinco años a temperaturas ambientales (Martignoni 1978).
La estabilidad de la actividad insecticida del WG y el virus sin formular podría atribuirse a la estabilidad innata de los baculovirus en un amplio rango de temperaturas, hecho que fue comprobado por Pokharkar y Kurhade (1999), quienes observaron que temperaturas entre 20ºC y 35ºC no tuvieron un efecto significativo en la infectividad del granulovirus de P. operculella.
Agradecimientos
Los autores manifiestan sus agradecimientos al Ministerio de Agricultura y Desarrollo Rural por el apoyo financiero.
Literatura citada
ALCÁZAR, J.; RAMAN, K.; 1992. Control biológico de la polilla de la papa con Baculovirus Phthorimae. Boletín de Capacitación CIP No. 2, Centro Internacional de la Papa (CIP), Lima, Perú. 27 p. [ Links ]
ALLEN, L.; POPOVICH, N.; ANSEL, H.; 2005. Ansel´s pharmaceutical dosage forms and drug delivery systems. Editorial Baltimore MD, Estados Unidos. 672 p. [ Links ]
ARAQUE, M.; GARCÍA, C. 1999. Manual integrado de la polilla guatemalteca de la papa Tecia solanivora (Polvony). CRECED, Santander, Colombia. 46 p. [ Links ]
AULTON, M. 2004. Farmacia, La ciencia del diseño de las formas farmacéuticas. Elsevier, España. 681 p. [ Links ]
BARRERA, G.; CUARTAS, P.; VILLAMIZAR, L. 2009. Comparative analysis of a granulin fragment of Colombian granulovirus isolated from Tecia solanivora. Insect Pathogens and Insect Parasitic Nematodes. IOBC wprs Bulletin 45: 129-132. [ Links ]
BATISTA, A.; ALVES, S.; AUGUSTO, N.; PEREIRA, R. 2001. Stability and persistence of two formulations containing Anticarsia gemmatalis nuclear polyhedrovirus (AgMNPV). Neotropical Entomology 30 (3): 411-416. [ Links ]
BURGES, H. 1998. Formulation of microbial biopesticides: Beneficial microorganisms, nematodes and seed treatments. Kluwer Academic Publishers. Dordrecth. Holanda. 496 p. [ Links ]
CABALLERO, P.; LOPEZ, M.; WILLIAMS, T. 2001. Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Phytoma. Navarra. España. 518 p. [ Links ]
CARRERA, M.; ZEDDAM, J.; POLLET. A.; LE´RY, X.; LÓPEZFERBER, M. 2008. Evaluation of the per os insecticidal activity of baculoviruses by a nebulization method. IOBC/WPRS Bull. 31: 40-43. [ Links ]
CHAPARRO, M.; ESPINEL, C.; COTES, A.; VILLAMIZAR, L. 2010. Fotoestabilidad y actividad insecticida de dos formulaciones de granulovirus sobre larvas de Tecia solanivora. Revista Colombiana de Entomología 36 (1): 25-30. [ Links ]
CHEMICAL REGULATION DIRECTORATE. 2009. Data Requirements Handbook. Mallard House. York. UK. 3: 24-25. [ Links ]
CHERRY, A. 1994. Oil formulation of insect viruses. European meeting: Microbial Control of Pests. Disponible en: http://www.fao.org/agris/search/display.do?f=./1995/v2109/FR9501332.xml;FR9501332 [Fecha de revisión: 10 Junio 2009]. [ Links ]
CIPAC - COLLABORATIVE INTERNATIONAL PESTICIDES ANALYTICAL COUNCIL. 1989. CIPAC Hanbook F. Black Bear Press, Cambridge. UK. 472 p. [ Links ]
CUBERO, N.; MONTEFERRER, A.; VILLALTA, J. 2002. Tecnología de alimentos y aditivos alimentarios. Mundi-prensa libros, España. 240 p. [ Links ]
ESPINEL, C.; GÓMEZ, J.; VILLAMIZAR, L.; COTES, A.; LERY, X.; LÓPEZ-FERBER, M. 2009. Biological activity and compatibility with chemical pesticides of a Colombian granulovirus isolated from Tecia solanivora. Insect Pathogens and Insect Par asitic Nematodes. IOBC wprs Bulletin 45: 145-148. [ Links ]
FAO (FOOD AND AGRICULTURE ORGANIZATION OF UNITED NATIONS). 2008. Gestión de las plagas y enfermedades de la papa. Disponible en: http://www.potato2008.org [Fecha de revisión: 6 Mayo 2009]. [ Links ]
GIPSON, A.; SCOTT, C. 1975. Alkaline protease associated with the matrix protein of a virus infecting the cabbage looper. Biochemical and Biophysical Research Communications 62: 478- 484. [ Links ]
GÓMEZ, J.; VILLAMIZAR, L.; ESPINEL, C.; GRIJALBA, E.; TORRES, L.; COTES, A. 2005. Reconocimiento, selección y evaluación de aislamientos nativos de virus de la granulosis para el control biológico de la polilla guatemalteca de la papa Tecia solanivora. Produmedios, Bogotá, Colombia. 24 p. [ Links ]
GRACIANI, C. 2006. Los aceites y grasas: Composición y propiedades. Mundi-prensa libros, España. 316 p. [ Links ]
GRZYWACZ, D.; MCKINLEY, D.; JONES, K.; MOAWAD, G. 1997. Microbial contamination in Spodoptera littoralis nuclear polyhedrosis virus produced in insects in Egypt. Journal of Invertebrate Pathology 69: 151-156. [ Links ]
HERRERA, F. 1998. La polilla guatemalteca de la papa. Biología, comportamiento y Prácticas de manejo integrado. Produmedios, Bogotá, Colombia. 46 p. [ Links ]
IGNOFFO, C.; GARCIA, C. 1992. Combinations of environmental factors and simulated sunlight affecting inclusion bodies of the Heliothis (Lepidoptera: Noctuidae) nucleopolyhedrosis virus. Environmental Entomology 21: 210-213. [ Links ]
JENKINS, N.; GRZYWACZ. 2000. Quality control of fungal and viral biocontrol agents- Assurance of product performance. Biocontrol Science and Technology 10: 753-777. [ Links ]
JONES, K.; BURGES, H. 1997. Microbial insecticides: novelty or necessity. British Crop Protection Council Symposium Proceedings 68: 163-171. [ Links ]
KUZINA, L.; MILLER,E.; GE, B.; MILLER, T. 2002. Transformation of Enterobacter gergoviae isolated from pink bollworm (Lepidoptera: Gelechiidae) gul with Bacillus thuringiensis toxin. Current Microbiology. 44 (1): 1-4. [ Links ]
LASA, R.; WILLIAMS, T.; CABALLERO, P. 2008. Insecticidal properties and microbial contaminants in a Spodoptera exigua multiple nucleopolyhedrovirus (Baculoviridae) formulation stored at different temperatures. Journal of Economical Entomology 101 (1): 42-49. [ Links ]
LAWRIE, J.; DOWN, J.; GREAVES, M. 2001. Effects of storage on viability and efficacy of granular formulations of the microbial herbicides Alternaria alternata and Trematophoma lignicola. Biocontrol Science and Technology 11: 283-295. [ Links ]
MARTIGNONI, M. 1978. Virus in biological control: production, activity, and safety. USDA Forest Service Technology Bulletin 30: 140-145. [ Links ]
MATTHIESSEN, J.; CHRISTIAN, R.; GRACE, T.; FILSHIE, K. 1978. Large-Scale field propagation and the purification of the granulosis virus of the potato moth, Phthorimae operculella (Zeller) (Lepidoptera: Gelechiidae). Bulletin of Entomological Research 68: 385-391. [ Links ]
MONTALVO, E. 1989. Introducción a la tecnología farmacéutica. Universidad Central de Quito, Quito, Ecuador. 92 p. [ Links ]
NEHAL, A.; AMAL, N.; NAEL, Z.; HUSSEIN, K. 1999. Stability and rheology of heavy Crude oil-in-water emulsion stabilized by an anionic-nonionic surfactant mixture. Petroleum Science and Technology 17 (6): 553-576. [ Links ]
OECD - ORGANIZATION FOR ECONOMIC COOPERATION AND DEVELOPMENT. 2005. Directory of Microbial Pesticides for Agricultural Crops in OECD Countries Disponible en:. http://www.oecd.org/dataoecd/18/0/1900785.pdf [Fecha de revisión: 07 Abril 2011]. [ Links ]
PINTO, A.; URIBE, L.; BLANCO, J.; FONTECHA, G.; RODRÍ- GUEZ, C.; MORA, M.; JANZEN, D.; CHAVARRIA, F.; DÍAZ, J.; SITTENFELD, A. 2007. Actividades enzimáticas en aislamientos bacterianos de tractos digestivos de larvas y del contenido de pupas de Automeris zugana y Rothschildia lebeau (Lepidoptera: Saturniidae). Revista de Biología Tropical 55 (2): 32-39. [ Links ]
POKHARKAR, S.; KURHADE, V. 1999. Cross infectivity and effect of Environmental factors on the infectivity of granulosis virus of Phthorimae operculella (Zeller) (Lepidoptera: Gelechiidae). Journal of Biological Control 13: 79-84. [ Links ]
RODRÍGUEZ, M. 1998. Envasado de alimentos bajo atmósfera protectora. alimentación, equipos y tecnología. Editorial Acribia, España. 130 p. [ Links ]
SALAZAR, R. 2003. Tecnología farmacéutica industrial. Fabricación y control de medicamentos sólidos de administración por vía oral. Editorial Acribia, España. 34 p. [ Links ]
SANTOS, A.; VILLAMIZAR, L.; GARCÍA, M.; BELTRAN. C.; COTES, A. 2008. Caracterización de un prototipo de bioplaguicida mixto para la protección de semilla de papa en almacenamiento. Memorias VI seminario latinoamericano de uso y comercialización de la papa. Asociación Latinoamericana de la Papa, Mar del Plata, Argentina. 475-476. [ Links ]
SENASA - SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA. 2002. Establece una norma que determina las condiciones en que los productos formulados fitosanitarios mantengan la aptitud para su uso. Ministerio de Agricultura Ganadería y Pesca. Resolución 489. República Argentina. Disponible en: http://www.ambiente.bioetica.org/normas/02-489.htm. [Fecha de revisión: 07 Abril 2011]. [ Links ]
SHIED, T. 1989. Industrial production of viral pesticides. Advances in Virus Research 36: 315-343. [ Links ]
TÁMEZ, P.; MCGUIRE, M.; BEHLE, R.; SHASHA, S.; PINGEL, R. 2002. Storage stability of Anagrapha falcifera nucleopolyhedrovirus in spray-dried formulations. Journal of Invertebrate Pathology 79: 7-16. [ Links ]
TÁMEZ, P.; ZAMUDIO, V.; MARTÍNEZ, J.; RODRÍGUEZ, C.; REYES, S.; GÓMEZ, R. 2006. Formulaciones granulares de baculovirus en combinación con abrillantadores ópticos para su empleo como bioinsecticida. Ciencia UANL 4 (2): 149-156. [ Links ]
VARGAS. R. 2003. Evaluación preliminar del método utilizado en la determinación de la fotoestabilidad de alimentos piscícolas. Agronomía Mesoamericana 14 (2): 193-199. [ Links ]
VILLAMIZAR, L.; ZEDDAM, J-L.; ESPINEL, C.; COTES, A. 2005. Implementación de técnicas de control de calidad para la producción de un bioplaguicida a base del granulovirus de Phthorimae operculella PhopGV. Revista Colombiana de Entomología 31 (2): 127-132. [ Links ]
VOIGHT, R.; BORNSCHEIN, M. 1982. Tratado de tecnología farmacéutica. Editorial Acribia. España. 297 p. [ Links ]
ZEDDAM, J.; POLLET, A.; MANGOENDIHARJO, S.; RAMADHAN, H.; LÓPEZ, F. 1999. Ocurrence and virulence of a Granulosis virus in Phthorimae operculella (Lepidoptera: Gelechiidae) populations in Indonesia. Journal of Invertebrate Pathology 74: 48-54. [ Links ]