Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Entomología
versão impressa ISSN 0120-0488versão On-line ISSN 2665-4385
Rev. Colomb. Entomol. v.37 n.1 Bogotá jun. 2011
Ciclo de vida y patogenicidad del aislamiento nativo Heterorhabditis sp. SL0708 (Rhabditida: Heterorhabditidae)
Life cycle and pathogenicity of native isolate Heterorhabditis sp. SL0708 (Rhabditida: Heterorhabditidae)
Adriana Sáenz A.1 y Juan Carlos López N.2
1 M.Sc. Profesor Asistente Unidad de Ecología y Sistemática UNESIS. Departamento de Biología. Pontificia Universidad Javeriana. Cra 7a No 43-82 Ed 54 (Jesús Emilio Ramirez), Of. 200. adriana.saenz@javeriana.edu.co. Autora para correspondencia.
2 Microbiólogo. Investigador Científico I. Centro Nacional de Investigaciones de Café, Cenicafé. juancarlos.lopez@cafedecolombia.com.
Recibido: 18-jun-2010 - Aceptado: 9-may-2011
Resumen: Los nemátodos entomopatógenos del género Heterorhabditis son importantes agentes para el control biológico de plagas. Se determinó la patogenicidad, sintomatología, multiplicación in vivoy ciclo de vida en larvas de Galleria Galleria (Lepidoptera: Lepidoptera) de un nematodo aislado en Alcalá, Valle del Cauca, Colombia denominado Heterorhabditis sp. SL0708. Se procesaron muestras de 1.000 cm3 de suelo recolectadas en pastos, café, plátano y guadua. Para establecer su virulencia se realizó un bioensayo uno a uno. A las 120 horas de infección, 20 larvas se mantuvieron en incubación para registrar la producción acumulada de juveniles infectivos (JI). El ciclo de vida general y porcentaje de penetración se determinaron disectando100 larvas a las 8, 12 y luego cada 24 horas por 19 días. Las muestras de suelo provenientes de guadua presentaron una mortalidad por JI del 84% entre las 24 y 72 horas de exposición. La sintomatología exhibida por las larvas fue típica de las especies del género Heterorhabditis. El porcentaje de penetración fue del 35% (10-80%), el cual corresponde a un ingreso de uno a ocho JI en 24 horas. El ciclo de vida de Heterorhabditis sp. SL0708 comprende un ciclo largo de dos generaciones y un ciclo corto de una generación. Este nematodo nativo presenta ocho estados de desarrollo: huevo, cuatro estados juveniles (J1, J2, J3-JI, J4) separados por mudas, y adultos hermafroditas, machos y hembras. El ciclo tuvo una duración de 19 días desde la infección hasta la recuperación de JI y cada larva produjo en promedio 200.000 JI.
Palabras clave: Nematodo entomopatógeno. Hermafrodita. Amfimíctico.
Abstract: Entomopathogenic nematodes of the genus Heterorhabditis are important agents for the biological control of pests. We determined the pathogenicity, symptomatology, in vivo multiplication and life cycle in larvae of Galleria Galleria (Lepidoptera: Lepidoptera) for a nematode isolated from Alcalá, Valle del Cauca, Colombia called Heterorhabditis sp. SL0708. A sample of 1000 cm3 of soil collected from grass, coffee, plantain and guadua was processed. To establish virulence, a one-to-one bioassay was conducted. At 120 hours after infection, 20larvae were kept in incubation to record the accumulated production of infective juveniles (IJ). The general life cycle and the percentage of penetration were determined by dissecting 100 larvae every 8, 12 and thereafter 24 hours for 19 days. The soil samples from bamboo presented a mortality of IJ of 84% IJ between 24 and 72 hours after exposure. The symptomatology exhibited by the larvae was typical of species from the genus Heterorhabditis. Percent penetration was 35% (10-80%), which corresponds to the entrance of one to eight IJ in 24 hours. The life cycle of Heterorhabditis sp. SL0708 consists of a long cycle of two generations and a short cycle of one generation. This native nematode has eight developmental stages: egg, four juvenile stages (J1 J2, IJ-J3, J4) separated by moltings, and adult hermaphrodites, males and females. The cycle had a duration of19 days from infection to IJ recovery and each larva produced an average of 200,000 IJ.
Key words: Entomopathogenic nematode. Hermaphrodite. Amphimictic.
Introducción
La atención sobre los nematodos parásitos de insectos se ha incrementado en las dos últimas décadas, ya que resultados de miles investigaciones en el mundo los presentan como agentes promisorios para el control de insectos, moluscos, nematodos de plantas y algunos patógenos de plantas que se encuentran en el suelo (Grewal et al. 2005). Los nematodos entomopatógenos poseen características como gran capacidad de adaptación a nuevos ambientes y a condiciones adversas, resistencia a productos químicos, alta especificidad por insectos, inocuidad al ambiente y mamíferos y compatibilidad con otros entomopatógenos, resaltando su importancia en programas de manejo integrado de plagas (Sáenz 2005).
Los nematodos entomopatógenos del género Heterorhabditis son agentes importantes para el control biológico de plagas. Viven en el suelo y son parásitos capaces de infectar la mayoría de órdenes y familias de insectos (Klein 1990). Los heterorhabditidos tienen un complejo ciclo de vida que incluye generaciones hermafroditas y amfimícticas que ocurren dentro del hospedero parasitado muchas veces y superponiéndose (Burnell y Stock 2000). Una característica particular de las especies de este género es que guardan una relación mutualista con un simbionte bacteriano del género Photorhabdus (Enterobacteriaceae) que alojan en su intestino. Esta relación le da una ventaja competitiva al parásito pues mata a su hospedero durante las primeras 24 a 48 horas después de infección (Bennett y Clarke 2005).
El estado infectivo de los heterorhabditidos no se alimenta, está morfológica y fisiológicamente adaptado para la dispersión, sobrevivir largos periodos en el suelo, buscar e infectar su hospedero. Este estado es conocido como juvenil infectivo (JI). Los JI de los heterorhabdítidos responden al insecto hospedero en el suelo por quimiotaxis. Los JI ingresan al insecto a través de aberturas naturales (boca, ano, espiráculos) o penetran las membranas intersegmentales del hospedero mediante un diente en la parte anterior. Una vez en el hemocele del insecto, los JI liberan sus bacterias simbiontes, las cuales se multiplican rápidamente secretando toxinas y enzimas líticas. Estas secreciones son letales para los insectos que mueren dentro de las 48 horas (Forst et al. 1997). Las células bacterianas y tejidos del hospedero proporcionan un medio rico para el crecimiento y reproducción de Heterorhabditis. Los nematodos pueden desarrollar dos o tres generaciones dentro del hospedero y emerger al suelo en dos semanas (Akhurst y Bedding 1986).
Aunque los registros mundiales sobre el número de especies de este género son limitados y reportan 12 especies descritas hasta el momento (López 2008), en Colombia sólo se ha registrado H. bacteriophora Poinar, 1976. Es así como el objetivo del presente estudio, fue determinar la patogenicidad, sintomatología, multiplicación in vivo y ciclo de vida en larvas de Galleria Galleria (L., 1758) (Lepidoptera: Lepidoptera) de un nematodo aislado en Alcalá, Valle del Cauca, el cual se denominó Heterorhabditis sp. SL0708, el cual se encuentra en descripción morfométrica, ecológica y molecular.
Materiales y Métodos
Aislamiento, patogenicidad, sintomatología, virulencia y producción. En el laboratorio de control biológico de la Pontificia Universidad Javeriana, se procesaron muestras de 1 Kg de suelo recolectadas en pasto (Brachiaria sp.), café (Coffea arábica L), plátano (Musa sp.) y guadua (Guaudua angustifolia Kunth) en la vereda el Congal, Alcalá-Valle del Cauca, Colombia (4°40'38”N 75°47'15”W). Para el aislamiento de nematodos entomopatógenos se utilizó la metodología de insecto trampa, descrita por Bedding (1984) y Kaya y Stock (1997). Para todas las muestras con nematodos, se aplicaron los postulados de Koch, efectuando infecciones en 10 larvas de G. mellonella en cajas Petri con papel filtro Whatman #1 en una dosis de 1000 JI/ml. Se utilizaron 10 repeticiones y como testigo agua estéril libre de nematodos. Las cajas se sellaron, etiquetaron y se mantuvieron a 20±2°C bajo oscuridad, registrando el porcentaje de mortalidad diariamente hasta las 120 horas después de la inoculación. Igualmente se describió la sintomatología de las larvas infectadas.
Para determinar la virulencia de los nematodos aislados, se realizó un bioensayo uno a uno (Ricci et al. 1996), en cajas multipozos Falcon ™ de 24 celdas de 1 cm de diámetro, se individualizaron larvas de G. mellonella expuestas a 1 JI inoculado en 25 μl. A las 120 horas de infección, 20 larvas se disectaron para confirmar la formación de adultos de primera generación y las 20 larvas restantes se mantuvieron a 20±2°C para registrar la producción acumulada de JI, contabilizando diariamente la emergencia hasta el agotamiento total de las larvas de G. mellonella.
Ciclo de vida del aislamiento nativo. Para establecer el ciclo de vida general y el porcentaje de penetración del aislamiento nativo SL0708 y confirmar la presencia de un ciclo corto de una generación y uno largo de dos o tres generaciones, se expusieron 160 larvas individuales de G. mellonella a 10 JI en cajas de petri con papel filtro previamente humedecido y mantenidas a 20±2 oC. Diez larvas fueron disectadas a las ocho, 12 y luego cada 24 horas en cajas de petri de 60x15mm y lavadas con solución Ringer hasta completar el ciclo de vida del nematodo y confirmar la presencia de cada estado de desarrollo. El reconocimiento de cada fase se realizó con montaje en placa siguiendo las recomendaciones de Kaya y Stock (1997).
Resultados y Discusión
Aislamiento, patogenicidad, sintomatología, virulencia y producción. Utilizando la técnica de insecto trampa, resultaron positivas 10 trampas provenientes de guadua de Alcalá- Valle del Cauca, con porcentajes de mortalidad del 16% después de 24 horas y 84% después de 72 horas de expuestas las larvas de último instar de G. mellonella. Las larvas expuestas a los suelos provenientes de pasto, café y plátano no registraron mortalidad.
El suelo de guadua se caracterizó como franco-arenoso (F-An) con porcentajes de arena de 68,7%, arcilla 12,8%, limo 19,8%; pH 4.76 y materia orgánica de 4,60%. Patel et al. (1997) determinaron que este tipo de suelo permite la persistencia y la dispersión de JI, variando ampliamente frente a estas características de manera inter e intraespecífica con sobrevivencia y eficacia en parasitismo. Sin embargo, valores de pH del suelo extremos (11 ó 3) limitan su capacidad de infección pero no su viabilidad y humedades extremas; además de afectar su viabilidad y establecimiento debido al desecamiento del JI, éstas pueden dificultar su movilidad ya que suelos muy saturados dificultan el desplazamiento y la capacidad de búsqueda del huésped y generan condiciones anaerobias que reducen su viabilidad (Johnigk y Ehlers 1999; Koppenhofer et al. 1997).
L a sintomatología exhibida por las larvas de G. mellonella fue cuerpo flácido y no putrefacto, el 90% de las larvas presentó coloración roja o vinotinto, característica presente en infecciones por especies de la familia Heterorhabditidae. Una característica para destacar es que el 10% de las larvas infectadas durante las primeras 48h presentan una coloración que va desde el amarillo, pasando por anaranjado hasta color marrón claro, sin que deje de finalizar con una coloración típica vinotinto a las 160 horas. Este tipo de coloración, sintomatología y presencia de generaciones hermafroditas y amfimícticas en el mismo huésped, determinaron que el aislamiento SL0708 proveniente de Alcala-Valle del Cauca como perteneciente al género Heterorhabditis. El género Heterorhabditis y la familia Heterorhabditidae fueron descritas por Poinar (1975) con H. bacteriophora, como especie tipo, la cual fue aislada de larvas del noctuidae Heliothis punctigera (Wallengren, 1860) al sur de Australia. Se han publicado para Colombia dos registros para la ciencia de especies no descritas del género Heterorhabditis aislados de suelo cultivado con café en Fresno, Tolima (López et al. 2007). Estas dos especies y el reciente aislamiento de Heterorhabditis sp., se encuentran en proceso de identificación especifica.
L a prueba de patogenicidad con los JI de Heterorahbditis sp. SL0708 recuperados de larvas de G. mellonella de trampas Bedding, mostró 96% de mortalidad entre las 24 y 72 horas, exhibiendo la sintomatología descrita anteriormente. Este porcentaje de mortalidad es similar al registrado por otros aislamientos analizados por Burnell y Stock (2000) y Adams et al. (2006). La prueba de virulencia arrojó un porcentaje de mortalidad del 82% entre las 24 y 72 horas, considerando al aislamiento SL0708 virulento, lo cual es similar a lo reportado por Dix et al. (1992), Molina y López (2001) y Andalo et al. (2006), con especies del mismo género. No obstante la diferencia en el porcentaje de mortalidad de la prueba de patogenicidad y virulencia está determinada por el número de JI al cual se expone el hospedero (100JI vs 1JI respectivamente), capacidad y comportamiento de búsqueda y porcentaje de invasión en el hospedero, como lo establece Campbell y Kaya (1999) y Sáenz y Luque (2000).
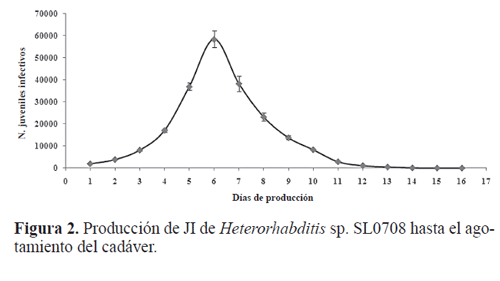
Las larvas muertas por el aislamiento nativo Heterorhabditis sp. SL0708 y disectadas a las 120 horas posterior a la infección, mostraron adultos hermafroditas de primera generación (Fig. 1A), confirmando que el aislamiento SL0708 corresponde al género Heterorhabditis. En cuanto a la producción acumulada de JI, se inicia después de los 15 días de infección, recuperando en promedio 10.414 JI (10.414- 17.784) y con producción total de 150.000 a 280.000 JI/ larva de G. mellonella hasta el agotamiento del hospedero, siendo el quinto y sexto día, los de mayor recuperación de JI (Fig. 2). Esta diferenciación en producción de JI se debe principalmente al proceso de infección, el cual involucra el ingreso al hospedero por el ano, boca, espiráculos o cutícula, número de JI que ingresan por hospedero, penetración hasta la hemolinfa del insecto, liberación y propagación de las bacterias antes de iniciarse el desarrollo de Heterorhabditis sp. SL0708; resultados similares ofrecen con H. bacteriophora Flanders et al. (1996), Wang y Bedding (1996), Boff et al. (2000), Shapiro-Ilan et al. (2002).
Ciclo de vida. El porcentaje de penetración de Heterorhabditis sp.SL0708 fue del 35% (10-80%), el cual corresponde a un ingreso de uno a ocho JI en un periodo de 24 horas. Este porcentaje es alto respecto a lo reportado para H. bacteriophora que presenta un rango de 2,7-12,3% (Caroli et al. 1996) pero es similar al encontrado para las especies Steinernema feltiae (Filipjev, 1934) (27,8-63,5) y S. riobravae Cabanillas, Poinar y Raulston, 1994 (30,1-53,7) (Caroli et al. 1996; Ricci et al. 1996).
L a disección de las larvas inoculadas mostró que el JI de vida libre aplicado a las larvas de último instar de G. mellonella invade por la boca, ano, espiráculos o las membranas intersegmentales del insecto usando el diente dorsal, esta última forma de penetración se observó en pocas larvas. Posteriormente penetra la pared del sistema digestivo y entra a la cavidad corporal. La mayoría de los JI se acumula en la cápsula cefálica y parte posterior del intestino. El JI, antes de mudar al próximo estado juvenil, inicia su desarrollo incrementando la longitud total del cuerpo y estoma; este proceso toma entre 8 a 14 horas.
Heterorhabditis sp. SL0708 presenta dos ciclos uno largo con dos generaciones y uno corto con una generación pero esto depende del número de JI que inicialmente invade el hospedero y la disponibilidad de nutrientes para los estados de desarrollo. Este nematodo nativo presenta ocho estados de desarrollo: huevo, cuatro estados juveniles (J1, J2, J3-JI, J4), separados por mudas y adultos hermafroditas, machos y hembras. Todos los estados son morfológicamente distintos.
Catorce horas después de haber ingresado al hospedero, el estoma del JI se abre gradualmente, el esófago incluyendo el bulbo basal, se expande y las glándulas excretoras incrementan su tamaño. Las bacterias simbiontes, localizadas a lo largo del intestino son regurgitadas en el hemocele de las larvas de G. mellonella, matándola entre 24 y 72 horas. A las 48 horas muda a J4 o preadultos hermafroditas lo que se inicia con el desprendimiento anterior de la cutícula (Fig. 1B), rompimiento de la cutícula posteriormente y el nematodo sale. El ancho del cuerpo de los J4 se incrementa más rápido que en longitud, hasta alcanzar casi el ancho y la longitud del adulto. Durante este tiempo, el ducto excretor llega a ser largo y se ha formado el sistema reproductor (Johnigk y Ehlers 1999).
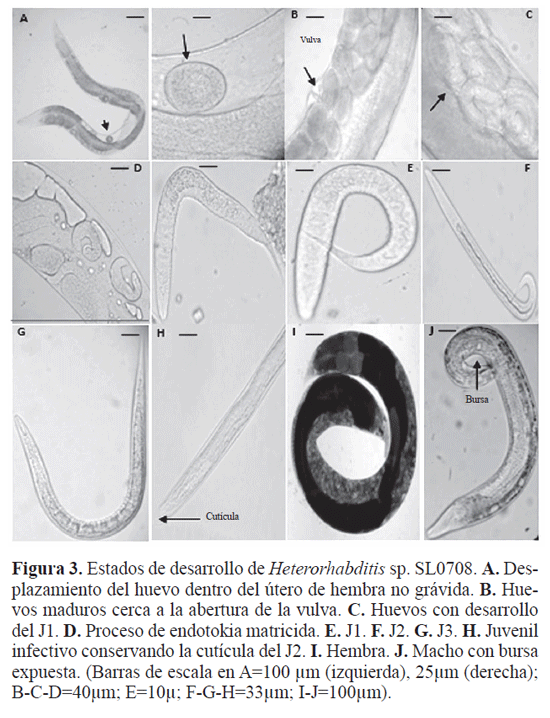
El J4 muda formando la primera generación de adultos hermafroditas jóvenes entre las 68 y 72 horas después de la inoculación. Se caracterizan por tener órganos reproductivos (ovarios, oviductos) visibles en sus cuerpos semitransparentes y vulva no desarrollada (Fig. 1C). Al madurar en un periodo de 18 a 22 horas, las hembras hermafroditas están llenas de huevos y su vulva es sobresaliente (Fig. 1D). Los huevos son transparentes y ovales, descienden dentro del útero y son fertilizados por el esperma localizado en el receptaculum seminis que está ubicado entre el ovario y útero y dirigiéndose hacia el centro del útero (Fig. 3A). Los huevos maduros se observan entre las 90-94 horas, se localizan cerca a la abertura de la vulva (Fig. 3B) y en su interior se visualiza el primer estado juvenil (J1) (Fig. 3C). Esto coincide con los resultados de Johnigk y Ehlers (1999) con Heterorhabditis spp. en estudios sobre periodos de puesta por hermafroditas. Los J1 se encuentran en el hemocele del insecto y en el interior de algunos hermafroditas desarrollados tardíamente, esto último se conoce como endotokia matricial (Fig. 3D) (Lordello 1951).
L os J1son transparentes (Fig. 3E) y muestran movimientos lentos, se alimentan y 10 horas después mudan a J2 (Fig. 3F), los cuales son parcialmente transparentes por la acumulación de nutrientes almacenados. Entre las 94-120 horas, algunos J1 pasan a J2 dentro de los adultos hermafroditas, rompiendo la cutícula de la madre y aproximadamente a las 144 horas pasan a J3 (Fig. 3G) pero si no hay suficientes nutrientes los J3 retienen la cutícula del estadio anterior (J2) que le sirve como protección, llevan células bacterianas de su simbionte, cierran boca, ano y dejan el cadáver del hospedero, en este caso se completa el ciclo de vida corto y este estadio es conocido como juvenil infectivo (JI) (Fig. 3H).
ciclo de vida largo y mudan a J4 o preadultos a las 168 horas. Los adultos de la segunda generación son hembras y machos amfimícticos que aparecen a las 185 horas (Figs. 3I-J). Estos son más pequeños que los adultos hermafroditas de primera generación. Las hembras amfimícticas desarrollan en su interior los huevos y en aproximadamente 204 horas forman los primeros J1 que pasan a J2 entre las 230-254 horas y finalmente forman los J3 a las 278 horas, los cuales conservan la cutícula del J2 y abandonan el cadáver como JI. La emergencia de los JI está determinada por la disponibilidad de nutrientes ofrecidos por el hospedero que permite otra generación, para el caso de Heterorhabditis sp. SL0708 se completa en 456 horas, es decir 19 días bajo las condiciones experimentales trabajadas. Diferentes autores confirman que el ciclo de vida y número de generaciones de los nematodos entomopatógenos en un hospedero depende de la densidad poblacional de la primera y segunda generación, disponibilidad de alimento y tamaño del hospedero (Sáenz y Luque 2000; Ciche et al. 2007).
Conclusiones
Las características sintomatológicas presentadas por las larvas entre las 72 y 120 horas después de infección por el aislamiento nativo de Heterorhabditis sp., sugieren que se mantiene una asociación bacteriana con una especie de Photorhabdus. Además las diferentes coloraciones exhibidas por las larvas de G. mellonella, son atribuibles a la concentración de células bacterianas a lo largo del intestino del JI, pigmentos producidos por las bacterias y número de JI que ingresan al hospedero.La evidencia mostrada en el presente estudio acerca de la patogenicidad, virulencia y ciclo de vida del nematodo entomopatógeno nativo Heterorhabditis sp. SL0708, es importante para orientar estudios sobre su potencial reproductivo, genética y uso potencial para el control de diferentes insectos plaga que afectan la agricultura del país.
Agradecimientos
Los autores agradecen a los propietarios de la finca el Topacio por permitir el acceso a las zonas de estudio y a la estudiante Natalia Naranjo de la carrera de biología por la toma de las muestras.
Literatura citada
ADAMS, B. J.; FODOR, A.; KOPPENHOFER, H. S.; STACKEBRANDT, E.; STOCK, P.; KLEIN, M. 2006. Biodiversity and systematics of nematode-bacterium entomopathogens. Biological Control 37: 32-49. [ Links ]
AKHURST, R.; BEDDING, R.A. 1986. Natural occurrence of insect parasitic nematodes (Steinernematidae, Heterorhabditidae) in soil in Australia. Journal of the Australian Entomological Society 25 241-244. [ Links ]
ANDALO, V.; NGUYEN, K. B.; MOINO, J. 2006. Heterorhabditis amazonensis n. sp. (Rhabditida: Heterorhabditidae) from Amazonas, Brasil. Nematology 8 (6): 853-867. [ Links ]
BEDDING, R. A. 1984. Large-scale production, store and transport of the insect parasitic nematodes Neoaplectana sp and Heterorhabditis. Annals of Applied Biology 101: 117-120. [ Links ]
BENNETT, H. P.; CLARKE, D. J. 2005. The pbgPE operon in Photorhabdus luminescens is required for pathogenicity and simbiosis. Journal. Bacteriology 187 77-84. [ Links ]
BOFF, M. I. C.; WIEGERS, G. L.; GERRITSEN, L. J. M.; SMITS, P. H. 2000 Development of the entomopathogenic nematode Heterorhabditis megidis strain NLH-E 87,3 in Galleria Galleria. Nematology 2 303-308. [ Links ]
BURNELL , A. M.; STOCK, S. P. 2000. Heterorhabditis, Steinernema and their bacterial symbionts lethal pathogens of insects. Nematology 2 (1): 31-42. [ Links ]
CAMPBELL , J. F.; KAYA, H. K. 1999. How and why a parasitic nematode jumps. Nature 397: 485-486. [ Links ]
CAROLI, L.; GLAZER, I.; GAUGLER, R. 1996. Entomopathogenic nematode infectivity assay: multi variable comparison of penetration into different hosts. Biocontrol Science and Technology 6 227-233. [ Links ]
CICHE, T. A.; DARBY, C.; EHLERS, R.; FORST, S.; GOODRICHBLAIR, H. 2007. Dangerous liaisons: The symbiosis of entomopathogenic nematodes and bacteria. Biological Control 38 22-46. [ Links ]
DIX, I.; BURNELL , A. M.; GRIFFIN, C. T.; JOYCE, S. A.; NUGENT, J. M. 1992. The identification of biological species in the genus Heterorhabditis (Nermatoda: Heterorhabditidae) by cross breeding second generation amphimictic adults. Parasitology 104: 509-518. [ Links ]
FLANDERS, K.L.; MILL ER, J. M.; SHIELDS, E. J. 1996 In vivo production of Heterorhabditis bacteriophora 'Oswego' (Rhabditida: Heterorhabditidae), a potential biological control agent for soil-inhabiting insects in temperate regions. Journal of Economic Entomology 89 373-380. [ Links ]
FORST, S.; DOWDS, B.; BOEMARE, N.; STACKEBRANDT, E. 1997. Xenorhabdus and Photorhabdus spp. Bugs that kill bugs. Annual Review of Microbiology 51 47-72. [ Links ]
GREWAL, P. S.; KOPPENHOFER, A. M.; CHOO, H.Y. 2005. Lawn, turfgrass and pasture applications, pp. 115-146. En: Grewal, P. S.; Ehlers, R-U.; Shapiro-Ilan, D. (eds). Nematodes as biocontrol agents. CABI, New York, USA. [ Links ]
JOHNIGK, S. A.; EHLERS, R. 1999. Juvenile development and life cycle of Heterorhabditis bacteriophora and H. indica (Nematoda Heterorhabditidae). Nematology 1: 251-260. [ Links ]
KAYA, H. K.; STOCK, S. P. 1997. Techniques of insect nematology. Chapter VI. In: Manual of techniques in insect pathology. Lacey L. (Ed). Biological Techniques Series. Academic Press, San Diego (Estados Unidos), 409 p. [ Links ]
KLEIN, M. G. 1990. Efficacy against soil-inhabiting insect pest, pp. 195-210. En: Gaugler, R.; Kaya, H. K. (eds). Entomopathogenic nematodes in biological control. CRC Press, Boca Raton, Florida. [ Links ]
KOPPENHOFER, A. M.; BAUR, M.; STOCK, P.; CHOO, H.; CHINNASRI, B.; KAYA, H. K. 1997. Survival of entomopathogenic nematodes within host cadavers in dry soil. Applied Soil Ecology 6: 231-240. [ Links ]
LÓPEZ, N. J.; CANO, L.; GONGORA, C.E.; STOCK, S. P. 2007. Diversity and evolutionary relationships of entomopathogenic nematodes (Steinernematidae and Heterorhabditidae) from the central Andean region of Colombia. Nematology 9 (3): 333-341. [ Links ]
LÓPEZ, N. J.C. 2008. Nematodos para el control de insectos plaga, pp. 150-183. En: Bustillo, A. (ed). Los insectos y su manejo en la caficultura colombiana. Chinchina (Colombia). Cenicafé, Federación Nacional de cafeteros. [ Links ]
LORDELL O, L. G. 1951. Endotokia matricida em Rhabditis sp. (Nematoda, Rhabditidae). Anais Escola Superior de Agricultura Luiz de Queiros de Sao Paulo 3: 111-114. [ Links ]
MOLINA, J. P.; LOPEZ, J. C. 2001. Producción in vivo de tres entomonemátodos con dos sistemas de infección en dos hospedantes. Revista Colombiana de Entomología 27 (1/2): 73-78. [ Links ]
PATEL, M. N.; PERRY, R. N.; WRIGHT, D. 1997. Desiccation survival and water contents of entomopathogenic nematodes, Steinernema spp (Rhabditida: Steinernematidae). International Journal for Parasitology 27 (1): 61-70. [ Links ]
POINAR, G. O. JR. 1975. Description and biology of a new parasitic rhabditoid Heterorhabditis bacteriophora n. gen., n sp. Nematologica 21 463-470. [ Links ]
RICCI, M.; GLAZER, J.; GAUGLER, R. 1996. Entomopathogenic nematode infectivity assay: comparison of laboratory bioassays. Bicontrol Science and Technology 6 235-245. [ Links ]
SÁENZ, A. A. 2005. Importancia de los nematodos entomopatógenos para el control biológico de plagas en palma de aceite. Palmas 26 (2): 41-57. [ Links ]
SÁENZ, A. A.; LUQUE, J. E. 2000. Cicle de vida del entomonematodo nativo Steinernema feltiae Filipjev. Agronomía Colombiana 17: 17-24. [ Links ]
SHAPIRO-ILAN, D. I.; GAUGLER, W. L.; TEDDERS, I.; BROWN, E.; LEWIS, I. 2002. Optimization of inoculation for in vivo production of entomopathogenic nematodes. Journal of Nematology 34 (4): 343-350. [ Links ]
WANG, J.; BEDDING, R.A. 1996. Population development of Heterorhabditis bacteriophora and Steinernema carpocapsae in the larvae of Galleria mellonella . Fundamental and Applied Nematology 19 363-367. [ Links ]