Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.1 Bogotá June 2011
Transmisión del Virus del Mosaico Suave del Ñame a Dioscorea rotundata (Dioscoreaceae) por Oncometopia sp. (Cicadellidae)
Transmission of Yam Mild Mosaic Virus to Dioscorea rotundata (Dioscoreaceae) by Oncometopia sp (Cicadellidae)
DEIVYS ÁLVAREZ G.1,6, ANTONIO PÉREZ H.2,6, JUAN DÍAZ S.3,6, MARIO MAESTRE H.4,6 y JAVIER BELTRÁN H.5,6
1 Biólogo, Correo electrónico: deivysalvarez@gmail.com. Autor para correspondencia.
2 M.Sc. Entomología.
3 M.Sc. Recursos Fitogenéticos Neotropicales.
4 Estudiante de Maestría en Biotecnología.
5 Ph.D. Fitopatología.
6 Grupo de Biotecnología Vegetal, Universidad de Sucre, Carrera 28 No 5-67, Sincelejo- Colombia.
Recibido: 3-mar-2010 - Aceptado: 17-feb-2011
Resumen: Se determinó la capacidad de transmisión del Virus del Mosaico Suave del Ñame (YMMV) por Oncometopia sp en D. rotundata cv. Botón. Para ello, se realizaron colectas de adultos de Oncometopia sp en un cultivo de D. rotundata ubicado en el municipio de Toluviejo departamento de Sucre, Colombia. Se realizaron bioensayos de transmisión en D. rotundata cv. Botón libres de YMMV, utilizando plantas infectadas naturalmente en campo como fuente de inóculo. Las plantas utilizadas en los bioensayos desarrollaron diferentes síntomas como mosaico, bandeo, corrugamiento y deformación foliar. La detección del virus en esas plantas así como en Oncometopia sp se realizó mediante la técnica de IC-RT-PCR. Este es el primer informe sobre la identificación de un cicadélido vector de virus en ñame.
Palabras clave: Vector. Potyvirus. YMMV. IC-RT-PCR.
Abstract: The transmission capacity of the Yam Mild Mosaic Virus (YMMV) by Oncometopia sp in D. rotundata cv. Botón was determined. This was done by collecting adult specimens of Oncometopia sp from D. rotundata crops located in the municipality of Toluviejo, department of Sucre, Colombia. Transmission bioassays were conducted on D. rotundata cv. Botón free of YMMV, using naturally infected field plants as a source of inoculum. The plants used in the bioassays developed different symptoms, such as mosaics, banding, wrinkling and foliar deformation. Detection of the virus in these plants as well as in Oncometopia sp was achieved by the IC-RT-PCR technique. This is the first report on the identification of a leafhopper as a yam virus vector.
Key words: Vector. Potyvirus. YMMV. IC-RT-PCR.
Introducción
Los Cicadellidae, comúnmente llamados cicadélidos, saltahojas o chicharritas (Freytag y Sharkey 2002) son de gran importancia económica ya que son capaces de transportar y transmitir fitopatógenos; además, pueden causar daños directos en las plantas al alimentarse de la savia de las células y tejidos, lo cual resulta en un debilitamiento general (Nielson 1985). Estos insectos poseen piezas bucales picadoras-chupadoras las cuales utilizan para penetrar de manera delicada las células vegetales y succionar la savia. Entre los cicadélidos, algunas especies del género Oncometopia poseen gran interés al ser plagas en cultivos de cítricos pudiendo transmitir la bacteria Xilella fastidiosa (Wells et al., 1987) agente causal de la clorosis variegada de los cítricos (Roberto et al. 1996).
El ñame pertenece a la familia Dioscoreaceae, género Dioscorea (Perea y Buitrago 2000). Es una planta de importancia económica en regiones pluviosas tropicales y subtropicales cuyos tubérculos son considerados como producto esencial para la alimentación de millones de personas en África, Asia y América latina (Perea 2000) y Alvarez (2000) considera que en Colombia el cultivo del ñame se encuentra restringido a la región Caribe, con Bolívar, Córdoba y Sucre como los departamentos de mayor producción.
Los cultivos de ñame pueden ser infectados por virus de los géneros Potyvirus, Badnavirus, Cucomovirus, Comovirus, Potexvirus y Carlavirus (Asiedu et al. 2003; Kenyon et al. 2003). Entre los Potyvirus del ñame se encuentran el Virus del Mosaico del Ñame (YMV) (Thouvenel y Fauquet 1979) y el Virus del Mosaico Suave del Ñame (YMMV) (Munford y Seal 1997) que ha sido reportado como Virus de Dioscorea Alata (DAV) (Odu et al. 1999), los cuales causan síntomas como mosaicos, moteados, bandeos, deformación foliar y atrofiamiento. Además, existen otros virus que afectan la producción como el Virus Baciliforme de Dioscorea Alata (DaBV) del género Badnavirus (Phillips et al. 1999) y el Virus del Mosaico del Pepino (CMV) del género Cucumovirus (Thottappilly 1992).
En atención a esto, se propuso determinar la capacidad de transmisión del Virus del Mosaico Suave del Ñame (YMMV) por una entidad del género Oncometopia (Cicadellidae: Cicadellinae: Proconiini) en plantas de ñame espino cv. Botón (Dioscorea rotundata Poir.).
Materiales y Métodos
Los muestreos de Oncometopia sp y de incidencia sintomática se realizaron en un cultivo de ñame espino cv. Botón, ubicado en el corregimiento de La Siria, en el municipio de Toluviejo, localizado en el departamento de Sucre, en el año 2007. Los bioensayos de transmisión se llevaron a cabo en el laboratorio de Entomología de la Universidad de Sucre. Las condiciones para los bioensayos fueron: temperatura máxima - mínima de 29,8ºC y 26,4ºC respectivamente y humedad relativa promedio de 74,2%.
Las plantas de ñame espino cv Botón para los bioensayos de transmisión, se obtuvieron a partir de microtubérculos, los cuales se sembraron en sustrato compuesto por suelo negroarena- estiércol bovino seco en proporciones 1:1:1, previamente desinfectado con formol al 2% durante 48 horas. Dos meses después de la germinación, las plantas se evaluaron mediante IC-RT-PCR para detectar la presencia o no del Virus del Mosaico Suave del Ñame.
Adultos del cicadélido Oncometopia sp se coleccionaron sobre plantas de ñame espino cv. Botón con síntomas de Potyvirus, mediante captura manual y con aspirador bucal (Oliveira et al. 2001).
Plantas de ñame espino cv. Botón infectadas naturalmente, ubicadas en los cultivos donde se realizaron las capturas de los insectos, se eligieron como fuente de inóculo para los bioensayos con Oncometopia sp. Se tomaron muestras foliares y se trasladaron en bolsas autosellantes refrigeradas (Rodríguez et al. 2004), hasta el laboratorio de Biotecnología Vegetal de la Universidad de Sucre donde se analizaron mediante IC-RT-PCR para verificar la presencia del YMMV.
Se uso un período de adquisición viral (PAV) de ocho días, para ello los Oncometopia sp capturados se trasfirieron a las plantas destinadas como fuente de inóculo en campo (Fig.1A). Posteriormente, se transportaron hasta el laboratorio de Entomología de la Universidad de Sucre. El período de inoculación viral (PIV) fue de 11 días, utilizando plantas de ñame espino cv Botón libres de YMMV las cuales estuvieron aisladas en jaulas cilíndricas cubiertas con una caperuza de muselina (Fig. 1B) durante todo el ensayo. Se realizaron cinco bioensayos y cada uno consistió de una planta con un grupo de cinco individuos de Oncometopia sp como presión de inóculo. Finalizado el PIV, se realizó seguimiento durante 100 días para observar el desarrollo de síntomas acompañado del diagnóstico del YMMV mediante IC-RT-PCR en los insectos y las plantas. La incidencia de la enfermedad de la virosis del ñame se determinó por sintomatología visible (Sepúlveda et al. 2005) reportada para los Potyvirus en ñame. Se realizó un muestreo aleatorio en forma de zig-zag de 150 plantas en una hectárea, después de seis meses de siembra, contando cada planta muestreada y registrando el síntoma encontrado en el mismo cultivo donde se realizaron las colectas de Oncometopia sp.
Las pruebas de detección del YMMV mediante IC–RT– PCR se realizaron con los cebadores propuestos por Munford y Seal (1997): (CP2F: 5’ GGC ACA CAT GCA AAT GAA AGC 3’) y (UTR2R: 5’ CAC CAG TAG AGT GAA CAT AG 3’). Los extractos se obtuvieron mediante maceración de las muestras sean tejido foliar o insectos en 10mL de tampón de extracción general 1X (Agdia catálogo SRA 27200/0500) y clarificación por centrifugación a 8000rpm durante 5 min.
En las inmunocapturas (IC) se utilizaron anticuerpos para Potyvirus (Agdia catálogo SRA 27200/0500). El anticuerpo fue preparado en tampón de incubación (tampón ECI 1X) en una dilución de 1/200 y fijado en tubos de 0,2mL (40μl c/u) durante 12h a 4°C. Después, se realizaron tres lavados con PBS-T 1X y se adicionaron 40μl del extracto a cada tubo, se incubó 12h a 4°C y se lavó tres veces nuevamente con PBS-T 1X. La reacción de retrotranscripción (RT) se realizó adicionando a cada tubo 1μl de Oligo (dT) (500μg/μl), 1μl dNTP Mix 10mM y 10μl de agua destilada y estéril. Se incubó a 94°C/1min y 75°C/8min. Luego se agregaron 4μl de tampón primera cadena 5X [Tris-HCl 250mM (pH 8,3), KCl 375Mm, MgCl2 15mM], 2μl de DTT 0,1M, 1μl RNasaOUT (40U/μl) y 1μl M-MLV RT (200U/μl) e incubó a 45°C/50min y 70°C/15min. Culminada la etapa RT se procedió con la PCR, para lo cual se adicionaron 5μl de tampón PCR 10X [Tris-HCl 200mM (pH 8,4), KCl 500mM], 1,5μl de MgCl2 50mM, 1μl dNTP Mix 10mM, 1μl de cada cebador (10μM), 0,4μl de Taq DNA polimerasa (5U/μl), 5μl de ADNc y 35,1μl de agua destilada, estéril, con el siguiente perfil de temperaturas por 35 ciclos: desnaturalización (95ºC/4min); desnaturalización (95ºC/30s); alineamiento (58,5ºC/30s); elongación (72ºC/30s) y elongación final (72ºC/7min). El producto del PCR se analizó mediante electroforésis en gel de agarosa 0,8% con SYBR safe y el peso de las bandas se determinó mediante el marcador molecular 100 bp DNA Ladder de Invitrogen®. Para las etapas RT-PCR se usó un termociclador My Cycler termal cycler de BIO-RAD.
Resultados y Discusión
Las plantas de ñame espino cv. Botón fuentes de inóculo presentaron síntomas de infección por Potyvirus como el bandeo con un alto grado de severidad y los resultados del IC-RTPCR indicaron que éstas se encontraban infectadas naturalmente con el YMMV.
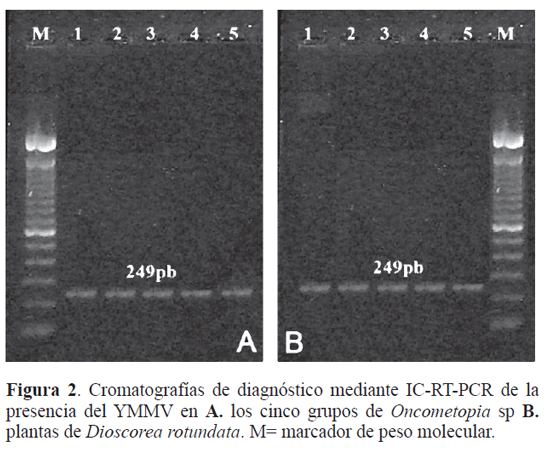
De las plantas obtenidas a partir de los microtubérculos solo cinco de 28 resultaron negativas para YMMV luego de ser analizadas por IC-RT-PCR, por lo cual solo se pudo realizar igual número de bioensayos de transmisión. Todos los grupos de Oncometopia sp resultaron positivos para YMMV (Fig. 2A) luego de haber cumplido con el PAV y el PIV, lo anterior permitió demostrar la capacidad que tiene este cicadélido de adquirir dicho virus, al alimentarse en plantas de ñame espino cv. Botón infectadas naturalmente. Las plantas resultaron infectadas con el YMMV (Fig. 2B), 14 días después del PIV, desarrollando síntomas como el bandeo, limbo corrugado, mosaico y deformación foliar, reportados como la sintomatología típica producida por los Potyvirus en ñame (Thouvenel y Fauqueth 1979; Goudou-Urbino et al 1996a; Munford y Seal 1997; Odu et al. 1999). Estos resultados demuestran que Oncometopia sp puede transmitir el Virus del Mosaico Suave del Ñame en D. rotundata cv. Botón, indicando así un nuevo vector de virus en esta especie y el primer informe sobre un cicadélido transmisor de virus en ñame.
Investigaciones realizadas en África, sobre virosis en ñame, demuestran que los áfidos componen el mayor número de insectos vectores, es así como Aphis gossypii (Glover, 1877), Toxoptera citricidus (Kirkaldy, 1907), Aphis craccivora (Koch, 1854) y Rhopalosiphum maidis (Fitch, 1856) son capaces de transmitir el YMV en Dioscorea cayenensis Lam
(Thouvenel y Fauquet 1979); A. craccivora y R. maidis son vectores del YMMV en Dioscorea alata L. (Odu et al. 1999); A. craccivora y R. maidis que transmiten el CMV en D. alata y D. rotundata (Thottappilly 1992; Odu et al. 2004). Además, el DaBV es transmitido por la cochinilla Planococcus citri (Risso, 1813) (Phillips et al. 1999; Odu et al. 2004). Sin embargo, hasta la fecha, en Colombia no se conocen informes de colonias de dichos insectos en este cultivo, mientras que si se encuentran abundantes cicadélidos, entre ellos Oncometopia sp, asociados al agro-ecosistema ñame, lo cual permite advertir el papel que estos últimos pueden tener en la epidemiología de las virosis del ñame en la región Caribe colombiana.
La incidencia sintomática, en el cultivo de ñame espino cv. Botón ubicado en La Siria, fue del 95,4% y los síntomas encontrados coincidieron con los reportados para los Potyvirus del ñame (Thouvenel y Fauquet 1979; Thottappilly 1992; Goudou-Urbino et al. 1996a, 1996b). Dentro de las sintomatologías encontradas, el bandeo fue frecuente con un 83,6%, aunque también se observó mosaico, clorosis y moteado con una frecuencia de 4,5%, 4,5% y 2,7% respectivamente. Investigaciones anteriores, como la realizada por Dallot et al. (2001) y Guzmán et al. (2001), sugieren una alta incidencia de Potyvirus en los cultivos de ñame en la región Caribe de Colombia, reportando síntomas como moteados y mosaicos; así como también la infección de estos con el YMMV. Se ha demostrado que los Potyvirus del ñame pueden ser transmitidos mediante tubérculos infectados utilizados como material de siembra (Thouvenel y Fauquet 1979; Goudou-Urbino et al. 1996b; Guzmán et al. 2001; Odu et al. 2004), esta situación sumada a la presencia de insectos vectores sería la causa de la alta incidencia de virosis encontrada en los cultivos de ñame en el departamento de Sucre.
Literatura citada
ÁLVAREZ, A. 2000. Prácticas agronómicas para el cultivo del ñame. p. 33-39. En: GUZMÁN, M. y BUITRAGO, G. (eds). Ñame: producción de semilla por biotecnología. Unibiblos. Bogotá. Colombia. 112 p. [ Links ]
ASIEDU, R.; MIGNOUNA, H.; ODU, B.; HUGHES, J. 2003. Yam breeding. p. 466-475. In: Plant virology in sub-Saharan Africa. International Institute of Tropical Agriculture (IITA), Ibadan. Nigeria. 583 p. [ Links ]
DALLOT, S.; BOUSALEM, M.; GUZMAN, M. 2001. Occurrence of potyviruses on yam (Dioscorea spp) in Colombia and first molecular characterization of Yam mild mosaic virus. Plant Disease 85 (7): 803. [ Links ]
FREYTAG, F.; SHARKEY, M. 2002. A preliminary list of the leafhoppers (Homoptera) of Colombia. Biota Colombiana 3(2): 235-283. [ Links ]
GOUDOU - URBINO, C.; GIVORD, L.; QUIOT, J.; BOEGLIN, M.; KONATE, G.; DUBERN, J. 1996a. Differentiation of yam virus isolates using symptomatology, western blot assay, and monoclonal antibodies. Journal of Phytopathology 144: 235-240. [ Links ]
GOUDOU - URBINO, C.; KONATE, G.; QUIOT, J.; DUBERN, J. 1996b. Aetiology and ecology of a yam mosaic disease in Burkina Faso. Tropical Science 36: 34-40. [ Links ]
GUZMÁN, M.; BERMUDEZ, Y.; CASTRO, C. 2001. Identificación del Virus del mosaico suave del ñame (YMMV) en muestras colombianas de Dioscorea alata caracterización biológica, serológica y molecular. Revista Colombiana de Biotecnología 3(1): 72-79. [ Links ]
KENYON, L.; SHOYINKA, S.; HUGHES, J.; ODU, B. 2003. An overview of viruses infecting Dioscorea yams in sub-Saharan Africa. p. 432-439. In: Plant virology in sub-Saharan Africa. International Institute of Tropical Agriculture (IITA). Ibadan. Nigeria. 583 p. [ Links ]
MUNFORD, R.; SEAL, S. 1997. Rapid single tube immunocapture RT-PCR for the detection of two yam potyviruses. Journal of Virological Methods 69: 73-79. [ Links ]
NIELSON, M. 1985. Leafhopper systematic. p. 11-39. In: NAULT, L.; RODRIGUEZ, J. (eds). The Leafhoppers and planthoppers. John Wiley & Sons. New York. 500 p. [ Links ]
ODU, B.; HUGHES, J.; ASIEDU, R.; NQ, N.; SHOYINKA, S.; OLADIRAN, O. 2004. Responses of white yam (Dioscorea rotundata) cultivars to inoculation with three viruses. Plant Pathology 53: 141-147. [ Links ]
ODU, B.; HUGHES, J.; SHQYINKA, S.; DONGO, L. 1999. Isolation, characterization and identification of Potyvirus from Dioscorea alata L. (water yam) in Nigeria. Annals of Applied Biology 134: 65-71. [ Links ]
OLIVEIRA, C.; MOLINA, R.; ALBRES, R.; LOPES, J. 2001. Disseminação de molicutes do milho a longas distâncias por Dalbulos maidis (Hemiptera). Fitopatología Brasilera 27(1): 91-95. [ Links ]
PEREA, M. 2000. Utilización de los sistemas in vitro para la obtención de plantas de ñame (Dioscorea spp) libres de patógenos. p. 41-53. En: GUZMÁN, M.; BUITRAGO, G. Ñame: producción de semilla por biotecnología. Unibiblos. Bogota. Colombia. 112 p. [ Links ]
PEREA, M.; BUITRAGO, G. 2000. Aplicación de la biotecnología agrícola al cultivo de ñame. p. 17-32. En: GUZMÁN, M.; BUITRAGO, G. Ñame: producción de semilla por biotecnología. Unibiblos. Bogota. 112 p. [ Links ]
PHILLIPS, S.; BRIDDON, R.; BRUNT, A.; HULL, R. 1999. The partial characterization of a Badnavirus infecting the greater asiatic or water yam (Dioscorea alata). Journal of Phytopathology 147: 265-269. [ Links ]
ROBERTO, S.R.; COUTINHO, A.; LIMA, J.; MIRANDA, V.; CARLOS, E. 1996. Transmissão de Xylella fastidiosa pelas cigarrinhas Dilobopterus costalimai, Acrogonia terminalis e Oncometopia facialis em citros. Fitopatología Brasilera 21: 517-518. [ Links ]
RODRIGUEZ, Y.; RANGEL, E.; CENTENO, F.; MENDOZA, O.; PARRA, A. 2004. Detección de enfermedades virales afectando al pimentón en los municipios Iribarren, Jiménez y Torres del Estado Lara, Venezuela, utilizando la técnica ELISA. Revista de la Facultad de Agronomía. (Venezuela) 21(2): 105-115. [ Links ]
SEPULVEDA, P.; LARRAÍN, P.; QUIROZ, C.; REBUFEL, P.; GRAÑA, F. 2005. Identificación e incidencia de virus en pimiento en la zona centro norte de chile y su asociación con vectores. Agricultura Técnica. (Chile) 65(3): 235-245. [ Links ]
THOTTAPPILLY, G. 1992. Plant virus diseases of importance to african agriculture. Journal of Phytopathology 134: 265-288. [ Links ]
THOUVENEL, J.; FAUQUET, C. 1979. Yam mosaic Potyvirus infecting Dioscorea cayenensis in the Ivory coast. Annals of Applied Biology 93: 279-283. [ Links ]