Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.2 Bogotá July/Dec. 2011
Actividad insecticida y fijadora de nitrógeno de la bacteria transformada PaeniBacillus polymyxa que expresa Cry1C
Insecticidal and nitrogen fixation activities of the transformed PaeniBacillus polymyxa expressing Cry1C
Amal Ibrahim Hussien1,2, Nahed Ibrahim Abd El-Ghaffar3,4, Adel El-Sayed Hatem2,3, Hani K. Aldebis2,3 y Enrique Vargas-Osuna2,3
1 Becaria de Investigación.
2 Departamento de Ciencias y Recursos Agrícolas y Forestales, Grupo de Entomología Agroforestal, ETSIAM, Universidad de Córdoba, Edificio Celestino Mutis, Campus Universitario de Rabanales, Crta. Madrid-Cádiz, km 396-a, 14071, Córdoba, España. z72ibiba@uco.es Autora para correspondencia.
3 Ph. D.
4 Department de Microbial Molecular Biology, Agricultural Genetic Engineering Research Institute (ARC), 9 Gamaa Street, 12619, Giza, Egypt.
Recibido: 18-mar-2011 - Aceptado: 31-oct-2011
Resumen: Se realizaron ensayos de laboratorio con el objeto de conocer la posibilidad de utilización de la bacteria PaeniBacillus polymyxa modificada genéticamente para expresar la toxina Cry1C de Bacillus thuringiensis como un sistema de aplicación de proteínas Cry para el control del noctuido Spodoptera littoralis en cultivos de algodón. Se ha estudiado la actividad insecticida en larvas de primer estadio de S. littoralis y la persistencia de la cepa de P. polymyxa transformada, en comparación con la misma cepa no modificada y con B. thuringiensis var. aizawai que expresa de forma natural la toxina. Los resultados muestran que la bacteria transformada tiene una mayor toxicidad (CL50=7,04x107 espora+cristal/ml) que B. thuringiensis var. aizawai (CL50=8,47x107 espora+cristal/ml). Se encontraron altos niveles de supervivencia de la bacteria en el interior de los tejidos foliares y actividad insecticida al menos hasta 720 horas después del tratamiento foliar. Por otro lado, su aplicación en la planta aumenta la cantidad de Nitrógeno y en el suelo mejora la actividad nitrogenasa, en comparación con P. polymyxa no transformada.
Palabras clave: Algodón. Bacillus thuringiensis. Persistencia. Spodoptera littoralis. Toxicidad.
Abstract: Laboratory tests have been conducted in order to ascertain the possibility of using the bacteria PaeniBacillus polymyxa expressing the Bacillus thuringiensis Cry1C toxin as a delivery system for Cry proteins that can be used to control the Spodoptera littoralis noctuid on cotton crops. We have studied the insecticidal activity on first instar larvae of S. littoralis and the persistence of the transformed strain of P. polymyxa, compared with the unmodified strain and B. thuringiensis var. aizawai naturally expressing the toxin. The results show that the transformed bacteria was more toxic (LC50=7.04x107 spore+crystal/ml) than B. thuringiensis var. aizawai (LC50=8.47x107 spore+crystal/ml). High levels of persistence into foliar tissues and insecticide activity were found, at least until 720 hours after foliar treatment. On the other hand, its application in the plant increases the amount of nitrogen and improves soil nitrogenase activity compared to untransformed P. polymyxa.
Key words: Cotton. Bacillus thuringiensis. Persistence. Spodoptera littoralis. Toxicity.
Introducción
Bacillus thuringiensis (Berliner, 1915) (Bt) es una bacteria Gram-Positivo que se caracteriza por producir una inclusión parasporal durante la esporulación formada por uno o más cuerpos cristalinos que contienen las proteínas insecticidas (Höfte y Whiteley 1989; Schnepf et al. 1998). Estas proteínas, llamadas delta-endotoxinas o Cry, son tóxicas para insectos de los órdenes Lepidoptera (Brock y Madigan 1988), Coleoptera (Dulmage y Aizawa 1982; Chiang et al. 1986) y Diptera (Lambert y Peferoen 1992) y constituyen la base del insecticida biológico más difundido a nivel mundial (Brar et al. 2006).
Los avances en la genética de Bt permiten el desarrollo de su máxima potencialidad como insecticida mediante manipulación de genes cry (que codifican determinadas toxinas) con objeto de ampliar su espectro de actividad, aumentar su toxicidad mediante efectos sinérgicos o aditivos (Crickmore et al. 1995; Lee et al. 1996) o para la producción de organismos genéticamente modificados.
Un problema relacionado con los preparados comerciales a base de Bt es su limitada persistencia y estabilidad en campo (Cohen 1991) y para paliar este inconveniente se han puesto en práctica técnicas de inserción de genes cry específicos en otros organismos con capacidad de colonizar la planta huésped del fitófago, de tal manera que los organismos transformados puedan sintetizar de forma continua cantidades suficientes de proteína Cry para evitar el daño causado por el insecto (Obukowicz et al. 1986; Gelernter 1990; Stock et al. 1990; Waalwijk et al. 1991; Lampel et al. 1994).
Sin embargo, la introducción de genes cry en bacterias distintas a B. thuringiensis acarrea inconvenientes debido a la inestabilidad de la característica introducida (Tiedje et al. 1989). La utilización de bacterias del mismo género que Bt permite solventar estos inconvenientes y reducir los problemas asociados a la expresión de los genes cry (Perlak et al. 1991; Fujimoto et al. 1993). Además, se ha visto que cepas transformadas de Bacillus megaterium de Bary, 1884; Bacillus subtilis (Ehrenberg 1835) y Bacillus licheniforme (Weigmann, 1898) que expresan proteínas Cry especificas de Bt pueden tener una persistencia prolongada y mejorar su eficacia insecticida (Bora et al. 1994; Theoduloz et al. 2003).
El lepidóptero Spodoptera littoralis (Boisduval, 1833) (Noctuidae), conocido comúnmente en España como “rosquilla negra”, es una especie polífaga y de distribución mediterránea que causa daños de importancia económica en numerosos cultivos y plantas hortícolas. En Egipto es considerada como la plaga principal del cultivo de algodón (Hosny et al. 1986; Hatem et al. 2009) y en España sus poblaciones son abundantes en las regiones del Levante y Andalucía (Gómez de Aizpurúa y Arroyo Varela 1994). Esta especie, como otras del mismo género, mostraron en principio poca susceptibilidad a los primeros productos comerciales de Bt, pero luego se han aislado cepas naturales pertenecientes a las variedades entomoocidus y aizawai (Navon et al. 1983; Broza et al. 1984) con mayor capacidad tóxica para las larvas de estos noctuidos, y más recientemente se han obtenido cepas transformadas genéticamente que son más activas (Kalman et al. 1995). Se sabe que las especies de Spodoptera poseen en la membrana de las células columnares del mesenterón un receptor específico de la proteína Cry1C (Sanchis et al. 1994) responsable de esta mayor susceptibilidad.
A partir de la bacteria fijadora de Nitrógeno PaeniBacillus polymyxa (Prazmowski, 1880) que habita la rizosfera del algodón, se ha construido una cepa (NMO10) que expresa la proteina Cry1C y que presenta toxicidad para larvas de S. littoralis (Ibrahim et al. 2006; Ibrahim y Omar 2009).
Este trabajo estudia la actividad insecticida y la persistencia de la bacteria P. polymyxa que expresa la toxina Cry1C de Bt, para conocer su idoneidad como un sistema de aplicación de toxinas Cry que pueda ser utilizado en aplicaciones foliares para el control de S. littoralis en el cultivo de algodón. Así mismo, se determina si esta bacteria transformada mantiene su capacidad fijadora de nitrógeno.
Materiales y Métodos
Material biológico. Se usaron PaeniBacillus polymyxa transformada con cry1C de Bt, la cepa natural de PaeniBacillus polymyxa (ambas obtenidas por la Dra. Nahed Abdel Al-Ghaffar Ibrahim del Agriculture Genetic Engineering Research Institute de Egipto) y Bacillus thuringiensis var. aizawai reaislado del producto comercial Xantari® GD: 15% (15 millones U.I./gr) p/p suministrado por Kenogard, S.A (Barcelona). La técnica de obtención de la cepa de P. polymyxa transformada ha sido descrita por Ibrahim et al. (2008) y el gen cry1C fue obtenido por el laboratorio del Dr. Donald H. Dean (Universidad de Ohio, USA).
Las bacterias se multiplicaron en medio de cultivo T3 [5g/l de peptona, 1,5g/l de extracto de levadura, 0,005g/l de MnCl2 y solución tampón de fosfato sódico 0,5M (pH 6,8)] y para la bacteria transformada se añadió al medio kanamicina (100μg/ml). El periodo de incubación fue de siete días, tras lo cual se confirmó que los cultivos estaban completamente lisados y se procedió a la centrifugación a 10000rpm durante 15min a 4ºC en tubos de polipropileno de 30ml. El sedimento se lavó en agua bidestilada y el precipitado final se obtuvo como una suspensión en agua estéril de espora-cristal que se conservó a -20˚C hasta su uso. La riqueza de las suspensiones en número de esporas y cristales por ml (esp+cri/ml), se determinó mediante recuentos en cámara Neubauer.
Las larvas de S. littoralis proceden de una población mantenida en condiciones de insectario (26±2ºC, 60±5% HR y fotoperiodo de 16 horas de luz) que fueron alimentadas con dieta semisintética a base de harina de alfalfa modificada de Poitout y Bues (1974).
Bioensayos de toxicidad. En estos bioensayos se comparó, en condiciones de insectario, la toxicidad de P. polymyxa transformada (Ppt) y de B. thuringiensis var. aizawai (Bt) que contiene el gen cry1C de forma natural. Se emplearon cinco concentraciones de Ppt, seis concentraciones de Bt y un testigo para cada tipo de bacteria, utilizando 10 larvas de primer estadio (L1) por repetición, con cinco repeticiones para Ppt siendo necesario un mayor número de repeticiones (10) para Bt con el fin de que el ajuste de la recta de regresión fuera estadísticamente aceptable. Las concentraciones de Ppt fueron 6,12x106 18,40x106 55,06x106 165,30x106 y 495,90x106 esp+cri/ml y las de Bt 0,68x106 2,10x106 6,16x106 18,47x106 55,40x106 y 166,20x106 esp+cri/ml.
El complejo espora-cristal se suministra a las larvas de S. littoralis depositando 200μl de la suspensión sobre dieta previamente vertida en el fondo de cajas de plástico de 39mm de diámetro y 25mm de altura. Después de dejar secar, se introducen 10 larvas neonatas por caja. La duración de bioensayo es de siete días.
Bioensayos de supervivencia y persistencia. Como inóculos se utilizaron las bacterias P. polymyxa transformada y P. polymyxa natural, que procedían de la multiplicación en medio T3 antes descrita y que posteriormente se liofilizaron hasta su uso. Los liofilizados se resuspendieron en agua hasta una concentración final de 1000ppm, a los que se añadió goma arábiga (1%) y Tween-20 (0,01%). Estas suspensiones fueron aplicadas en pulverización foliar sobre plantas de algodón de cuatro semanas de edad mantenidas en condiciones de semicampo. Finalmente se dejaron secar 2 horas antes de iniciar la toma de muestras para los bioensayos. Para ello, en diferentes periodos después de la inoculación de las plantas (2, 4, 6, 8, 10, 12, 24, 48, 72, 96, 120, 144, 168, 336, 504 y 720 horas) se eligieron al azar dos hojas, de las cuales una de ellas se usaron para la determinación de la supervivencia de la bacteria y la otra para el ensayo de persistencia de la actividad insecticida.
Para determinar la supervivencia de las bacterias en el interior de los tejidos foliares, tras su desinfección superficial con hipoclorito sódico al 10%, se cortaron en pequeños trozos que se sometieron a inmersión y agitación suave en 50ml de una solución estéril de MgSO4 100mM durante 15min para la liberación de la bacteria fijada al tejido. Con cada líquido resultante (suspensión madre) se hicieron tres diluciones (1/10, 1/100 y 1/1000) y cada suspensión fue cultivada en placa (2 placas/suspensión) con medio LB sólido (triptona 10g/l, levadura 5g/l, cloruro sódico 5g/l y agar 15g/l) y se incubaron a 30ºC durante la noche. Finalmente se calculan las Unidades Formadoras de Colonias (UFC) como valor medio de los recuentos de las placas y se determinan los valores de UFC/g peso seco (Sudha et al. 1999).
Para evaluar la persistencia de la toxicidad de P. polymyxa transformada, las hojas de algodón seleccionadas se colocaron separadamente en una placa Petri (16cm de diámetro y 3,5cm de altura) en condiciones de insectario y se infestaron artificialmente con 10 larvas neonatas de S. littoralis. A las 72 horas se realizó el control de mortalidad larvaria. Para cada tiempo después de la aplicación se realizaron tres repeticiones, utilizando los valores medios de mortalidad para determinar la toxicidad correspondiente.
Contenido de nitrógeno en planta y actividad nitrogenasa en suelo. El nitrógeno total se determinó con plantas tratadas por pulverización foliar con 1000ppm de P. polymyxa transformada y de P. polymyxa natural. Dos semanas después de la inoculación se tomaron muestras de la parte epigea que se analizaron con el método Micro Kjeldahl, usando una mezcla de H2SO4 + HClO3 (1:1) de acuerdo al procedimiento de Page et al. (1982). El contenido de N se calculó mediante la fórmula: mg N/planta = %N × Peso seco (g)/planta × 10.
Para ambas bacterias se determinó también la actividad nitrogenasa en muestras de suelo que fue artificialmente infestado con 1000ppm de P. polymyxa transformada y de P. polymyxa natural, siguiendo la técnica de reducción del acetileno (ARA) a partir de muestras de 100gr de suelo activado con dos fuentes de carbono e incubado a 28ºC durante 72h. Las muestras se transfirieron a tubos de 300ml y se analizaron por cromatografía de gases según el método descrito por Hardy et al. (1973) y Somasegaran y Hoben (1985). A partir de las cantidades de etileno (en μmoles) de las muestras, se determinan los valores expresados en nanomoles de etileno/ gr/h.
Análisis estadísticos. Los datos de mortalidad larvaria en los bioensayos de toxicidad se sometieron a análisis de regresión Probit (Finney 1971) para determinar las ecuaciones lineales que relacionan concentración-mortalidad y a partir de ellas se calcularon las concentraciones letales medias (CL50). Para los análisis de regresión y la comparación de las rectas se utilizó el programa POLO (Russell et al. 1977). Los datos de cantidad de Nitrógeno y de actividad nitrogenasa fueron sometidos a análisis de la varianza y las medias se compararon con la prueba de la Minima Diferencia Significativa (LSD) al 5% de significación.
Resultados y Discusión
Evaluación de la toxicidad. Se determinó la mortalidad de larvas de primer estadio de Spodoptera littoralis tratadas con P. polymyxa transformada y B. thuringiensis var. aizawai (Tabla 1).
Los valores de la prueba χ2 indican un buen ajuste de ambas rectas, cuyas pendientes difirieron entre sí (test de paralelismo χ2(1)=14,87 (p<0,001), siendo significativamente mayor la pendiente en el tratamiento con P. polymyxa transformada. Esta diferencia se atribuye a la menor heterogeneidad de la población de la bacteria transformada en comparación con la cepa de B. thuringiensis.
La toxicidad de P. polymyxa transformada se caracterizó por una CL50 de 7,04x107 esp+cri/ml para larvas de primer estadio de S. littoralis; este valor fue menor que el de B. thuringiensis var. aizawai de 8,47x107 esp+cri/ml. No obstante, como se deduce por el solape de los intervalos fiduciales, ambos valores no difirieron significativamente. A resultados similares llegaron Ibrahim y Omar (2009) al comparar la toxicidad de P. polymyxa transformada con B. thuringiensis var. entomocidus sobre larvas neonatas de S. littoralis.
Bora et al. (1994) utilizaron la cepa RS1 de B. megaterium aislada de la filosfera de las plantas de algodón para introducir el gen cry1Aa de la cepa HD-1 de B. thuringiensis var. kurstaki. La actividad insecticida del organismo transformado en larvas de Helicoverpa armigera (Hübner, 1805) fue similar a la cepa HD1 pero su efecto persistió durante más tiempo ofreciendo una mejor protección de las plantas. Así mismo, cepas transformadas de B. subtilis y B. licheniforme que expresan Cry1Ab y habitan de forma natural en el filoplano de plantas del tomate, muestran una actividad insecticida contra el lepidóptero Tuta absoluta (Meyrich, 1917) similar a una cepa de B. thuringiensis que expresa de forma natural la proteína (Theodulos et al. 2003). La utilización de estas bacterias colonizadoras de plantas, transformadas genéticamente para tener acción insecticida contra plagas, se ha venido desarrollando desde la década de los 90 (Gelernter y Schwab 1993), sin que hasta ahora se hayan encontrado efectos ambientales adversos en la evaluación de su bioseguridad en campo.
Supervivencia de P. polymyxa. En las hojas superficialmente esterilizadas se encontraron altos niveles de supervivencia de la bacteria establecida en los tejidos foliares al menos hasta 720 horas después del tratamiento (Tabla 2). Los valores en UFC/g peso fresco mostraron oscilaciones entre periodos consecutivos, probablemente debido a que las determinaciones procedían de una sola muestra de hoja. No obstante, la supervivencia de la bacteria transformada se extendió durante los 30 días de duración del ensayo, al igual que la bacteria no transformada. Resultados semejantes se han obtenido en caña de azúcar (James y Olivares 1998) y arroz (James et al. 2002). En cultivos en invernadero Denise et al. (2002) encuentran bacterias endófitas colonizando sus plantas huéspedes originales 42 días después de la inoculación a unos niveles de 3,5-7,7×1010 UFC/g peso fresco.
Persistencia de la actividad insecticida. Los porcentajes de mortalidad oscilaron entre 46,7 y 100%, y al final del ensayo la media estuvo alrededor del 50% de las larvas tratadas (Fig. 1). Datos similares han sido señalados por Ibrahim et al. (2006) y Sudha et al. (1999) con el también lepidóptero Scirpophaga incertulas (Walker, 1863) en arroz. La cepa RS1 de B. megaterium transformada con el gen cry1Aa de B. thuringiensis var. kurstaki persiste en la superficie de las hojas de algodón durante más de 28 días, mientras que la cepa de B. thuringiensis desaparece completamente siete días después de la inoculación. La actividad insecticida de la cepa transformada en larvas de H. armigera persistió a altos niveles durante tres semanas desde la aplicación (Bora et al. 1994). Así mismo, cepas transformadas de B. subtilis y B. licheniforme que expresan Cry1Ab fueron capaces de sobrevivir en las hojas del tomate durante más de 45 días (Theoduloz et al. 2003).
Los resultados indican que la toxicidad de la bacteria permanece durante un largo periodo, en contraste con la pérdida mucho más rápida de actividad de las pulverizaciones con Bt convencional que se degrada significativamente en 24-48 horas (Pusztai et al. 1990). La mayor persistencia puede ser una cualidad como bioinsecticida cuando se tratan poblaciones larvarias heterogéneas, como las que suelen caracterizar los ataques de S. littoralis, aunque la presencia de residuos de bajas dosis en la planta pueden contribuir a la aparición de resistencia (Nester et al. 2002). En estas circunstancias, los enemigos naturales pueden influir también en el desarrollo de resistencia a la bacteria por preferir los intoxicados-susceptibles o los saludables-resistentes (Schnepf et al. 1998).
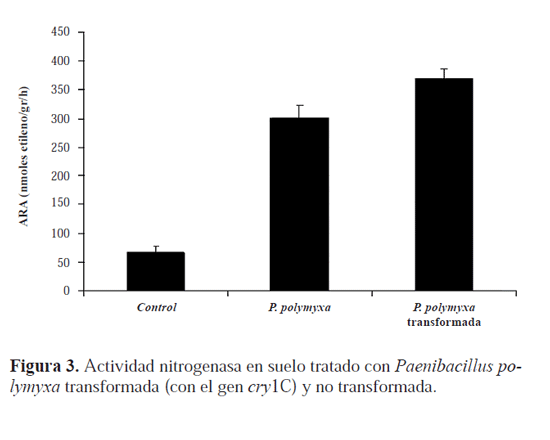
Contenido de Nitrógeno y actividad nitrogenasa. En las plantas tratadas con P. polymyxa transformada el contenido medio de Nitrógeno fue de 52,93mg/planta, significativamente mayor (F=34,5; gl=2; P=0,0005) que el de 28,79mg en las tratadas con P. polymyxa no transformada (Fig. 2). En cuanto a la actividad nitrogenasa (ARA) (Fig. 3), se encontraron diferencias significativas entre tratamientos (F=75,4; gl=2; P=0,0001) de tal forma que en suelos con P. polymyxa transformada la actividad fue mayor que en suelos con P. polymyxa no transformada. Por tanto, en ambos casos la bacteria transformada mostró mayor actividad fijadora de Nitrógeno en las plantas de algodón que la propia bacteria no transformada, lo cual es un resultado no esperado cuyas causas han de ser investigadas. Gyaneshwar et al. (2001) detectaron también actividad nitrogenasa en plantas de arroz inoculadas con la bacteria fijadora de nitrógeno Serratia marcescens (Bizio, 1823).
En resumen, los resultados indican buenas aptitudes de la bacteria P. polymyxa que expresa la toxina Cry1C de B. thuringiensis, como bioinsecticida y que serviría también como biofertilizante en programas de Producción Integrada para el control de S. littoralis. Por un lado, la bacteria transformada tiene similar actividad tóxica que B. thuringiensis var. aizawai sobre larvas de primer estadio de S. littoralis y en pulverizaciones foliares presenta alta persistencia y supervivencia al mismo tiempo que favorece la capacidad fijadora de nitrógeno en la planta; por otro lado, su aplicación mejora la actividad nitrogenasa en suelo, en comparación con la bacteria P. polymyxa no transformada.
Agradecimientos
A la Agencia Española de Cooperación Internacional para el Desarrollo (AECID) por la concesión de una Beca de Doctorado al primer autor.
Literatura citada
BORA, R.; MURTY , M.; SHENBARGARATHAI, R.; SEKAR, V. 1994. Introduction of Lepidopteran-specific insecticidal crystal protein gene of Bacillus thuringiensis subsp. kurstaki by conjugal transfer into a Bacillus megaterium strain that persists in the cotton phylloplane. Applied and Environmental Microbiology 60: 214-22. [ Links ]
BRAR, S.; VERMA, M.; TYAGI, R.; VALÉRO, J. 2006. Recent advances in downstream processing and formulations of Bacillus thuringiensis based biopesticides. Process Biochemistry 41: 323-342. [ Links ]
BROCK, T. D.; MADIGAN, T. 1988. Biology of microorganisms. Prentice-Hall. Inc. Englewood, Cliffs. New Jersey. 835 p. [ Links ]
BROZA, M.; SNEH, B.; YAWETZ, A.; ORON, U.; HONIGMAN, A. 1984. Commercial application of Bacillus thuringiensis var. entomocidus for the control of Spodoptera littoralis Boisduval. Journal of Economic Entomology 77: 1530-1533. [ Links ]
CHIANG, A. S.; YEN, D. F.; PENG, W. K. 1986. Germination and proliferation of Bacillus thuringiensis in the gut of rice month larva Corcyca cephalica. Journal of Invertebrate Pathology 48: 96-99. [ Links ]
COHEN, E.; ROZEN, H.; JOSEPH, T.; BRAUN, S.; MARGULIES, L. 1991. Photoprotection of Bacillus thuringiensis var. kurstaki from ultraviolet irradiation. Journal of Invertebrate Pathology 57: 343-351. [ Links ]
CRICKMORE, N.; BONE, E.; WILLIAMS, J.; ELLAR, D. 1995. Contribution of the individual components of the δ-endotoxin crystal to the mosquitocidal activity of Bacillus thuringiensis subsp. israelensis. FEMS Microbiology Letters 131: 249-254.
DENISE, K. Z.; PAT, N. B.; HARRIA, F.; ZHENGYA, K.; DANIEL, H.; PHYLLIS, I. A.; ANNE, V. K. 2002. Isolation and characterization of endophytic colonizing bacteria from agronomic crops and prairie plants. Applied and Environmental Microbiology 68: 2198-2208. [ Links ]
DULMAGE, H. T.; AIZAWA, K. 1982. Distribution of Bacillus thuringiensis in nature. (pp. 209-237). En: E. Kurstak (Ed.). Microbial and Viral Pesticide. Marcel Dekker. New York. [ Links ]
FINNEY, D. J. 1971. Probit analysis. Cambridge University Press, Cambridge, United Kingdom. 333 p. [ Links ]
FUJIMOTO, H.; ITOH, K.; YAMAMOTO, K.; KYOZUKA, J.; SHIMAMOTO, K. 1993. Insect resistant rice generated by introduction of a modified d-endotoxin gene of Bacillus thuringiensis. Biotechnology 11: 1151-1155. [ Links ]
GELERNTER, W. 1990. Targeting insectice-resistance markers: new developments in microbial based product. Managing resistance to agrochemicals: from fundamental research to practical strategies. American Chemical Society-USA 4221: 105-117. [ Links ]
GELERNTER, W.; SCHWAB, G.E. 1993. Transgenic bacteria, viruses, algae and other microorganisms as Bacillus thuringiensis toxin delivery systems (pp. 89-104). En: P.F. Entwistle, J.S. Cory, J. Bailey and S. Higgs (Eds.). Bacillus thuringiensis, an environmental biopesticide: theory and practice. John Willey. New York. [ Links ]
GÓMEZ DE AIZPURÚA, C.; ARROYO-VARELA, M. 1994. Principales noctuidos actuales de interés agrícola. Edigur. Madrid. 145 p. [ Links ]
GYANESHWAR, P.; JAMES, E. K.; MATHAN, N.; REDDY, P. M.; REINHOLD-HUREK, B.; LADHA, J. K. 2001. Endophytic colonization of rice by a diazotrophic strain of Serratia marcescens. Journal of Bacteriology 183: 2634-2645. [ Links ]
HARDY, R.; BURNS, R.; HOLSTEN, T. 1973. Application of the acetylene reduction assay for the measurement of nitrogen fixation. Soil Biology and Biochemistry 5: 47-81. [ Links ]
HATEM, A. E.; ABDEL-SAMAD, S. S. M.; SALEH, H. A.; SOLIMAN, M. H. A.; HUSSIEN, A. I. 2009. Toxicological and physiological activity of plant extracts against Spodoptera littoralis (Boisduval) (Lepidoptra: Noctuidae) larvae. Boletín Sanidad Vegetal Plagas 35: 517-531. [ Links ]
HOFTE, H.; WHITELEY, H. R. 1989. Insecticidal crystal proteins of Bacillus thuringiensis. Microbiology Reviews 53: 242-255. [ Links ]
HOSNY, M. M.; TOPPER, C. P.; MOAWAD, G. M.; EI-SAADANY, G. 1986. Economic damage thresholds of Spodoptera littoralis (Boisd.) (Lepidoptera: Noctuidae) on cotton in Egypt. Crop Protection 5: 100-104. [ Links ]
IBRAHIM, N. A. A.; OMAR, M. N. A. 2009. Expression of the insecticidal protein gene cry1C of Bacillus thuringiensis in plantcolonizing nitrogen fixing bacteria. Pest Technology 3: 45-49. [ Links ]
IBRAHIM, N. A. A.; SANNA. A. O.; MOHAMED, S. S.; MAGDY, A. M. 2008. Construction of a potent strain of Bacillus thuringiensis against the cotton leaf worm Spodoptera littoralis. German Journal of Agriculture and Forestry Research 58: 111-123. [ Links ]
IBRAHIM, N. A. A.; HASSAN, O. S.; OMAR, M. N. A. 2006. Protection of cotton plant (Gossypium barbadense) against lepidopteran insects due to colonization with nitrogen fixing bacteria expressing the Bacillus thuringiensis toxin gene Cry1C. Egypt Journal of Genetics and Cytology 35: 305-319. [ Links ]
JAMES, E. K., G. PRASAD, M. NATARAJAN, B. L. WILFREDO, L. BARRAQUIO, R. M. PALLAVOLA, O. L. FABIO; L. K. JAGDISH. 2002. Infection and colonization of rice seedling by the plant growth-promoting bacterium Herbaspirillum seropedicae Z67. Molecular Plant-Microbe Interactions 15: 894-906. [ Links ]
JAMES, E. K.; OLIVARES, F. L. 1998. Infection and colonization of sugarcane and other graminaceous plants by endophytic diazotrophs. Critical Reviews in Plant Sciences 17: 77-119. [ Links ]
KALMAN, S.; KIEHNE, K. L.; COOPER, N.; REYNOSO, M. S; YAMAMOTO, T. 1995. Enhanced production of insecticidal proteins in Bacillus thuringiensis strains carrying an additional crystal protein gene in their chromosomes. Applied and Environmental Microbiology 61: 3063-3068. [ Links ]
LAMBERT , B.; PERFEROEN, M. 1992. Insecticide promise of Bacillus thuringiensis. Facts and mysteries about a successful biopesticide. Bioscience 42: 112-122. [ Links ]
LAMPEL, J.; CANTER, G.; DUMOCK, M.; KELLY, J.; ANDERSON, J.; URATANI, B. 1994. Integrative cloning, expression and stability of the cry1A(c) gene from Bacillus thuringiensis subsp. kurstaki in a recombinant strain of Clavibacter xyli subsp. cynodontis. Applied and Environmental Microbiology 60: 501-508. [ Links ]
LEE, M. K.; CURT ISS, A.; ALCANTARA, E.; DEAN, D. H. 1996. Synergistic effect of the Bacillus thuringiensis toxins Cry1Aa and Cry1Ac on the gypsy moth, Lymantria dispar. Applied and Environmental Microbiology 62: 583-586. [ Links ]
NAVON, A.; WYSOKI, M.; KEREN, S. 1983. Potency and effect of Bacillus thuringiensis preparations against larvae of Spodoptera littoralis and Boarmia (Ascotis) selenaria. Phytoparasitica 11: 3-11. [ Links ]
NESTER, E.; THOMASHOW, L. S.; METZ, M.: GORDON, M. 2002. 100 years of Bacillus thuringiensis: A critical Scientific Assessment, American Academy of Microbiology, Washington, D. C. (www.asmusa.org/acasrc/aca1.htm). [ Links ]
OBUKOWICZ, M.; PERLAK, F.; KUSANO-KRETZMER, K.; MAYER, E.; BOLTEN, S.; WATRUD, L. 1986. Tn5-mediated integration of the deltaendotoxin gene from Bacillus thuringiensis into the chromosome of root-colonizing pseudomonads. Journal of Bacteriology 168: 982-989. [ Links ]
PAGE, A. L.; MILLAR, R. H.; KEENY, D. R. 1982. Methods of soil analysis. American Agriculture Inc. Madison. 1159 p. [ Links ]
PERLAK, F. J.; FUCH, R. L.; DEAN, D. A.; MCPHERSON, S. L.; FISCHHOFF, D. A. 1991. Modification of the coding sequences enhances plant expression of insect control protein genes. Proceedings of the National Academy of Sciences of the United States 88: 3324-3338. [ Links ]
POITOUT, S.; BUES, R. 1974. Élevage de chenilles de vingt-huit espèces de lépidopteres Noctuidae et de deux espèces d'Arctiidae sur milieu artificiel simple. Particularités de l'élevage selon les espèces. Annales de Zoologie-Ecologie Animale 6: 431-441. [ Links ]
PUSZTAI, M; FAST, P.; GRINGORT EN, L.; KAPLAN, H.; LESSARD, T.; CAREY, P. R. 1991. The mechanism of sunlight-mediated inactivación of Bacillus thuringiensis crystals. Biochemistry Journal 273: 43-47. [ Links ]
RUSSELL, R. M.; ROBERTSON, J. L.; SAVIN, N. E. 1977. POLO: a new computer program for probit analysis. Bulletin of the Entomological Society of America 23: 209-213. [ Links ]
SANCHIS, V.; CHAUFAUX, J.; PAURON, D. 1994. A comparison and analysis of the toxicity and receptor binding properties of Bacillus thuringiensis CryIC delta-endotoxin on Spodoptera littoralis and Bombyx mori. FEBS Letters 353: 259-263. [ Links ]
SCHNEPF, E.; CRICKMORE, N.; VAN RIE, J.; LERECLUS, D.; BAUM, J.; FEITELSON, J. 1998. Bacillus thuringiensis and its pesticidal crystal proteins. Microbiology and Molecular Biology Reviews 62: 775-806. [ Links ]
SOMASEGARAN, P.; HOBEN, H. 1985. Methods in legume- Rhizobium technology. University of Hawai. Niftal Project and Mircen. Hawai, 367 p. [ Links ]
STOCK, C.; MCLOUGHLIN, T.; KLEIN, J.; ADANG, M. 1990. Expression of Bacillus thuringiensis crystal protein gene in Pseudomonas cepacia 526. Canadian Journal of Microbiology 396: 879-884. [ Links ]
SUDHA, S. N.; JAYAKUMAR, R.; VAITHILINGAM, S. 1999. Introduction and expression of the cry1Ac gene of Bacillus thuringiensis in a cereal-associated bacterium, Bacillus polymyxa. Current Microbiology 38: 163-167. [ Links ]
THEODULOZ, C.; VEGA, A.; SALAZAR, M.; GONZÁLEZ, E.; MEZA-BASSO, L. 2003. Expression of a Bacillus thuringiensis d-endotoxin cry1Ab gene in Bacillus subtilis and Bacillus licheniformis strains that naturally colonize the phylloplane of tomato plants (Lycopersicon esculentum, Mills). Journal of Applied Microbiology 94: 375-381. [ Links ]
TIEDJE, J.; COLWELL, R.; GROSSMAN, Y.; HODSON, R.; LENSKI, R.; MACK, R. 1989. The planned introduction of genetically engineered organisms: ecological considerations and recommendations. Ecology 70: 298-315. [ Links ]
WAALWIJK, C.; DULLEMANS, A.; MAAT, C. 1991. Construction of a bioinsecticidal rhizosphere isolate of Pseudomonas . FEMS Microbiology Letters 77: 257-64. [ Links ]