Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.2 Bogotá July/Dec. 2011
Dispersión de Encarsia formosa (Hymenoptera: Aphelinidae) parasitando Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) en tomate bajo invernadero
Dispersion of Encarsia formosa (Hymenoptera: Aphelinidae) parasitizing Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) on greenhouse tomato crops
DIANA ELIZABETH PÉREZ M.1, FERNANDO CANTOR R.2, DANIEL RODRÍGUEZ C.3 y JOSÉ RICARDO CURE2
1 Bióloga Facultad de Ciencias Universidad Militar Nueva Granada, Bogotá, Colombia. diana.perez@unimilitar.edu.co Autora para correspondencia.
2 Ph.D. Docentes Facultad de Ciencias Universidad Militar Nueva Granada, Bogotá, Colombia. ecología@unimilitar.edu.co.
3 M.Sc. Docente Facultad de Ciencias Universidad Militar Nueva Granada, Bogotá, Colombia. ecología@unimilitar.edu.co.
Recibido: 20-dic-2009 - Aceptado: 18-may-2011
Resumen: Hacia el año 2003 el número de hectáreas sembradas con tomate en Colombia era de 16.000. Con el aumento del área sembrada también aumentó el efecto de plagas como la mosca blanca de los invernaderos Trialeurodes vaporariorum, capaz de causar pérdidas en el rendimiento hasta de 50%. Los métodos más usados para el control de esta plaga son el uso de insecticidas, prácticas culturales como el deshoje, trampas de pegante amarillas y el uso de enemigos naturales como Encarsia formosa. Aunque se ha demostrado la eficiencia de este parasitoide, no se ha determinado la distancia máxima en la que el parasitismo alcanza niveles efectivos. Con este propósito se efectuó un ensayo de liberación de E. formosa con base en la respuesta funcional, distribución y densidad de la plaga en cada uno de los puntos de muestreo del cultivo. En zonas donde se encontraron focos con densidades mayores de mosca blanca se liberaron más parasitoides y en consecuencia los porcentajes de parasitismo fueron superiores al resto del área. El radio de acción de este parasitoide es de 8 a 10 m con un parasitismo máximo de 47,27%.
Palabras clave: Mosca blanca de los invernaderos. Control biológico. Parasitismo.
Abstract: In 2003 the number of hectares with tomato crops in Colombia, was over 16.000. With the increase of the cultivated area, the number of plagues such as the white fly of the greenhouses, Trialeurodes vaporariorum, also increased. The most common methods for the control of the white fly are the use of insecticides, cultural practices like defoliation, yellow sticky traps and, the use of natural enemies like Encarsia formosa. Although the efficiency of this parasitoid has been demonstrated, the determination of the maximum distance in which the parasitism reaches effective levels, was needed. In order to reach this objective, E. formosa was released based on its functional response, and according to the distribution and density of the plague in each sampling point. In those areas were higher densities of white fly were found, more parasitoids were released. As a result the percentage of parasitism was higher compared with the rest of the area. A radio of action between 8 to 10 m was found for this parasitoid, with a maximum parasitism of 47.27%.
Keywords: White fly. Biological control. Parasitism.
Introducción
El tomate Solanum lycopersicon L., 1753 es una de las hortalizas más cultivadas y actualmente Colombia ocupa el lugar 41 en producción con 16.000 hectáreas 20% de las cuales se producen bajo cubierta (FAO 2007). Con el aumento del área sembrada de esta hortaliza también se ha incrementado el número e incidencia de plagas de importancia económica para este cultivo. Dentro de las plagas más importantes se encuentran la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood, 1856) (Hemiptera: Aleyrodidae) (Pedigo y Rice 2006) es una las principales plagas del cultivo de tomate (Suárez y López 1992; De Vis 2001) debido a que los adultos e inmaduros succionan la savia de las hojas lo que debilita la planta e impide el desarrollo normal de los frutos (Escobar y Lee 2001; Rodríguez y Cardona 2001). Adicionalmente los inmaduros generan una sustancia azucarada llamada mielecilla que propicia el desarrollo del hongo negro conocido como fumagina (Salmeron 1991). Cuando las hojas son cubiertas por esta sustancia se reduce el área fotosintéticamente activa (Rodríguez et al. 1996). Si se alcanzan densidades elevadas de esta plaga el hongo alcanza los frutos, reduciendo la activad del enemigo natural (Madrigal 2001) por lo cual requieren un manejo post cosecha que incrementa el precio del producto y reduce la calidad del fruto.
Esta plaga es controlada comúnmente con insecticidas y se ha demostrado que su uso en Colombia ha sido excesivo; cerca del 70% de los agricultores de nuestro país usan este método como única alternativa (Cardona et al. 2005). Las aplicaciones de insecticidas se hacen de forma regular teniendo en cuenta umbrales de acción definidos en cultivos como habichuela (Cardona et al. 1993) y en muchos casos hasta tres veces por semana, esto tiene implicaciones en la salud humana y los recursos naturales (Dent 2000), además de reducir el efecto de enemigos naturales y aumentar la probabilidad de aparición de resistencia de la plaga a las sustancias activas de los insecticidas (Cardona et al. 2005; Dent 2000).
Las hembras de E. formosa controlan las poblaciones del insecto inmaduro pues parasitan ninfas de tercer instar (Hussey y Scopes 1985) y entre tres o cuatro semanas después emerge el adulto del parasitoide. Adicionalmente el adulto de E. formosa se alimenta de ninfas de segundo instar (Soto et al. 2001; Martin 1999; Van Lenteren 2003). El control biológico de T. vaporariorum con E. formosa está bien descrito en la literatura y su efectividad se ha demostrado en países de Europeos (Hoddle et al. 1998; Salmeron 1991). Sin embargo, los criterios de liberación reportados en dichas localidades no son necesariamente aplicables a las condiciones de establecimiento de mosca blanca de los invernaderos en países como Colombia máxima a la cual los individuos son efectivos luego de la liberación, pues una misma cantidad de parasitoides podría tener diferentes niveles de efectividad dependiendo de su distribución en el campo. Teniendo en cuenta estos aspectos, se determinó el radio de dispersión de E. formosa como uno de uno de los parámetros de liberación para mejorar el modo de acción de este parasitoide en un cultivo comercial de tomate en Boyacá, Colombia.
Materiales y Métodos
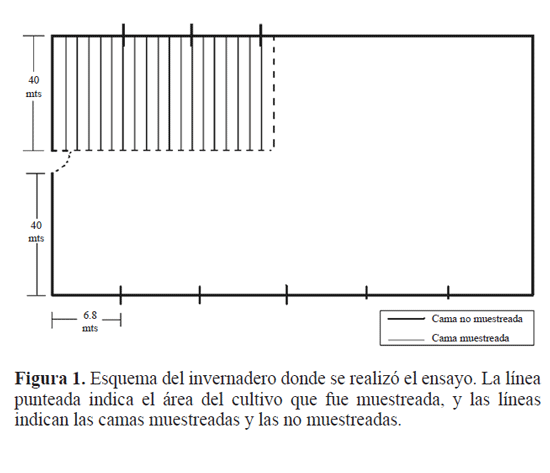
El presente trabajo se desarrolló en un invernadero de 4.500 m2 sembrado con tomate, ubicado a 1 km de Sutamarchán, en el Departamento de Boyacá (Colombia), entre los meses de febrero y abril de 2008. Para la toma de datos se usó una cuadrícula imaginaria de 840 m2 con 180 puntos de muestreo separados entre si cada uno a 2m (Fig. 1). En cada punto se marcó una planta en la que se estimó la densidad de ninfas de tercer instar de mosca blanca y el porcentaje de parasitismo de E. formosa durante todo el desarrollo del ensayo.
En este trabajo se hizo una modificación de la metodología descrita por Bernal et al. (2008), para el monitoreo directo de ninfas de tercer instar de mosca blanca de los invernaderos, con el fin de evaluar la mayor cantidad de muestras posibles en una sola fecha de muestreo, se muestrearon dos hojas por estrato por planta por punto de muestreo. Semanalmente se contó el número promedio de ninfas de tercer instar y el número de hojas presentes en cada uno de los estratos. Los datos se ingresaron al modelo diseñado por Bernal et al. (2008) con el fin de estimar el número de ninfas en toda la planta.
Para el análisis de los datos se usó el software GS+ (Gamma Design Sofware 2002) versión 5.0 (Demo) (Liebhold et al. 1993). Este programa genera un mapa de distribución espacial de la densidad de mosca blanca teniendo en cuenta la semivarianza del número de ninfas de mosca blanca por planta ingresados (Ludwig y Reynolds 1988). El tamaño de los focos se estableció usando las coordenadas en X y Y de los cuatro puntos más extremos, asumiendo para los mismos una forma rectangular. La densidad de la plaga fue determinada usando el valor de la variable Z (ninfas/planta) mostrada por el programa en el foco, Z fue multiplicada por la densidad de siembra del cultivo (3,3 plantas/m2) y el área del foco. Con esta información y teniendo en cuenta la máxima capacidad parasítica de E. formosa (1:17, Parasitoide: plaga) (Aragón et al. 2008) se estimó el número de parasitoides que fueron llevados a campo. Los parasitoides fueron liberados en grupos de 120 pupas dispuestas en dispensadores en los que se garantiza la emergencia de 100 adultos.
Tres días después de establecer la densidad de ninfas en cada foco se liberaron los parasitoides y de cuatro a cinco semanas después se contó el número de ninfas de mosca blanca melanizadas (oscuras) y el número de ninfas totales para determinar el porcentaje de parasitismo promedio en cada punto. Estas evaluaciones se hicieron teniendo en cuenta las recomendaciones de Aragón et al. (2008) quienes encontraron que 26 días después de la liberación se evidencia un bajo porcentaje de parasitismo (Cerca del 30%), mientras que 70 días después de la misma liberación se encuentran valores máximos de 72% de parasitismo. Los datos de esta variable también fueron analizados en el programa Gs+ para determinar su distribución espacial. Por último con ayuda del mismo programa se generaron cuatro semivariogramas a partir de los cuales se obtuvo la distancia máxima de parasitismo.
Resultados y Discusión
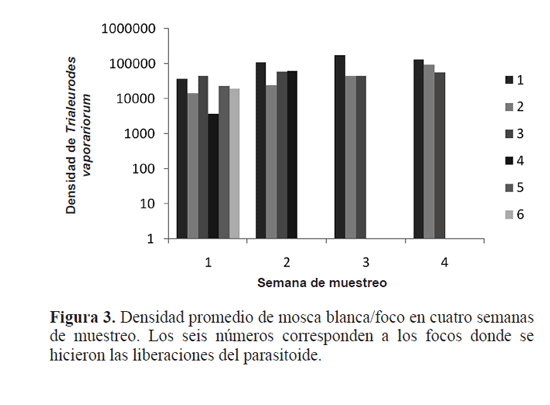
Para la primera semana las densidades de mosca blanca fueron inferiores a las tres semanas siguientes (Figs. 2A, 3), por lo cual fue usada una escala diferente. Así las máximas densidades de la plaga para esta semana se encontraron en los bordes del invernadero con valores entre 529 y 562 ninfas de tercer instar/planta. En la misma figura también se observa que en toda el área muestreada se encontraron seis focos que fueron las zonas donde se hicieron las liberaciones para la primera semana.
Para la segunda semana de evaluación (Figs. 2B, 3) las densidades de la plaga alcanzaron hasta los 4,500 individuos/ planta en las afueras de los focos uno y dos con áreas de 7,14m2 y 2,06m2 respectivamente. Para los puntos tres, cuatro y cinco se encontró que las densidades de ninfas de tercer instar de mosca blanca no superan las 3,500 ninfas/planta. Adicionalmente se observó que los bordes del invernadero son las zonas donde se encontraron las densidades de ninfas de T. vaporariorum más elevadas. Para esta semana se hizo la liberación de 6,500 y 1,500 pupas/foco de E. formosa en los puntos uno y dos respectivamente.
La figura 2C muestra un aumento importante en la densidad en tres de los focos para la tercera semana de evaluación. Por ejemplo, en el foco uno la densidad de mosca blanca pasó de 4,500/planta ninfas de tercer instar de mosca blanca en la semana dos a 17,6204 ninfas en la tercera semana (aumento del 62%) (Fig. 5). Para el foco dos se observa que pasa de una densidad de 5,000 a casi 14,000 ninfas/planta.
Por último en la cuarta semana de muestreo se ven tres focos de mosca blanca, los focos uno y tres son los mismos de las semanas dos y tres, mientras que el foco número dos se encuentra un poco más hacia el interior del invernadero. Para la cuarta semana la densidad de mosca blanca en el foco uno fue de 12,9128 ninfas/foco mientras que para la semana anterior fue de 17,6204 ninfas/foco y fueron liberadas 7,599/foco y 10,364/foco pupas del parasitoide, respectivamente. Esta diferencia en las densidades de mosca blanca entre semanas se pudieron haber originado por movimientos de adultos de la plaga hacia el interior del invernadero en semanas anteriores (Fig. 2D).
Los mapas generados por el programa Gs+ muestran que la distribución espacial de mosca blanca de los invernaderos es agregada (Fig. 2). Bernal et al (2008) mediante el índice Varianza/media encontraron que la distribución de ninfas de mosca blanca es agregada durante todo el ciclo de cultivo aunque prácticas culturales como el despunte influyen significativamente en que la distribución sea de esta forma. Esto coincide con lo planteado por Basso et al. (2001) quienes encontraron que la distribución de la plaga era agregada, mediante el uso de la distribución de probabilidad binomial negativa.
Para las cuatro semanas de muestreo se observa que las mayores densidades de mosca blanca se encuentran hacia los bordes del invernadero y en casos como el foco dos, se nota un desplazamiento de las poblaciones de ninfas de tercer instar en la semana cuatro que probablemente fue ocasionada por el movimiento de los adultos en busca de nuevo recurso de nuevo. Adicionalmente la densidad de ninfas de mosca blanca en la semana uno es similar en todos los focos, pero para las semanas posteriores en los focos uno, dos y tres las poblaciones de mosca blanca aumentan, mientras que en los focos cuatro, cinco y seis las densidades se mantienen similares a aquellas encontradas en la semana uno, por lo cual no se libera el parasitoide en estos puntos.
Encarsia formosa ha sido objeto de amplios estudios para determinar su efectividad como controlador de T. vaporariorum. Dentro de estos trabajos se encuentra el realizado por De Vis et al. (2002) quienes recomiendan iniciar las liberaciones del parasitoide cuando las poblaciones de mosca blanca son menores a 0,05 adultos por planta para que el control sea efectivo. La cantidad de individuos a liberar sugerida por estos autores es de 5 individuos/m2 semanalmente, e introducir pupas de E. formosa preferiblemente en lugar de adultos. En el mismo trabajo de también se encontró que bajo condiciones de invernadero los porcentajes de parasitismo alcanzaron valores superiores al 80%. De igual forma Aragón et al. (2008) presentan porcentajes de parasitismo hasta del 80% en condiciones de confinamiento y afirma que estos valores pueden ser superiores. Sin embargo la forma de liberación en el primer trabajo es diferente a la del segundo ya que Aragón et al. (2008) liberaron adultos recién emergidos de E. formosa, mientras que De Vis et al (2002) liberaron pupas del parasitoide.
A diferencia de los trabajos anteriormente mencionados, los porcentajes máximos de parasitismo encontrados en este trabajo fueron del 40% y representaron casos extremos de puntos específicos de muestreo, mientras que el promedio general mostró porcentajes máximos del 23% (Fig. 4) en algunos de los focos. Estos resultados concuerdan en algunos aspectos con los encontrados por Aragón et al. (2008), quienes afirman que para los 35 días después de la liberación de E. formosa se pueden observar las primeras ninfas de T. vaporariorum con síntomas de parasitismo (melanización), sin embargo, para este momento no todas las ninfas del herbívoro que han sido parasitadas presentan estos síntomas. Las condiciones en las que se desarrolló el trabajo no permitieron la evaluación de esta variable hasta los 70 días después de la liberación debido a dificultades de carácter logístico. Tomando en cuenta los datos reportados en este trabajo, se esperaría que los porcentajes de parasitismo siguieran la misma tendencia para los 40 días de evaluación restantes.
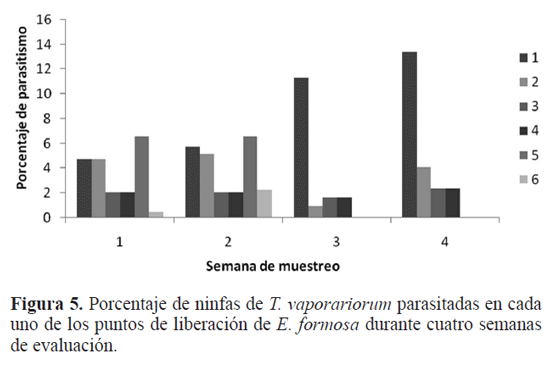
De esta forma para la primera semana de muestreo se encontró que las zonas uno, dos y tres presentaron porcentajes de parasitismo cercanos al 17% en comparación con los puntos cuatro, cinco y seis cuyos porcentajes fueron menores (6%) (Fig. 4). Estos resultados demuestran que las diferencias en los porcentajes de parasitismo de cada uno de los puntos pueden estar relacionados con las liberaciones del parasitoide en puntos donde las densidades de la plaga son mas o menos altas según corresponda.
Para la segunda semana de evaluación el porcentaje de parasitismo de E. formosa aumenta en las zonas cercanas a los bordes del invernadero, donde se liberaron los parasitoides. En la zona de liberación uno el porcentaje de parasitismo es del 17% al 20%, mientras que en los puntos dos y tres el parasitismo alcanza el 10% (Fig. 4B). Este valor es mucho menor que el encontrado para los mismos puntos en la primera semana de evaluación, lo que se le atribuye a una labor de deshoje realizada en la misma semana. De igual forma se observa que hacia el interior del invernadero los valores de parasitismo no alcanzan el 1%, lo cual corresponde a zonas donde no se hizo ninguna liberación.
Para la tercera semana (Fig. 4C) se observa que el porcentaje de parasitismo se eleva hasta cerca del 23%, en el punto de liberación uno. Este aumento se puede explicar como una acumulación de ninfas de mosca blanca que han sido parasitadas por más de tres liberaciones de E. formosa que se efectuaron en el mismo punto.
Finalmente en la cuarta semana (Fig. 4D) se observó que el porcentaje máximo de parasitismo es del 20% en los puntos uno, dos y tres, mientras que zonas como el punto cuatro de las semanas anteriores presentan porcentajes de parasitismo inferiores al 1%. Por otra parte el punto 5 encontrado en las dos primeras semanas aparece de nuevo en la cuarta semana mostrando un valor cercano al 6% de parasitismo, esto sugiere que las poblaciones de parasitoides liberadas en las primeras semanas ya comienzan a tener efecto incluso en puntos donde las liberaciones no se hicieron de forma permanente.
Para la zona uno el porcentaje de parasitismo promedio de E. formosa aumenta de 5%, en la primera semana a 15% en la cuarta semana. En este punto se encontraron las densidades más altas de ninfas de mosca blanca/planta y valores máximos de parasitismo cercanos al 40%. Por otra parte se observa una disminución en el porcentaje de parasitismo en el punto dos, de la primera y segunda semana (19,5%) a la tercera semana (5%), mientras que las zonas tres y cuatro los valores de esta variable se mantienen constantes (2%). Las zonas cinco y seis solo se evaluaron hasta la segunda semana ya que los porcentajes de parasitismo fueron cercanos al 4% y se mantuvieron por debajo de este valor a lo largo del periodo de evaluación.
Aragón et al. (2008) encontraron que al liberar 30 avispas de E. formosa por planta con una población de 500 ninfas de T. vaporariorum es el tratamiento que mejor porcentaje de parasitismo presentó (77,1%) en comparación con los demás tratamientos. Adicionalmente Tello et al. (2007) encontraron que para controlar la plaga en plantas de tomate infestadas con 15 a 45 ninfas de mosca blanca es necesario liberar seis avispas en tres momentos, con lo que se obtienen porcentajes de parasitismo cercanos al 50%. En ambos trabajos el parasitoide recién emergido fue liberado directamente en las unidades experimentales y bajo condiciones de confinamiento, mientras que en el presente trabajo la liberación de E. formosa se hizo en forma de pupas empacadas en dispensadores y con una frecuencia de liberación de dos veces por semana. Esta diferencia en las condiciones de experimentación explica los bajos índices de parasitismo encontrados durante el desarrollo del trabajo.
Aspectos como la presencia de hongos, la aplicación de químicos para el control de otras plagas (tal es el caso de Tuta absoluta con Tracer) dificultan la capacidad de búsqueda del parasitoide. Según Koppert Biological Systems (2008) este producto reduce hasta en un 75% la población de adultos de E. formosa y no tiene ningún efecto sobre pupas de este enemigo natural. Auque las liberaciones del parasitoide se hicieron en forma de pupa se podría pensar que la aplicaciones de Tracer no tendrían ningún efecto. Sin embargo el mismo producto tiene dos días de efecto residual tiempo durante el cual pudo afectar los primeros adultos que emergieron en los días posteriores a la liberación.
Por otra parte y siguiendo las recomendaciones hechas por Tello et al. (2007), las liberaciones de pupas de E. formosa se hicieron fraccionadas pero sólo en dos momentos, debido a facilidades en el transporte, almacenamiento y movilidad de los dispensadores. Según lo encontrado por estos autores si no se siguen estas recomendaciones es probable que el fenómeno de interferencia intraespecifica se vea reflejado en menores porcentajes de parasitismo (Coiller y Hunter 2001) (López et al. 2005). Otro factor que pudo afectar los porcentajes de parasitismo es el almacenamiento y transporte. Las avispas eran almacenadas en una nevera de icopor y mantenidas a una temperatura de 5ºC, sin embargo en estas condiciones no podían permanecer más de cinco días porque la viabilidad del parasitoide era reducida por efecto del frío. En las dos primeras liberaciones los dispensadores del parasitoide estuvieron sometidos a estas condiciones por cinco días, lo que redujo los porcentajes de parasitismo en las semanas uno y dos (Fig. 4).
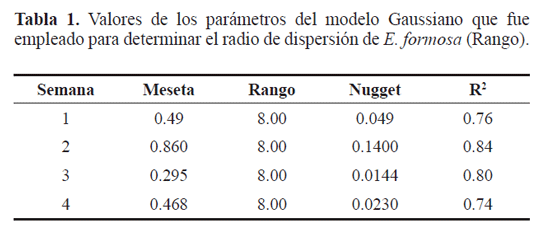
Para determinar el radio de dispersión de E. formosa se generaron cuatro semivariogramas correspondientes a las cuatro semanas de evaluación de esta variable y usando el modelo Gaussiano que fue el que presentó el valor de ajuste más alto (r ≈ 0,84). Para las cuatro semanas se encontró que la pendiente de los semivariogramas es mayor a 5,33m y de esa distancia hasta 8m la curva se estabiliza lo que se conoce con el nombre de rango (Tabla 1). En la misma tabla también se muestra el nugget que es el punto donde el valor de la distancia de separación es cero y la meseta que es donde el porcentaje de parasitismo se estabiliza. Según estos resultados a distancias superiores de 8m del punto de liberación de E. formosa los porcentajes de parasitismo observados no presentan correlación con la distancia, lo que sugiere que a distancias mayores no cabe esperar porcentajes de parasitismo importantes.
Esta distancia encontrada está relacionada con la característica sinovigenica de E. formosa (Van Roermund 1997). A diferencia de los parasitoides pro-ovigénicos, los parasitoides sinovigénicos tienen la tendencia a mantenerse en el foco de infestación donde se encuentra su hospedero. Este fenómeno fue reportado por Cantor (2001) al comparar diferentes parámetros biológicos, entre esos la capacidad de dispersión de tres parasitoides de la broca del café. Estas características permiten que E. formosa sea considerado un buen controlador biológico de T. vaporariorum en comparación con otros enemigos naturales en condiciones del altiplano de Bogotá, tal es el caso de Amitus fuscipennis (MacGown and Nebeker, 1978) el cual tiene una mayor frecuencia de oviposición, emplea menos tiempo en la manipulación de la presa y en otras actividades diferentes al parasitismo (Fuentes 2001; de Vis et al. 2002); sin embargo, E. formosa presenta mayores porcentajes de control con menor número de parasitoides liberados. Este aspecto representa una ventaja para su uso en cultivos comerciales de tomate donde la cantidad de individuos requeridos es elevada (De vis 2001).
Para el caso de otras especies sinovigénicas como Cephalonomia stephanoderis Betrem se encontró que la dispersión del parasitoide presentó dependencia espacial hasta los 20 metros de distancia con respecto al punto de liberación, zona en donde se encontraron porcentajes de parasitismo del 10% al 50% (Aristizabal 1995), mientras que a distancias mayores a 20 metros la concentración de avispas y el porcentaje de parasitismo fueron menores. Esta diferencia entre las distancias de dispersión y su correlación con el porcentaje de parasitismo para cada uno de los parasitoides se puede explicar por el tamaño de los mismos ya que E. formosa es un microhimenoptero que mide 0,6mm aproximadamente mientras que C. stephanoderis mide de 1,6 a 2,0 mm, si el tamaño del parasitoide es más grande el radio de dispersión del mismo será más grande. Esta distancia también es comparable con la encontrada por Vergara (1998) para el parasitoide de la broca del café, Phymastichus coffea La Salle (Hymenóptera: Eulophidae), el cual mostró una mayor concentración de avispas a una distancia máxima a 23 metros con un porcentaje de parasitismo del 94,74%. En el mismo trabajo también se encontró que distancias de 23 a 60 metros presentaron parasitismos del 31,29%.
Conclusiones
Los porcentajes de parasitismo sobre ninfas de tercer instar de T. vaporariorum cercanos al 40% y evaluados 35 días después de la primera liberación demuestran que E. formosa es capaz de controlar los focos de la plaga y permanecer en los mismos durante su periodo como adulto. Por otra parte, la distancia de dispersión de los adultos de E. formosa a 8m del punto de liberación indican que este parasitoide forrajea inicialmente en el punto donde fue liberado, allí parasita los hospederos que encuentra y permanece hasta que su recurso se agota. Cuando esto sucede si decide ir en busca de mas hospederos no muy lejos de la zona donde fue liberado. Estos resultados pueden usarse como punto de referencia para hacer liberaciones de E. formosa como estrategia de control preventiva en cultivos comerciales de tomate donde se tengan en cuenta los focos de T. vaporariorum.
Literatura citada
ARAGÓN, S.; RODRÍGUEZ, D.; CANTOR, F. 2008. Criterios para la liberación y evaluación de la efectividad de Encarsia formosa (Hymenoptera: Aphelinidae) para el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum Westwood (Hemiptera: Aleyrodidae) en cultivos comerciales de tomate bajo invernadero. Agronomía Colombiana 26(2): 275-286. [ Links ]
ARISTIZABAL, L. F. 1995. Efecto del parasitoide Cephalonomia stephanoderis (Betrem) (Hymenoptera: Bethylidae) sobre una población de Hypothenemus hampei (Ferrari) (Coleoptera: Scolytidae) en condiciones de campo. Manizales (Colombia), Universidad de Caldas. Facultad de Agronomía. 129 p. [ Links ]
BASSO, C.; FRANCO, J.; GRILLE, G.; PASCAL, C. 2001. Distribución espacial de Trialeurodes vaporariurum (Homoptera: Aleyrodidae) en plantas de tomate. Boletín de Sanidad Vegetal de Plagas, 27: 475-478. [ Links ]
BERNAL M., L. A.; PESCA, B. L. A. RODRÍGUEZ, D.; CANTOR, F. Y CURE, J. R. 2008. Estandarización de un método de monitoreo directo de mosca blanca Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae) en un cultivo comercial de tomate bajo invernadero. Agronomia Colombiana. 26 (2): 266-276. [ Links ]
CANTOR, F. 2001. Análise de fatores que afetam o potencial de ação de parasitoides em programas de controle biológico: o caso dos parasitóides da broca-do-café. Tese de Doutorado em Entomologia, Universidade Federal de Vicosa (Brasil). [ Links ]
CARDONA, C.; LÓPEZ-AVILA, A.; RENDÓN, F.; RODRÍGUEZ, I.; VALAREZO, O. 2005. Sección cuatro: Whiteflies as pests of annual crops in the tropical highlands of Latin America p. 269-300. En: Anderson, P.K.; Morales, F. (eds.). Whitefly and whitefly-borne viruses in the tropics: Building a knowledge base for global action. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia. 345 p. [ Links ]
CARDONA, C.; RODRIGUEZ, A.; PARADA, P. C. 1993. Umbral de Acción para el Control de la Mosca Blanca de los Invernaderos, Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae), en Habichuela. Revista Colombiana de Entomología 19 (1): 23-33. [ Links ]
COILLER, T. R.; HUNTER, M. S. 2001. Lethal interference competition in the whitefly parasitoids Eretmocerus eremicus and Encarsia sophia. Oecologia 129: 147-154. [ Links ]
DENT, D. 2000. Insect Pest Management. CABI Publishing, Wallingford UK, 410 p. [ Links ]
DE VIS, R.M.J. 2001. Biological control of whitefly on reenhouse tomato in Colombia: Encarsia formosa or Amitus fuscipennis? Tesis doctoral. Universidad de Wageningen, Wageningen, Alemania. 166 p. [ Links ]
DE VIS, R. M. J.; FUENTES, L. E.; VAN LENTEREN. 2002. Life history of Amitus Fuscipennis (Hym., Platygastridae) as parasitoid of the greenhouse whitefly Trialeurodes vaporariorum (Hom.,Aleyrodidae) on tomato as function of temperature. Journal of Applied Entomology 126 (24-23). [ Links ]
ESCOBAR, H.; LEE, R. 2001. Producción de Tomate Bajo Invernadero. Universidad de Bogotá Jorge Tadeo Lozano, Colciencias, Centro de Investigaciones y Asesorías Agroindustriales (CIAA). 66 p. [ Links ]
FAO.2007. Faostat Estadística Databases, Agricultura, Cultivos Primarios, Tomate (Www.Fao.Gov.Co) Fao (2007). Faostat Estadística Databases, Agricultura, Http://Faostat. Fao.Org/Site/340/Default.Aspx [ Links ]
FUENTES, L. E. 2001. Ciclo de vida de Amitus fuscipenis MacGown y Nebeker parasitoide de Trialeurodes vaporariorum (Westwood) a 15, 20, 25 y 30º C en tomate. Trabajo de grado. Universidad Nacional De Colombia. Facultad De Agronomía. Bogotá Colombia. Pp 54. [ Links ]
GAMMA DESIGN SOFWARE. 2002. Geostatistics for the environmental Sciences. Version 5.3 1 Demostration. [ Links ]
HODDLE, M.S.; VANDRIESCHE, R.G.; SANDERSON, J. 1998 Biology and use of the Whitefly parasitoid Encarsia formosa. Annual Review of Entomology 43:645-69. [ Links ]
HUSSEY, N. W.; SCOPES, N. 1985. Biological pest control the glasshouse experience. Cornell University Press. Ithaca, New York. 240 p. [ Links ]
KOPPERT BIOLOGICAL SYSTEMS. 2008. Web site. www.koppert. com. http://efectos-secundarios.koppert.nl/#. Fecha último acceso: [4 abril 2011]. [ Links ]
LÓPEZ, S. N.; VISCARRET, M. M.; ANDORNO, A. V.; BOTTO, E. 2005. Estudio de la interacción entre Encarsia formosa y Eretmocerus corni (Hymenoptera: Aphelinidae), parasitoides de la mosca blanca de los invernáculos Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Revista de Investigaciones Agropecuarias 34 (3): 73-82. [ Links ]
LIEBHOLD, A. M.; ROSSI, R. E.; KEMP, W. P.1993. Geostatics and Geographic information Systems in Applied insect Ecology. Annual Review of Entomology 38: 303-27. [ Links ]
LUDWIG, J.A.; REYNOLDS, J. F. 1988. Statistical ecology: a primer of methods and computing. Wiley Press, New York, New York. 337 p. [ Links ]
MADRIGAL C., A. 2001. Fundamentos de control biológico de plagas. 453 p. [ Links ]
MARTIN, N.A. 1999. Whitefly natural enemies of the whitefly and their biology. New Zealand Institute for the crops & Research Limited a Crow Research Institute. Web site. http://www.crop.cri.nz/home/products-services/publications/broadsheets/92.pdf. Fecha último acceso: [24 enero 2011]. [ Links ]
PEDIGO, L. P.; RICE, M. E. 2006. Entomology and Pest Management. Fifth Edition. Pearson / Prentice Hall Upper Saddle River. New Jersey, Columbus Ohio 259-264. [ Links ]
RODRÍGUEZ, I.; CARDONA, C. 2001. Problemática de Trialeurodes vaporariorum y Bemisia tabacci (Homoptera: Aleyrodidae) como plagas de cultivos semestrales en el Valle del Cauca. Revista Colombiana de Entomología 27 (1): 21-26. [ Links ]
RODRIGUEZ G., A.; HILLER, M.; WILLIAMS, E. 1996. Umbrales de Acción para la Mosca Blanca de Los invernaderos, Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae), en Tomate. Revista Colombiana de Entomología 22 (1): 87-92. [ Links ]
SALMERÓN, A. 1991. Plagas del Tomate: Bases Para el Control Integrado. Ministerio de Agricultura, Pesca y Alimentación. Dirección general de Sanidad de Producción Agraria. Madrid, España: 37-51. [ Links ]
SOTO, A., NORENO, A., APABLAZA, J., Y ESTAY, P. 2001. Requerimientos térmicos para el desarrollo de Encarsia formosa (hymenoptera: aphelinidae) criado en Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Ciencias e Investigación Agraria 28 (2). 103-106. [ Links ]
SUÁREZ G., M R.; LÓPEZ A. 1992. Estudio para la cría masiva de Encarsia formosa Gahan bajo condiciones de invernadero en la sabana de Bogota. Trabajo de grado Universidad Nacional De Colombia Facultad de Agronomía. Bogota Colombia. 96 p. [ Links ]
TELLO, P. CANTOR, F.; RODRIGUEZ, D.;CURE, J. R. 2007. Densidades y frecuencias de liberación de Encarsia formosa (Hymenoptera: Aphelinidae) sobre Trialeurodes vaporariurum (Homoptera: Aleyrodidae) en tomate. Agronomía Colombiana 25 (2): 314-319. [ Links ]
VAN LENTEREN, J.C. 2003. Quality control and Production ob biological control agents, Theory and testing procedures. CABI publishing. United Kingdom. 327 p. [ Links ]
VAN ROERMUND, H. J. W.; VAN LENTEREN, J. C.; RABINGE, R. 1997. Analysis of Foraging Behavior of the Whitefly Parasitoid Encarsia formosa on a Leaf: A Simulation Study. Biological Control 8: 22-36. [ Links ]
VERGARA O., J. D. 1998. Biología y comportamiento de Phymastichus coffea La Salle (Hymenoptera: Eulophidae), Parasitoide de la broca del café en condiciones de campo. Trabajo de Grado, Universidad Nacional de Colombia, Sede Medellín. 125 p. [ Links ]