Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.2 Bogotá July/Dec. 2011
Patogenicidad de aislamientos de hongos entomopatógenos contra Spodoptera frugiperda (Lepidoptera: Noctuidae) y Epilachna varivestis (Coleoptera: Coccinellidae)
Pathogenicity of isolates of entomopathogenic fungi against Spodoptera frugiperda (Lepidoptera: Noctuidae) and Epilachna varivestis (Coleoptera: Coccinellidae)
CIPRIANO GARCÍA G.1, MARÍA BERENICE GONZÁLEZ M.2 y NÉSTOR BAUTISTA M.3 1 Ph.D. CIIDIR-IPN COFAA. Blvd. Juan de Dios Bátiz Paredes No. 250. C.P. 81101. Guasave, Sinaloa, México. cgarciag@ipn.mx Autor para correspondencia. 2 M. Sc. CIIDIR-IPN COFAA Unidad Durango. Sigma No. 119. Fracc. 20 de Nov. II. C. P. 34220. Durango. mbgonzalez@ipn.mx. 3 Ph.D. Colegio de Posgraduados. Instituto de Fitosanidad. Carr. México-Texcoco Km. 36.5 Montecillo Texcoco. Edo. de México C.P. 56230. nestor@colpos.mx. Recibido: 3-mar-2010 - Aceptado: 20-oct-2011
Resumen: Con la finalidad de contar en Durango, México, con aislamientos nativos de hongos entomopatógenos con patogenicidad contra Spodoptera frugiperda y Epilachna varivestis, principales plagas de maíz y frijol, respectivamente, se evaluaron 97 aislamientos de los cuales se seleccionaron a Bb42 y Bb18 de Beauveria bassiana y Ma91 de Metarhizium anisopliae, la actividad insecticida de éstos se midió mediante bioensayos con un diseño completamente al azar aplicando diferentes concentraciones de esporas sobre larvas jóvenes de ambos insectos, los datos de mortalidad de larvas se analizaron con un ANOVA y una prueba de Tukey, la DL50 y TL50 se determinó con el programa Polo PC. El aislamiento Bb42 obtenido de larvas de S. frugiperda fue evaluado contra larvas del segundo estadio ocasionando una mortalidad de 96,6 % a una concentración de 1,0x109 esporas mL-1 y tuvo una CL50 de 5,92x103 esporas mL-1 con un tiempo letal de 3,6 días, siendo la más virulenta de las seleccionadas. De igual forma el aislamiento Bb18 obtenido de frijol fue el más virulento contra E. varivestis, ya que causó una mortalidad de larvas neonatas del 93,3%, a 1,0x109 esporas mL-1 a los 3 días, con una CL50 de 1,20x106 esporas mL-1 y tiempo letal de 5,1 días (Tukey; p ≤ 0,05). Con base en estos resultados se concluyó que la patogenicidad de los aislamientos fue mayor cuando se obtuvieron directamente del insecto que de suelos cultivados con maíz y frijol, así como cuando provienen del respectivo cultivo en el que se encuentra la plaga.
Palabras clave: Conchuela del frijol. Gusano cogollero. Beauveria bassiana. Metarhizium anisopliae.
Abstract: In order to obtain native isolates of entomopathogenic fungi in Durango, Mexico, with pathogenicity against Spodoptera frugiperda Fall Armyworm and Epilachna varivestis Mexican Bean Beetle, main pests of maize and beans, respectively, 97 isolates were evaluated, Bb42 and Bb18 of Beauveria bassiana and Ma91 of Metarhizium anisopliae. A bioassay using neonate larvae under completely randomized design of treatments per dose (ANOVA) and Tukey´s test were use to measure the insecticidal activity in both insects, mortality data were used to calculate LC50 and LT50. The isolation Bb42 obtained from larvae of S. frugiperda and evaluated against second instar larvae of the same insect showed the highest virulence 96.6% of mortality to rate of 1x109 spores mL-1, with LC50 of 5.92x103 spores mL-1, and lethal time of 3.6 days; isolation Bb18 from beans was highly virulent against neonate larvae of E. varivestis, 93.3% of mortality to 1x109 spores mL-1 with an LC50 of 1.20x106 and lethal time of 5.1 days (Tukey, p ≤ 0.05). In conclusion, the pathogenicity of the isolates was greater when were obtained directly from the insect hosts than from maize and beans soil samples, as well as when it´s are obtain from their respective host culture where was find the pest insect.
Key words: Mexican Bean Beetle. Fall Armyworm. Beauveria bassiana. Metarhizium anisopliae.
Introducción En el Estado de Durango, México, se cultivan anualmente 231.497,61 ha de frijol (Phaseolus vulgaris L.) y 146.587,00 ha de maíz (Zea mays L.) siendo los cultivos de mayor importancia económica, ya que cubren el 71,43% del total de la producción agrícola (SAGARPA 2009). Los insectos plaga que causan los mayores daños a estos cultivos son el gusano cogollero Spodoptera frugiperda (J. E Smith 1797) (Lepidoptera: Noctuidae) y la conchuela del frijol Epilachna varivestis (Mulsant, 1850) (Coleoptera: Coccinellidae). Una alternativa viable para el control biológico de estos insectos son los hongos entomopatógenos (HE): Beauveria bassiana (Balsamo-Vuilleimin, 1912), Metarhizium anisopliae (Metsch-Sorokin, 1883) y Nomuraea rileyi (Farlow-Samson) (Lezama et al. 2005; Molina et al. 2003; García et al. 1999; Morales y Röchling 1998). Debido a la importancia de contar con aislamientos nativos con patogenicidad para el control de estos insectos, adaptados a las condiciones climáticas de una región, Lezama et al. (2000) colectaron larvas de S. frugiperda logrando aislar cepas de B. bassiana, N. rileyi e Hirsutella sp., de cultivos de maíz y sorgo en Michoacán, Colima y Jalisco, mientras que en suelo encontraron a B. bassiana, M. anisopliae e Isaria fumosorosea (Wize 1904). Con este mismo fin, Molina et al. (2003) tomaron muestras de suelo y colectaron larvas de S. frugiperda en campos cultivados con maíz, sorgo Sorghum vulgare (Pers.) y pasto Sudán Sorghum sudanense Piper (Stapf, 1917) en seis Estados de la República, donde también encontraron larvas infectadas con N. rileyi e Hirsutella sp., mientras que del suelo aislaron sólo B. bassiana y M. anisopliae. Respecto a E. varivestis, García et al. (1999) evaluaron la susceptibilidad de 10 cepas de colección sobre larvas de tres días de desarrollo, las cepas fueron aisladas de insectos de diferentes órdenes y las más patogénicas fueron obtenidas de coleópteros: Diabrotica sp., Geraeus senilis (Casey, 1920) (Coleoptera: Curculionidae), Diabrotica balteata LeConte (Coleoptera: Chrysomelidae), Hippodamia convergens (Guerin- Meneville, 1842) (Coleoptera:Coccinellidae) e Hypothenemus hampei (Ferrari, 1867) (Coleoptera:Scolytidae). De éstas la que generó mayor mortalidad fue la que se aisló de Diabrotica sp., con 96.6 % de mortalidad a una dosis de 1,27x107 esporas/mL en comparación con las que no fueron aisladas de coleópteros, lo que sugiere que existe cierto grado de especificidad de cepas dependiendo de la ubicación taxonómica del insecto (Srisukchayakul et al. 2005); la que mostró menor toxicidad (66 %) fue la cepa aislada de Cydia pomonella (Linnaeus, 1758) (Lepidoptera: Tortricidae). Por otro lado, Behle et al. (2006) evaluaron la efectividad tóxica de blastosporas y esporas de I. fumosorosea utilizando dos tipos de bioensayos; uno por aplicación tópica y otro por contaminación de dieta natural (hojas de frijol) a una concentración de 1x108 esporas mL-1 sobre larvas del tercer estadio de E. varivestis, se demostró que las blastosporas fueron más efectivas que las esporas, además el bioensayo por aplicación tópica tuvo una mejor CL50 (2,34x108 esporas mL-1 y 9,88x106 blastosporas mL-1) que el bioensayo por contaminación de dieta (9,39x108 esporas mL-1 y 3,47x107 blastosporas mL-1), tanto para blastosporas como para esporas. En relación con la patogenicidad de HE sobre S. frugiperda, Lezama et al. (1996) evaluaron seis cepas sobre huevecillos y larvas a una concentración de 1x108 esporas mL-1; y observaron que resultaron más efectivas las cepas de M. anisopliae y la combinación de I. fumosorosea y P. javanicus (Friedrichs & Bally) (94 y 100 %), los valores de CL50 fueron de 9,8 x 105 y 5,6 x 106 conidias mL-1 para huevecillos y de 3,9 x 106 y 1,5 x 104 conidias mL-1 para larvas, con un tiempo letal medio (TL50) de 1,3 y 3,3 días, respectivamente. Por la importancia de obtener aislamientos nativos de HE para el control biológico de estas plagas, se realizó el presente trabajo cuyo objetivo fue: Evaluar la patogenicidad de aislamientos provenientes de suelo e insectos colectados en cultivos de maíz y frijol, contra larvas del gusano cogollero y conchuela del frijol.
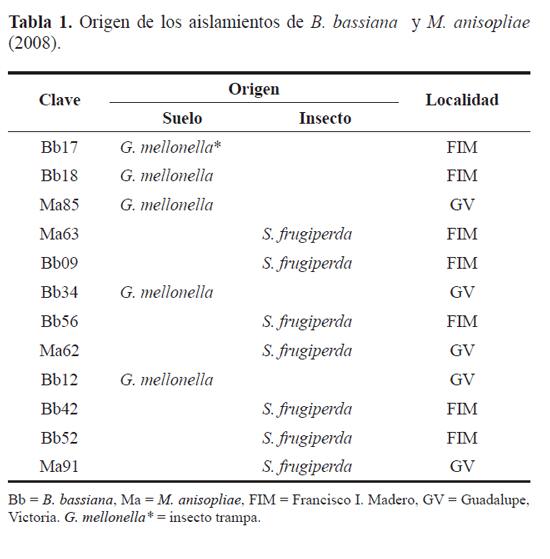
Materiales y Métodos Se obtuvieron 39 muestras de suelos cultivados con maíz y frijol en los municipios de Guadalupe Victoria (GV) (24°27’31,6”N 104°05’37,3”W) con altitud de 1997 m.s.n.m., y Francisco I. Madero (FIM) (24°24’ 16,5” N 104°20’45,2”W), con altitud de 1958 m.s.n.m, en el Estado de Durango, México (Tabla 1). Se colectaron larvas de E. varivestis y S. frugiperda con manifestación de micosis, aspecto momificado o esporulación del hongo. Los insectos se colectaron directamente de las plantas y se pusieron en vasitos de plástico con capacidad de 10mL, etiquetados por localidad y mantenidos refrigerados en laboratorio. Los muestreos de larvas y suelos se realizaron semanalmente del 4 de julio al 26 de septiembre del 2008. Para el aislamiento de HE de suelo se utilizó como insecto trampa a larvas de Galleria mellonella (Linnaeus, 1758) (Lepidoptera: Pyralidae) que son altamente susceptibles a hongos (Vanninen 1997). Cada una de las muestras de suelo se tamizaron y se tomaron 300g, el cual se humedeció y se colocó dentro de un recipiente de plástico junto con siete larvas de G. mellonella del último estadio de desarrollo, el recipiente con el suelo y las larvas se tapó y se invirtió. Las muestras se incubaron por siete días a 25±1ºC (Bedding y Akurst 1975). Pasado este tiempo, las larvas se recuperaron del suelo y se desinfectaron superficialmente con hipoclorito de sodio al 1%, se enjuagaron tres veces en agua destilada estéril; se removió el exceso de agua y se colocaron en cajas de Petri con papel filtro con el fin de mantener la humedad relativa elevada, para favorecer el desarrollo de los hongos las larvas se incubaron a 25°C durante siete días (Hatting et al. 1999), luego se aisló el HE por diferentes técnicas como transferencia directa de hifas, impronta y maceración del insecto, dependiendo del desarrollo del HE en el cuerpo del insecto, hasta obtener cultivos puros. La identificación de los hongos se hizo considerando la forma y el color de las hifas, esporas, células conidiógenas y fiálides, mientras que las características macroscópicas se basaron en la forma y color de la colonia, el crecimiento del sinema y la apariencia del hongo sobre su hospedero (Humber 1998; Samson 1988). La selección de los aislamientos se hizo con base en su rápida esporulación y alta viabilidad durante los primeros 15 días. Las colonias de B. bassiana, M. anisopliae e I. fumosorosea se sembraron por estrías en cajas petri con el medio de cultivo de referencia para cada hongo, para que el porcentaje de germinación no se viera disminuido. La viabilidad se determinó mediante microcultivos según Jiménez (1992), con un microscopio de contraste de fases (objetivo 40 X); las esporas se consideraron viables si el tubo germinativo era dos veces el diámetro de la espora, contando 400 esporas/ repetición, la viabilidad debió ser superior al 90% para que los aislamientos fueran considerados como efectivos (Milner et al.1991). Los aislamientos seleccionados se propagaron en medio de cultivo líquido como se describe a continuación, para obtener un inoculo que se utilizó para la producción de esporas aéreas en sustrato sólido, éstas fueron usadas para su evaluación contra las larvas de E. varivestis y de S. frugiperda. Una vez conservados los aislamientos en medio de cultivo papa dextrosa agar (PDA), se preparó una suspensión de los hongos adicionando 20mL de agua destilada estéril en el tubo de ensayo, se raspó la superficie del medio de cultivo con ayuda de una asa bacteriológica y dicha suspensión se colocó en 200mL de medio de cultivo líquido a base de melaza de caña de azúcar como fuente de carbono y sulfato de amonio como fuente de nitrógeno, posteriormente se colocó en una incubadora-agitadora por 48h, a 27ºC y agitación de 200rpm, hasta que el hongo alcanzó el 80% de la fase logarítmica de crecimiento, luego se inocularon en bolsas con 250g de arroz previamente tratadas (lavado, estilado, esterilizado), las bolsas se almacenaron en un cuarto a 27ºC, 70% de HR, durante 15-18 días (García et al. 2006). Una vez que las esporas germinaron se separaron del arroz con ayuda de un tamizador automático, posteriormente se redujo el contenido de humedad (<10%) con ayuda de un deshumidificador, luego las esporas se formularon en Celite® en proporción 1:1, 1g de esporas/1g de Celite®, las esporas se contaron en una cámara de Neubauer y se determinó la viabilidad de esporas formuladas mediante la técnica descrita anteriormente. Cría de insectos. Se recolectaron larvas y adultos de E. varivestis en cultivos de frijol para establecer la cría masiva del insecto en laboratorio (25±2ºC, 60% de HR y 14:10 HL). Los insectos se colocaron sobre plantas de frijol “Flor de Mayo” sembradas en macetas hasta obtener larvas neonatas de la tercera generación de la colonia, las cuales se utilizaron en la ventana de respuesta biológica y en los bioensayos para la determinación de la CL50 y TL50. Se colectaron larvas de gusano cogollero en un cultivo de maíz, las cuales se criaron individualmente en laboratorio con dieta artificial (Ashby 1972), se usaron recipientes de plástico con capacidad de 10mL con tapa y en su interior se colocaron 8g de dieta. Las pupas se pasaron a una cámara de emergencia con arena húmeda, y una vez que alcanzaron el estado adulto se colocaron en una bolsa de papel y dentro de ésta se colocó un recipiente de 5cm de diámetro con arena, miel y agua, para alimentar a los adultos y obtener los huevecillos, mismos que se pasaron a una caja Petri dentro de la cámara de cría (27±2ºC, 80±10% de HR y fotoperiodo 14:10 HL) hasta la emergencia de larvas, las cuales se usaron en las pruebas de patogenicidad. Bioensayos de actividad insecticida. Con base en los mejores resultados de patogenicidad en las pruebas descritas se obtuvieron ocho aislamientos de B. bassiana y cuatro de M. anisopliae; se preparó una solución base de cada uno a una concentración de 1x109 esporas mL-1. A partir de ésta se preparó una serie de diluciones para obtener las dosis requeridas para causar el 0 y 100% de mortalidad de larvas. Para lograrlo, se adicionaron 10 mL de agua destilada estéril sobre el crecimiento del tubo de ensaye y 0,1% de Tween® 80% como dispersante raspando la superficie con un asa, después las esporas se contaron en una cámara de Neubauer. Se emplearon veinticinco larvas por tratamiento de cada insecto, por triplicado y agua destilada como testigo. La aplicación de los tratamientos se realizó sumergiendo las larvas por 30 segundos en cada suspensión, posteriormente las larvas de S. frugiperda se mantuvieron con dieta artificial y las de E. varivestis con dieta natural, se incubaron bajo las condiciones de cría previamente descritas. A las 72h se determinó el número de larvas muertas en cada aislamiento. Análisis estadístico. Los resultados de mortalidad de larvas en los insectos se analizaron mediante un diseño completamente al azar de tratamientos por dosis (ANOVA) donde los tratamientos fueron los aislamientos Bb18, Bb42 y Ma91 y las seis diluciones las dosis; se usó el programa SAS, ver 9.0., además de una prueba de Tukey para la comparación de medias entre los diferentes aislamientos y concentraciones (Pr < F = 0,05). Selección de aislamientos. De esta manera se seleccionaron los aislamientos Bb18, Bb42 de B. bassiana y Ma91 de M. anisopliae, debido al mayor porcentaje de mortalidad de larvas (>90%) y menor tiempo letal (≤72h). Para determinar la CL50 y TL50, se utilizaron los aislamientos Bb18, Bb42 y Ma91 contra larvas neonatas de E. varivestis. Para lograrlo, se preparó una suspensión adicionando 10mL de agua destilada estéril a un tubo de ensayo con el hongo más 0,1mL de Tween® 80, de ésta se tomó 1mL y se adicionó en 9 mL de agua destilada estéril, hasta obtener seis diluciones seriadas (10-9 a 10-4); en el bioensayo se utilizaron 25 larvas neonatas de E. varivestis, las cuales se sumergieron 30 s por separado en cada concentración, se dejaron secar y luego se colocaron en macetas con frijol para que se alimentaran, cada 24h se observó el número de larvas muertas/ tratamiento. Para los bioensayos con S. frugiperda se utilizaron los mismos aislamientos, se obtuvo una suspensión de esporas raspando el contenido del HE con ayuda de una asa adicionando 10mL de agua estéril mas 0,1mL de Tween® 80 (dispersante), se hicieron seis diluciones seriadas (10-9 a 10-4). De cada concentración se adicionó 1mL/8g de dieta artificial antes de que solidificara, también se utilizaron 25 larvas con tres repeticiones, las cuales se incubaron de la misma forma que para la cría y cada 24h se reviso de mortalidad de larvas. A estos datos se les aplicó un análisis Probit (POLO PC 1996) para conocer la relación de las concentraciones con el número de insectos muertos (DL50 y TL50) a lo largo de las horas, respecto al control.
Resultados y Discusión Aislamientos nativos de HE. De las muestras de suelo y larvas en cultivos de maíz y frijol se obtuvieron 97 aislamientos, de los cuales 57 fueron de M. anisopliae (58,7%), 36 de B. bassiana (37,11%) y cuatro de I. fumosorosea (4,12%); de 63 larvas de S. frugiperda colectadas en campo, se encontró M. anisopliae en 37 y B. bassiana en 23, pero no se encontraron aislamientos de HE en larvas o adultos de E. varivestis provenientes de campo. Respecto a esto último, Ceryngier (2000) y Beyene et al. (2007) señalan que la infección natural de HE en coccinélidos es menor a 20%. En el gusano cogollero nuestros resultados concuerdan con los reportados por Lezama et al. (2000) quienes encontraron que M. anisopliae fue dominante (10,9 %), seguido por B. bassiana (4,7 %) e I. fumosorosea, aislados del suelo y asociados a poblaciones de S. frugiperda en diferentes localidades de México. Selección de aislamientos nativos de HE. Del total de aislamientos encontrados se seleccionaron ocho cepas de B. bassiana y cuatro de M. anisopliae ya que fueron patogénicos, tuvieron un adecuado desarrollo en medio de cultivo, un alto porcentaje de esporulación a los 15 días, y una viabilidad superior al 90%. Con los aislamientos Bb18 y Bb42 de B. bassiana y Ma91 de M. anisopliae se presentó un rango alto de mortalidad de larvas de E. varivestis y S. frugiperda del 93,2 al 100% (1x109 esporas mL-1) a las 72h. Con base en la actividad insecticida observada se seleccionaron sólo los aislamientos Bb18 de suelo cultivado con frijol y Bb42 y Ma91, aisladas de larvas infectadas en maíz, como las más efectivas para el control de E. varivestis y S. frugiperda (Fig. 1). De acuerdo con la Prueba de Tukey (α=0,05), los aislamientos más patogénicos para el control de S. frugiperda fueron Bb42 a las seis concentraciones y Ma91 moderadamente (1x107-1x109), también para E. varivestis (Bb18) a las tres concentraciones más altas; al comparar los valores medios y bajos de mortalidad de larvas a las distintas concentraciones se comprobó que los otros aislamientos fueron menos patogénicos a las concentraciones probadas (Tabla 2). Actividad insecticida El aislamiento que tuvo la más alta patogenicidad sobre larvas de E. varivestis fue Bb18 de B. bassiana, aislada de cultivos con frijol, con una mortalidad de 93,3 % a dosis de 1,0x109; la CL50 fue de 1,20x106 esporas mL-1 y el TL50 fue de 5,1 días (Tabla 3). En los insectos tratados se observó que el inicio de la infección fue a los 3 días, quedando cubiertos totalmente por el micelio a los 13 días después de haber aplicado las diferentes concentraciones. El aislamiento que causó mayor mortalidad fue el obtenido de larvas infectadas de S. frugiperda en campo (Bb42), con una mortalidad máxima de 96,6 % a 1x109 esporas mL-1, CL50 de 5,92x103 y TL50 de 3,6 días (valor más bajo). Este resultado coincide con el TL50 reportado por Lezama et al. (1996) de 3,3 días para el control de larvas de S. frugiperda. El aislamiento Bb18, el cual fue aislado de suelos cultivados con frijol causó una mortalidad de 69,3 % en larvas de S. frugiperda. No obstante, al evaluarlo contra larvas de E. varivestis causó una mayor mortalidad (93,3 %) a la misma concentración, mientras que el aislamiento Ma91 proveniente de larvas de S. frugiperda infectadas con M. anisopliae en campo causó una menor mortalidad (78,6 %) en larvas de S. frugiperda que B. bassiana. Sin embargo, para el control de E. varivestis la mortalidad fue menor (20%). Polanczyk y Alves (2005) aplicaron 100μL de una suspensión de B. bassiana de 1x108 esporas/mL en la superficie de placas con dieta artificial para evaluar su toxicidad sobre larvas de S. frugiperda, obteniendo una mortalidad del 30 al 45 %, la que fue mayor cuando se aplicó en combinación con Bacillus thuringiensis Berlinier (58 %), esto indica la patogenicidad del hongo probada en nuestro ensayo con este insecto. En relación con la selección de cepas, Kaur y Padmaja (2008) evaluaron 32 cepas de N. rileyi de diferente origen geográfico y huésped para el control de Spodoptera litura (Fabricius, 1775) (Lepidoptera: Noctuidae) encontrando tres cepas altamente tóxicas, donde el grado de variación entre aislamientos se relacionó con la muda del insecto. De forma similar, en nuestro estudio también observamos que el mayor número de larvas muertas de E. varivestis se dio durante la muda del insecto. Al evaluar las diferencias entre el grado y la rapidez de la infección de aislamientos de I. fumosorosea en lepidópteros, Altre y Vandenberg (2001) encontraron que las blastosporas del aislamiento 4461 fueron capaces de penetrar a la cutícula y proliferar en la hemolinfa de S. frugiperda a las 22h después de la inoculación, mientras que el aislamiento 1576 no fue efectivo, es decir que no hubo penetración de las hifas del HE en el insecto. Así mismo, Srisukchayakul et al. (2005) sugieren que la germinación de esporas en aislamientos nativos depende del insecto hospedero, debido quizás a la variación del integumento, la penetración de los HE a través de la cutícula es a veces precedida por la formación de un apresorio que se fija a la epicutícula y proporciona el punto de apoyo para los procesos mecánicos y enzimáticos. Lo anterior sugiere que el origen de los aislamientos determina el grado de patogenicidad, esto apoya el porqué los aislamientos de frijol fueron más efectivos contra E. varivestis y los de maíz contra S. frugiperda, pues las quitinasas poseen el dominio de unión a la quitina, componentes genéticos del insecto huésped, lo que aumenta la capacidad de penetración de aislamientos nativos de HE (Fan et al. 2007). También podrían ser hongos endófitos localizados en diversos cultivos propiciando la infección en diversas plagas (Vera 2008). En síntesis se encontraron abundantes aislamientos nativos de M. anisopliae y B. bassiana en campos cultivados con frijol y maíz en la región de estudio, siendo posible aislar a los dos hongos sólo de gusano cogollero con potencial para biocontrol. Fue evidente una mayor patogenicidad y virulencia de los dos hongos dependiendo de su origen; el aislamiento Bb42 aislado de larvas de S. frugiperda en maíz fue el más virulento, mientras que para E. varivestis lo fue el Bb18 aislado del frijol.
Agradecimientos Los autores agradecen al Instituto Politécnico Nacional (SIP 20070543), el apoyo económico otorgado al Proyecto de Investigación: Búsqueda e identificación de hongos y nematodos entomopatógenos en suelos cultivados con frijol y maíz en Durango.
Literatura citada Altre , J. A.; J. D. Vandenberg . 2001. Penetration of cuticle and proliferation in hemolymph by Paecilomyces fumosoroseus isolates that differ in virulence against lepidopteran larvae. Journal of Invertebrate Pathology 78(2): 81-86. [ Links ] Ashb y, G. 1972. The UFAW Handbook on the care and management of laboratory animals, eds. Worden, A. N. and Lane-Petter, W. The Universities Federation for Animal Welfare, London. 582-587 p. [ Links ] Bedding , R. A.; r. j. Akurst . 1975. A simple technique for the detection of insect parasitic rhabditid nematodes in soil. Nematológica 21:109-116. [ Links ] Behle , R. W., C. Garcia G., P. Tame z G., M. R. McGuire ., M. A. Jackson . 2006. Pathogenicity of blastospores and conidia of Paecilomyces fumosoroseus against larvae of the Mexican bean beetle, Epilachna varivestis Mulsant. Southwestern Entomologist 31(4): 289-295. [ Links ] Beyene , Y., T. Hofsvang ., F. Azerefegne . 2007. Population dynamics of tef Epilachna (Chnootriba similis Thunberg) (Coleoptera: Coccinellidae) in Ethiopia. Crop Protection 26: 1634-1643. [ Links ] Cer yngier , P. 2000. Overwintering of Coccinella septempunctata (Coleoptera: Coccinellidae) at different altitudes in the Karkonosze Mts, SW Poland. European Journal of Entomology 97: 323-328. [ Links ] Fan, Y., W. Fang ., S. Guo ., X. o. Pei .,Y. Zhang ., Y. Xiao ., D. Li., K. Jin ., M. J. Bidochka ., Y. Pei . 2007. Increased insect virulence in Beauveria bassiana strains overexpressing an engineered chitinase. Applied and Environmental Microbiology 73(1): 295-302. [ Links ] García G., C., H. Medrano R., J. Morales C., V. Hernández V. 1999. Toxicological assessment of Beauveria bassiana against Mexican bean beetle (Coleoptera: Coccinellidae). Southwestern Entomologist 24(3): 255-260. [ Links ] Garc ía G. C., P. Tamez G., H. Medrano R., y M. B. González Maldonado . 2006. Mercado de bioinsecticidas en México. En: Cipriano García Gutiérrez e Hiram Medrano Roldán (Eds). Biotecnología Financiera Aplicada a Bioplaguicidas. 17-40 pp. [ Links ] Hatting , j.l., r.a.humber .,t. j.poprawski , r.m.miller .1999. A survey of fungal pathogens from South Africa with special reference to cereal aphid. Biological Control 16:1-12. [ Links ] Humber , R., A. 1998. Entomopathogenic fungal identification. APS/ESAWorkshop. November 7, 1998. APS/ESA Joint Annual Meeting. Las Vegas, NV. 26. [ Links ] Jim éne z J., A. 1992. Patogenicidad de diferentes aislamientos de Beauveria bassiana sobre la broca del café. Cenicafé 43: 84-98. [ Links ] Kaur , G., V. Padmaja . 2008. Evaluation of Beauveria bassiana isolates for virulence against Spodoptera litura (Fab.) (Lepidoptera: Noctuidae) and their characterization by RAPD-PCR. African Journal of Microbiology Research 2: 299-307. [ Links ] Lezama G., R., R. Alatorre R., L. F. Bojalil J., J. Molina O., M. Arenas V., M. Gonzále z R., y O. Rebolledo D. 1996. Virulence of five entomopathogenic fungi (Hyphomycetes) against Spodoptera frugiperda (Lepidoptera: Noctuidae) eggs and neonate larvae. Vedalia (México) 3: 35-40.
Lezama G., R., J. J. Hamm ., J. Molina O., M. López E., A. Pescador R., M. González R.; L. E. Styer . 2000. Occurrence of entomopathogens of Spodoptera frugiperda (Lepidoptera: Noctuidae) in the Mexican states of Michoacán, Colima, Jalisco and Tamaulipas. Florida Entomologist 84(1): 23-28. [ Links ] Lezama G., R., J. Molina O., M. López., A. Pescador ., E. Galindo ., C. A. Ángel y A. C. Michel . 2005. Efecto del hongo entomopatógeno Metarhizium anisopliae sobre el control del gusano cogollero del maíz en campo. Avances de Investigación Agropecuaria (México) 9(1): 1-6. [ Links ] Milner , R. J., R. Huppat z.; B. Swaris B. 1991. A new method for assessment of germination of Metarhizium conidia. Journal of Invertebrate Pathology 57: 121-123. [ Links ] Morales , E.; H. Röchling . 1998. Water-dispensable granule of spores or live Beauveria bassiana. United States Patent. Patent Number 5, 9730, 973. US005730973A. [ Links ] Molina O., J., R. Lezama G., M. González R., M. López E., M. A. Rodríguez V.; A. Palacios F. 2003. Pathogens and parasitic nematodes associated with populations of fall armyworm (Lepidoptera: Noctuidae) larvae in Mexico. Florida Entomologist 86(3):244-253. [ Links ] Polanc zyk, R. A., S. B. Alves . 2005. Interação entre Bacillus thuringiensis e outros entomopatógenos no controle de Spodoptera frugiperda (Coleoptera: Melolonthidae) bajo. Manejo Integrado de Plagas y Agroecología (Costa Rica) 74: 24-33. [ Links ] POLO PC. 1996. A user's guide to Probit or Logit analysis. LeOra Berkeley, CA. SAGARPA. 2009. Anuario estadístico de datos del sitio web: http:// www.oeidrus-durango.gob.mx/ Fecha última revisión: 28 de febrero 2008. Fecha último acceso: [19 de abril 2009]. [ Links ] [ Links ] Samson , R. A., H. C. Evans , and J. P. Latgé. 1988. Atlas of Entomopathogenic Fungi. Springer-Verlag, Berlin, Germany. 187 p. [ Links ] Srisukcha yakul , P., C. Wiwat ., and S. Pantuwatana . 2005. Studies on the pathogenesis of the local isolates of Nomuraea rileyi against Spodoptera litura. Sci enceAsia 31: 273-276. [ Links ] SAS/STAT User's Guide, Release 6.03 Edition, SAS Institute Inc, Cary (1988). 1028. [ Links ] Vanninen , I. 1997. Distribution and occurrence of four entomopathogenic fungi in Finland: effect of geographical location, habitat and soil type. Mycological Research 91:93-101. [ Links ] VERA, F. E. 2008. Insect pathology and fungal endophytes. Journal of Invertebrate Pathology. 98: 277-279. [ Links ]