Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.2 Bogotá July/Dec. 2011
Relación entre Polyphagotarsonemus latus (Acari: Tarsonemidae) y el virus de la mancha anular del papayo (PRSV-p)
Relationship between Polyphagotarsonemus latus (Acari: Tarsonemidae) and the papaya ringspot virus (PRSV-p)
JOSÉ ANGEL ALCANTARA J.1, MA. TERESA SANTILLÁN-GALICIA2, GABRIEL OTERO-COLINA2, ANTONIO MORA A.2, M. ALEJANDRA GUTIÉRREZ E.3 y ELÍAS HERNÁNDEZ C.4 1 Estudiante de Doctorado. Colegio Superior Agropecuario del Estado de Guerrero, Av. Guerrero No. 81, Iguala, Gro. México, C.P. 4000. 2 Profesor Investigador. Ph.D. Instituto de Fitosanidad. Colegio de Postgraduados, Km. 36.5 Carretera México-Texcoco, Montecillo Edo. de México, México, C.P. 56230 teresa.santillan.galicia@gmail.com. Autora para correspondencia. 3 Profesor Investigador. Ph. D. Instituto de Recursos Genéticos y Productividad. Colegio de Postgraduados, Km. 36.5 Carretera México-Texcoco, Montecillo Edo. de México, México, C.P. 56230. 4 Profesor Investigador. Ph. D. Universidad Autónoma de Guerrero, Calle Corregidora No. 55 “a”, Barrio de San Mateo, Gro, México, C.P. 39055. Recibido: 25-oct-2010 - Aceptado: 14-may-2011
Resumen: Polyphagotarsonemus latus es una especie cosmopolita que afecta diferentes cultivos tanto en áreas templadas como tropicales. El principal daño ocasionado por esta especie es la reducción o deformación de hojas jóvenes, brotes, frutos y flores. Cuando P. latus se alimenta de hojas de papayo, éstas presentan clorosis y las hojas se enrollan. En México, el daño causado por este ácaro es conocido como “mano de chango” porque el área de las hojas de papayo se reduce casi hasta las nervaduras. Este daño es similar al causado por el Virus de la mancha anular del papayo (PRSVp). Debido a que P. latus y PRSV-p causan daños similares a las hojas de papayo, el objetivo de esta investigación fue determinar el efecto de P. latus, PRSV-p y su posible interacción en la reducción del área foliar en plantas de papayo. El diagnóstico de PRSV-p se realizó mediante RT-PCR. Los efectos producidos por P. latus fueron similares a los producidos por PRSV-p; sin embargo, éstos pueden diferenciarse por la zona que es atacada. Los daños de los ácaros sólo se encontraron en las hojas más jóvenes, la clorosis siempre comenzaba de la vena central hacia la parte terminal de los foliolos, a diferencia de la producida por el virus que podía presentarse en cualquier parte de la lámina foliar. La altitud y el diámetro de los tallos pueden verse afectados por la infestación de los ácaros, lo cual no sucede con la presencia del virus.
Palabras clave: Papayo. Área foliar. Relación ácaro-virus.
Abstract: Polyphagotarsonemus latus is a cosmopolitan species that affects several crops in tropical and temperate areas. The main damage caused by the infestation of this species is the reduction or deformation of young leaves, buds, fruits and flowers. When P. latus feeds on young papaya leaves, these present chlorosis and down curled distorted areas. In Mexico, the damage caused by this mite is called “monkey´s hand” because the area of the young papaya leaves is reduced leaving only the veins visible. This damage is similar to the symptoms caused by the infection of Papaya ringspot virus-p (PRSV-p). As P. latus and PRSV-p may cause similar damage to papaya leaves, the aim of this investigation was to determine the effect of P. latus, PRSV-p and their possible interaction in the reduction of foliar area. The diagnosis of PRSV-p was done by RT-PCR. The results showed that the effect produced by P. latus and PRSV-p were similar; however, the mites were found only on the younger leaves. As a result, the damage was observed only on these leaves, the chlorosis produced by the mites started in the central vein towards the end of the leaves; on the contrary, the damage of the virus can be found in any part of the leaves. The height and diameter of the stems in the plants were affected only by the infestation of the mites, as no difference was found on plants inoculated with PRSV-p.
Key words: Papayo. Leaf area. Virus-mite relationship.
Introducción El ácaro blanco Polyphagotarsonemus latus (Banks, 1904) (Acari: Tarsonemidae) es una especie de importancia económica por ser polífaga y cosmopolita, ya que puede alimentarse de diversos cultivos como papa (Solanum tuberosum Linneo, 1753), fríjol (Phaseolus vulgaris Linneo, 1753), pimiento (Capsicum annuum Linneo, 1753), pepino (Cucumis sativum Linneo, 1753), berenjena (Solanum melongena Linneo, 1753), calabaza (Cucurbita pepo Linneo, 1753), tomate (Lycopersicom sculentum Linneo, 1753), papaya (Carica papaya Linneo, 1753), melón (Cucumis melo Linnaeus, 1753), maracuyá (Passiflora edulis Linnaeus, 1753), guayaba (Psidium guajava Linnaeus, 1753), mango (Mangifera indica Linnaeus, 1753) y cítricos, entre otros (Cross y Bassett 1982; Gerson 1992; Peña y Bullock 1994; De Coss-Romero y Peña 1998). P. latus se alimenta de las yemas en formación, de hojas o frutos de sus huéspedes (Jeppson et al. 1975). Los daños que ocasiona a la planta se manifiestan por una variedad de síntomas que se le atribuyen a la toxicidad de su saliva (Gerson 1992) y a la susceptibilidad de la variedad de planta de la que se está alimentando (Peña y Bullock 1994). En general, se le encuentra en el envés de las hojas jóvenes, en donde perfora la epidermis de la lámina foliar donde succiona su contenido celular (Jeppson et al. 1975). Se ha sugerido que esta acción da como resultado la formación de manchas descoloridas en las hojas que aumentan conforme aumenta la intensidad de alimentación de la población de P. latus. Así mismo, la lámina foliar comienza a distorsionarse hasta deformarse o sus orillas se enroscan hacia adentro (Cross y Bassett 1982; Gerson 1992; Peña y Bullock 1994; De Coss-Romero y Peña 1998). En infestaciones severas se inhibe el crecimiento del tallo y la producción de frutos (Collier et al. 2004). En México, el cultivo de papayo tiene una gran importancia socioeconómica ya que en los últimos cuatro años ha ido en aumento la superficie cultivada. Durante 2007 se cultivaron 22.451 ha de las que se produjeron 821.540 toneladas de fruta. Como resultado de dicha producción México ocupó el tercer lugar a nivel mundial en producción de papaya y el primer lugar como exportador de dicho producto (37%) (FAO 2007). En papayo, se ha observado que P. latus puede ocasionar una reducción de la lámina foliar casi hasta las nervaduras y deformación de hojas (Aubert et al. 1981; Acuña et al. 2005; Acuña y Agostini 2004; De Coss 2006), síntomas que también se han atribuido a la infección por el Virus de la mancha anular del papayo (PRSV-p), por sus siglas en inglés (Jensen 1949; Téliz et al. 1991; Gonsalves 1998). Este virus, al infectar plantas de papayo, también puede causar aclaramiento de venas en las hojas más nuevas, amarillamiento, manchas aceitosas en hojas, tallos y peciolos y deformación de hojas. En frutos se observan manchas anulares, reducción de tamaño y deformación (Riding 1978; Téliz et al. 1991; Sánchez y Martínez 1976; Kiranmai et al. 1998). De manera general, siempre se menciona a cada uno de estos organismos (P. latus y PSRV-p) como los agentes causales de la deformación de las hojas de papayo, pero no se ha considerado la interacción que puede existir entre ellos. Es importante determinar el agente causal de dicha malformación para poder establecer una estrategia de manejo adecuada, ya que la atribución errónea de cierta sintomatología a un agente causal puede ocasionar mala selección de un método de control y un manejo deficiente. No existen, hasta donde sabemos, estudios que comparen directamente los daños causados por P. latus y PRSV-p. Considerando lo anterior, se realizó la siguiente investigación con el objetivo de determinar el efecto de P. latus, PRSV-p y su posible interacción en la reducción del área foliar en plantas de papayo.
Material y Métodos Todos los experimentos se llevaron a cabo dentro de una cámara de cría con temperatura entre 28 y 30°C, humedad relativa de 60 a 70%, intensidad lumínica de 6300 lux (103 VE M2 1´) y un fotoperiodo de 14 horas luz y 10 horas oscuridad. Los experimentos se realizaron durante 2007 y 2008 en las instalaciones del Colegio de Postgraduados, México. La colonia de P. latus se inició con individuos colectados de una plantación de chile (Capsicum sp) de la comunidad del Papayo, Costa Grande de Guerrero, México. Una vez confirmada la especie mediante claves taxonómicas para la familia Tarsonemidae (Lindquist 1986), se colectaron las hembras adultas y se depositaron en hojas jóvenes de plantas de frijol (var. Jamapa). En cuanto maduraban las hojas de frijol infestadas, se cortaban y se colocaban sobre plantas de frijol jóvenes para que los ácaros se movieran a éstas. La siembra de frijol se realizó en un sustrato esterilizado de Growing Mix y Agrolita (1000:100 g). Las semillas se desinfectaron en una solución de hipoclorito de sodio al 6% durante 15 minutos, posteriormente se secaron y se sembraron en macetas de 1L con el sustrato previamente mencionado. A los siete días de la emergencia de las plantas, se amarraron para evitar que se doblaran durante su manipulación. La siembra de frijol se hizo cada siete días para mantener constante la colonia de ácaros. Las plantas se regaron cada dos días. Se obtuvieron semillas certificadas de papaya variedad Maradol a las cuales se les dio un tratamiento pre-germinativo que consistió en remojarlas durante tres días en agua, renovando ésta cada ocho horas (especificaciones recomendadas por el proveedor). Al tercer día se les aplicó 1g de N-triclorometiltio- 4 ciclohexeno-1,2-dicarboximida (CaptanR 50 PH) para evitar la contaminación por hongos. Posteriormente, las semillas se sembraron en recipientes de germinación, y una semana después de germinadas se trasplantaron individualmente a vasos de unicel de 150 mL usando como sustrato Growing Mix y Agrolita estéril. Las plantas se regaron cada dos días con una solución nutritiva universal (Steiner 1968). Las plantas utilizadas en todos los experimentos estaban en la etapa fenológica de cuatro y cinco pares de hojas verdaderas, alcanzada dos meses después de su germinación. Para la detección de PRSV-p en las plantas usadas en los experimentos, se cortó una hoja de cada planta antes y después de realizar cada experimento. Debido a que este virus es sistémico, se supone que en caso de estar presente está distribuido en toda la planta, por lo que las hojas se seleccionaron de manera aleatoria. Las hojas se mantuvieron a -20°C y posteriormente se analizaron mediante transcripción inversa de la reacción en cadena de la polimerasa (RT-PCR). El ARN total de cada hoja se extrajo con Trizol (Sigma-Aldrich) de acuerdo con las recomendaciones del fabricante. Antes de la reacción de transcripción inversa, se verificó la integridad del ARN de cada muestra mediante un gel desnaturalizante de formaldehido y la concentración de ARN se determinó mediante un Nanodrop 2000 (Thermo Scientific). En la reacción de transcripción inversa se utilizaron 5μg de RNA y 30 pmol/μl del primer oligonucleótido 3΄ (Ruiz- Castro y Silva-Rosales 1997) en un volumen final de 14,5 μL, los cuales se incubaron por 10 min a 70ºC y 2 min a 4ºC. Posteriormente se le agregó una mezcla de dideoxinucleótidos a una concentración de 10 mM más 0,5 μL de la enzima transcriptasa inversa SuperScript II (Invitrogen, United States), 5μL de 5X del “First strand buffer” y 10 mM de DTT (incluida con la SuperScript II). La síntesis de ADN se realizó por 60 min a 42ºC. La reacción de PCR se llevó a cabo al agregar el oligonucleótido 5´ (Ruiz-Castro y Silva-Rosales 1997) a una concentración de 30 pmol, 50mM de MgCl2, 5 unidades de Taq polimerasa (Quiagen, California USA) con un volumen final de reacción de 50μL. Las condiciones de reacción fueron un ciclo inicial de desnaturalización a 94°C durante 5 min, seguidos por 35 ciclos de desnaturalización a 94°C durante 45s, hibridación a 58°C durante 1 min, extensión a 72°C durante 2 min y un ciclo final de extensión a 72°C durante 7 min en un termociclador (BIO-RAD). Los productos finales se tiñeron con bromuro de etidio (10mg/μl), se visualizaron en un gel de agarosa y buffer TAE al 0,8% y finalmente se fotografiaron. En cada etapa de la detección de PRSV-p (transcripción inversa y PCR) se incluyó un testigo positivo, que era una muestra conocida de PRSV-p, y un testigo negativo compuesto por agua destilada estéril libre de RNasas, los cuales sirvieron primero, para confirmar la validez de las reacciones y la presencia o ausencia del virus, y segundo, para confirmar la no existencia de contaminación cruzada. Efecto de Polyphagotarsonemus latus. Se seleccionaron 32 plantas de papayo con cinco y seis pares de hojas verdaderas, las cuales se distribuyeron al azar en cuatro grupos. Antes de iniciar el experimento se midió el diámetro del tallo y la altitud de las plantas, y se tomó una hoja para verificar la ausencia de PRSV-p mediante RT-PCR. Los tratamientos consistieron en inocular diferente número de hembras adultas de P. latus, tal y como se describe a continuación: T1 (10 ácaros), T2 (20 ácaros), T3 (30 ácaros) y T4 (testigo, al cual no se le añadió ningún ácaro); se decidió evaluar este número de ácaros para facilitar su manipulación. Las plantas se revisaron con un microscopio estereoscópico 24 h después de haber inoculado a los ácaros para corroborar su establecimiento y además fueron revisadas semanalmente para verificar el daño causado por los ácaros. Las observaciones continuaron durante nueve semanas, al término de las cuales se midió el ancho del tallo y la altitud de las plantas, se fotografiaron y registraron los cambios que sufrieron durante el desarrollo del experimento; y finalmente, se cortaron todas las hojas, iniciando con la hoja en la que se inocularon los ácaros para medir el área foliar usando el método propuesto por (O´neal et al. 2002). Todas las hojas se digitalizaron con un escáner (HP ScanJet 4990), y posteriormente se procesaron las imágenes usando el software Adobe Photoshop SC3 versión 10,0. Finalmente, el área foliar se obtuvo al convertir los pixeles a centímetros cuadrados mediante el software UTHSCSA Image Tool versión 3,0. La hoja más joven fue almacenada en toallas de papel a -20 °C para corroborar la presencia/ausencia de PRSV-p mediante RT-PCR. El experimento se realizó en un diseño completamente al azar con seis repeticiones por tratamiento y todo el experimento se repitió en dos ocasiones. Los datos de área foliar, ancho del tallo y altitud de planta se analizaron mediante una prueba ANOVA con una estructura de bloques para ocasión y repetición, para determinar primeramente si había diferencia entre el tratamiento T4 (testigo) y la combinación de los tratamientos T1, T2 y T3; finalmente se determinó si había diferencias entre los tratamientos T1, T2 y T3 (inoculados con ácaros). Todos los análisis se realizaron con el paquete estadístico GenStat (v8.2) (Payne et al. 2005). Efecto de PRSV-p y su interacción con Polyphagotarsonemus latus. Antes de iniciar el experimento se hizo un diagnóstico de las plantas utilizadas para confirmar la ausencia de PRSV-p; así mismo se midieron el diámetro del tallo y la altitud de las plantas. Se evaluaron cinco tratamientos: T1, plantas inoculadas con PRSV-p; T2, plantas infestadas con 30 hembras adultas de P. latus, cantidad con la cual observamos que los daños producidos por los ácaros fueron claramente visibles; T3, plantas inoculadas con agua destilada; T4, plantas inoculadas con PRSV-p más 30 hembras de P. latus y T5, plantas testigo sin hembras de P. latus ni PRSV-p. Los tratamientos T1 y T3 se inocularon mediante el raspado con un hisopo, previamente esterilizado en una autoclave, humedecido con una suspensión de PRSV-p en agua destilada estéril. El raspado se hizo sobre la lámina de una hoja preseleccionada proveniente de la parte media de la planta, hasta que ésta quedó translúcida (Ruiz-Castro y Silva-Rosales 1997). El inóculo de PRSV-p se obtuvo a partir de 1 g de hojas de plantas infectadas con PRSV-p, las cuales se molieron con 3 mL de agua destilada estéril (Silva-Rosales, comunicación personal). Las plantas se revisaron semanalmente para verificar el daño causado por los ácaros y PRSV-p. Las observaciones continuaron durante nueve semanas. Al término de este periodo, se midió el diámetro del tallo y la altitud de plantas, se fotografiaron y registraron los cambios que éstas sufrieron durante el desarrollo experimental, y finalmente se colectaron todas las hojas, progresivamente hacia arriba, a partir de la hoja en la que se inocularon los ácaros o el virus. Siguiendo el método descrito en el experimento anterior, se determinó el área de todas las hojas colectadas. Las plantas que se consideraron positivas a PRSV-p fueron aquellas que presentaron los síntomas del virus (aclaramiento de las venas y manchas aceitosas en las hojas) y que además fueron positivas para el virus mediante la técnica de RT-PCR. Las variables estudiadas y el procedimiento para su obtención fueron los mismos empleados y descritos anteriormente. El experimento se realizó en un diseño completamente al azar con cinco repeticiones por tratamiento. Los datos de área foliar, ancho del tallo y altitud de planta se analizaron mediante una prueba ANOVA para diseños desbalanceados. Para analizar las diferencias de área foliar entre los tratamientos, estos fueron particionados en cuatro contrastes ortogonales. Primero se comparó el tratamiento T5 (testigo) y la combinación de los tratamientos T1, T2, T3 y T4; segundo, se comparó el tratamiento T3 con la combinación de los tratamientos T4, T2, y T1; tercero, se comparó el tratamiento T4 con la combinación de los tratamientos T2 y T1, y finalmente se compararon los tratamientos T2 y T1. Todos los análisis se realizaron con el paquete estadístico GenStat (v 8,2) (Payne et al. 2005).
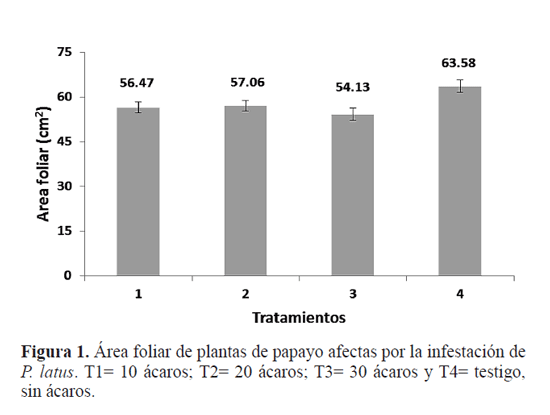
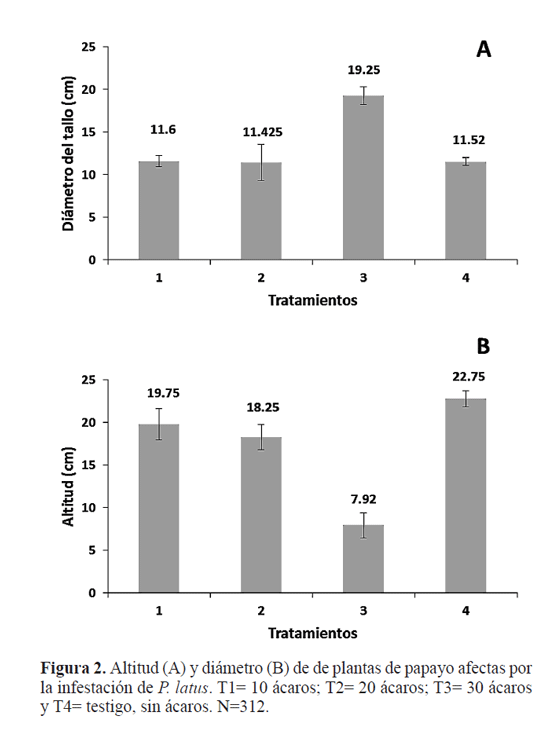
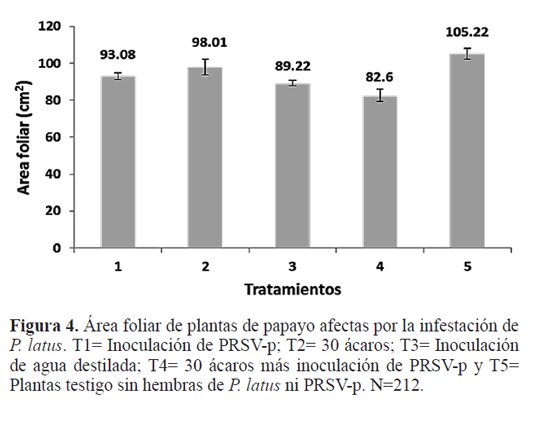
Resultados Efecto de Polyphagotarsonemus latus. Se encontraron diferencias significativas entre el T4 (testigo) con respecto a los otros tratamientos combinados en donde se inocularon ácaros (T1, T2 y T3) (F1, 309 = 15,42; P=<0,001) (Fig. 1) pero no hubo diferencias significativas en el área foliar de plantas entre los tratamientos T1, T2 y T3 (F2,309=1,57; P=0,210) (Fig. 1). Con respecto al diámetro de tallo y la altitud de las plantas, al realizar el análisis antes de iniciar la primera repetición del experimento no hubo diferencias significativas de estas dos variables en las plantas usadas entre los tratamientos (F3,26 = 1,36, P=0,277; F4,26 = 1,19, P=0,332, respectivamente). Al final del experimento se encontraron diferencias significativas en la variable altitud entre los tratamientos (F3, 26 = 19,84; P<0,001). La mayor altitud se obtuvo en el tratamiento T4 y la menor con el tratamiento T3 (Fig. 2A). Igualmente se encontraron diferencias significativas en el diámetro del tallo (F3,26 = 7,95; P=<0,001), e l cual fue mayor con el tratamiento T3 (30 ácaros), y el menor con el tratamiento T2 (20 ácaros) (Fig. 2B). Los síntomas ocasionados por la alimentación de P. latus comenzaron con una pequeña decoloración de la lámina foliar en el centro de la hoja (Fig. 3A), la cual posteriormente se extendió conforme aumentó la población del ácaro (Fig. 3B). Al extenderse esa decoloración, también comenzó a cambiar el patrón de venación de la hoja (Fig. 3C y D). Estos síntomas fueron más evidentes en el tratamiento T3 (30 ácaros por planta). El análisis de PCR mostró que el virus no estuvo presente en ninguna de las plantas experimentales, lo cual confirma que la sintomatología cuantificada y observada es atribuible únicamente al efecto de la alimentación de los ácaros. Efecto de PRSV-p y su interacción con Polyphagotarsonemus latus. Se presentó una diferencia significativa entre el tratamiento T5 y la combinación de los tratamientos T1, T2, T3 y T4 (F1,209= 26,07, P=<0,001). La mayor área foliar se observó en el tratamiento T5 (testigo absoluto) (110,16 cm2) comparado con los otros tratamientos (Fig. 4). No hubo diferencias significativas entre el tratamiento T3 y la combinación de los tratamientos T4, T2, y T1 (F1,209= 0,44, P=0,508). Se encontraron diferencias significativas al comparar el tratamiento T4 con la combinación de los tratamientos T2 y T1 (F1,209= 12,45, P<0,001), donde la mayor reducción en área foliar se registró en el tratamiento T4 (inoculación de PRSVp más virus) comparado con los tratamientos que contenían al ácaro (T2) y al virus (T1) por separado (Fig. 4). Finalmente, no se encontraron diferencias significativas entre los tratamientos T1y T2 (F1,209= 1,51, P=0,220), lo que señala un efecto similar en la reducción de área foliar ocasionado por el virus y el ácaro respectivamente (Fig. 4). Con respecto al diámetro de tallo y la altitud de las plantas, antes de iniciar el experimento no hubo diferencias significativas entre las plantas usadas en todos los tratamientos (F4,16 = 0.53, P=0.719; F4,16 = 0.54, P=0.711, respectivamente). Tampoco hubo diferencias significativas en estas variables entre los tratamientos al término del experimento (F4,16 = 0.60, P=0.667; F4,16 = 1.32, P=0.306). Los síntomas observados en los tratamientos con virus, ácaros, y virus más ácaros fueron similares a los anteriormente descritos; venación más aparente, reducción del área foliar y decoloración de la lámina foliar en el centro de la hoja (Fig. 5). Las deformaciones de la lámina foliar fueron más evidentes en el tratamiento en donde se inocularon 30 ácaros (Fig. 6). Con el análisis de PCR realizado en todas las plantas de papayo antes del establecimiento del experimento, se pudo confirmar que el virus no estuvo presente en ninguna de las plantas experimentales. Posteriormente, al aplicar el mismo análisis a todas las plantas al término del experimento, se encontró que el virus no estuvo presente en los tratamientos T2 (30 ácaros por planta), T3 (agua destilada) y T5 (testigo absoluto). El mismo análisis realizado en las plantas de los tratamientos T1 (inoculado con PRSV-p) y T4 (inoculado con ácaros y PRSV-p) mostró que PRSV-p no fue detectado en todas las plantas inoculadas con virus o virus más ácaros, por lo que únicamente las plantas que fueron positivas al virus se consideraron para el análisis estadístico.
Discusión En general, los resultados del primer experimento muestran que hubo una reducción en el área foliar de las plantas inoculadas con ácaros comparados con el testigo, lo cual está de acuerdo con lo reportado por otros autores (De Coss-Romero y Peña 1998; De Coss 2006), pero no se encontró una relación directa en el grado de reducción foliar y la densidad inicial de ácaros inoculados, puesto que no se observaron diferencias significativas entre ellos. Es probable que las densidades de ácaros evaluadas no fueron suficientes para tener un efecto significativo, y pudo haber sido enmascarado por diferencias en incrementos poblacionales de cada grupo de hembras inoculadas en las diferentes plantas, ya que a pesar de haberse confirmado el establecimiento de cada grupo de ácaros en cada planta, no se tuvo control sobre el incremento de la población. A pesar de observar una reducción del área foliar ésta no tuvo la magnitud que describen Aubert et al. (1981) y De Coss (2006). Esta diferencia puede deberse a la cantidad de ácaros inoculados, ya que los investigadores citados experimentaron con un mayor número de ácaros por planta. El análisis de PCR realizado en todas las plantas de este experimento, antes y después del mismo, confirma que el efecto encontrado fue atribuible al ácaro y no al virus. En el segundo experimento, la máxima reducción foliar se encontró en el tratamiento T4 (ácaros más PRSV-p), y la menor reducción foliar en el tratamiento T5 (testigo absoluto), pero hubo un efecto intermedio y similar entre ellos en los tratamientos T1, T2 y T3, lo que sugiere un efecto similar por el ácaro y el virus al ser evaluados de manera independiente. Es probable que este efecto pueda ser diferente al modificar las concentraciones de virus o el número de ácaros inoculados, pero esto deberá ser confirmado en futuros experimentos. El efecto del raspado de las plantas con un hisopo con agua destilada, realizado para la inoculación del virus en los tratamientos T1 y T4, no tuvo un efecto adicional en la reducción del área foliar. Al evaluar la altitud de las plantas y el diámetro del tallo se observó, al menos en el primer experimento (efecto de Polyphagotarsonemus latus), que P. latus pudiera tener influencia en la disminución de la altitud y el grosor del tallo, ya que las plantas testigo crecieron mucho más en comparación con aquellas en donde se inocularon 30 hembras; sin embargo, el diámetro del tallo fue más grande en este último tratamiento. Daños similares han sido observados en otros trabajos en donde P. latus fue inoculado en plantas de papa (Peña y Bullock 1994), en chile (Capsicum spp.) (De Coss-Romero y Peña 1998) y en papayo (De Coss 2006). Estos parámetros, sin embargo, parecieran depender del tipo de cultivo u hospedante del que se alimente el ácaro. En cuanto a los daños visuales cualitativos en ambos experimentos, es evidente que aquellos ocasionados por los ácaros son muy similares a los producidos por PRSV-p, tales como la venación más clara, decoloración de la lámina foliar y reducción del área foliar (Vegas et al. 1985; Téliz et al. 1991; Gonsalves et al. 2008; Tripathi et al. 2008). Sin embargo, hay diferencias que permiten en cierto grado determinar si el daño es producido por P. latus o por PRSV-p. Por ejemplo, la decoloración de la lámina foliar producida por la infestación de P. latus siempre comenzó en la vena central entre la unión del peciolo y el área foliar o limbo, a diferencia de la decoloración producida por PRSV-p, la cual se presentaba en cualquier parte de la lámina foliar, con mayor frecuencia en la parte terminal de los foliolos. En nuestros experimentos también observamos que las plantas infectadas con PRSV-p no se volvían a recuperar, las hojas nuevas aparecían cada vez más pequeñas y deformadas. En cambio en las plantas infestadas con P. latus, las hojas nuevas podían recuperarse si la población del ácaro desaparecía. Otro diferencia de los daños producidos por PRSV-p es la producción de manchas aceitosas en las hojas y en los tallos (Téliz et al. 1991; Tripathi et al. 2008), lo cual no fue producido por la infestación de P. latus. Éste es el primer reporte del efecto combinado de P. latus y PRSV-p en plantas de papayo. Así mismo, se recomienda la inclusión de la detección molecular en tiempo real para poder identificar la presencia del virus de una manera más segura, y cuantificar su concentración para poder definir concentraciones bajo las cuales su infección producirá efectos visibles y cuantificables, así como considerar diferentes tiempos de incubación. En conclusión, tanto P. latus como PRSV-p pueden ocasionar reducción de la lámina foliar de plantas de papayo. Este efecto se incrementa cuando ambos organismos son inoculados de manera simultánea.
Agradecimientos Este trabajo fue realizado con el financiamiento del colegio de Postgraduados con el “Financiamiento a proyectos de investigación y desarrollo tecnológico 2008”. Se agradece a la Dra. L. Silva del CINVESTAV Irapuato, México por proporcionarnos plantas infectadas con PRSV-p. Así mismo se le agradece a la Dra. M. De Coss por sus atinadas sugerencias para mantener la cría de P. latus.
Literatura citada ACUÑA, L. E.; AGOSTINI, J. P. 2004. Búsqueda del agente causal de los síntomas del mosaico del mamon Carica papaya L. Citrusmisiones 29:17-20. [ Links ] ACUÑA, L. E.; AGOSTINI, J. P.; HABERLE, T. H. 2005. Control químico del ácaro blanco Polyphagotarsonemus latus Banks. del mamón Carica papaya L. Citrusmisiones 30:10-20. [ Links ] AUBERT, B.; LOSSOIS, P.; MARCHAL, J.; RABAUD, J.; BOISVILLIERS, P. 1981. Mise en evidence des dégats causes par Polyphagotarsonemus latus (Banks) sur papayer á I' íle de la Reunión. Fruits 36 (1): 9-24. [ Links ] COLLIER, K. F. S.; DE LIMA, J. O. G.; ALBUQUERQUE, G. S. 2004. Predacious mites in papaya (Carica papaya L.) orchards: in search of a biological control agent of phytophagous mite pests. Neotropical Entomology 33(6):799-803. [ Links ] CROSS, J. V.; BASSETT, P. 1982. Damage to tomato and aubergine by broad mite, Polyphagotarsonemus latus (Banks). Plant Pathology 31: 391-393. [ Links ] DE COSS, F. M. E. 2006. Bioecología y Herbivoría del Ácaro Polyphagotarsonemus latus (Banks) en Carica papaya L. Tesis de Doctorado. Universidad Autónoma de Chiapas. 18 p. [ Links ] DE COSS-ROMERO, M.; PEÑA, J. E. 1998. Relationship of broad mite (Acari: Tarsonemidae) to host phenology and injury levels in Capsicum annuum. Florida Entomologist 81:515-526. [ Links ] FAO, 2007. Crop Protection Compedium Disponible en: http://www.cabi.org/compendia/cpc/ (Fecha de revisión: 12 noviembre 2010). [ Links ] GERSON, U. 1992. Biology and control of the broad mite, Polyphagotarsonemus latus (Banks) (Acari: Tarsonemidae). Experimental and Applied Acarology 13:163-178. [ Links ] GONSALVES, D. 1998. Control of papaya ringspot virus in papaya: a case study. Annual Review of Phytopathology 36:415-37. [ Links ] GONSALVES, D.; SUZUKI, J. Y.; TRIPATHI, S.; FERREIRA, S. 2008. Papaya ringspot virus (Potyviridae). p. 1-8. En: B. Mahy; M. Van Regenmortel (eds.). Encyclopedia of Virology. Elsevier. Oxford. UK. [ Links ] JENSEN, D. D. 1949. Papaya virus diseases with especial reference to papaya ringspot. Phytopathology 39: 191-211. [ Links ] JEPPSON, L. R.; KEIFER, H. H.; BAKER, E. W. 1975. Mites injurious to economic plants. University of California Press. Berkeley. USA. 614 p. [ Links ] KlRANMAI, G.; HEMA, M.; SREENIV, P. 1998. Identification of a virus causing leaf distortion disease of papaya in Andhra Pradesh as cucumber mosaic cucumovirus. Indian Phytopathology 51 (2): 130-135. [ Links ] LINDQUIST, E. E. 1986. The world genera of Tarsonemidae (Acari: Heterostigmata): a morphological, phylogenetic, and systematic revision, with a reclassification of family-group taxa in the Heterostigmata. Memoirs of the Entomological Society of Canada 136: 1-517. [ Links ] O´NEAL, E. M.; LANDIS, A. D.; ISAACS, R. 2002. An inexpensive, accurate method for measuring leaf area and defoliation through digital image analysis. Journal of Economic Entomology 95(6): 1190-1194. [ Links ] PAYNE, R. W.; MURRAY, D. A.; HARDING, S. A.; BAIRD, D. B.; SOUTAR, D. M. 2005. GenStat for Windows (8th Edition) Introduction. VSN International, Hemel Hempstead. UK. [ Links ] PEÑA, J. E.; BULLOCK, R. C. 1994. Effects of feeding of broad mite (Acari: Tarsonemidae) on vegetative plant growth. Florida Entomologist 77 (1): 180-184. [ Links ] RIDINGS, W. H.; ZETTLER, F. W.; CONOVER, R. A. 1978. Distortion ringspot of papaya. Fla. Depto. Agric. Cons. Serv. Div. Plant Ind. Gainesville, Plant Pathology Circular No. 184. [ Links ] RUIZ-CASTRO, S.; SILVA-ROSALES, L. 1997. Use of RT-PCR for papaya ringspotyvirus detection in papaya (Carica papaya) plants from Veracruz, Tabasco y Chiapas. Revista Mexicana de Fitopatologia 15(2): 86-90. [ Links ] SÁNCHEZ, D. L. C.; MARTÍNEZ, L. G. 1976. Algunas observaciones sobre el virus de la mancha anular de la papaya en Colombia. Noticias Fitopatológicas 5(2): 62-73. [ Links ] STEINER, A. A. 1968. A universal method for preparing nutrient solutions of a certain desired composition. Plant Soil 15:134- 154. [ Links ] TÉLIZ, O. D.; MORA, A. A.; NIETO, A. D.; GONSALVES, D.; GARCÍA E.; MATHEIS, L.; AVILA, C. 1991. La mancha anular del papayo en México. Revista Mexicana de Fitopatología 9: 64-68. [ Links ] TRIPATHI, S; SUZUKI, J. Y.; FERREIRA, S. A.; GONCALVES, D. 2008. Papaya ringspot virus-P: characteristic, pathogenicity, sequence variability and control. Molecular Plant Pathology 9 (3): 269-280. [ Links ] VEGAS, A. G.; CERMELI, M.; TRUJILLO, G. 1985. Áfidos relacionados con el virus de la mancha anillada de la lechosa en Venezuela. Presencia, transmisión y eficiencia. Agronomía Tropical 35 (1-3): 21:31.