Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.37 no.2 Bogotá July/Dec. 2011
Sección Médica
Evaluación del perfl neurofarmacológico del aceite de Ulumoides dermestoides (Coleoptera: Tenebrionidae)
Evaluation of neuropharmacological profle of oil from Ulumoides dermestoides (Coleoptera: Tenebrionidae)
Flor Ángela Tobón1, Gloria Patricia Gutiérrez Z.2 y Marta Liliana Mejía G.3
1 M. Sc. Facultad Química Farmacéutica. Grupo UNIPLURI/VERSIDAD, Universidad de Antioquia, Medellín, Colombia. Carrera 74 No.40-27, edificio Samarkanda, apto 603. Medellín, Colombia. Telefax 2503975, tel. 2198462. fatobon@farmacia.udea.edu.co, jvm@une.net.co. Autora para correspondencia.
2 integrante del grupo uniPLuri/VErSiDAD-giTT, universidad de Antioquia, Medellín, Colombia. Especialista en gerencia de Proyectos. Correo electrónico: patri0411@hotmail.com, teléfono 2195783, 4118329.
3 grupo uniPLuri/VErSiDAD-giTT, universidad de Antioquia, Medellín, Colombia. Correo electrónico: marlig74@gmail.com, teléfono 2195783.
Recibido: 21-ene-2011 - Aceptado: 8-nov-2011
Resumen: Este estudio investiga el perfl neurofarmacológico del aceite extraído del Ulumoides dermestoides in-vivo para establecer su efecto sobre el sistema nervioso central. La técnica empleada en el diseño experimental fue bloques completamente aleatorizados de cuatro tratamientos: Sustancia control (solución salina), Sustancia problema (aceite de U. dermestoides), Sustancia patrón estimulante (Anfetamina) y Sustancia patrón depresora (Diazepam y Difenhidramina), utilizando ratones albinos (Mus musculus), cepa suizo iCr. Los resultados muestran que el aceite (3mg/Kg, vo) tiene un efecto depresor en el SNC de esta especie e indican diferencia significativa entre tratamientos. Dicho efecto depresor es dosis-dependiente a través del tiempo.
Palabras clave: Aceite. Depresión. Sistema nervioso Central.
Abstract: The neuropharmacological profle of extracted oil from Ulumoides dermestoides in vivo to establish its effect on the central nervous system was studied. The method used was random blocks of four treatments: Control Substance (saline solution), Problem Substance (oil from U. dermestoides), Stimulant Pattern substance (Amphetamine) and Depressive Pattern Substance (Diazepam and Diphenhydramine) by using Swiss iCr strain albino mice (Mus musculus). The results show that the oil (3mg/kg, ov) has a CnS depressing effect on this specie and indicate some significant difference between treatments. The comparative analysis of obtained data concerning the CNS depressing effect of the oil compared with the other treatments used, points out this depressing effect is dose-dependent over time.
Key words: oil. Depression. Central nervous System.
Introducción
El coleóptero Ulumoides dermestoides (Fairmaire, 1893), es un insecto de la familia Tenebronidae, originario de la China que fue introducido en Colombia desde hace varias décadas como remedio natural antiasmático. El uso de este insecto como remedio por parte de personas del común despertó el interés de entomólogos biólogos y profesionales de la salud. U. dermestoides se reproduce adecuadamente en los granos de maní (Arachis hypogaea L.), maíz (Zea mays L.), arroz (Oriza sativa L.), sorgo (Sorghum bicolor L.), frijol mungo (Vigna radiata) y soya (Glycine max (L.) Merill), (Londoño 1992). Según referencia popular en la China y Malasia, las heces de este insecto se utilizan para curar indigestiones, afecciones cardíacas, mialgias, enfermedades renales y asma. Además, se utiliza en el tratamiento de una variedad de infecciones y se ingiere vivo como afrodisíaco (Chua y Chandrepal 1978; Chu et al. 1997).
Las medicinas alternativas de origen chino utilizan generalmente mezcla de principios activos –PA– y la mayoría de ellos son responsables de la actividad farmacológica y usos clínicos, pero no están bien definidos. El grado de evidencia clínica para apoyar estas medicinas como terapéuticas no reúne los estándares internacionales de fármacos nuevos aceptados para tratamientos clínicos. Algunos estudios preclínicos y clínicos realizados en China se publican en la literatura de ese país, pero los resultados no son de fácil acceso para las comunidades occidentales. Las medicinas de origen natural constituyen una perspectiva de la investigación de la biodiversidad, como un beneficio sostenible enorme, es además fuente de oportunidades de empresa; razones culturales y económicas, entre otras, la convierten en una alternativa terapéutica que presenta bioactividad con potencialmente menos eventos indeseados que alteren organismos y el ambiente, comparados con los medicamentos sintéticos tradicionales (Largo 1987; gutiérrez 2002; Li et al. 2003). Desde esta perspectiva, este artículo presenta la valoración del perfl neurofarmacológico del aceite obtenido de U. dermestoides, partiendo de un estudio de casos, en el cual se consultaron algunas personas del común que recibían tratamiento en el departamento de neumología del Hospital San Vicente de Paúl de la ciudad de Medellín (Colombia) y que además tomaban infusión de este coleóptero vivo, en leche o en agua de panela caliente, para aliviar los síntomas en crisis asmáticas. Las personas consultadas expresaron que dicha infusión les mejoraba los síntomas agudos de asma y notaban una mayor recuperación. Estos resultados plantean la posibilidad de que el aceite extraído del coleóptero, obtenido en condiciones de estrés a una temperatura entre 35-45°C /10min, tenga bioactividad farmacológica broncodilatadora o antiinfamatoria. Esta acción broncodilatadora puede ser debido indirectamente a que el maní contiene ácidos grasos poliinsaturados de dos familias:1) la familia ω-3 como el ácido linolénico (C18:3, ω-3), compuestos de cadena más larga como los ácidos eicosapentenoico –EPA– (C20:5), docosapentenoico –DPA– (C22:5, ω-3) y docosahexenoico (C22:6, ω-3). 2) la familia ω-6 como el ácido araquidónico (C20:4, ω-6). Estos PA intervienen en la reducción de los niveles de colesterol y triglicéridos, y en el aumento de las lipoproteínas de alta densidad (HDL) en el plasma; que pueden ser utilizados por el organismo como un factor protector en la prevención del riesgo de enfermedades cardiovasculares y enfermedades infamatorias en vías respiratorias y articulaciones porque tienen acción antioxidante (Tobón et al. 2002). En Colombia es una necesidad la búsqueda de sustancias de origen natural que tengan mayor probabilidad de presentar pocos efectos adversos para las personas y menor impacto negativo al medio (Echeverri y Quiñones 1997; Smith 2002; Li et al. 2003).Por las razones anteriores, el propósito de investigación fue iniciar un tamizaje farmacológico de dicho aceite utilizado por la comunidad, empezando por establecer su efecto depresor o estimulante en el SnC, el cual es uno de los sistemas vitales del organismo.
Materiales y Métodos
Esta investigación se desarrolló en la universidad de Antioquia, en el Laboratorio de Farmacología de la Facultad de Química Farmacéutica. Las pruebas biológicas se realizaron de conformidad con las normas colombianas para el uso e investigación en animales vivos (Ley 84, 1989; resolución 8430, 1993), teniendo en cuenta los principios técnico-científicos y éticos del manejo y el respeto al animal como sujeto experimental, desde las tres R de Russell y Burch (Reemplazo, Reducción y Refinamiento), para proporcionar al animal bienestar mientras viva, minimizando las molestias que pueda originarle el estudio; como también garantizar que los resultados de la investigación sean confables (Tobón 1998; Mrad 2006; Cardoso et al. 2007; Concepción et al. 2007). El proceso metodológico se hizo en dos fases:
Cultivo del pie de cría de U. dermestoides. Los especímenes adultos de este coleóptero, se obtuvieron de un pie de cría reproducido en maní, en el laboratorio de Entomología Médica de la Facultad de Medicina, universidad de Antioquia, Medellín, Colombia. De dicho pié de cría se extrae el aceite que se utiliza en las pruebas neurofarmacológicas (Londoño 1992).
Ambientación del animal de experimentación. Se utilizaron 36 ratones albinos, cepa suizo iCr, adquiridos en el bioterio de la facultad de Medicina de la universidad de Antioquia, y éstos se distribuyeron en seis grupos homogéneos de cuatro ratones, con las siguientes características: machos con peso entre 18 y 21g y 50 días de edad. La edad de los animales de experimentación garantiza la madurez del SNC para que el efecto por el aceite no sea alterado debido a la no maduración del cerebro. Las condiciones ambientales se ajustaron a una temperatura aproximada entre 22 y 25°C; períodos de luz y oscuridad de 12 horas c/u; humedad relativa entre 65 y 70%; como material de cama se utilizó viruta de madera libre de elementos extraños. Los ratones se alimentaron con concentrado de soya, teniendo en cuenta los requerimientos nutricionales y con agua acidulada ad líbitum (Tobón 1998; Mrad 2006; Cardoso et al. 2007; Concepción et al.2007).
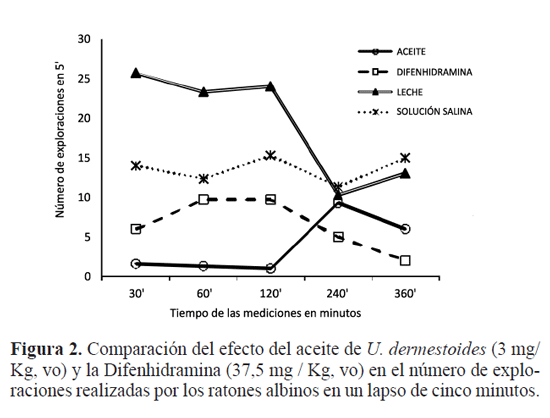
Evaluación del perfl neurofarmacológico del aceite de U. dermestoides
1. Test de Irwin preliminar. Es una prueba preliminar que consiste en hacer un estudio cualitativo observacional con enfoque hermenéutico, para identificar efecto depresor o estimulante del aceite de U. dermestoides (0,60mg/Kg, vo) en el SnC de ratones albinos. La prueba se realizó por medio de la observación del comportamiento general del animal de experimentación comparado con el efecto del patrón estimulante Anfetamina (25mg/Kg, ip), del patrón depresor Diazepam (25 mg/Kg, ip) y del efecto del control solución salina (0,9%, ip).
2. Test de Irwin prueba de validación. Confrma el efecto depresor que se presenta en la prueba preliminar con el aceite de U. dermestoides (3mg/Kg, vo). Este efecto depresor se comparó con el patrón Difenhidramina (37,50mg/Kg, vo) de menor potencia depresora que el Diazepam, con leche (62,5 mg/Kg, vo) vehículo del aceite y el control solución salina (0,9%, vo).
3. Pruebas neurofarmacológicas específicas de validación: Se realizaron cuatro experimentos: Memoria, Aprendizaje y Discriminación; Actividad Motriz Exploratoria; Actividad Motriz Espontánea y Neurosis Experimental. Estos experimentos se llevaron a cabo en un acercamiento a las investigaciones de Turner (1965) y Lipman (1978).
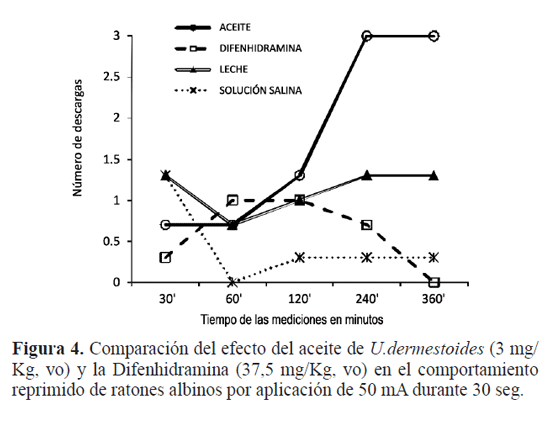
Los ensayos de los tests de Irwin, preliminar y confirmatorio, son una prueba cualitativa de observación mediante la cual se estima con destreza y cuidado el efecto de los tratamientos en el comportamiento general del animal. Los ensayos se dividieron en tres categorías básicas: la observación del comportamiento, los efectos neurológicos y los efectos sobre el sistema nervioso autónomo del aceite, comparado con el efecto de los otros tres tratamientos. La evaluación del efecto depresor o estimulante, se realizó partiendo del criterio farmacológico del Todo o nada, es decir: prueba positiva (si afecta el estado de alerta, el estado de ánimo, la postura corporal, la actividad motora, el tono muscular y los refejos; si produce excitación del SNC incoordinación motora; aumenta o disminuye la micción y la defecación), o prueba negativa (no afecta el comportamiento, no tiene efectos neurológicos ni efectos sobre el sistema nervioso autónomo). La prueba positiva, se interpreta como aquel efecto preestablecido que se manifesta en términos de: presencia del efecto (+), efecto aumentado (++) o ausencia del efecto (-). Al administrar el aceite de U. dermestoides (3mg/Kg, vo),comparándolo con el patrón Difenhidramina (37,50mg/ Kg, vo); leche (62,5mg/Kg, vo) vehículo del aceite y el control solución salina (0,9%, vo). El efecto se valora mediante una escala de valores entre 0 y 8, bajo los siguientes criterios: respuesta normal (4), estimulación (5-8), depresión (3-1) y ausencia de respuesta (0), siguiendo los criterios experimentales y del efecto farmacológico (Tobón 1998; rang et al. 2004). Actividad Motriz Exploratoria: en este ensayo evalúa la actividad locomotora mediante el registro del número de exploraciones realizadas por el animal (introducción de la cabeza en los agujeros hasta, por lo menos, el nivel de las orejas) en un dispositivo con el suelo agujereado, durante 5min (nakama 1972; Meneses et al. 1990; Ariza et al. 2007). Actividad Motriz Espontánea: La prueba determina la longitud (cm) de los movimientos del ratón en su desplazamiento habitual durante dos min (F=1,19; gl=4; p≤ 0,05), utilizando un actógrafo con unos sensores en el piso del dispositivo, el cual registra y mide la longitud del desplazamiento de los animales (nakama 1972; Meneses et al. 1990). El análisis estadístico de los datos de este ensayo permite rechazar la hipótesis Ho, el análisis define que existe diferencia en el efecto depresor sobre el SnC producido por los cuatro tratamientos. La fgura 3 muestra que el aceite de U. dermestoides (3mg/ Kg, vo), causa un efecto depresor en esta función del SnC de los ratones, semejante al efecto producido por el patrón depresor, la Difenhidramina (37,50mg/Kg, vo). Neurosis experimental. Este ensayo mide el grado de ansiedad de los animales; para lo cual se priva de agua durante 48 horas a los biomodelos experimentales antes del ensayo, con el fin de generarles ansiedad. La prueba evalúa la respuesta del comportamiento reprimido mediante electrodos conectados al tetero del animal y se precisa el promedio de descarga eléctrica de 50 miliamperios durante 30 segundos que soportaba el animal (F=3,24; gl=4; p≤0,05). Para esta prueba, se tuvo en cuenta que la corriente eléctrica aplicada al animal, alcanzará el umbral de respuesta, sin causarle excesivo temor. Si bien causa cierto malestar al animal, esta descarga eléctrica es mínima y la molestia es leve; por lo que este tratamiento se justifica por los posibles beneficios que esta investigación puede aportar en la construcción del conocimiento en este campo, una necesidad poco explorada en Colombia. Criterios de experimentación. La dosificación de los tratamientos se determinó de acuerdo al peso del animal. La administración por vía oral a los ratones albinos iCr, se hizo mediante una sonda metálica, teniendo en cuenta no ocasionarles malestar. El aceite de U. dermestoides se incorporó en leche hasta que se disolviera, a una temperatura aproximada a la temperatura corporal del ratón de 36,9 a 37,9ºC; semejante a la forma como utilizan el U. dermestoides las personas del común, para tratar los síntomas del asma en la cotidianidad. Los ensayos específicos evaluaron el efecto depresor del aceite de U. dermestoides (3mg/Kg, vo), comparándolo con el patrón Difenhidramina (37,50mg/Kg, vo); leche (62,5mg/ Kg, vo) vehículo del aceite y el control solución salina (0,9%, vo). La evaluación se realizó por triplicado a los 30, 60, 120, 240 y 360 minutos, entre las 6H y las 14H, teniendo en cuenta el tiempo de vida media de eliminación (t1/2) de los medicamentos utilizados (rang et al. 2004; Alcaraz 2005). Se empleó el diseño de bloques completamente aleatorizados en cada una de las pruebas neurofarmacológicas para confrmar el efecto depresor del aceite del coleóptero en el SNC de ratones albinos ICR. El nivel de significancia fue de 0,05 en la prueba de análisis de varianza simple (AnoVA), seguido de un análisis de comparaciones múltiples (Tukey) (Wayne 1995; Díaz 1999). Se utilizaron los programas Excel® y SPSS® para el procesamiento de los datos.
Resultados y Discusión La evaluación preliminar del efecto del aceite en la conducta y en el sistema autónomo de los ratones albinos, mediante el Test de irwin, se realizó en términos de la discriminación de presencia del efecto neurofarmacológico depresor o estimulante (+) y aumento del efecto (++). Los efectos más relevantes que presentaron los animales en esta prueba preliminar fueron somnolencia y pasividad (++); mientras que la relajación y la autoacicalación se presentan (+) a través del tiempo del experimento; comparándolo con el efecto depresor del patrón Diazepam y el efecto estimulante de la Anfetamina en el SNC. Estos hallazgos preliminares dan lugar a afrmar que el aceite de U. dermestoides (3mg/Kg, vo) tiene un efecto depresor moderado en el SnC en una relación directa y dependiente de la dosificación; el cual después de media hora de administrado comenzaba a disminuir y los animales recuperaron su comportamiento normal a las seis horas de iniciado el ensayo (Tabla 1). El efecto neurofarmacológico más notorio causado por aceite de U. dermestoides (3mg/Kg, vo) fue la depresión, demostrada como pasividad. Este efecto depresor se confrma mediante otro Test de irwin, comparando dicho efecto con el patrón depresor del SnC Difenhidramina (37,50mg/Kg, vo), cuya prueba muestra disminución de la alerta y de la reactividad, además de la presencia y el aumento de la pasividad a través del tiempo del experimento (Tabla 2). Las dos pruebas del Test de irwin sugieren que el aceite de U. dermestoides produce un efecto depresor leve sobre el SNC de los ratones albinos, el cual desaparece después de seis horas de administrado en una relación directa y dependiente de la dosificación en los signos observados respecto al comportamiento, en los efectos neurológicos y en los efectos en el sistema nervioso autónomo, tales como el estado de alerta (atento, ubicación visual, pasividad); el estado de ánimo (autoacicalación, intranquilidad, irritabilidad, temor), la actividad motora (reactividad, actividad motora espontánea, respuesta al dolor); la postura corporal y de extremidades, la incoordinación motora (marcha vacilante, marcha normal, refejo de posición) y el tono muscular (de extremidades, fuerza prensil, encorvadura corporal, tono corporal, tono abdominal); comparados con el efecto producido por la Difenhidramina. Dichos ensayos de irwin están en coherencia con ensayos reportados por (Turner 1965; nakama 1972; Lipman 1978; Meneses et al. 1990). Pruebas neurofarmacológicas confrmatorias del efecto depresor del aceite de U. dermestoides La determinación del perfl de actividad en el SNC del aceite, se realizó por medio de pruebas orientadas a valorar las siguientes funciones del cerebro: Memoria, Aprendizaje y Discriminación: El animal se entrena previamente y se somete a un ayuno de alimentos sólido durante 24 horas, con el fin de que se estimule durante el experimento a buscar el alimento colocado al final de una ruta establecida como un premio (Velasco y gonzález 1981; Poldinger 1984; Meneses et al. 1990). Se evaluó el tiempo que tarda el animal en atravesar el recorrido trazado en el equipo (laberinto múltiple) hasta llegar al alimento. El aceite origina una notable disminución en estas funciones del SnC (Fig. 1), comparado con el efecto depresor de la Difenhidramina (F=1,30; gl=4; p≤0,05). El análisis estadístico de los promedios de los datos obtenidos durante esta prueba, revela que el aceite de U. dermestoides produce una notable disminución en estas funciones del cerebro de los animales. Actividad Motriz Exploratoria: La evaluación de este efecto farmacológico muestra que el aceite de U. dermestoides produce un efecto depresor moderado (F=11,09; gl=4; p≤0,0001) y que existe diferencia en el efecto depresor en el SnC por lo menos entre dos tratamientos. Comparado con el efecto depresor de la Difenhidramina (37,50mg/Kg, vo) en el SnC, el aceite de U. dermestoides (3mg/Kg, vo), genera una disminución en el número de exploraciones del ratón, lo que sugiere un estado de depresión. En este sentido, esta prueba confrma un efecto depresor moderado del aceite de U. dermestoides en esta función del SnC (Fig. 2). Actividad Motriz Espontánea: El análisis estadístico de los datos de este ensayo permite rechazar la hipótesis Ho, el análisis define que existe diferencia en el efecto depresor sobre el SnC producido por los cuatro tratamientos. El aceite de U. dermestoides (3mg/Kg, vo) causa un efecto depresor en esta función del SnC de los ratones, semejante al efecto producido por el patrón depresor, la Difenhidramina (37,50 mg/Kg, vo) (Fig. 3). Neurosis Experimental. En este experimento, la ansiedad generada por la sed causa en el animal un conficto entre si toma la decisión de calmar la sed, a pesar del malestar que le causa el tetero cuando intenta acercarse a él, o no calmar la sed (Vogel 1971; nakama 1972; Meneses et al. 1990). El análisis estadístico indica que hay diferencias estadísticas en la respuesta. Comparado con el efecto depresor de la Difenhidramina (37,50mg/Kg, vo) en el SnC, el aceite de U. dermestoides (3mg/Kg, vo), inhibe la respuesta emocional del animal de experimentación, compatible con un efecto ansiolítico del aceite (Fig. 4). Esta prueba confrma que existe diferencia en el efecto depresor sobre el SnC producido por los cuatro tratamientos. En aproximación a las opiniones de Tasaka (1986) y Rang et al. (2004), las pruebas desarrolladas durante esta investigación para evaluar el perfl neurofarmacológico del aceite de U. dermestoides comparado con los patrones depresores del SnC: Diazepam (medicamento ansiolítico) y Difenhidramina (medicamento antihistamínico, antagonista de los receptores H1 de Histamina), se puede deducir que los resultados presentaron cierta variabilidad biológica, debido probablemente a factores genéticos propios del animal de experimentación, a los factores ambientales y de sensibilidad de los animales y a la manipulación; variables que son dinámicas en el tiempo (Vogel 1971; Meneses et al. 1990; Tobón y Meneses 1991). En general se determinó que en las condiciones de esta investigación, el aceite presenta un efecto depresor leve sobre el SnC y ciertos signos neurofarmacológicos compatibles con un efecto ansiolítico moderado en los biomodelos. Las pruebas neurofarmacológicas específicas al aceite, en especial el ensayo de la Neurosis Experimental, muestran un efecto ansiolítico moderado, probablemente por una acción farmacológica de tipo gabaérgico, como sucede con el patrón Diazepam (rodgers y Dalvi 1997). Sin embargo, la literatura reporta más efectos empíricos en otros órganos y sistemas; por ejemplo, se vincula con la curación de indigestiones, afecciones cardíacas, mialgias, enfermedades renales, variedad de infecciones, asma y se ingiere vivo como afrodisíaco (Chua y Chandrepal 1978; Chu et al. 1997).
Agradecimientos Al Laboratorio de Farmacología y a las estudiantes practicantes en formación investigativa, Luz Mary Lopera b, Diana M. Márquez F., Erika Sofía Martínez garcés y Elizabeth Parody, hoy egresadas de la Facultad de Química Farmacéutica de la universidad de Antioquia, quienes contribuyeron al desarrollo de esta investigación.
Literatura Citada
ALCARAZ, M.; FERRÁNDIZ, M.; PAYÁ, M. 2005. Histamina y fármacos antihistamínicos. Farmacología de otros mediadores inflamatorios. pp. 487-500. En: Lorenzo, P.; Moreno, A.; Leza, J.;Moro, M. Velásquez Farmacología Básica y Clínica. Editorial Médica Panamericana, S.A. Madrid. España. 1250 p. [ Links ]
ARIZA, S.; RUEDA, D.; rinCón, j.; LinArES, E. guErrEro, M. 2007. Efectos farmacológicos sobre el Sistema nervioso central inducidos por Cumarina, aislada de Hygrophila tyttha LEonArD. revista Vitae 14 (2): 51-58. [ Links ]
CARDOSO, C.; MrAD,A.; MArTínEz, C.; roDríguEz, E.; LoLAS, C. 2007. El animal como sujeto experimental. Aspectos técnicos y ética. 1a ed. universidad de Chile: Centro interdisciplinario de Estudio en bioética. 228p. En internet: http://www.actabioethica.cl/ docs/elanimal.pdf. Consultado 19 de septiembre de 2011. [ Links ] Colombia. Congreso de la república. Ley 84. Estatuto nacional de Protección de los Animales, Capítulo Vi: Del uso de Animales Vivos en Experimentos e Investigación. Bogotá: El Congreso; 1989. [ Links ] Colombia. Ministerio de la Protección Social. resolución 8430 de 1993. Título V: La investigación biomédica con Animales. bogotá: El Ministerio; 1993. [ Links ] CONCEPCIÓN, A.; DE LA PEÑA Pino, r.; gArCíA, j. 2007. Acercamiento al accionar ético-moral del científico que trabaja con animales de Experimentación. Acta Bioethica 13 (1): 9-15. [ Links ] CHU, g.; PALMIERI, j.; SuLLiVAn, j. 1997. beetle eating: A Malaysia folk medical practice and its public health implications. Tropical geography Medicine 29(4): 422-427. [ Links ] [ Links ] DÍAZ, A. 1999. Diseño estadístico de experimentos. Editora Universidad de Antioquia, Medellín. Colombia. 347 p. [ Links ] ECHEVERRI, F.; QuiÑonES, W. 1997.Tópicos en productos naturales: La biodiversidad como fuente de moléculas activas. Conferencias selectas del V Congreso Colombiano de Fitoquímica. Editora universidad de Antioquia, Medellín. Colombia. 490 p. [ Links ] LARGO, r.1987. Medicina natural, Aceites, jarabes y licores medicinales. Editora Edison S.A. Madrid. España. 387 p. [ Links ] LI, g.; DuKE, C.; LECTurEr, S.; rouFogALiS, b. 2003.The quality and safety of traditional Chinese medicines. Australian Prescriber 26(6):128-131. [ Links ] LIPMAN, A. 1978. Multidimensional screening as a pharmacology laboratory experience. American Journal of Pharmaceutical Education 42(1): 223-227. [ Links ] LONDOÑO, L. 1992. Ciclo biológico del Palembus dermestoides (Coleoptera Tenebrionidae), en condiciones de laboratorio. Tesis de Pregrado. universidad de Antioquia, Departamento de biología. Medellín, Colombia. [ Links ] MENESES, b.; LunA, F.; MALDonADo, C.1990. Actividad neuro-farmacológica del extracto de Senecio vaccinoides. revista Colombiana de Ciencias Químico Farmacéuticas 18: 11-16. [ Links ] MRAD DE oSorio, A. 2006. ética en la investigación con modelos animales experimentales. Alternativas y las 3 R de Russel. Revista Colombiana de bioética 1(1): 163-183. [ Links ] NAKAMA, M. 1972. Effects of psychotropic drugs on emotional behavior. Exploratory behavior of naive rats in holed open-field. Japanese Journal of Pharmacology 22:767-775. [ Links ] RANG, H.;DALE, M.; RITTER, J.; MOORE, P. 2004. Antiinflamatorios e inmunodepresores. pp. 245-261. En: Farmacología. 5ta ed., Editora Elsevier S.A., Madrid. España.797 p. [ Links ] RODGERS, R. J.; DALVI A. 1997. Anxiety, defense and the elevated plus maze. Neurosciences Biobehavioral Review 21(6): 801-10. [ Links ] SERAFIN, W.; BABE, K. 1996. Autacoides: farmacoterapia de la inflamación. pp. 619-728. En: Goodman y Gilman (eds). Las bases Farmacológicas de la terapéutica. 9a ed. Volumen I. Editora Panamericana. México. 1015 p. [ Links ] SMITH, A. 2002. it's natural so it must be safe. Australian prescriber 25(3): 50-51. [ Links ] TASAKA, K. 1986. Antiallergic Drugs. Drugs of today 22: 101-133. [ Links ] [ Links ] TOBÓN, F. 1998. Principios básicos de la farmacología experimental; Procedimientos teóricos prácticos. Medellín: Fondo Editorial Cooperativo. Cooperativa de Profesores. universidad de Antioquia. 129 p. [ Links ] TURNER, R. 1965. Screening methods in pharmacology. Ed. Academic Press, new York. u.S.A. 312 p. [ Links ] [ Links ] WAYNE, W. 1995. Bioestadística. 3ª ed., Editora Limusa S.A. México. 521 p. [ Links ]