Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.1 Bogotá Jan./June 2012
Biotipo B de Bemisia tabaci (Hemiptera: Aleyrodidae): plaga de pimentón en el Valle del Cauca, Colombia
ISAURA V. RODRÍGUEZ T.1, JUAN M. BUENO M.2, CÉSAR CARDONA M.3 y HÉCTOR MORALES M.4
1 Estudiante de Doctorado en Ciencias Agropecuarias, Línea Protección de Cultivos, Universidad Nacional de Colombia. Carrera 32 vía Candelaria, Palmira. ivrodriguuezt@unal.edu.co. Autor para correspondencia.
2 M. Sc. Asociado de Investigación. Laboratorio de Entomología de Fríjol. CIAT. Km. 17 recta Cali-Palmira. j.bueno@cgiar.org.
3 Entomólogo particular. cesarciat@gmail.com.
4 Técnico. Laboratorio de Entomología de Fríjol. CIAT. Km. 17 recta Cali-Palmira.
Recibido: 28-feb-2011 - Aceptado: 14-may-2012
Resumen: Para identificar la distribución del biotipo B de Bemisia tabaci en los cultivos de ají y pimentón en el Valle del Cauca, Colombia, se tomaron muestras de adultos y pupas en 33 localidades de 12 municipios del departamento. Por observación de las características morfológicas de las pupas se diferenciaron las especies B. tabaci y Trialeurodes vaporariorum. La reconfirmación de especies y la diferenciación entre los biotipos A y B de B. tabaci se hizo por medio de polimorfismo en ADN amplificado al azar (RAPD-PCR). La especie dominante fue B. tabaci biotipo B, que se registró en el 50% de las muestras. No se evidenció la presencia del biotipo A y 31,2% de las muestras presentó mezcla del biotipo B y T. vaporariorum. En laboratorio se hicieron pruebas de resistencia a insecticidas en adultos y ninfas de primer instar del biotipo B en seis localidades con las metodologías y dosis diagnóstico previamente establecidas por CIAT sobre razas susceptibles. Además, se calcularon las líneas base, CL90, CL50 y dosis diagnóstico para tioxiclam hidrógeno oxalato en adultos y para spiromesifen y pyriproxifen en ninfas de primer instar con la técnica de inmersión del follaje. Se encontró resistencia alta a metamidofos y algunos casos de resistencia intermedia a cipermetrina, imidacloprid y thioxyclam hidrógeno oxalato en adultos. Se encontraron niveles de resistencia intermedia a imidacloprid, buprofezin y diafentiuron en localidades con exagerado uso de insecticidas. Se discuten las implicaciones de estos resultados en el manejo del insecto en cultivos de ají y pimentón.
Palabras clave: Moscas blancas. Resistencia a insecticidas. Identificaciones. Distribución altitudinal.
Abstract: To identify the distribution of Bemisia tabaci biotype B in pepper crops in the Cauca Valley, Colombia, adult and pupal samples were taken from thirty-three sites in 12 different locations visited. Initial differentiation between the species Bemisia tabaci and Trialeurodes vaporariorum was based on morphological characteristics of the fourth instar (pupae). Reconfirmation of species identity and identification of biotypes was done by means of random amplified polymorphic DNA (RAPD's-PCR analysis). The dominant species was B. tabaci B biotype, which was recorded in 50% of the samples. The A biotype of B. tabaci was not detected and a mixture of biotype B and T. vaporariorum was found in 31.2% of the samples. Levels of insecticide resistance were studied in adults and first instar nymphs of the B biotype, across six sites of the department with the methodologies and diagnostic doses previously established by CIAT. In addition, line base data, LC50, LC90 and diagnostic doses for thioxiclam hydrogen oxalate on adults and pyriproxifen and spiromesifen on first instar nymphs were calculated using the leaf-dip methodology. Adult populations showed high levels of resistance to methamidophos, and some cases of intermediate resistance to cypermethrin, imidacloprid and thioxyclam hydrogen oxalate. The nymphs from locations with excessive use of insecticides have shown intermediate resistance to imidacloprid, buprofezin and diafentiuron. The implications of these results in the management of insect in pepper crops are discuss.
Key words: Whiteflies. Insecticide resistance. Identification. Altitudinal distribution.
Introducción
Aunque existen más de 1.100 especies de moscas blancas (Hemipetra: Aleyrodidae), solo un número limitado de ellas ha sido considerado plagas de importancia económica. En los trópicos se destacan Trialeurodes vaporariorum (Westwood, 1856) y Bemisia tabaci (Gennadius, 1889) como plagas clave en diversos cultivos (Anderson 2005). Estos insectos son chupadores de floema y causan daño directo al extraer grandes cantidades de savia. De manera indirecta, la excreción de melaza por parte de adultos e inmaduros favorece el desarrollo de hongos como Capnodium sp. el cual bloquea la fotosíntesis y demerita la calidad de los frutos. Adicionalmente, B. tabaci es vector de begomovirus (Geminiviridae: Begomovirus) que pueden llegar a causar pérdidas totales en cultivos de hortalizas (Anderson 2005).
Además de la marcada capacidad para transmitir virus, B. tabaci se destaca por la ocurrencia de biotipos dentro de la especie (Perring 2001), entre los cuales se destacan el biotipo B, que algunos autores han registrado como una nueva especie a la que denominaron B. argentifolii Bellows y Perring, 1993 la cual ha demostrado tener mayor potencial biótico y que tiende a desplazar al biotipo tradicional denominado biotipo A (Perring 2001). Morfológicamente no se pueden distinguir los biotipos de B. tabaci sin embargo, el biotipo B presenta características que lo distinguen del biotipo A como son el mayor espectro de hospedantes, las mayores densidades de población, la mayor capacidad para adquirir resistencia a insecticidas y la inducción de desórdenes fisiológicos como la maduración desigual de frutos tomate y plateado de las hojas en cucurbitáceas (Perring 2001). Una identificación precisa se puede hacer a nivel molecular, por medio de polimorfismo en ADN amplificado al azar (RAPD), ya que los biotipos presentan patrones de bandas que permiten diferenciarlos y determinar la presencia de cualquiera de ellos en un cultivo o región determinada (Perring 2001). Por medio de estas técnicas también se ha detectado en países como España, China (Dong et al. 2005) y México (Martínez-Carrillo y Brown 2007) la presencia de una nueva forma de B. tabaci denominada biotipo Q.
El biotipo B de B. tabaci fue detectado por primera vez en Colombia en 1996 en poblaciones de mosca blanca colectadas en la Costa Atlántica (Quintero et al. 1998), atacando diversos cultivos desde Córdoba hasta la Guajira. Estudios posteriores de Quintero et al. (2001) demostraron que el biotipo B desplazó al biotipo A en la Costa Norte del país y otras zonas del interior. En el Valle del Cauca el biotipo B fue encontrado por primera vez en 1997 en plantas de poinsettia bajo invernadero (Rodríguez y Cardona 2001). Su presencia no tuvo mayores repercusiones iniciales pero en el año 2002 los agricultores reportaron poblaciones muy altas de moscas blancas en diversos hospedantes. En ese mismo año, estudios desarrollados por Rodríguez et al. (2005), registraron síntomas evidentes de daño por B. tabaci biotipo B tales como excesiva producción de melaza y fumagina en algodón, maduración desigual de en frutos de tomates, plateado de hojas en zapallo y desórdenes fisiológicos en habichuela. Por medio de análisis de ADN en pruebas de RAPD-PCR en muestras tomadas en 22 municipios se halló que el biotipo B de B. tabaci había desplazado no solamente al biotipo A sino también a T. vaporariorum, especie que por muchos años fue la más importante en el Departamento (Rodríguez et al. 2005). El biotipo B se detectó en altitudes cercanas a los 1600 msnm, lo cual sugiere que este insecto está ampliando su espectro de adaptación ecológica al sobrepasar los 995 m, altura máxima a la cual este insecto había sido registrado en Colombia (Quintero et al. 2001).
Dos de los cultivos más afectados por el biotipo B de B. tabaci en el Valle del Cauca (Colombia) son el pimentón y el ají, cultivos que han adquirido gran importancia en los últimos años en el Departamento. Las pérdidas causadas por mosca blanca en cultivos hortícolas incluyendo pimentón y ají en México y América Central alcanzan valores superiores a los 100 millones de dólares por año. Cuando la mosca blanca actúa como vector de virus, las pérdidas pueden ser del 100% (Morales 2005). Otros estimativos de pérdidas causadas por B. tabaci en ají en Centro América incluyen los trabajos de Dardón (1992) en Guatemala y Jara (1998) en Honduras. Sediles (1998) calculó pérdidas de 30-50% en pimentón en Nicaragua.
En Colombia no se han estimado las pérdidas causadas por mosca blanca en ají y pimentón. Sin embargo, los resultados de encuestas con agricultores muestran que los productores temen a la mosca blanca como plaga clave de los cultivos hortícolas y hacen hasta 12 aplicaciones de insecticidas para su control en regiones como el Valle del Cauca (Rodríguez y Cardona 2001). Esta situación aumenta la presión de selección y favorece el desarrollo de niveles de resistencia del biotipo B a insecticidas como los que se han reportado a nivel mundial para insecticidas con variados modos de acción (APRD 2009). En Colombia el biotipo B ha adquirido niveles muy altos de resistencia a los insecticidas convencionales organofosforados, carbamatos y piretroides (Cardona et al. 2001, 2005). En el Valle del Cauca la manifestación de resistencia a estos productos convencionales es también generalizada (Rodríguez et al. 2005). Sin embargo, el insecto todavía mostraba susceptibilidad a los productos de nueva generación como neonicotinoides (imidacloprid, tiametoxam) y reguladores de crecimiento como diafentiuron, buprofezin (Rodríguez et al. 2005).
Con estos antecedentes, surgió entonces la necesidad de actualizar la información sobre la presencia de especies de moscas blancas en zonas productoras de ají y pimentón en el Valle del Cauca, ya que estos cultivos son prioridad para la oferta exportadora del Ministerio de Agricultura y Desarrollo Rural colombiano. Además, como los agricultores recurren al control químico como principal estrategia de manejo, es necesario evaluar la resistencia a algunos productos en adultos y ninfas, en aquellas zonas con excesivo uso de insecticidas para el manejo de moscas blancas en cultivos de ají y pimentón porque el desarrollo de resistencia en estos cultivos pueden influenciar la problemática de control en otros cultivos hospedantes.
Materiales y Métodos
Identificación de especies. Se colectaron muestras en 33 localidades de 12 municipios del Valle del Cauca, Colombia en los cuales se encontraron cultivos de ají y pimentón afectados por moscas blancas. Se tomaron 48 muestras en las visitas, las cuales se hicieron en abril de 2008 (26 muestras) y marzo de 2009 (22 muestras). Para cada muestra se registraron los datos de altitud sobre el nivel del mar, el nombre de la planta hospedante y observaciones correspondientes a la presencia de síntomas característicos de la presencia del biotipo B.
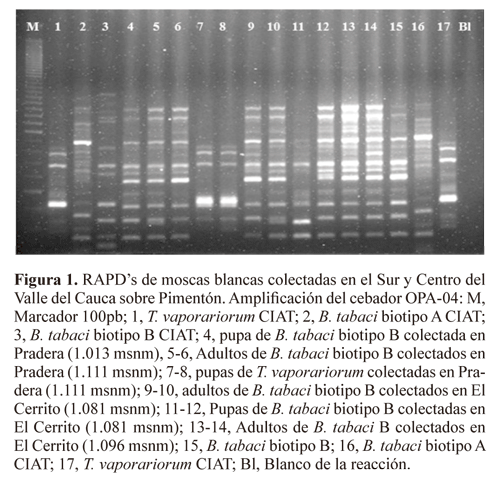
Para la identificación morfológica se colectaron en cajas de petri hojas infestadas con pupas de moscas blancas que fueron revisadas con estereoscopio en el laboratorio. Las especies se clasificaron utilizando las características registradas en la clave de campo para inmaduros de moscas blancas de Centro América (Caballero 1994). Los adultos se colectaron con aspiradores bucales y se conservaron en etanol al 70% hasta el momento de la identificación molecular, la cual partió de la extracción de ADN de insectos individuales según el método descrito por Quintero et al. (1998), en el cual cada adulto se maceró en 200 µL de 50 mM EDTA, 500 mM NaCl, 10 mM β-mercaptoetanol. Posteriormente, se agregaron 20 µL de SDS al 10% y se incubó a 65°C por 10 minutos. Se añadieron 20 µL de 5M acetato de potasio y se centrifugó 10 minutos a 10000 rpm. El ADN se precipitó por la adición de 0,5 volumenes de isopropanol frío. El pellet resultante se lavó en etanol al 70% y luego de secarlo se resuspendió en 50 de 10 mM Tris-HCL, 1 mM EDTA pH 8.0. La amplificación de 10 µL del ADN molde se realizó en un volumen final de 25 µL. Cada reacción tenía 2,5 µL de buffer (100 mM Tris-HCl, pH 8.3; 500 mM KCl), 3,0 mM MgCl2, 0,15 mM dNTPs, 0,8 mM del cebador OPA-04, 0,2 µL BSA (10 mg/ml) y 1.5 U Taq polimerasa. Los productos de la amplificación se separaron en geles de agarosa al 1,5% en TAE. Los geles se corrieron a 60 voltios constantes por 5-6 horas. El ADN de todas las muestras se amplificó con el cebador OPA-04 ya que este es uno de los productos con el cual se han obtenido los mejores resultados en cuanto a polimorfismos entre el biotipo A y B de Bemisia tabaci y T. vaporariorum (Gawel y Bartlett 1993; Quintero et al. 1998). Se utilizaron como testigos los biotipos A y B de B. tabaci criados en el Centro Internacional de Agricultura Tropical (CIAT) sobre Phaseolus vulgaris L. (var. ICA Pijao) a 23oC y 70% HR y T. vaporariorum criado sobre el mismo hospedante a 21oC y 80% HR. Estas razas se han utilizado como testigos de identificación en trabajos anteriores (Quintero et al.1998; Rodríguez y Cardona 2001; Rodríguez et al. 2005). La comparación con los testigos de las colonias permitió la identificación de las bandas polimórficas y, en consecuencia, de las especies de moscas blancas.
Niveles de resistencia a insecticidas. Con el propósito de evaluar el impacto causado por el incremento de aplicaciones de insecticidas debido a la presencia del biotipo B en cultivos de ají y pimentón, se hicieron mediciones de resistencia a insecticidas en adultos y ninfas en aquellos sitios en los cuales se hacen mayor número de aplicaciones para controlar moscas blancas. En las evaluaciones con adultos se utilizaron las dosis diagnóstico previamente establecidas por Cardona et al. (2001, 2005) sobre adultos y las evaluadas por Rodríguez et al. (2003b) sobre ninfas de primer ínstar. Con el aumento en el desarrollo de nuevas moléculas para el control de moscas blancas, fue necesario establecer las líneas base y las dosis diagnóstico para tioxiclam hidrógeno oxalato (EVI-SECT® S) con adultos y para piriproxifen (EPINGLE® 10 EC) y spiromesifen (OBERON® 240 SC) con ninfas.
Líneas base para nuevos insecticidas. Los experimentos de laboratorio se adelantaron en las instalaciones del Centro Internacional de Agricultura Tropical - CIAT en Palmira (Valle, Colombia) con insectos provenientes de crías del biotipo B de B. tabaci susceptibles a insecticidas, mantenidas bajo condiciones controladas en cuartos de crecimiento: 24 ± 1oC y 70-80% H.R. Para adultos, se estableció la línea base y dosis diagnóstico de tioxiclam hidrógeno oxalato por medio de la técnica de inmersión de folíolos para insecticidas de contacto descrita por Rodríguez et al. (2003a). Se emplearon trifolios de fríjol variedad 'ICA Pijao', los cuales fueron sumergidos por 10 s en dosis del producto disueltas en agua destilada. El follaje se dejó secar por dos horas y se infestó con adultos de biotipo B sin sexar. Se evaluaron dosis a partir de soluciones madre de 2000 a 7 ppm del producto comercial. Se usó un diseño de bloques completos al azar con cinco repeticiones por dosis y 20 insectos por caja de petri, para un total de 100 individuos por dosis de cada producto. Para corregir la mortalidad, se utilizaron como controles folíolos sumergidos en agua destilada. El tiempo de exposición a los insecticidas fue de 48 horas, tiempo después del cual se registró el número de insectos vivos y muertos por repetición.
En el caso de inmaduros, se estableció una población de ninfas de primer instar de cada raza suficiente para las pruebas, en las cuales se evaluaron dosis de producto comercial preparadas a partir de diluciones en serie de una solución madre de 200 a 0,09 ppm para piriproxifen y de 50 a 0,02 ppm para spiromesifen con la técnica de inmersión del follaje desarrollada por Prabhaker et al. (1985) y utilizada en Colombia por Rodríguez et al. (2003b). Como tratamiento para corrección de mortalidad se usaron trifolios infestados con ninfas sumergidos en agua destilada. Se usó un diseño de bloques completos al azar con cuatro repeticiones por dosis diagnóstico de cada producto.
En todas las evaluaciones la mortalidad se corrigió con la fórmula de Abbott (Busvine 1971) y se realizaron tres ensayos por producto. Se descartaron las pruebas en las cuales la mortalidad del testigo fue superior al 10%. Las concentraciones letales media y 90 (CL50 y CL90) de cada ensayo, así como los límites de confianza de las regresiones se calcularon por medio de análisis Probit (SAS 2000). Se consideraron estadísticamente iguales las CL50 y CL90 de un producto dado cuyos límites de confianza se superpusieron. A partir de las líneas base, se escogió un juego de tres dosis empíricas de cada producto, que causaran mortalidades entre 5 y 95% de la población susceptible. Estas dosis se evaluaron de nuevo sobre la raza susceptible del biotipo B de CIAT con las metodologías establecidas para cada insecticida, con el fin de estimar las dosis diagnóstico para cada producto es decir, aquella que mata por lo menos el 95% de una raza susceptible. Las dosis diagnóstico así estimadas, se usaron para comparar las mortalidades en adultos e inmaduros de razas del biotipo B colectadas en campo con las mortalidades en la raza susceptible mantenida bajo condiciones controladas en el CIAT.
Mediciones periódicas de resistencia. Los trabajos con adultos del biotipo B de B. tabaci se hicieron con las dosis diagnóstico de metamidofos (32 µg/vial), metomil (2,5 µg/ vial), cipermetrina (500 µg/vial) e imidacloprid (CONFIDOR® 350 SC, 40 ppm) establecidas en trabajos anteriores (Cardona et al. 2001, 2005) y la de tioxiclam hidrógeno oxalato identificada en el presente trabajo. En ninfas de primer ínstar, se evaluaron las dosis diagnóstico establecidas por Rodríguez et al. (2003b) para buprofezin (OPORTUNE® 25 SC, 16 ppm), diafentiuron (POLO® 250 SC, 300 ppm) e imidacloprid (300 ppm) y las de piriproxifen y spiromesifen obtenidas en esta investigación.
Se visitaron seis localidades del Valle del Cauca: La Unión, Palmira, Rozo, Yotoco, La Cumbre y Vijes. Estas zonas se seleccionaron por área sembrada en ají y pimentón y por el alto consumo de insecticidas utilizados para el control de moscas blancas. Se realizaron dos mediciones periódicas de resistencia para cada estado de desarrollo, una en el 2008 y otra en el 2009. La medición periódica de resistencia de adultos del biotipo B de B. tabaci con insecticidas tradicionales como metomil, metamidofos y cipermetrina se hizo mediante la técnica de viales impregnados desarrollada por Plapp et al. (1990) y usada en Colombia por Rodríguez et al. (2003b) con la dosis diagnóstico de cada insecticida. Los individuos colectados directamente de las plantas de ají o pimentón en cada zona visitada, se introdujeron en los viales de 25 ml previamente tratados con 250 µg de la solución de ingrediente activo diluido en acetona. Como controles para corregir la mortalidad se usaron viales impregnados con acetona pura. El tiempo de exposición a los insecticidas fue de 6 horas. Para imidacloprid (insecticida sistémico), se colectaron hojas infestadas con pupas, las cuales se llevaron a cuartos de cría del CIAT para esperar la emergencia de adultos de edad conocida. Los adultos de cinco días de edad se utilizaron en pruebas con trifolios de fríjol tratados con la dosis diagnóstico por el método de inmersión de pecíolos descrita por Cahill et al. (1996) y utilizada en trabajos anteriores por Rodríguez et al. (2003b). En el caso de tioxiclam hidrógeno oxalato los adultos emergidos fueron transferidos a trifolios de fríjol tratados con la dosis diagnóstico de este producto por el método de inmersión de folíolos, tal como se procedió para establecer la línea base. El tiempo de exposición a imidacloprid y tioxiclam hidrógeno oxalato fue de 48 horas y como testigos para corregir mortalidad se utilizaron pecíolos tratados con agua destilada. En todas las pruebas con adultos del biotipo B se usó un diseño de bloques completos al azar con cinco repeticiones por dosis de cada insecticida y 20 insectos por repetición, para un total de 100 individuos evaluados por dosis de producto.
Para medir la resistencia en ninfas, se establecieron crías de cada raza o sitio a partir de hojas infestadas con pupas colectadas en cultivos de ají y pimentón afectados en cada una de las zonas visitadas. Los adultos emergidos se mantuvieron en plantas de fríjol variedad 'ICA Pijao', en las mismas condiciones ambientales a las cuales se cría la raza susceptible. Se estableció una población de ninfas de primer ínstar de cada raza suficiente para las pruebas, las cuales se evaluaron con la dosis diagnóstico de cada insecticida usando la metodología de inmersión del follaje descrita por Rodríguez et al. (2003b). Como tratamiento para corrección de mortalidad se usaron trifolios infestados con ninfas sumergidos en agua destilada. Se usó un diseño de bloques completos al azar con cuatro repeticiones por dosis diagnóstico de cada producto.
En todos los casos (adultos y ninfas) la mortalidad se corrigió por la fórmula de Abbott (Busvine 1971) y no se aceptaron pruebas con porcentajes de mortalidad en los testigos superiores al 10%. Todos los datos se sometieron a análisis de varianza previa transformación a arcoseno de la raíz cuadrada de la proporción. En el trabajo se presentan las medias sin transformación. Cuando la prueba de F fue significativa, se hizo la separación de medias por Diferencia Mínima Significativa al 5% (SAS 2000).
La interpretación de los datos de mortalidad corregida se hizo mediante la escala arbitraria para clasificar la resistencia o susceptibilidad de las poblaciones utilizada en los trabajos de Cardona et al. (2001, 2005) y Rodríguez et al. (2005): 0-50% de mortalidad, resistencia; 50-80%, resistencia intermedia; > 80%, susceptibilidad.
Resultados y Discusión
Identificación de especies. De las 48 muestras colectadas, 37 (77%) fueron identificadas por morfología de pupas. T. vaporariorum y B. tabaci fueron las dos especies de moscas blancas predominantes en los cultivos de ají y pimentón. Con respecto a los hospederos, el 95,8% de las muestras fueron colectadas en pimentón, mientras que solo el 4,2% se colectó sobre ají. Esta técnica permite el manejo fácil de las muestras en campo sin necesidad de refrigerar (Quintero et al. 2001). Como lo han registrado diversos autores, el uso del cebador OPA-04 en el presente trabajo también reveló un alto grado de polimorfismo entre T. vaporariorum y los biotipos A y B de B. tabaci (Gawel y Bartlett 1993; Quintero et al. 1998, 2001; Rodríguez et al. 2005) (Fig. 1). Hubo 100% de coincidencia entre las identificaciones morfológicas y las moleculares.
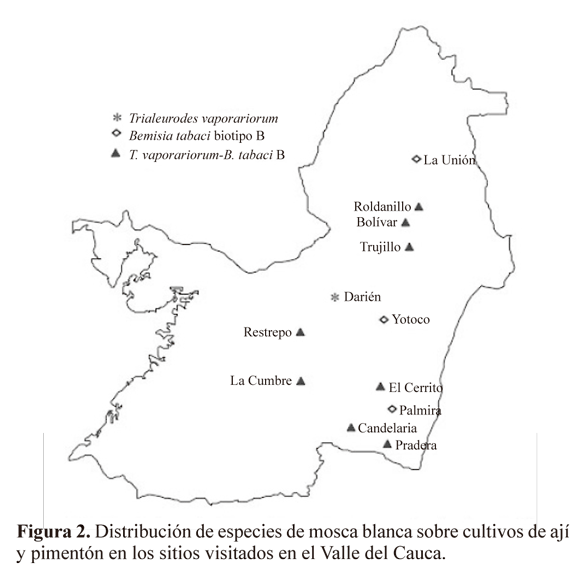
Después de identificar todas las muestras de moscas blancas se analizó la distribución geográfica del biotipo B sobre cultivos de ají y pimentón en 12 municipios el Valle del Cauca (Fig. 2). De manera similar a los registros de Rodríguez et al. (2005) se encontró dominancia del biotipo B en la mayoría de los sitios visitados. Ocurrió en 24 localidades de 11 municipios desde el norte hasta el Sur del Departamento (Fig. 2). El biotipo B de B. tabaci se encontró la mayoría de las veces a campo abierto, resultado que confirma los registros de Rodríguez et al. (2005) donde se califica a este biotipo como un insecto de mucha agresividad, que se ha dispersado rápidamente por la geografía del Valle del Cauca. Esta situación fue similar a la ocurrida a finales de 1994 en la costa Atlántica colombiana, donde el biotipo B causó daños severos en cultivos de algodón y tomate (Quintero et al. 1998).
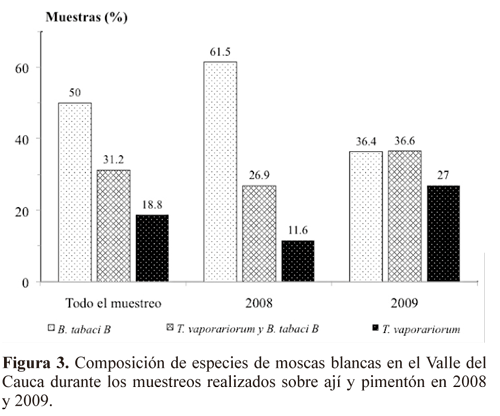
De igual manera a los estudios de Rodríguez et al. (2005), en el análisis de la composición de especies de moscas blancas en cultivos de ají y pimentón, el biotipo B de B. tabaci es la especie dominante ya que constituyó el 50% de las muestras (Fig. 3). Sin embargo, a diferencia de los estudios desarrollados por los mismos autores en años anteriores sobre otras hortalizas cultivadas en el Valle del Cauca (Rodríguez y Cardona 2001; Rodríguez et al. 2005), se encontró una proporción considerable de muestras (31,2 %) que correspondió a mezcla de individuos del biotipo B con T. vaporariorum. De manera similar a los estudios hechos en el 2005, no se halló evidencia de la presencia del biotipo A en el muestreo. T. vaporariorum por su parte se encontró en el 18,8% de las muestras tomadas en los dos años, valor inferior al detectado en estudios de Rodríguez y Cardona (2001) y Rodríguez et al. (2005) sobre otras hortalizas en el Valle del Cauca. Al hacer la comparación de la composición de especies 2008 y 2009, se observa una tendencia similar a la descrita anteriormente por Quintero et al. (2001) y Rodríguez et al. (2005), donde se confirma que el biotipo B de B. tabaci desplazó al biotipo A y a T. vaporariorum (Fig. 3).
Con respecto a la distribución altitudinal de las especies de moscas blancas, se encontró a T. vaporariorum entre 1179 y 1896 msnm. Esta distribución concuerda con la registrada por Rodríguez y Cardona (2001), Quintero et al. (2001) y Rodríguez et al. (2005). El biotipo B se registró desde 940 hasta 1635 msnm. Este intervalo altitudinal es similar al detectado por Rodríguez y Cardona (2001), quienes detectaron la presencia del biotipo B en invernaderos localizados a más de 1500 msnm. Por su parte, la combinación T. vaporariorum - biotipo B se halló desde 947 hasta 1437 msnm. Esta distribución por altitudes es superior a las detectadas en los trabajos de Quintero et al. (2001), Rodríguez y Cardona (2001) y Rodríguez et al. (2005) lo cual sugiere que el biotipo B ha ampliado su intervalo de adaptación ecológica al sobrepasar los 1147 msnm, altura máxima registrada previamente (Rodríguez et al. 2005). Esto es explicable por la facilidad de adaptación a nuevos hábitats que posee el insecto, hecho que sumado a las movilizaciones humanas de material vegetal infestado por ejemplo a zonas altas con invernaderos, favorece la aparición, adaptación y diseminación de especies de moscas blancas en lugares donde generalmente no podrían desarrollarse (Perring 2001).
Los bajos niveles de abundancia de la población del insecto no permitieron detectar afecciones características del ataque del biotipo B en ají y pimentón. Sin embargo, de igual manera que en los estudios de Rodríguez et al. (2005), en lotes cercanos a los cultivos de ají y pimentón visitados se observaron desórdenes fisiológicos característicos causados por este biotipo tales como la maduración desigual de los frutos de tomate y el plateado de las hojas de zapallo. Es importante destacar que estas sintomatologías son indicativos de la presencia de biotipo B en una nueva área geográfica.
Niveles de resistencia a insecticidas
Líneas base y dosis diagnóstico. Los resultados presentados en la Tabla 1 corresponden a las líneas base y las dosis diagnóstico de insecticidas con nuevos modos de acción, los cuales son de uso frecuente por los agricultores del Valle del Cauca. Estos resultados, además de los publicados por Cardona et al. (2001, 2005) incrementan el número productos con los cuales se puede medir la resistencia a insecticidas en poblaciones de adultos y ninfas del biotipo B de B. tabaci de Colombia.
De igual manera que en los trabajos de Cardona et al. (2001, 2005) y Rodríguez et al. (2005), las dosis escogidas como diagnóstico en cada estado de desarrollo con la metodología correspondiente, causaron mortalidades corregidas superiores al 90% en la raza susceptible del biotipo B mantenida en el CIAT, lo cual permite concluir que se pueden utilizar en los monitoreos para medir la resistencia o susceptibilidad a ingredientes de reciente introducción en el mercado, como spiromesifen y piriproxifen.
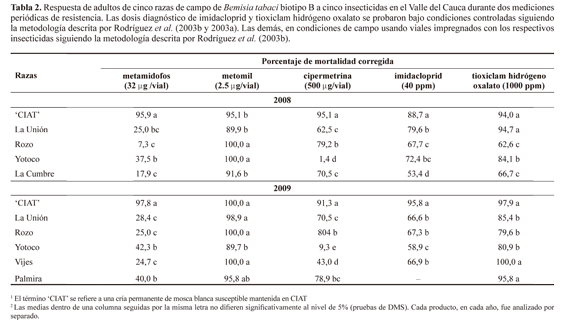
Medición periódica de resistencia en adultos. En las pruebas de resistencia hechas en el 2008, los porcentajes de mortalidad corregida con metamidofos en los cuatro sitios de estudio fueron inferiores al 50% y difirieron significativamente del porcentaje de mortalidad en la raza susceptible 'CIAT'. Esta tendencia fue similar a la detectada en los monitoreos hechos en el 2009 (Tabla 2). Estos resultados concuerdan con Rodríguez et al. (2005) sobre poblaciones evaluadas en Rozo, Santa Helena y La Unión en el Valle del Cauca, las cuales mostraron altos niveles de resistencia a organofosforados como metamidofos y monocrotofos. En Colombia, la resistencia a metamidofos también ha sido detectada en razas del biotipo B colectadas en la costa Atlántica (Cardona et al. 2001, 2005).
Con metomil, los porcentajes de mortalidad corregida a la dosis diagnóstico en los dos monitoreos superaron el 85%, aunque estadísticamente menores a los del testigo susceptible 'CIAT', los valores permiten concluir que hay susceptibilidad marcada de adultos del biotipo B al producto en todas las razas (Tabla 2). Autores como Cardona et al. (2001, 2005) han registrado niveles de resistencia intermedios a este carbamato en Córdoba, Atlántico y Sucre. En el Valle del Cauca, Rodríguez et al. (2005) también detectaron resistencia intermedia a metomil y a otros carbamatos como carbofuran y carbosulfan en zonas como La Unión, Santa Helena y Rozo.
Se encontraron niveles de resistencia intermedios a cipermetrina en la mayoría de los sitios visitados durante el 2008 y 2009 (Tabla 2). Sin embargo, las poblaciones evaluadas en Yotoco y Vijes mostraron significativos niveles de resistencia al producto (Tabla 2). La resistencia a cipermetrina también ocurre en razas de biotipo B de Sucre y Córdoba (Cardona et al. 2001). Para el caso del Valle del Cauca, razas colectadas en Rozo, Santa Helena y La Unión mostraron resistencia a éste y otros piretroides como cialotrina y bifentrin (Rodríguez et al. 2005).
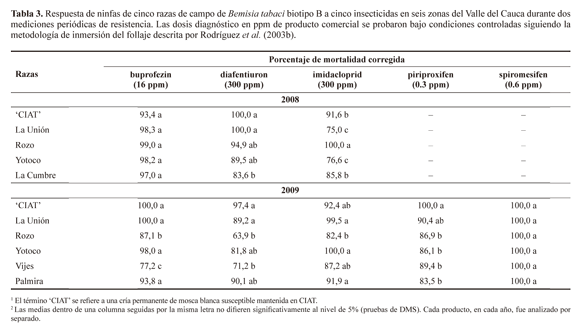
Los niveles de resistencia de adultos de biotipo B a insecticidas tradicionales como organofosforados, carbamatos y piretroides, están relacionados con el historial de exposición a insecticidas para el control de mosca blanca y otras plagas en cultivos de ají y pimentón, en zonas como La Unión, Yotoco y Vijes, donde estos cultivos se siembran en grandes extensiones. Tal como lo registraron Rodríguez y Cardona (2001) y Rodríguez et al. (2003b, 2005), son sitios donde los agricultores hacen aplicaciones de tipo calendario con insecticidas convencionales para el control de moscas blancas y otras plagas. Esto favorece el aumento de individuos resistentes a los insecticidas con mayor frecuencia de uso. Nuestros resultados sugieren que la presencia del biotipo B de B. tabaci en cultivos de ají y pimentón en el Valle del Cauca significa que estos cultivos han sido invadidos por una forma de mosca blanca cuyos adultos presentan altos niveles de resistencia a productos tradicionales y concuerda con múltiples registros sobre la mayor habilidad del biotipo B de B. tabaci para tolerar estos grupos de insecticidas (Tabla 3) (Dittrich et al. 1990; Palumbo et al. 2001; Martínez-Carrillo et al. 2006; Ma et al. 2007; Erdogan et al. 2008).
A diferencia de los resultados de Rodríguez et al. (2005), con las dosis diagnóstico de imidacloprid se encontraron niveles de resistencia intermedia en los adultos de todas las razas evaluadas sobre cultivos de ají y pimentón en el Valle del Cauca (Tabla 2); en el caso específico de la raza colectada en Yotoco, ésta mostró una disminución en la mortalidad de un año al otro. Con respecto a tioxiclam hidrógeno oxalato, producto que actualmente es de amplio uso para el control de moscas blancas (CIAT 2007), solo se encontraron niveles de resistencia intermedia en Rozo y La Cumbre (Tabla 2). Para estos dos insecticidas, nuestros resultados demuestran que su uso frecuente para el manejo de moscas blancas en hortalizas y leguminosas (Rodríguez y Cardona 2001; CIAT 2007) ha favorecido la selección de individuos resistentes y sugieren la necesidad de hacer un manejo adecuado de los dos productos en algunas zonas del Departamento.
Medición periódica de resistencia en ninfas. La mortalidad de ninfas con buprofezin en todos los sitios estudiados en el año 2008 fue mayor al 80%, lo cual permite clasificar esta reacción como susceptible (Tabla 3). Sin embargo, en el segundo monitoreo de resistencia (año 2009), se detectaron mortalidades inferiores al 80% en poblaciones colectadas en cultivos de ají y pimentón en la zona de Vijes. La resistencia del biotipo B a buprofezin se ha reportado en Israel, los Países Bajos (Palumbo et al. 2001) y Turquía (Erdogan et al. 2008). En España también se han presentado niveles de resistencia a este inhibidor de quitina en poblaciones del biotipo Q de B. tabaci (Gorman et al. 2003).
En el caso de diafentiuron durante el monitoreo del 2008 todas las razas fueron susceptibles al producto (Tabla 3). Sin embargo, en el 2009 las razas de Rozo y Vijes presentaron porcentajes de mortalidad corregida a la dosis diagnóstica inferiores al 80% y estadísticamente diferentes a la respuesta de la raza susceptible 'CIAT'. Con imidacloprid solo las razas evaluadas en el 2008 en Rozo y Yotoco presentaron mortalidades inferiores al 80% y estadísticamente diferentes al testigo susceptible 'CIAT'. La resistencia del biotipo B de B. tabaci a imidacloprid y otros neonicotinoides se han detectado en países como Alemania (Nauen et al. 2002), Israel (Horowitz et al. 2004), Italia, Estados Unidos, Guatemala (Prabhaker et al. 2005) y China (Ma et al. 2007).
Los resultados con buprofezin, diafentiuron e imidaclo-prid sobre ninfas de primer instar de esta investigación difieren con los registros de Rodríguez et al. (2003b, 2005), donde estos insecticidas eran considerados ingredientes efectivos en el control del biotipo B de B. tabaci. Estos resultados pueden ser consecuencia del uso frecuente de los insecticidas como lo indica Rodríguez et al. (2003b, 2005), señalando la necesidad de replantear la estrategia de manejo del insecto en cultivos de ají y pimentón en algunas regiones del Valle del Cauca, ya que si se continúan usando frecuentemente se podrían presentar mayores problemas de control de la plaga en estos cultivos.
Aunque hubo diferencias significativas entre las mortalidades de las poblaciones de campo y la raza susceptible, no se puede decir que existen niveles de resistencia a piriproxifen y spiromesifen, porque los porcentajes de mortalidad con la dosis diagnóstico de estos productos fueron superiores al 83% (Tabla 3). La susceptibilidad de B. tabaci a insecticidas como spiromesifen también ha sido reportada por autores como Nauen et al. (2003), Liu (2004) y Kontseclalov et al. (2009) quienes recomiendan el uso de este ingrediente para el control del insecto en campo. Sin embargo, si se incrementa el uso de este producto sin ninguna posibilidad de rotación con otros insecticidas, la susceptibilidad de las razas del biotipo B en ají y pimentón podría disminuir y se crearían problemas de resistencia como los que se han detectado hacia piriproxifen en Estados Unidos (Crowder et al. 2007) y China (Ma et al. 2007).
La identificación de moscas blancas mediante RAPDs, permitió establecer que el biotipo B de B. tabaci es hoy en día la especie de mosca blanca más importante en ají y pimentón en el Valle del Cauca. Esta información es fundamental para diseñar un plan de investigación encaminado a desarrollar programas de manejo integrado del insecto. Los niveles de resistencia a insecticidas informados en este trabajo, señalan que existe una problemática de moscas blancas difícil de manejar en las zonas más afectadas por el biotipo B en el departamento, donde productos como imidacloprid, buprofezin y diafentiuron que anteriormente eran eficientes, hoy no son tan efectivos. También aportan información fundamental para el diseño de futuros planes de control químico del biotipo B, donde los insecticidas como spiromesifen y piriproxifen, juegan un papel fundamental. Estos ingredientes activos constituyen herramientas importantes para una alternativa química que, manejada adecuadamente en programas de rotación y aplicada con criterio a niveles de población cercanos a umbrales de acción, pueden hacer parte del paquete de manejo integrado del biotipo B de B. tabaci sobre cultivos de ají y pimentón en zonas con ataques críticos del insecto tales como Yotoco, Vijes, La Unión y Rozo.
Agradecimientos
Los autores expresan su agradecimiento al Ministerio de Agricultura y Desarrollo Rural por la financiación de este trabajo de investigación.
Literatura citada
ANDERSON, P. 2005. Introduction. pp. 1-11. In: Anderson, P.; Morales, F. (Eds.). Whitefly and Whitefly-Borne Viruses in the Tropics: Building a Knowledge Base for Global Action. Centro Internacional de Agricultura Tropical CIAT. Cali. Colombia. 351 p. [ Links ]
APRD 2009. Arthropod Pesticide Resistance Database. Disponible en: http://www.pesticideresistance.org/search/12/0/38/0/. Fecha revisión: 29 noviembre 2009. [ Links ]
BUSVINE, J. R. 1971. A critical review of the techniques for testing insecticides. Commonwealth Agricultural Bureau. The Commonwealth Institute of Entomology, 56 Queens Gate, London. 345 p. [ Links ]
CABALLERO, R. 1994. Clave de campo para inmaduros de moscas blancas en Centroamérica (Homoptera: Aleyrodidae). Escuela Agrícola Panamericana, Departamento de Protección Vegetal, Sección de Entomología. El Zamorano (Honduras). 4 p. [ Links ]
CAHILL, M.; GORMAN, K.; DAY, S.; DENHOLM, I. 1996. Baseline determination and detection of resistance to imidacloprid in Bemisia tabaci (Homoptera: Aleyrodidae). Bulletin of Entomological Research. 86: 343-349. [ Links ]
CARDONA, C.; RENDÓN, F.; GARCIA, J.; LÓPEZ-ÁVILA, A.; BUENO, J.; RAMÍREZ, J. 2001. Resistencia a insecticidas en Bemisia tabaci y Trialeurodes vaporariorum (Homoptera: Aleyrodidae) en Colombia y Ecuador. Revista Colombiana de Entomología 27 (1-2): 33-38. [ Links ]
CARDONA, C.; RENDÓN, F.; RODRÍGUEZ. I.; LÓPEZ-ÁVILA, A. 2005. Whiteflies as pests of annual crops in the tropical highlands of Latin America: Insecticide resistance in Colombia and Ecuador. pp. 285-293. In: Anderson, P.; Morales, F. (Eds.). Whitefly and Whitefly-Borne Viruses in the Tropics: Building a Knowledge Base for Global Action. Centro Internacional de Agricultura Tropical CIAT. Cali. Colombia. 351 p. [ Links ]
CIAT 2007. Annual Report Improved Beans for the Develomping World. Centro Internacional de Agricultura Tropical. Cali. p. 205-210. [ Links ]
CROWDER, D.; DENNEHY, T.; ELLERS-KIRK, C.; YAFUSO, C.; ELLSWORTH, P.; TABASNIK, B.; CARRIERE, Y. 2007. Field evaluation of resistance to pyriproxifen in Bemisia tabaci (B biotype). Journal of Economic Entomology 100 (5): 1650-1656. [ Links ]
DARDÓN, D. E. 1992. Las moscas blancas en Guatemala. pp. 38-41. En: Hilje, L.; Arboleda, O. (Eds.). Las moscas blancas en América Central y el Caribe. Memorias del Taller Centroamericano y del Caribe sobre moscas blancas, Turrialba, Costa Rica. [ Links ]
DITTRICH, V.; UK, S.; ERNST, H. 1990. Chemical control and insecticide resistance of whiteflies. pp. 263-285. In: Gerling, D. (Ed.). Whiteflies: Their Bionomics, Pest Status and Management. Intercep Limited. Andover. UK. 348 p. [ Links ]
DONG, C.; ZHANG, Y.; BIN, C.; BAOYUN, X.; QINGJUN, W.;GUOREN, Z. 2005. Sequence analysis of mtDNA COI gene and molecular phylogeny of different geographical populations of Bemisia tabaci (Gennadius). Agricultural Sciences in China 4 (7): 533-541. [ Links ]
ERDOGAN, C.; GRAHAM, D.; OKTAY, M.; GORMAN, K.; DENHOLM, I. 2008. Insecticide resistance and biotype status of populations of the tobacco whitefly Bemisia tabaci (Hemiptera: Aleyrodidae) from Turkey. Crop Protection 27: 600-605. [ Links ]
GAWEL, N.J.; BARTLETT, A.C. 1993. Characterization of differences between whiteflies using RAPD-PCR. Insect. Molecular Biology 2: 33-38. [ Links ]
GORMAN, K.; WREN, J.; DEVINE, G.; DENHOLM, I. 2003. Characterization of neonicotinoid resistance in Bemisia tabaci from Spain. pp. 783-788. En: British Crop Protection Council (Eds.). The BCPC International Congress: Crop Science and Technology Vol. 1 y 2. Glasgow. Escocia. 900 p. [ Links ] [ Links ]
JARA, L. A. 1998. Caracterización de la incidencia y manejo de mosca blanca en el valle de Comayagua. Tesis de Grado, Departamento de Protección Vegetal, Escuela Agrícola Panamericana (EAP), El Zamorano, HN. 84 p. [ Links ]
KONTSECLALOV, S.; GOTTLIEB, Y.; ISHAAYA, I.; NAUEN, R.; HOROWITZ, R.; GHANIM, M. 2009. Toxicity of spirome-sifen to the developmental stages of Bemisia tabaci biotype B. Pest Management Science 65 (1): 5-13. [ Links ]
LIU, T.X. 2004. Toxicity and efficacy of spiromesifen, a tetronic acid insecticide, against sweetpotato withefly (Homoptera: Aleyrodidae) on melons. Crop Protection 23: 505-513. [ Links ]
MA, D.; GORMAN, K.; DEVINE, K.; LUO, W.; DENHOLM, I. 2007. The biptype and insecticide resistance status of Bemisia tabaci (Hemiptera : Aleyrodidae) invading cropping systems in Xinjiang Uygur Autonomus Region, northwestern China. Crop Protection 26: 612-617. [ Links ]
MARTÍNEZ-CARRILLO, J.; SERVIN-VILLEGAS, R.; NAVA-CAMBEROS, U.; CORTEZ-MONDACA, E.; GARCÍA-HERNÁNDEZ, J. 2006. A five-year study of insecticide resistance in whitefly Bemisia argentifolii Bellows & Perring from the Yaque Valley, Mexico. Southwestern Entomologist 31 (4): 307-320. [ Links ]
MARTÍNEZ-CARRILLO, J. L.; BROWN, J. K. 2007. First Report of the Q Biotype of Bemisia tabaci in Southern Sonora, Mexico. Phytoparasitica 35 (3): 282-284. [ Links ]
MORALES, F. 2005. Whiteflies as vectors of viruses in legume and vegetable mixed cropping systems in the Tropical lowlands of Central America, Mexico and the Caribbean. pp. 173-203. En: Anderson, P.; Morales, F. (Eds.). Whitefly and Whitefly-Borne Viruses in the Tropics: Building a Knowledge Base for Global Action. Centro Internacional de Agricultura Tropical CIAT. Cali. Colombia. 351 p. [ Links ]
NAUEN, R.; SUTUMPF, N.; ELBERT, A. 2002. Toxicological and mechanistic studies on neonicotinoid cross resistance in Q-type Bemisia tabaci (Hemiptera: Aleyrodidae). Pest Management Science 58: 868-875. [ Links ]
NAUEN, R.; BRESCHNEIDER, T.; ELBERT, A.; FISCHER, R.; TIENANN, R. 2003. Spirodiclofen y spiromesifen. Pesticide Outlook 14 (6): 243-245. [ Links ]
PALUMBO, J.; HOROWITZ, A; PRABHAKER, N. 2001. Insecticidal control and resistance management for Bemisia tabaci.Crop Protection 20 (9): 739-765. [ Links ]
PERRING, T. M. 2001. The Bemisia tabaci complex. Crop Protection 20 (9): 725-735. [ Links ]
PLAPP, F. W.; JACKMAN, J. A.; CAMPANHOLA, C.; FRISBIE, R. E.; GRAVES, J. B.; LUTRELL, R. G.; KITTEN, W. F.; WALL, M. 1990. Monitoring and management of pyrethroid resistance in the tobacco budworm (Lepidoptera: Noctuidae) in Texas, Mississippi, Louisiana, Arkansas, and Oklahoma. Journal of Economic Entomology 33 (2): 335-341. [ Links ]
PRABHAKER, N.; COUDRIET, D.; MEYERDIRK, D. 1985. Insecticide resistance in the sweetpotato whitefly Bemisia tabaci (Homoptera: Aleyrodidae). Journal of Economic Entomology 78: 748-752. [ Links ]
PRABHAKER, N.; CASTLE, S.; HENNEBERRY, T. J.; TOSCANO, N. C. 2005. Assessment of cross-resistance potential to neonicotinoid insecticides in Bemisia tabaci (Hemiptera: Ale-yrodidae). Bulletin of Entomological Research 95 (6): 535-543. [ Links ]
QUINTERO, C.; CARDONA, C.; RAMÍREZ, D.; JIMÉNEZ, N. 1998. Primer registro del biotipo B de Bemisia tabaci (Homoptera: Aleyrodidae) en Colombia. Revista Colombiana de Entomología 24 (1-2): 23-28. [ Links ]
QUINTERO, C.; RENDÓN, F.; GARCÍA, J.; CARDONA, C.; LÓPEZ-ÁVILA, A.; HERNÁNDEZ, P. 2001. Especies y biotipos de moscas blancas (Homoptera: Aleyrodidae) en cultivos semestrales de Colombia y Ecuador. Revista Colombiana de Entomología 27 (1-2): 27-31. [ Links ]
RODRÍGUEZ, I.; CARDONA, C. 2001. Problemática de Trialeurodes vaporariorum y Bemisia tabaci (Homoptera: Aleyrodidae) como plagas de cultivos semestrales en el Valle del Cauca. Revista Colombiana de Entomología 27 (1-2): 21-26. [ Links ]
RODRÍGUEZ, I.; DURÁN, I.; MORALES, H.; CARDONA, C. 2003a. Líneas base, dosis diagnóstico y medición periódica de resistencia a imidacloprid, spinosad y carbosulfan en poblaciones de adultos de Thrips palmi (Thysanoptera: Thripidae) en el Valle del Cauca, Colombia. Revista Colombiana de Entomología 29 (1): 29-33. [ Links ]
RODRÍGUEZ, I.; MORALES, H.; CARDONA, C. 2003b. Líneas base, dosis diagnóstico y medición periódica de resistencia a insecticidas en poblaciones de adultos e inmaduros de Trialeurodes vaporariorum (Homoptera: Aleyrodidae) en el Valle del Cauca, Colombia. Revista Colombiana de Entomología 29 (1): 21-27. [ Links ]
RODRÍGUEZ, I.; MORALES, H.; BUENO, J.; CARDONA, C. 2005. El biotipo B de Bemisia tabaci (Homoptera: Aleyrodidae) adquiere mayor importancia en el Valle del Cauca. Revista Colombiana de Entomología 31 (1): 21-28. [ Links ]
SAS Institute Inc. 2000. SAS User's guide version 8.1. SAS Institute, Cary, North Carolina, USA. [ Links ]
SEDILES, A. 1998. La mosca blanca Bemisia tabaci (Gennadius) en Nicaragua: Historia y problemática. Informe Universidad Nacional Agraria (UNA). Nicaragua. 23 p. [ Links ]