Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.1 Bogotá Jan./June 2012
Selección artificial de resistencia a lambda-cialotrina en Aedes aegypti y resistencia cruzada a otros insecticidas
Artificial selection of insecticide resistance to lambda-cyhalothrin in Aedes aegypti and cross resistance to other insecticides
DUVERNEY CHAVERRA-RODRÍGUEZ1,2, NICOLÁS JARAMILLO-OCAMPO1,3 e IDALYD FONSECA-GONZÁLEZ1,4
1 Grupo Biología y Control de Enfermedades Infecciosas (BCEI). Universidad de Antioquia. Medellín. Colombia. AA. 1220.
2 M. Sc. Investigador Asociado. duverney@gmail.com. Autor para correspondencia.
3 M. Sc. Dr. Sc. Profesor Titular. nicolas.jaramillo@siu.udea.edu.co.
4 M. Sc. Dr. Sc. Profesor Asistente. idalyd.fonseca@siu.udea.edu.co.
Recibido: 7-dic-2011 - Aceptado: 28-may-2012
Resumen: Aedes aegypti es el principal vector del dengue alrededor del mundo. El control químico de larvas y adultos se basa principalmente en insecticidas organofosforados y piretroides; para los cuales se ha registrado el desarrollo de resistencia en campo. El manejo de la resistencia requiere evaluar la rapidez con la que ésta se desarrolla y la posible generación de resistencia cruzada entre ambos grupos de insecticidas. Este estudio evaluó durante siete generaciones el efecto de la selección con lambda-cialotrina sobre Ae. aegypti en el desarrollo de la resistencia a este piretroide y sus consecuencias en la aparición de resistencia cruzada a los insecticidas temefós, malatión y permetrina en condiciones de laboratorio. Se obtuvieron adultos a partir de larvas colectadas en campo en Cúcuta (Colombia) y sus descendientes fueron expuestos a concentraciones del insecticida incrementadas gradualmente cada generación. El desarrollo de la resistencia fue confirmado usando bioensayos en larvas y adultos. La selección incrementó los grados de resistencia (GR) en cada generación (1,25X promedio). La población de la generación F7 fue altamente resistente a lambda-cialotrina en adultos (F1 = 100% mortalidad disminuyó a F7 = 35% de mortalidad) y larvas (GR 50 F1 = 24,22X hasta GR50 F7 = 61,52X) al compararla con la cepa de referencia en susceptibilidad Rockefeller. La cepa resistente a lambda-cialotrina no presentó resistencia cruzada con temefós y malatión (organofosforados), pero sí a permetrina (piretroide). La información obtenida sugiere que la rotación de piretroides con organofosforados continúa siendo una alternativa apropiada para manejar la aparición de la resistencia en las estrategias de control del dengue.
Palabras clave: Resistencia a insecticidas. Insecticidas organofosforados. Insecticidas piretroides. Estrategias de control. Dengue.
Abstract: Aedes aegypti is the main vector of dengue virus worldwide. The chemical control of larvae and adults is based principally on organophosphate and pyrethroid insecticides, for which resistance has developed in the field. The management of resistance requires evaluating how rapidly it can develop and the possible generation of cross-resistance between both groups of insecticides. This study evaluates the effects of selection on Ae. aegypti with lambda-cyhalo-thrin on the development of resistance to this pyrethroid over seven generations and its impact on the appearance of cross-resistance to temephos, malathion, and permethrin insecticides under laboratory conditions. Adults were obtained from larvae collected in the field in Cúcuta (Colombia) and the descendants were exposed to gradually increasing concentrations of insecticides each generation. The development of resistance was confirmed using bioassays on the larvae and adults. Selection increased the ratio of resistance (RR) in each generation (1.25X average). At generation F7, the population was highly resistant to lambda-cyhalothrin for both adults (100% mortality in F1 decreased to 35% mortality in F7) and larvae (RR50 F1 = 24.22 X, RR50 F7 = 61.52 X) when compared to the susceptibility of Rockefeller, the reference line. The line resistant to lambda-cyhalothrin did not present cross-resistance to temephos and malathion (organophosphates), but did present resistance to permethrin (pyrethroid). The information obtained suggests that the rotation of organophosphates and pyrethroids continues to be an appropriate alternative for managing the appearance of resistance on dengue control strategies.
Key words: Insecticide resistance. Organophosphate insecticides. Pyrethroid insecticides. Control strategies. Dengue.
Introducción
La fiebre por dengue (FD) y la Fiebre hemorrágica por dengue (FDH) son manifestaciones clínicas de la infección viral con un arbovirus de la familia Flaviviridae transmitido al hombre por el mosquito Aedes aegypti Linnaeus, 1762 (Diptera: Culicidae). Esta enfermedad afecta anualmente más de 50 millones de personas causando más de 100 mil muertes y se reporta un incremento en su incidencia en más de 70 países alrededor del mundo (OMS 2010).
En Colombia, la FD y la FDH están ampliamente distribuidas en todo el país, pero su incidencia es marcada en 5 departamentos: Antioquia, Huila, Santander, Valle del Cauca y Norte de Santander. Este último departamento, ha presentado más de 13 mil casos de FD y 14 muertes desde 2004 de los cuáles, el 80% ocurren en el municipio de Cúcuta (SIVIGILA 2010). La ciudad de Cúcuta carece de un sistema de agua potable permanente, lo que obliga a sus habitantes a almacenar agua en grandes tanques y otro tipo de recipientes que se convierten en sitios apropiados para la reproducción y crecimiento de Ae. aegypti. El control vectorial del dengue en la ciudad ha incluido estrategias como el tratamiento focal, que consiste en la detección, destrucción de criaderos y la aplicación de larvicidas como el temefós (Abate® o Instarfox®), y además, tratamientos espaciales y perifocales con aerosoles de insecticidas organofosforados (fenitrotión y malatión) y piretroides (lambda-cialotrina, deltametrina o permetrina) a ultrabajo volumen (ULV) (Cárdenas 2008). Los piretroides se han usado en la ciudad a partir del año 2000, con moléculas como lambda-cialotrina y deltametrina y resultados inicialmente exitosos. Sin embargo, la aplicación de insecticidas ha conllevado a la aparición de resistencia en algunas localidades de la ciudad, lo que puede signiF1car un problema serio para el control de las poblaciones de Ae. aegypti (Alcaldía de San José de Cúcuta-Secretaría de Salud 2008). El manejo de la resistencia a insecticidas debe ser una prioridad en las estrategias de control de vectores y es fundamental reconocer como esta se desarrolla bajo distintas condiciones ambientales y en diferentes poblaciones del vector (Hemingway y Ranson 2000).
Cárdenas (2008) detectó pérdida de susceptibilidad en larvas y adultos de Ae. aegypti el barrio Ospina Pérez a insecticidas como temefós y lambda-cialotrina. El barrio Los Comuneros ha tenido una gran presión de uso de insecticidas debido a los altos índices de Breteau (68) y el número de casos (138 entre 2006 y 2008). La resistencia a ambos insecticidas ha sido documentada en otros estudios en algunas islas del Caribe (Rawlins y Wan 1995; Wirth y Georghiou 1999), Venezuela (Molina et al. 1995), Brasil (Da-Cunha et al. 2005, Melo-Santos et al. 2010), México (Flores et al. 2006) y Cuba (Rodríguez 2008), entre otros. Estos estudios muestran un desarrollo rápido de la resistencia a ambos insecticidas y sobre todo a piretroides.
Un aspecto importante en el manejo de la resistencia a insecticidas es la comprensión de cómo ésta se desarrolla bajo diferentes presiones selectivas y si la selección de resistencia con un insecticida podría llevar a la resistencia para otros insecticidas de acción similar o distinta. (Hemingway y Ranson 2000). Se ha evaluado las tasas de evolución de la resistencia y la resistencia cruzada con otros insecticidas en Ae. aegypti seleccionado artiicialmente en laboratorio para resistencia a temefós (Rawlins y Wan 1995; Wirth y Georghiou 1999; Rodríguez 2008; Tikar et al. 2009) y lambda-cialotrina (Ocampo et al. 2011) pero no se conocen estas tasas para la evolución de la resistencia a lambda-cialotrina en larvas y adultos de Ae. aegypti de la ciudad de Cúcuta. Así mismo se desconoce si la presión de selección con este insecticida podría generar resistencia cruzada a otros insecticidas. El objetivo de este trabajo fue establecer las tasas de desarrollo de resistencia mediante selección artiicial con el insecticida lambda-cialotrina en Ae. aegypti del barrio Los Comuneros y estudiar el desarrollo de resistencia cruzada a insecticidas organofosforados y piretroides usados para el control de este mosquito en esta localidad.
Materiales y Métodos
Área de estudio. Larvas y pupas se colectaron en diferentes lugares de cría dentro de domicilios en agosto de 2008 en el barrio Los Comuneros (7°54'54,42"N 72°31'44,82"W), municipio de Cúcuta, Colombia. Desde 1998, en esta ciudad se han presentado tasas de infección en seres humanos con el virus del dengue superiores a 114 casos/100.000 habitantes. La localidad ha sido expuesta frecuentemente a diferentes insecticidas para el control de la enfermedad (Tabla 1).
Cría de mosquitos. Las larvas fueron criadas en bandejas plásticas de dos litros de capacidad. Las condiciones de cría fueron 28 ± 1°C de temperatura, 70 ± 5% de humedad relativa y un fotoperiodo de 12:12 (luz: oscuridad). Las larvas se alimentaron con comida para peces (Baby Fish®) siguiendo un régimen estándar (Bedhomme et al. 2003). Una vez que las larvas alcanzaron el estado adulto, estos fueron trasladados a jaulas de 25 x 25 x 25 cm y allí los mosquitos fueron alimentados con solución de agua azucarada al 10% y con sangre de ratón cada dos días. La cepa de laboratorio Rockefeller se mantuvo en paralelo bajo las mismas condiciones ambientales y fue usada como referencia de susceptibilidad a los insecticidas evaluados.
Insecticidas. Los insecticidas lambda-cialotrina (99%), permetrina (99%), malatión (98%) y temefós (99%) fueron adquiridos en Chem Service (West Chester, USA). A partir de estas presentaciones puras se prepararon 10 ml de solución stock a 100, 50, 30, 20, 10, 5, 1 y 0,1 µg/ml en acetona para realizar los bioensayos de susceptibilidad y la presión de selección con lambda-cialotrina.
Bioensayos en larvas. La susceptibilidad de las larvas a los insecticidas evaluados antes y durante la selección se evaluó usando la metodología estándar de la OMS (WHO 1981). Los bioensayos consistieron en exponer veinte larvas de cuarto instar temprano a seis concentraciones de los insecticidas que produjeran entre 2-90% de mortalidad, preparadas en 100 ml de agua declorinada y ajustando con 1 ml de solución stock de insecticida. En cada bioensayo se hicieron tres repeticiones para cada concentración. Como testigo se usó una solución de un mililitro de acetona en 100 ml de agua declorinada. Cada bioensayo fue duplicado.
Selección de la resistencia a lambda-cialotrina en larvas.
Entre mil y dos mil larvas de cada generación se expusieron durante 24 horas a la concentración letal 50 (CL50) del insecticida lambda-cialotrina calculada para esa generación mediante los bioensayos en larvas. Los adultos obtenidos de las larvas sobrevivientes fueron criados como se mencionó anteriormente hasta obtener huevos. Las larvas obtenidas de estos huevos fueron usadas para estimar el cambio en los grados de resistencia entre generaciones usando la metodología de bioensayos en larvas de la OMS (WHO 1981) y para continuar con la selección, exponiéndolas a la CL50 calculada mediante el bioensayo de la OMS. La susceptibilidad de los adultos a lambda-cialotrina fue evaluada en cada generación usando la metodología de las botellas impregnadas del CDC (Brogdon y McAllister 1998).
Bioensayos de adultos. Los ensayos estandarizados del CDC (Brogdon y McAllister 1998) fueron usados para evaluar la susceptibilidad de los adultos a los insecticidas evaluados antes y durante la selección con lambda-cialotrina. En cada bioensayo se usaron cuatro botellas impregnadas con las dosis diagnósticas para cada uno de los insecticidas usados, que fueron previamente reportadas por Fonseca-González (2008), de la misma manera se utilizaron los tiempos diagnósticos reportados par a estos insecticidas por la misma autora. En cada botella se expusieron veinte hembras de tres días de edad alimentadas exclusivamente con agua azucarada. Como control se usó una botella impregnada con acetona. Cada bioensayo fue triplicado.
Resistencia cruzada. Se realizaron bioensayos en las larvas y adultos provenientes de las generaciones F1 (parental) y F7 (resistente) para evaluar el estatus de susceptibilidad de la población seleccionada a los insecticidas lambda-cialotrina, permetrina, malatión y temefós.
Análisis de datos. Las concentraciones letales 50 y 90 (CL50, CL90) se calcularon mediante análisis probit (Finney 1971) usando el programa de Raymond (Raymond 1985). La mortalidad fue corregida usando la fórmula de Abott (Abbott 1925). El análisis estadístico de las concentraciones letales CL50 y CL90 se basó en el sobresolapamiento de los intervalos de confianza del 95%. Los grados de resistencia (GR) se definieron como el cociente entre un valor de concentración letal de la cepa evaluada y la misma concentración de la cepa Rockefeller.
Los GR se interpretaron de la siguiente manera: Si GR > 10X la población es resistente; Si 5X < GR > 10X la población es tolerante; F1nalmente, Si GR < 5X la población es susceptible (Mazzarri y Georghiou 1995). Por otro lado la interpretación de los resultados en los bioensayos en adultos se hizo tomando la mortalidad en el tiempo diagnóstico para cada insecticida. Si la mortalidad fue menor al 80% la población es resistente, si la mortalidad fue igual o superior al 98% la población es susceptible y si la mortalidad está entre el 80% y el 98% la población se catalogó como en vigilancia.Resultados
Estatus de susceptibilidad inicial a los diferentes insecticidas
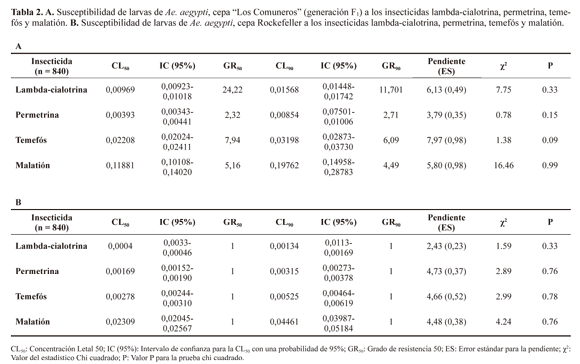
Larvas. Las larvas de la generación F1 de Ae. aegypti mostraron diferencias en su susceptibilidad a los insecticidas evaluados (Tabla 2A-B). Se observó susceptibilidad disminuida, evidenciada por valores altos de GR50 para los insecticidas: lambda-cialotrina, temefós y malatión (24,22X; 7,94X y 5,16X respectivamente). No se encontró resistencia al insecticida permetrina (GR50 = 2,32X).
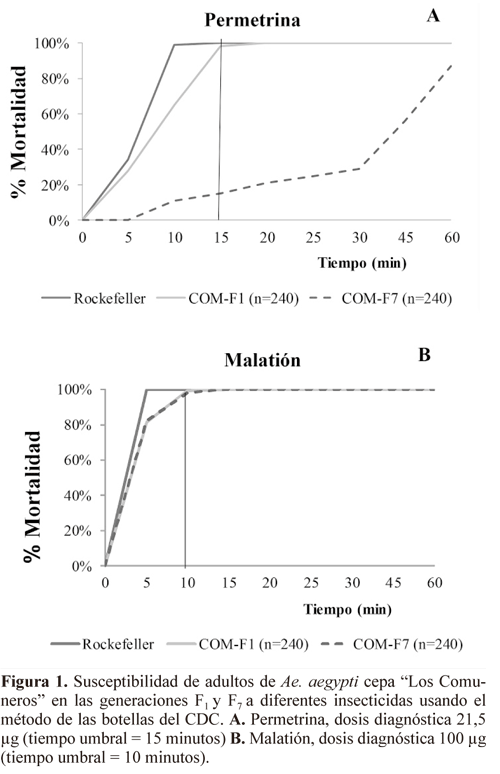
Adultos. Los adultos de la generación F1 de la población "Los Comuneros" mostraron susceptibilidad a todos los insecticidas: lambda-cialotrina (100% a los 10 minutos), malatión (100% a los 10 minutos) y permetrina (98% a los 15 minutos) (Figs. 1A y B ).
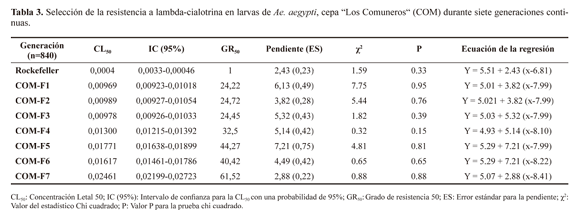
Respuesta a la selección. En todas las generaciones, los valores de x2 indicaron que la respuesta en susceptibilidad a lambda-cialotrina se ajustaron a un modelo lineal. Las pendientes de las líneas de regresión variaron entre 2,43 y 7,21;generación F7. Un incremento gradual también ocurrió para la CL90 (desde 0,01568 mg/l hasta 0,0681mg/l). La tasa de incremento en GR por generación fue en promedio de 1,2 en ambas concentraciones letales (50 y 90), sin embargo, fue más alta entre la generación F6 a la generación a la F7 (1,5 en CL50 y 2,18 en la CL90). Después de siete generaciones de selección con lambda-cialotrina se observó un incremento en 2,53 veces la CL50 con respecto a la generación F1(Tabla 3).
El incremento en las concentraciones letales 50 (CL50), sus intervalos de confianza y grados de resistencia de cada generación se muestran en la tabla 3. Bajo la selección con lambda-cialotrina, la CL50 se incrementó desde 0,00969 mg/l (GR50 = 24,22X) hasta 0,0246 mg/l (GR50 = 61,52X) en la generación F7. Un incremento gradual también ocurrió para la CL90 (desde 0,01568 mg/l hasta 0,0681mg/l). La tasa de
incremento en GR por generación fue en promedio de 1,2 en ambas concentraciones letales (50 y 90), sin embargo, fue más alta entre la generación F6 a la generación a la F7 (1,5 en CL50 y 2,18 en la CL90). Después de siete generaciones de selección con lambda-cialotrina se observó un incremento en 2,53 veces la CL50 con respecto a la generación F1(Tabla 3).
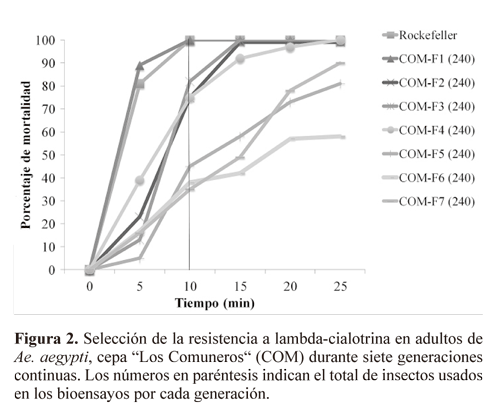
Se observó que la resistencia a lambda-cialotrina desarrollada por la selección en larvas también se expresó en adultos. Este estado mostró susceptibilidad al insecticida en la generación F1 (100% mortalidad en 10 minutos), pero en cada generación después de la selección esta susceptibilidad disminuyó gradualmente hasta la generación F7 (35% de mortalidad) (Fig. 2).
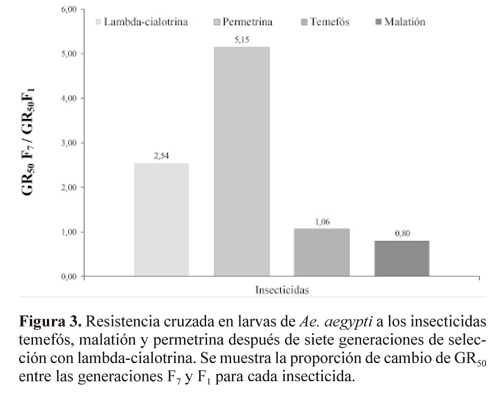
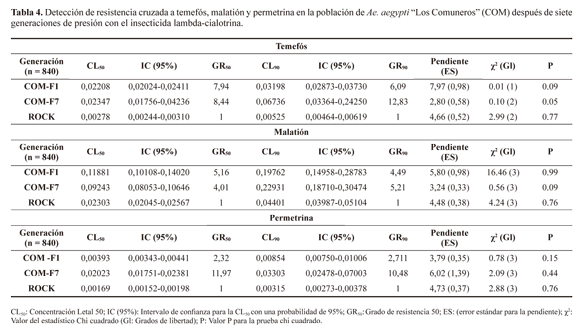
Resistencia cruzada. Después de llevar a cabo la selección con lambda-cialotrina en la generación F7, no se presentó resistencia cruzada a los insecticidas organofosforados temefós y malatión, pero sí al piretroide permetrina, en larvas y adultos (Fig. 3 y Tabla 4). Para este insecticida, el incremento en los GR50 entre la generación F7 y F1 fue de 5,16 veces, un valor dos veces mayor que el incremento observado en lambda-cialotrina (diferencias estadísticas significativas mediante el análisis de los intervalos de confianza). Los insecticidas organofosforados no mostraron ningún incremento estadísticamente significativo (fig. 3).
Discusión
Susceptibilidad a insecticidas. El valor de GR50 a lambdacialotrina que presentó Ae. aegypti cepa "Los Comuneros" (24,22X) da evidencia de la presencia de alelos de resistencia en la población. Dicho valor podría ser explicado por la aplicación frecuente del insecticida lambda-cialotrina usando equipo ULV. En esta localidad se ha observado que dicha aplicación puede alcanzar algunos criaderos naturales y artificiales de las larvas, ejerciendo presión selectiva sobre ese estado de desarrollo, incrementando el riesgo de desarrollar resistencia en los adultos. Una explicación complementaria es que la resistencia se haya alcanzado por el desarrollo de resistencia cruzada debido al uso de temefós o malatión. Rodríguez et al. (2003) mostraron que la presión durante cinco generaciones con malatión en larvas de Ae. aegypti de Cuba, no seleccionó una alta resistencia para ese insecticida pero si para piretroides como deltametrina y lambda-cialotrina, lo cual estaría apoyando esta idea. De manera similar Tikar et al. (2009) mostraron que la selección de resistencia a temefós en larvas puede generar resistencia cruzada con el piretroide permetrina en adultos y aunque los autores mencionados no evaluaron el insecticida lambda-cialotrina, es probable que ocurra algo similar dado que ambos insecticidas pertenecen al mismo grupo químico, los piretroides. Se espera que la resistencia a temefós se desarrolle en áreas donde se aplica éste insecticida de manera frecuente (Georghiou et al. 1987; Wirth y Georghiou 1999; Rodríguez et al. 2002; Braga et al. 2004; Carvalho et al. 2004; Luna et al. 2004). Los resultados presentados concuerdan con esta predicción en el barrio "Los Comuneros" en donde se viene presionando con este insecticida por más de 2 años continuos y las larvas presentan un GR50 de 7,5X. Si bien para este estudio no es posible demostrar que el desarrollo de la tolerancia a temefós haya generado resistencia cruzada con lambda-cialotrina, los resultados de Rodríguez et al. (2002, 2004, 2005) y Melo-Santos et al. 2010 apoyan la posibilidad de que esto ocurra.
En el presente estudio no se observó resistencia a permetrina en la población parental, esto puede deberse a que la ausencia de este insecticida en los programas de control en los años previos a este estudio, no haya seleccionado la resistencia para este insecticida aún. Lo que sugiere que la resistencia observada al temefós no está relacionada en este caso con resistencia a permetrina.
En cuanto al insecticida malatión, se observó una pérdida moderada de la susceptibilidad en larvas (GR50 = 5,16X) pero no en adultos de Ae. aegypti . Malatión es un insecticida usado para el control de adultos y los reportes de desarrollo de resistencia están ampliamente documentados para otros mosquitos, pero no para Ae. aegypti (Hemingway y Karunaratne 1998). Aunque Macoris et al. (2007) demostraron la presencia de poblaciones resistentes de Ae. aegypti en Brazil, parece que ésta no se ha dispersado todavía en Suramérica. Los niveles de resistencia detectados en la cepa Los Comuneros pueden ser productos de un mecanismo compartido con temefós, como ha sido reportado previamente por Rodríguez et al. (2002).
Respuesta a la selección. Los datos mostraron un incremento en el GR50 de 2,53 veces en la generación F7 comparado con la generación F1. Se ha reportado ampliamente que la variación en las tasas de desarrollo de la resistencia dependen de factores genéticos, biológicos y operacionales asociados con el control de los mosquitos tales como el origen geográico de las poblaciones, el insecticida usado y la dosiicación a la que se somete (Paeporn et al. 2004a, 2004b; Rodríguez et al. 2002, 2003, 2005; Hamdan et al. 2005; Bisset et al. 2006; Tikar et al. 2009). También, es conocido que la velocidad y grado de desarrollo de la resistencia depende de la frecuencia y el tipo de genes de resistencia en la población, la dosiicación de insecticida usada y la frecuencia de la aplicación, (Nazni et al. 1998). Rodríguez et al. (2002) observaron un aumento de tres veces los GR en tan sólo cuatro generaciones con selección a temefós en una cepa de Ae. aegypti de Cuba. Mientras que Tikar et al. (2009) observaron un incremento en 1,89 veces en cinco generaciones para selección con temefós en India. En Colombia, Ocampo et al. 2011 usando el parámetro tiempo letal 50 (TL50), mostraron que las tasas de desarrollo de resistencia en adultos de Ae. aegypti seleccionados en laboratorio con lambda-cialotrina incrementaron gradualmente a una tasa similar a la de las larvas y adultos en el presente estudio (1,2 veces en cada generación sometida a selección). La población "Los Comuneros" tenía el potencial de ser seleccionada para ser resistente a lambda-cialotrina y se observó un alto nivel de resistencia en sólo siete generaciones. Calculando tiempos generacionales cercanos a 30 días para Ae. aegypti podrían alcanzarse altos valores de resistencia en menos de siete meses de aplicación de las concentraciones usadas en este estudio.
En estudios similares se ha visto como la resistencia obtenida mediante la presión de selección en un estadio permanece en otros, aun cuando estos se encuentren en hábitats distintos (Nazni et al. 1998; Hamdan et al. 2005). En el presente estudio la resistencia observada en larvas permaneció en el estado adulto y generó un patrón de pérdida de susceptibilidad gradual en cada generación. El mecanismo de acción por el cual las larvas son resistentes a lambda-cialotrina no se exploró en este estudio, pero la permanencia en el estado adulto sugiere que debe estar relacionado con genes que se expresan en ambos estadios. Es necesario realizar pruebas bioquímicas o moleculares para determinar si estos genes están asociados con enzimas de detoxificación o con un mecanismo tipo kdr.
Resistencia cruzada. La resistencia cruzada a permetrina y la ausencia de resistencia cruzada a insecticidas organofos-forados, sugieren la presencia de un mecanismo común de resistencia a piretroides como puede ser la sobreexpresión de las oxidasas dependientes de citocromo P450 y/o la presencia de alteraciones en los canales de sodio dependiente de voltaje (resistencia "knockdown" o kdr) (Hemingway y Ranson 2000). Considerando que en Colombia, la resistencia a DDT se encuentra generalizada en Ae. aegypti (Fonseca-González et al. 2011), y que este organoclorado y los piretroides tienen su blanco de acción sobre los canales de sodio, es posible que como resultado del uso continuo del DDT durante más de 40 años en Colombia, mutaciones tipo kdr asociadas con la ijación de la resistencia a DDT estén relacionadas también con la rápida evolución de la resistencia a piretroides. Ensayos posteriores encaminados a determinar el mecanismo particular de resistencia presente en la población seleccionada ayudaran a aclarar este punto.
Aunque fue evidente que no se desarrolló resistencia cruzada con organofosforados, las predicciones de resistencia cruzada para lambda-cialotrina deben hacerse con mucho cuidado. Los genes responsables de conferir resistencia a un compuesto, podrían extender su efecto a compuestos que comparten la misma ruta metabólica o sitio blanco. Por lo tanto, si un compuesto puede seleccionar diferentes grupos de genes a la vez, la respuesta en resistencia cruzada podría confundirse (Selvi et al. 2005). En otros estudios se ha visto que el desarrollo de resistencia cruzada es poco predecible pues depende de los alelos en cuestión que se estén seleccionando (Rodríguez et al. 2002, 2003). Sin embargo demostrar la posibilidad de que dicha resistencia ocurra es un buen indicador de lo que podría pasar en campo y advertir sobre las estrategias más apropiadas para evitarlo.
Este estudio señala la posibilidad de que los insectos adultos de Ae. aegypti de "Los Comuneros" puedan desarrollar resistencia a lambda-cialotrina en campo y de desarrollar resistencia cruzada con el piretroide permetrina en siete generaciones (aproximadamente siete meses). Es indispensable que los métodos de control continúen usando la rotación de insecticidas como estrategia que disminuye la presión de selección. Con la información obtenida se sugiere que en la rotación de productos se mantenga el insecticida malatión para evitar la aparición de resistencia a lambda-cialotrina y el desarrollo de resistencia cruzada a otros insecticidas.
Agradecimientos
Los autores agradecen a A. Dapper por la revisión del manuscrito, a COLCIENCIAS (Proyecto código: 1115-343-19131) por la inanciación del trabajo y a la Secretaria de Salud de Norte de Santander por el apoyo logístico durante las salidas de campo.
Literatura citada
ABBOTT, W. 1925. Method of computing the effectiveness of an insecticide. Journal of Economical Entomology 18: 265-267. [ Links ]
ALCALDÍA DE SAN JOSÉ DE CÚCUTA-SECRETARÍA DE SALUD. 2008. Adquisición de insecticida adulticida y larvicida para el Control químico de los vectores del dengue, paludismo, fiebre amarilla y Chagas. Circular Análisis de conveniencia y oportunidad 12 p. [ Links ]
BEDHOMME, S.; AGNEW, P.; SIDOBRE, C.; MICHALAKIS, Y 2003. Sex-specific reaction norms to intraspecific larval competition in the mosquito Aedes aegypti. Journal of Evolutionary Biology 16 (4): 721-730. [ Links ]
BISSET, J.; RODRÍGUEZ, M.; FERNÁNDEZ, D. 2006. Selection of Insensitive Acetylcholinesterase as a Resistance Mechanism in Aedes aegypti (Diptera: Culicidae) from Santiago de Cuba. Journal of Medical Entomology 43 (6):1185-1189. [ Links ]
BRAGA, I.; LIMA, J.; SOARES, S.; VALLE, D. 2004. Aedes aegypti resistance to Temefós during 2001 in several Municipalities in the state of Rio de Janeiro. Sergipe and Alagoas; Brazil. Memorias do Instituto Oswaldo Cruz 99 (2): 199-203. [ Links ]
BROGDON, W.; McALLISTER, J. 1998. Simplification of adult mosquito bioassays through use of time-mortality determinations in glass bottles. Journal of the American Mosquito Control Association 14 (2): 159-164. [ Links ]
CÁRDENAS, R. 2008. Evaluación del estado actual de la susceptibilidad a insecticidas en los principales vectores de malaria; dengue y fiebre amarilla urbana en Norte de Santander; Colombia zona fronteriza con Venezuela e Iniciación de la red de vigilancia de la resistencia a insecticidas. Tesis de Maestría. Magister Scientiae en Protozoología. Núcleo Universitario Rafael Rangel Universidad de los Andes ULA. 98 p. [ Links ]
CARVALHO, M. P.; CALDAS, E.; DEGALLIER, N.; VILARINHOS, P.; SOUZA, L.; YOSHIZAWA, M.; KNOX, M.; OLIVEIRA, C. 2004. Susceptibility of Aedes aegypti larvae to the insecticide Temefós in the Federal District Brazil. Revista de Saúde Pública 8 (5): 623-629. [ Links ]
DA-CUNHA, M.; LIMA, J. B. P.; BROGDON, W. G.; MOYA, G. E.; VALLE, D. 2005. Monitoring of resistance to the pyrethroid cypermethrin in Brazilian Aedes aegypti (Diptera: Culicidae) populations collected between 2001 and 2003. Memorias do Instituto Oswaldo Cruz 100 (4): 441-444. [ Links ]
FINNEY, D. 1971. Probit analysis: a statistical treatment of the sigmoid response curve. Cambridge University Press. London, New York and Melbourne. 333 p. [ Links ]
FLORES, A. E; GRAJALES, J.; SALAS, I.; PONCE, G.; LOZANO, S.; BROGDON, W.; BLACK IV, W.; BEATY, B. 2006. Mechanisms of insecticide resistance in field populations of Aedes aegypti (L.) from Quintana Roo, Southern Mexico. Journal of the American Mosquito Control Association 22: 672677. [ Links ]
FONSECA-GONZÁLEZ, I. 2008. Estatus de la resistencia a insecticidas de los vectores primarios de malaria y dengue en Antioquia; Chocó; Norte de Santander y Putumayo; Colombia. Tesis de doctorado. Medellín. Universidad de Antioquia. 123 p. [ Links ]
FONSECA-GONZÁLEZ, I; QUIÑONES, M.; LENHART, A.; BROGDON, W. 2011. Insecticide resistance status of Aedes aegypti (L.) from Colombia. Pesticide Management Sciences 67 (4): 430-437. [ Links ]
GEORGHIOU, G.; WIRTH, M.; TRAN, H.; SAUME, F.; KNUDSEN, A. 1987. Potential for organophosphate resistance in Aedes aegypti (Diptera:Culicidae) in the Caribbean area and neighboring countries. Journal of Medical Entomology 24 (3):290-294. [ Links ]
HAMDAN, H.; SOFIAN-AZIRUN, M.; AHMAD, N.; LIM, L.2005. Insecticide resistance development in Culex quinquefasciatus (Say); Aedes aegypti (L.) and Aedes albopictus (Skuse) larvae against malathion; permethrin and temephos. Tropical Biomedicine 22 (1): 45-52. [ Links ]
HEMINGWAY, J.; RANSON, H. 2000. Insecticide resistance in insect vectors of human disease. Annual Review of Entomology 43: 371-391. [ Links ]
HEMINGWAY, J.; KARUNARATNE, S. 1998. Mosquito carboxylesterases: a review of the molecular biology and biochemistry of a major insecticide resistance mechanism. Medical and Veterinary Entomology 12: 1-12. [ Links ]
LUNA, J.; MARTINS, M.; ANJOS, A.; KUWABARA, E.; NAVARRO-SILVA, M. 2004. Susceptibility of Aedes aegypti to temephos and cypermethrin insecticides in Brazil. Revista de Saude Publica 38 (6): 842-843. [ Links ]
MACORIS, M.; MACORIS, M.; CAMARGO, V.; CARVALHO, L.; CALDAS, A; BROGDON, W. 2007. Association of insecticide use and alteration on Aedes aegypti susceptibility status. Memorias do Instituto Oswaldo Cruz 102 (8): 895-900. [ Links ]"
MAZZARRI, M.; GEORGHIOU, G. 1995. Characterization of resistance to organophosphate, carbamate, and pyrethroid insecticides in field populations of Aedes aegypti from Venezuela. Journal of the American Mosquito Control Association 11 (3): 315-322. [ Links ]
MELO-SANTOS, M.; VARJAL-MELO, J.; ARAUJO, A.; GOMES, T.; PAIVA M.; REGIS L.; FURTADO, A.; MAGALHAESA, T.; MACORIS, M.; ANDRIGHETTID, M.; AYRESA, C. 2010. Resistance to the organophosphate temephos: Mechanisms, evolution and reversion in an Aedes aegypti laboratory strain from Brazil. Acta Tropica 113 (2): 180-189. [ Links ]
MOLINA, D.; BISSET, J.; RODRIGUEZ, M.; GONZÁLEZ, J.; SALAS, O.; BARAZARTE, H.; SALCEDO, A. 1995. Estudio de la susceptibilidad a insecticidas organosfosforados y piretroides en cepas de Aedes aegypti (Linn). de cinco estados de Venezuela. Boletín de la Dirección de Malariología y Saneramiento Ambiental 4: 85-88. [ Links ]
NAZNI, W.; LEE, H.; SA'DIYAH, I. 1998. Rate of resistance development in wild Culex quinquefasciatus (Say) selected by malathion and permethrin. Southeast Asian Journal of Tropical Medicine & Public Health 29 (4): 849-855. [ Links ]
OCAMPO, C.; SALAZAR-TERREROS, M.J.; MINA, N.J.; MCALLISTER, J.; BROGDON, W. 2011. Insecticide resistance status of Aedes aegypti in 10 localities in Colombia. Acta Tropica 118 (1): 37-44. [ Links ]
OMS, 2010. Dengue y dengue hemorrágico. Nota descriptiva N° 117 Marzo de 2009. Disponible en: http://www.who.int/media-centre/factsheets/fs117/es/index.html [Fecha revisión: 10 enero 2010] [ Links ].
PAEPORN, P.; YAUMPHAN, P.; SUPAPHATHOM, K.;SAVANPANYALERT, P.; WATTANACHAI, P.; PATIMA-PRAKORN, R. 2004a. Insecticide susceptibility and selection for resistance in a population of Aedes aegypti from Ratchaburi Province; Thailand. Tropical Biomedicine 21 (2): 1-8. [ Links ]
PAEPORN, P.; SUPAPHATHOM, K.; SRISAWAT, R.; KOMALA-MISRA, N.; DEESIN, V.; YAUMPHAN, P. 2004b. Biochemical detection of pyrethroid resistance mechanism in Aedes aegypti in Ratchaburi province; Thailand. Tropical Biomedicine 21 (2): 145-151. [ Links ]
RAYMOND, M. 1985. Presentation d' un programme d'analyse log. Probit pour micro-ordinateur. Cahiers ORSTOM, Sér. Cnt. Medicine Et. Parasitology 22 (2): 117-121. [ Links ]
RAWLINS, S.; WAN, J. 1995. Resistance in some Caribbean populations of Aedes aegypti to several insecticides. Journal of the American Mosquito Control Association 11 (1): 59-65. [ Links ]
RODRIGUEZ, M.; BISSET, J.; RUIZ, M.; SOCA, A. 2002. Cross-resistance to pyrethroid and organophosphorus insecticides induced by selection with temephos in Aedes aegypti (Diptera: Culicidae) from Cuba. Journal of Medical Entomology 39: 882888. [ Links ]
RODRlGUEZ, M.; BISSET, J.; DIAZ, C.; SOCA, A. 2003. Resistencia cruzada a piretroides en Aedes aegypti de Cuba inducido por la selección con el insecticida organofosforado malatión. Revista Cubana de Medicina Tropical 55 (2): 105-111. [ Links ] [ Links ]
RODRIGUEZ, M.; BISSET, J.; DE ARMAS, Y.; RAMOS, F. 2005. Pyrethroid insecticide-resistant strain of Aedes aegypti from Cuba induced by deltamethrin selection. Journal of the American Mosquito Control Association 21 (4): 437-445. [ Links ]
RODRIGUEZ, M. 2008. Estudio de la resistencia a insecticidas. Tesis doctoral. Instituto de Medicina tropical Pedro Kouri 114 p. [ Links ]
SELVI, S.; ENDAH, M.; NAZNI, W.; LEE, H.; AZAHARU, A. 2005. Resistance development and insecticide susceptibility in Culex quinquefasciatus against selection pressure of malathion and permethrin and its relationship to cross-resistance towards propoxur. Tropical Biomedicine 22 (2): 103-113. [ Links ]
SIVIGILA 2010. Subdirección de Vigilancia y Control en Salud Pública SISTEMA DE VIGILANCIA EN SALUD PÚBLICA - SIVIGILA Semana Epidemiológica 51. [ Links ]
TIKAR, S.; KUMAR, A.; PRASAD, G.; PRAKASH, S. 2009. Temephos-induced resistance in Aedes aegypti and its cross-resistance studies to certain insecticides from India. Parasitology Research 105: 57-63. [ Links ]
WIRTH, M.; GEORGHIOU, G. 1999. Selection and characterization of temephos resistance in a population of Aedes aegypti from Tortola; British Virgin Islands. Journal of the American Mosquito Control Association 15: 315-320. [ Links ]
WHO, 1981. Instructions for determining the susceptibility of mosquito larvae to insecticides. Geneva. 10 p. [ Links ]