Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.2 Bogotá July/Dec. 2012
Parasitismo de larvas de Copturus aguacatae (Coleoptera: Curculionidae) por Heterorhabditis indica (Rhabditida: Heterohabditidae) en laboratorio
Parasitism of Copturus aguacatae (Coleoptera: Curculionidae) larvae by Heterorhabditis indica(Rhabditida: Heterorhabditidae) in the laboratory
MA. GUADALUPE SÁNCHEZ-SAAVEDRA1,2, HIPÓLITO CORTEZ-MADRIGAL1,3y SALVADOR OCHOA-ESTRADA1,4
1 Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional-IPN, Unidad Michoacán. Justo Sierra # 28, Col. Centro, C.P. 59510, Jiquilpan, Michoacán, México.
2 Auxiliar de investigación-M.C.
3 Profesor-Investigador-Dr., CIIDIR-IPN, Unidad Michoacán, hcortezm@ipn.mx, autor para correspondencia.
4 Profesor-Investigador-M.C., CIIDIR-IPN, Unidad Michoacán.
Recibido: 23-mar-2012 - Aceptado: 28-oct-2012
Resumen: Para evaluar el potencial del nematodo Heterorhabditis indica en el control del barrenador de ramas de aguacate, Copturus aguacatae, se planearon bioensayos con larvas de la plaga fuera y dentro de ramas en Jiquilpan, Michoacán (México). Fuera de ramas, larvas del segundo y tercer estadio se expusieron a cuatro concentraciones del nematodo: 1% (2.500 nematodos mL-1), 0,1% (250 nematodos mL-1), 0,01% (25 nematodos mL-1) y 0,001% (2,5 nematodos mL-1). Se estimó la concentración óptima y el tiempo en que murió el 50% de la población (TL50). Los bioensayos dentro de ramas incluyeron cuatro estrategias de aplicación: “baba” (savia) de nopal, gelatina, agua, agua + cubierta plástica. Tiras de esponja se empaparon con una suspensión de 500 nematodos mL-1 más el tratamiento correspondiente. Ramas de aguacate con larvas de la plaga colectadas en la región de Atapan, Michoacán (México) se cubrieron con las esponjas y se incubaron durante 15 días; la temperatura durante el estudio fue de 25 ± 1 °C. Los resultados mostraron alta virulencia de H. indica hacia larvas de la plaga. El TL50 estimado fue de 28,8 h, mientras que el 100% de mortalidad se estimó en 44 h. La concentración óptima fue del 0,1% (250 nematodos mL-1) con un 93,3% ± 5,7% de mortalidad. Sin embargo, se detectaron fuertes limitaciones de H. indica para penetrar e infectar a C. aguacatae dentro de las galerías. Aunque hubo tendencia a una mayor mortalidad en los tratamientos respecto al testigo, solo se obtuvieron nematodos juveniles en el tratamiento agua + cubierta plástica.
Palabras clave: Nematodos entomopatógenos. Control biológico. Barrenador de ramas. Aguacate.
Abstract: To evaluate the potential of the nematode Heterorhabditis indica as a biocontrol agent of the avocado stem weevil, Copturus aguacatae, bioassays were planned with larvae of the pest inside and outside of stems in Jiquilpan, Michoacan (Mexico). Outside of stems, second and third instars larvae were exposed to four nematode concentrations: 1% (2500 nematodes mL-1), 0.1% (250 nematodes mL-1), 0.01% (25 nematodes mL-1) and 0.001% (2.5 nematodes mL-1). The optimal concentrations and the time required to kill 50% of the population (LT50) were estimated. The bioassays inside of stems included four strategies of application: “baba” (soap) of nopal, gelatin, water, and water + plastic cover. Sponge strips were soaked in a suspension of 500 nematodes mL-1 plus the corresponding treatment. Avocado stems with larvae of the pest collected in Atapan, Michoacán (Mexico) were covered with the sponges and incubated for 15 days; the study conditions were 25 ± 1 °C. The results showed high virulence of H. indica to larvae of the pest. The estimated LT50 was 28.8 h, whereas the interval required to cause 100% mortality was estimated as 44 h. The optimal concentration was 0.1% (250 nematodes mL-1) with a mortality of 93.3% ± 5.7%. However, strong limitations were detected for H. indica to penetrate and infect C. aguacatae inside of the galleries. Although there was a trend for higher mortality in treatments with respect to the control, juvenile nematodes were only recovered from the treatment water + plastic cover.
Key words: Entomopathogenic nematodes. Biological control. Stem weevils. Avocado.
Introducción Con una superficie de 121.491 ha cosechadas y una producción de 1230.970 t, el aguacate es uno de los principales cultivos perennes de México y hace de este país el primer productor mundial (FAOSTAT 2009). En México, el estado de Michoacán es el principal productor, con una superficie de 98.463 ha y una producción de 1006.059 t (SAGARPA 2009). Aunque México es un consumidor importante de aguacate, gran parte de su producción se exporta a diversos países, donde destaca Estados Unidos con el 41,8% de las exportaciones (Salazar-García et al. 2005; INEGI 2006). Sin embargo, la exportación de aguacate está limitada por diversos problemas de plagas, donde destaca el barrenador de ramas Copturus aguacatae Kissinger, 1957 (Coleoptera: Curculionidae) (NOM-066-FITO-2002 2002). Junto con los barrenadores del hueso Conotrachelus aguacatae Barber, 1924 y C. persea Barber, 1919 (Coleoptera: Curculionidae), las pérdidas del cultivo fluctúan de 2 - 3 t/ha; el control de los tres insectos incluye un poco más del 15% del costo total del cultivo (SENASICA 2009). C. aguacatae presenta amplia distribución en las zonas productoras de aguacate de México (Talavera y Padilla 2003; Engstrand et al. 2010) y está categorizado de máximo riesgo para su introducción y establecimiento en zonas productoras de aguacate libres de la plaga (NOM-066-FITO-2002 2002). Su daño inicia con la oviposición de las hembras bajo la corteza de las ramas y posteriormente, por la penetración de las larvas al interior de ellas. La larva barrena la rama hasta llegar a la médula, causando defoliación, aborto de flores y marchites de frutos. En altas infestaciones, las ramas con frutos pueden quebrarse y así perder la producción (Equihua et al. 2007). No obstante su pequeño tamaño, el insecto presenta un ciclo biológico largo (215,8 - 285 días), pasando por cinco estadíos larvarios en ese periodo. Se reporta una sola generación anual (Talavera y Padilla 2003; Coria et al. 2007). El largo ciclo biológico y el hábitat críptico de las larvas de C. aguacatae dificulta su control, de manera que su manejo se basa en la combinación de estrategias culturales (poda) y la aplicación de insecticidas órgano-sintéticos, principalmente (Coria et al. 2007; Equihua et al. 2007); sin embargo, la poda “obligada” del aguacate es decir, de las ramas infestadas, no siempre es deseable, mientras que depender del control químico como estrategia principal tiene serias desventajas principalmente, por la contaminación, eliminación de enemigos naturales y por el desarrollo de resistencia de la plaga (Pimentel y Edwards 1982; Lacey et al. 2001). Además las limitaciones impuestas en la aplicación de productos químicos en aguacate como producto de exportación y los hábitos crípticos del barrenador reducen en gran medida la eficacia de los productos químicos (Equihua et al. 2007). El control biológico ha sido utilizado de manera limitada (Coria et al. 2007; Equihua et al. 2007); por ejemplo, aunque se han identificados diversos parasitoides de larvas de C. aguacatae (Huerta de la Peña et al. 1990) poco se ha hecho para evaluarlos. Sólo unas especies de hongos entomopatógenos como, Beauveria bassiana (Vuill.), han mostrado potencial en el control de la plaga (Coria et al. 2007; Equihua et al. 2007); sin embargo, se requieren más estudios al respecto. El uso de entomopatógenos en el manejo de plagas es una alternativa que ha cobrado fundamental importancia en los últimos años (Lacey et al. 2001) y se reconoce que los insecticidas microbiales con mayor potencial para el manejo de barrenadores son los basados en nematodos entomopatógenos (NEPs) de las familias Steinernernematidae y Heterorhabditidae (Georgis et al. 2006; Kaya et al. 2006; Shapiro-Ilan et al. 2006). Aunque diversos estudios con insectos barrenadores demuestran el potencial de los NEPs en el control de insectos de hábitat crípticos (Shapiro-Ilan y McCoy 2000; Unruh y Lacey 2001; Abbas 2010), solo uno ha sido documentado sobre el efecto de NEPs en larvas de C. aguacatae dentro de ramas (Huerta de la Peña et al. 1990); sin embargo, los resultados encontrados muestran inconsistencias y se requiere de más estudios. El nematodo Heterorhabditis indica Poinar, Karunaka y David, 1992, fue primero descrito en la India por Poinar et al. (1992) y desde entonces ha sido aislado en diferentes países, entre ellos México (Kaya et al. 2006) y evaluado en múltiples especies de insectos mostrando buen potencial en varias de ellas (Kaya et al. 2006; Shapiro-Ilan et al. 2009b; Abbas 2010; Campos-Herrera et al. 2010). Dada la importancia económica y social del cultivo del aguacate, el objetivo del estudio fue evaluar el potencial del nematodo H. indica (población Tab-03) en el control de larvas de C. aguacatae en condiciones de laboratorio.
Materiales y Métodos
Material biológico. Las larvas de C. aguacatae se colectaron en la región aguacatera de Atapan, Los Reyes, Michoacán (México) (Ubicado entre las coordenadas 19°39’ y 19°40’N y entre 103°24’ y 103°26’O), con altitudes comprendidas entre los 1.600 y 1.800 msnm. Durante marzo, abril, mayo, junio y octubre 2010 y enero y octubre 2011, ramas de aguacate infestadas por larvas del barrenador fueron transportadas en una hielera al Laboratorio de Entomología del Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional del Instituto Politécnico Nacional (CIIDIR-IPN) en Jiquilpan, Michoacán (México).
Se utilizó la especie de nematodo H. indica población Tab-03 aislada de la región de Tabasco (México) y conservada en el Laboratorio de Entomología del CIIDIR-IPN en Jiquilpan, Michoacán (México). El nematodo se multiplicó en larvas de Galleria mellonella L, 1758 (Lepidoptera: Pyralidae) y se conserva a temperatura ambiente en agua, dentro de frascos de cultivo de tejidos de 160 mL. Los nematodos utilizados fueron siempre de 10 días de emergidos.
Efecto de H. indica en larvas de C. aguacatae
Bioensayo preliminar. Las ramas recolectadas en campo se abrieron mediante navaja y tijeras de podar para obtener las larvas de C. aguacatae. Dado que fueron poblaciones de campo, la edad de las larvas varió, distinguiéndose edades desde el primero hasta el tercer estadio, predominando el segundo y tercer estadio.
En recipientes de plástico de 5 x 6 cm con una toalla de papel en el fondo, se añadió 1 mL de una suspensión conocida de nematodos (2.500 mL-1) con viabilidad > 95%, más 1 mL de agua para proporcionar humedad favorable al nematodo; inmediatamente, se depositó una larva de C. aguacatae (segundo y tercer estadio) por recipiente y se colocó la tapa, previamente perforada para favorecer el intercambio gaseoso. Se establecieron tres repeticiones con 10 - 14 larvas por repetición y un testigo con solo aplicación de agua para cada repetición. Los recipientes se mantuvieron a 25 ± 1 °C sin fotoperiodo. A partir de las 24 h se realizaron lecturas cada 2 h, y con la finalidad de determinar el tiempo en que murió el 50% de la población (TL50), la frecuencia de las lecturas se acortó conforme aumentó la mortalidad. Los datos se analizaron con base a un análisis probit, previa transformación a un modelo cuadrático completo, mediante el programa estadístico SAS (1999). Complementariamente se determinó el número de nematodos juveniles infectivos (JIs) que emergieron por larva de C. aguacatae (N = 10).
Evaluación de concentración. Además de la concentración preliminar evaluada (considerada como 1%), se evaluaron tres concentraciones más: 0,1% (250 nematodos mL-1), 0,01% (25 nematodos mL-1) y 0,001% (2,5 nematodos mL-1). La evaluación se realizó de forma similar al bioensayo preliminar, con tres repeticiones y un testigo sin nematodos para cada repetición. Los datos se procesaron mediante análisis de varianza (ANOVA) bajo un diseño completamente al azar (DCA) y la separación de medias mediante Tukey (P < 0,05). En el análisis se incluyó la concentración del 1% descrita anteriormente.
Bioensayo preliminar con larvas dentro de ramas. Para determinar el potencial de H. indica en la mortalidad de C. aguacate dentro de ramas, se realizó un primer bioensayo a dosis de 2.500 nematodos mL-1. Mediante un aspersor manual, la suspensión de nematodos se asperjó directamente sobre la rama donde se encontraban las larvas; inmediatamente, las ramas se introdujeron en bolsas de plástico herméticamente selladas para evitar la pérdida de humedad. Se consideraron tres repeticiones de siete ramas cada una, más un testigo con solo aplicación de agua. El experimento se desarrolló a 25 ± 1 °C sin fotoperiodo. Después de 10 días, las ramas se abrieron para registrar el estado de las larvas. Previa transformación al arcoseno de la proporción, los datos se procesaron mediante un ANOVA y la separación de medias mediante Tukey (P ≤ 0,05), con el programa estadístico SAS (1999).
Técnicas de aplicación de H. indica en ramas infestadas. Para favorecer el ingreso del nematodo a las galerías de C. aguacatae, cuatro estrategias de aplicación fueron evaluadas: “baba” (savia) de nopal (100 g 250 mL-1 de agua) (B), gelatina (21 g 250 mL-1 de agua) (G), agua + cubierta de plástico (Bolsipack®, A + P) y agua (A). Cada uno de los tratamientos incluyó un testigo sin nematodos. Se preparó una suspensión de nematodos de la especie H. indica a una concentración de 500 nematodos mL-1. Cintas de esponja de 30 x 5 cm fueron saturadas con 30 mL de la suspensión de nematodos y una rama de 20 cm infestada con larvas del barrenador (segundo y tercer estadio) se cubrió con la esponja. Dos repeticiones fueron consideradas, con cuatro ramas por repetición. Las ramas se mantuvieron en bolsas de plástico selladas para evitar la pérdida de humedad. El experimento se desarrolló a 25 ± 1 °C sin fotoperiodo. Después de 15 días se abrieron las ramas para registrar el estado de las larvas. Se realizaron observaciones adicionales sobre longitud de las galerías, presencia y viabilidad de los nematodos en el serrín de las galerías y el estadio larvario presente. Las larvas muertas se colocaron en trampas White (Woodring y Kaya 1988) para registrar la posible emergencia de los juveniles infectivos (JIs). Los datos se analizaron mediante estadísticas descriptivas.
Durante octubre 2011 se estableció un segundo experimento en ramas con daño inicial del barrenador (de primer estadio). La metodología fue similar al anterior experimento, solo que en este caso se usó únicamente la esponja más la suspensión de nematodos. Al menos se establecieron tres repeticiones y los datos se analizaron mediante un ANOVA.
Caracterización del serrín de galerías de C. aguacatae. Dado que las características de las galerías de diversos barrenadores donde se han aplicado exitosamente NEPs son diferentes a las de C. aguacatae, en donde la galería es bloqueada con “serrín” producto de su alimentación y excreción, no existen hasta donde sabemos estudios sobre la caracterización de ese producto. Para una mejor interpretación de los resultados de los bioensayos con larvas dentro de ramas, se consideró conveniente llevar a cabo una caracterización de ese producto. Se consideraron las propiedades físicas y químicas.
Análisis granulométrico de partículas. Con la finalidad de permitir el tamizado, una muestra de 10 g de serrín obtenido de galerías de C. aguacatae fue secada en estufa a 120 °C durante 2 h. El serrín se tamizó durante 10 minutos, empleando los juegos de mallas especificados en la descripción de las cribas (2,38; 1,19; 0,50; 0,4318; 0,149 y 0,177 mm); mediante una balanza analítica (Sartorius®) se pesó el material tamizado en cada una de las cribas, incluyendo el fondo o base de los tamices. Para conocer el tamaño de las partículas se realizaron mediciones del largo por ancho de dos maneras: para las partículas de las dos primeras cribas se utilizó un vernier bajo el estereoscopio, y los valores se expresaron en mm; para las últimas cribas debido al diminuto tamaño de las partículas, la medición se realizó mediante un micrómetro adaptado al microscopio compuesto (40X) y las unidades oculares obtenidas fueron transformadas a micrómetros. Los pesos del material de cada criba fueron transformados a porcentaje relativo del total del peso de la muestra.
Determinación del contenido de humedad. Se pesó 1 g de muestra, se secó a 103 ºC durante 24 h, inmediatamente después se pasó al desecador por 24 h y se peso la muestra, una vez anotado el peso de los crisoles, se llevó nuevamente a la estufa por 24 h, después de este tiempo se pasó al desecador. Se repitieron las operaciones anteriores hasta obtener peso constante.
Determinación del pH y conductividad eléctrica (C.E.). Se emplearon los métodos citados por Roffael et al. (2000). Se tomó 1 g de material de la porción fina obtenida del análisis granulométrico de las partículas, se introdujeron en un matraz, se mezclaron con 10 mL de agua destilada, y se agitaron durante 4 h. Finalizado el tiempo, parte del sobrenadante se utilizó para determinar el pH mediante un potenciómetro (ThermoOrion®). Además se tomó la lectura de la C.E, utilizando para este caso un conductímetro (Hanna®) para obtener el valor correspondiente.
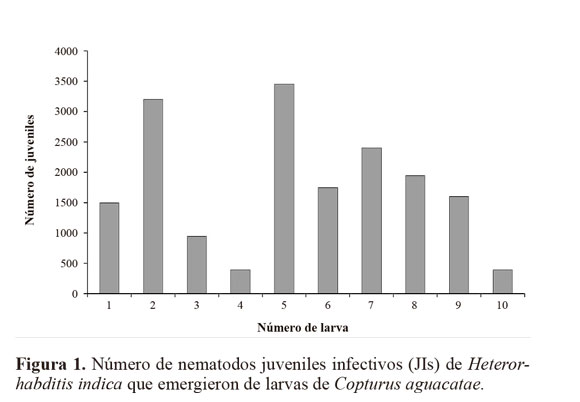
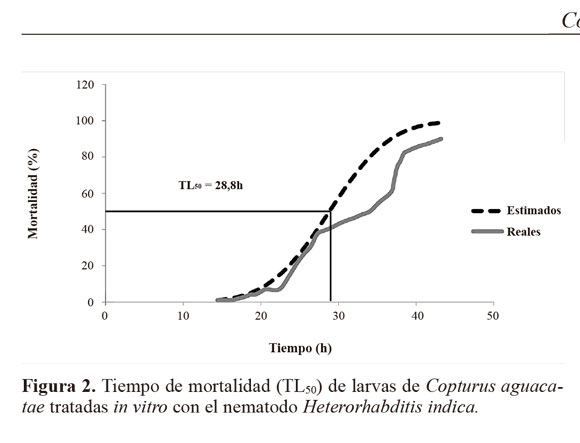
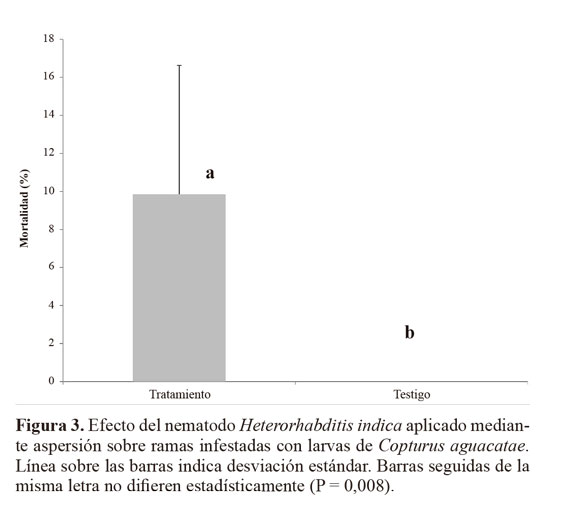
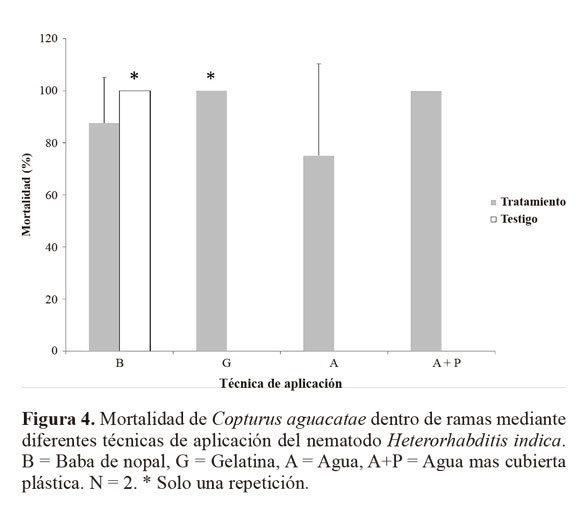
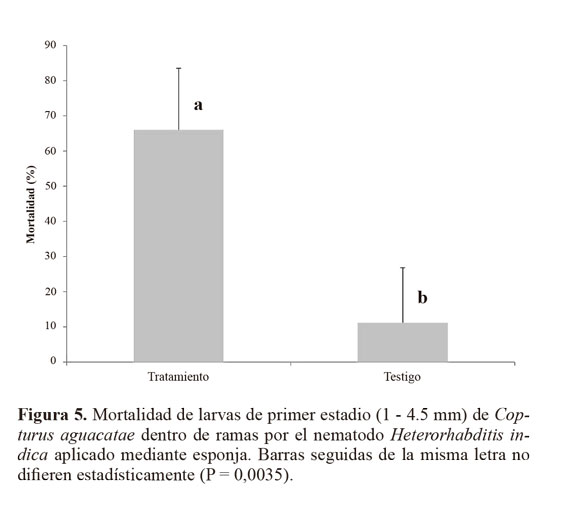
Resultados Susceptibilidad de larvas de C. aguacatae frente a H. indica. El nematodo H. indica causó alta mortalidad en larvas de C. aguacatae. A pesar de su pequeña talla (4,9-10 mm) las larvas del barrenador resultaron adecuadas para el desarrollo del nematodo, registrándose una emergencia de juveniles que fluctuó de 386 a 3.426,66 JIs por larva (Fig. 1). En el testigo no se registró mortalidad. Con base al análisis probit, previa transformación a un modelo cuadrático completo (P = 0,0001), el tiempo estimado en que murió el 50% de la población (TL50) con una concentración de 2.500 nematodos mL-1 (1%) fue de 28,8 h (27,2 - 29,7 h), mientras que el 100% con esa misma dosis se alcanzó a las 44 h (43,9 - 45,9 h) (Fig. 2). De las cuatro concentraciones evaluadas, las del 1% y 0,1% fueron las que causaron la mayor mortalidad de larvas (Tabla 1). Mortalidad dentro de ramas mediante aspersión. Después de 10 días de incubación la mortalidad media registrada en el tratamiento fue de 9,85 ± 6,77%, significativamente mayor (P = 0,008) que la del testigo (0%) (Fig. 3). Sin embargo, los cadáveres del tratamiento no mostraron la sintomatología característica de muerte por NEPs del género Heterorhabditis (rojo óxido) y en ningún caso hubo emergencia de juveniles. Estrategias de aplicación de H. indica en ramas. Quince días después de la aplicación de los nematodos, en todos los tratamientos se registró mortalidad de C. aguacatae, la que fluctuó del 75% al 100%; sin embargo, solo en el tratamiento agua + cubierta plástica los cadáveres tratados presentaron la sintomatología característica de muerte por nematodos del género Heterorhabditis; en el 25% de las larvas se recuperaron juveniles que mostraron patogenicidad hacia larvas de G. mellonella. Con excepción del tratamiento a base de baba de nopal sin nematodos, en ninguno de los testigos se registró mortalidad de larvas (Fig. 4). A diferencia del experimento preliminar, en este caso el tamaño de las larvas fue mayor (8 a 10 mm), correspondiendo al tercer y cuarto estadio del barrenador; el daño alcanzó desde 4 hasta 10 mm de longitud y las galerías estuvieron totalmente cubiertas por excreciones del insecto (“serrín”). Un experimento posterior con larvas del primer estadio dentro de ramas constató los resultados anteriores. La mortalidad en el tratamiento fue de 65,92 ± 17,6%, significativamente mayor (P = 0,035) que la del testigo (11,11%, Fig. 5). Al igual que en los casos anteriores, las larvas muertas en el tratamiento no presentaron la sintomatología característica del género del nematodo y tampoco se obtuvieron juveniles a partir de los cadáveres. Es importante señalar que en algunos casos el serrín se observó húmedo y con presencia de nematodos en él, lo que indica que H. indica intentó penetrar las galerías y alcanzar en algunos casos al insecto y matarlo, tal como ocurrió en el tratamiento agua + cubierta plástica. El análisis físico-químico del serrín de las galerías de C. aguacatae permitió saber que los valores de humedad fueron del 7,13%, el pH registrado fue de 7,37 y la conductividad eléctrica (C.E.) de 1.179 dS m-1. Por otra parte, las observaciones granulométricas del serrín indicaron partículas de diferentes tamaños, predominando las de 0,7 x 0,4 a 1,4 x 0,8 mm con un 33,3% del peso total de las partículas. Las que mostraron la menor proporción fueron las de 1,30 x 1,56 a 2,0 x 1,56 µm con solo el 0,44% del peso total (Tabla 2).
Discusión
Los síntomas de los insectos parasitados por el nematodo fueron los característicos para el género: disminución en su movilidad y posteriormente la muerte; ausencia de olor y coloración rojo óxido y posteriormente emergencia de JIs (Woodring y Kaya 1988). Los tiempos de mortalidad in vitro de larvas de C. aguacatae tratadas con H. indica sugieren una alta susceptibilidad de la plaga hacia el nematodo pues el tiempo de mortalidad (44 h) está dentro del indicado para insectos susceptibles a NEPs, ubicado entre 24 - 48 h. La baja concentración requerida (250 JIs mL-1 por larva) para matar las larvas sustenta dicha aseveración. Conotrachelus psidii Marshall, 1922 (Coleoptera: Curculionidae), una especie de similar tamaño, fue también susceptible frente a H. indica; sin embargo, solo se logró un 68,3% de mortalidad con una concentración de 500 JIs por larva y un TL50 de 6,5 - 10,6 días) (Dolinsky et al. 2006).
Otros estudios han documentado la efectividad de H. indica en diferentes especies de insectos plaga (Kaya et al. 2006). Por ejemplo, McCoy et al. (2000) registraron más del 40% de mortalidad en larvas de Diaprepes abbreviatus (L.) después de 35 días de haber aplicado H. indica en cítricos de Florida. De igual manera, de siete especies de nematodos evaluados, H. indica fue de los más virulentos hacia siete especies de insectos entre los que se mencionan D. abbreviatus y Plodia interpunctella Hübner, 1813 (Shapiro-Ilan et al. 2009b). Sin embargo, éste es el primer estudio donde se documenta la patogenicidad de H. indica hacia larvas de C. aguacatae.
No obstante lo anterior, en las condiciones de estudio los resultados mostraron fuertes limitantes para que H. indica penetrase e infectase larvas de C. aguacate dentro de las galerías, lo que parece estar altamente influenciado por la técnica de aplicación empleada y la presencia del serrín dentro de las galerías. Así, cuando se empleó la técnica de aspersión, aun cuando las larvas del barrenador se encontraban a poca profundidad, no se registró parasitismo por el nematodo. Al poco tiempo de asperjar la suspensión de nematodos se observó escurrimiento del agua y con ello el arrastre de juveniles lo que probablemente redujo el número disponible para entrar en la galería. Aunque la aspersión es ampliamente utilizada en la aplicación de NEPs al suelo, para insectos barrenadores han sido más eficientes estrategias de aplicación dirigidas, incluida la inyección en los orificios de entrada de la plaga (Shapiro-Ilan et al., 2006; Abbas, 2010). En nuestro caso, utilizamos la técnica de aspersión solo como un referente de comparación con las otras técnicas de aplicación empleadas.
Resultados similares a los aquí encontrados han sido reportados para otros curculionidos barrenadores. Por ejemplo, el picudo de la palma roja Rhynchophorus ferrugineus Olivier, 1790 fue altamente susceptible en condiciones de laboratorio a S. abbasi Elawad, Ahmad y Reid, 1997 y H. indica, en concentraciones tan bajas como 100 y 200 IJs por larva, y aunque la mortalidad fue alta, solo 11,5% y 8,6% de los cadáveres produjeron juveniles infectivos (Abbas 2010). Contrariamente, Huerta de la Peña et al. (1990) señalaron haber obtenido mortalidad de larvas de C. aguacatae dentro de ramas mediante la aspersión de Steinernema bibiones (= feltiae)Filipjev, 1934 y H. heliothidis Khan, Brooksy Hirschmann, 1976 a concentraciones de 500 y 1000 NEPs mL-1. Después de 5 días, la mortalidad fluctuó del 5% al 37,5%, dependiendo de la especie, donde Heterorhabditis fue superior; sin embargo, los resultados no fueron consistentes con las concentraciones evaluadas ni se indicaron detalles del estudio, tales como edad de la larva, profundidad de la galería y emergencia de juveniles, aspectos que pudieran indicar la capacidad de penetración de los nematodos.
A diferencia de los plaguicidas órgano-sintéticos, diversas estrategias de aplicación han sido sugeridas para los NEPs; entre las que podemos citar en el agua de riego, aspersores manuales y motorizados, cadáveres de larvas infectadas e inoculación directamente en las galerías (Kaya et al. 2006; Georgis et al. 2006; Shapiro-Ilan et al. 2006); Por lo tanto, es probable que la evaluación de otros coadyuvantes y técnicas de aplicación pudieran mejorar la acción de H. indica en el control de C. aguacatae. El hecho de haber recuperado JIs a partir de larvas de las ramas tratadas con nematodos en agua + cubierta plástica así lo sugieren.
Los NEPs son habitantes del suelo y con algunas excepciones, las galerías de insectos barrenadores no son su hábitat natural (Kaya et al. 2006). Al igual que en el suelo, las características físico-químicas del sustrato son determinantes en la actividad de los NEPs. De acuerdo con el análisis físico-químico practicado al serrín de las galerías de C. aguacatae, no parecieron existir limitantes de carácter químico para que H. indica lograse ser eficaz dentro de las galerías. Por ejemplo, aunque los valores de humedad del serrín fueron bajos (7,13%) respecto a los requeridos por los nematodos para su movilidad, se han encontrado nematodos en suelos con 10% de humedad (Giayetto y Chichón 2006). Además, la humedad puede ser proporcionada artificialmente, tal como fue documentado por Unruh y Lacey (2001), quienes mediante suplementos de humedad antes de la aplicación del nematodo S. carpocapsae contra larvas diapáusicas de la palomilla de la manzana Cydia pomonella L., 1758 indujeron mayor mortalidad que cuando no se adicionó humedad; la mortalidad alcanzó el 100% cuando la humedad se proporcionó antes y después de la aplicación.
El pH (7,37) del serrín también está dentro de los límites (4 - 8) para los NEPs, aunque puede variar de acuerdo con la especie (Stuart et al. 2006). Por su parte, la baja conductividad eléctrica (1,179 dS m-1) pudiera permitir ensayar aplicaciones del nematodo con mayores concentraciones de sales, buscando con ello reducir la pérdida de humedad. Al respecto, se sabe que las especies del género Heterorhabditis toleran altas concentraciones de sales e incluso pueden prolongar su viabilidad (Griffin et al. 1994).
A diferencia de las características químicas del serrín, las características físicas como la variabilidad en tamaño y forma de partículas pudieran limitar la movilidad de los NEPs tal como fue registrado en el presente estudio. Mas del 46% de las partículas del serrín de C. aguacatae se clasificaron como partículas de tamaño grande (0,7 - 1,1 x 0,4 - 2,3 mm) y aunado a su forma laminar e irregular constituirían una limitante para el ingreso y desplazamiento de los nematodos, aun para H. indica considerada una de las especies de menor talla (528 x 20 µm) (Poinar et al. 1992; Stock y Kaya 1996) y cuya búsqueda mediante “rastreo” le permitiría localizar hospederos de hábitat críptico (Georgis et al. 2006; Lewis et al. 2006) como lo es C. aguacatae. Además, es probable que el serrín de las galerías interfiera con las señales químicas, tan importantes para la localización del hospedero por NEPs con esa estrategia de búsqueda que ocurre en los Heterorhabditidos (Georgis et al. 2006; Lewis et al. 2006; Ramos-Rodríguez et al. 2007). Aunque otras estrategias para la localización del hospedero, incluidas señales eléctricas, han sido mencionadas para los NEPs, H. indica no mostró respuesta a ese tipo de señales (Shapiro-Ilan et al. 2012).
Hasta donde sabemos no existen estudios previos sobre la caracterización del sustrato de insectos barrenadores y la mayoría de los trabajos sobre el efecto del suelo en los NEPs se han enfocado más a la textura (la composición de los sólidos del suelo por rangos del tamaño de partículas) que a la estructura del suelo (el arreglo de las partículas del suelo en agregados de tamaño variable, geometría y porosidad), no obstante que la estructura del espacio poroso es determinada en gran medida por el tamaño y arreglo de los agregados, lo que afecta finalmente el movimiento de agua, aire y organismos del suelo (Stuart et al. 2006).
No obstante la baja recuperación de JIs a partir de larvas de C. aguacatae dentro de ramas, el hecho de haber encontrado una tendencia de mayor mortalidad donde se aplicaron los nematodos sugiere que además del efecto directo del nematodo, otros mecanismos pudieran estar involucrados en la mortalidad de larvas de C. aguacatae. Resultados similares fueron obtenidos por Huerta de la Peña et al. (1990) con NEPs de los géneros Steinernema y Heterorhabditis, sin proponer explicaciones sobre ello. Con base a los resultados obtenidos hasta el momento es difícil proponer alguna explicación sobre la mayor mortalidad de larvas ocurrida dentro de ramas donde se aplicó H. indica, aun cuando los cadáveres no presentaron los síntomas característicos de muerte por NEPs y no se hayan recuperado JIs. Estudios futuros deben dilucidar ese fenómeno.
Basados en los resultados obtenidos parece ser que el potencial de los NEPs para el manejo del barrenador de las ramas del aguacate C. aguacatae es amplio; por un lado, la eficiencia directa del nematodo dentro de las galerías pudiera incrementarse mediante diversas estrategias de aplicación, en donde la conservación de la humedad debe ser prioritaria. Basados en la alta tolerancia a las sales de los nematodos de la familia Heterorhabditidae (Griffen et al. 1994), la utilización de suspensiones de NEPs con diferentes concentraciones de sales pudieran ser evaluadas; de igual forma, el uso de coadyuvantes para favorecer la conservación de la humedad y consecuentemente la infectividad del nematodo han mostrado diferentes grados de éxito (Kaya et al. 2006; Shapiro-Ilan et al. 2006; Abbas, 2010). Aplicaciones preventivas del nematodo S. carpocapsae durante la oviposición del barrenador del durazno Synanthedon exitosa Say, 1823 proporcionaron una reducción del daño similar a la proporcionada por los insecticidas químicos recomendados (Shapiro-Ilan et al. 2009a). Estrategias similares pudieran evaluarse para C. aguacatae; sin embargo, es necesario un conocimiento más preciso de la biología del insecto que nos permita aplicar oportunamente los nematodos.
Por otro lado, la exploración del potencial de las bacterias asociadas a los nematodos sería una línea interesante de explorar en el manejo de C. aguacatae. Investigaciones recientes en China y La India han demostrado la actividad antibiótica e insecticida de metabolitos producidos por los géneros Phothorabdus y Xenorhabdus asociadas a los NEPs de los géneros Heterorhabditis y Steninernema, respectivamente. Por ejemplo, en larvas de Plutella xylostella L., 1758 (Lepidoptera: Plutellidae) y Phthorimaea operculella Zeller, 1873 (Lepidoptera: Gelechiidae) se registró hasta un 100% de mortalidad 48 h después de aplicarles un filtrado de un cultivo de las bacterias. De igual manera, larvas de Helicoverpa armígera Hübner, 1808 y Spodoptera litura Fabricius, 1775 (Lepidoptera: Noctuidae) presentaron un 58% y 49% de mortalidad, respectivamente (Kaya et al. 2006).
Conclusiones
Con base al tiempo requerido para matar el 50% y el 100% de la población de larvas, el nematodo H. indica mostró alta eficacia frente a larvas de C. aguacate fuera de ramas en condiciones de laboratorio. Sin embargo, bajo las condiciones de estudio, los resultados indican fuertes limitaciones de H. indica para penetrar e infectar a C. aguacate dentro de las galerías, lo que fue altamente influenciado por las características físicas del serrín dentro de las galerías y la técnica de aplicación empleada.
Agradecimientos
A la Secretaría de Investigación y Postgrado del Instituto Politécnico Nacional por el apoyo económico otorgado para la realización del proyecto SIP-20110238. A la junta local de Sanidad Vegetal de Atapan, Michoacán (México). Al Arquitecto Fabián Villalpando Barragán por el apoyo en la edición de las figuras. A los evaluadores anónimos del presente escrito.
Literatura citada
ABBAS, M. S. T. 2010. IPM of the red palm weevil, Rhynchophorus ferrugineus. p. 209-233. En: Ciancio, A.; Mukerji, K. G. (eds.). Integrated management of arthropod pests and insect borne diseases. Springer. Londres-New York. 266 p. [ Links ]
CAMPOS-HERRERA, R.; STUART, R. J.; EL-BORAI, F.; GUTIERREZ, C.; DUNCAN, L. 2010. Entomopathogenic nematode ecology and biological control in Florida citrus orchards. p. 101-123. En: Ciancio, A.; Mukerji, K. G. (Eds.). Integrated management of arthropod pests and insect borne diseases. Springer. Londres-New York. 366 p. [ Links ]
CORIA, V.; PESCADOR, A.; LÓPEZ, E.; LEZAMA, R.; SALGADO, R.; LÓPEZ, M.; VIDALS, A.; MUÑOZ, J. 2007. Autoecología del barrenador de ramas del aguacate Copturus aguacate Kissinger (Coleoptera: Curculionidae) en Michoacán, México. Proceedings VI World Avocado Congress. Viña del Mar, Chile. 11 p. [ Links ]
DOLINSKI, C.; DEL VALLE, E.; STUART, R. J. 2006. Virulence of entomopathogenic nematodes to larvae of the guava weevil, Conotrachelus psidii (Coleoptera: Curculionidae), in laboratory and greenhouse experiments. Biological Control 38: 422-427. [ Links ]
EQUIHUA M., A.; ESTRADA V., E.; GONZÁLEZ H., H.; GASCA C., L.; SALINAS C., A.; GONZÁLEZ A., J.; MORA A., G.; TELIZ O., D. 2007. Plagas. pp. 135-146. En: Téliz-Ortiz, D.; Mora A., A. (Eds.). El aguacate y su manejo integrado. Mundi-Prensa. México. 321 p. [ Links ]
ENGSTRAND, R. C.; CIBRIAN T., J.; CIBRIAN-JARAMILLO, A.; KOLOKOTRONISI, S. O. 2010. Genetic variation in avocado stem weevils Copturus aguacatae (Coleoptera: Curculionidae) in Mexico. Mitochondrial DNA 21 (S1): 38-43. [ Links ]
FAOSTAT. 2009. Avocados production. Disponible en: http://www.faostat.fao.org/site/567/desktopdefault.aspx?PageID=567#ancor. Fecha revisión: 23 noviembre 2011. [ Links ]
GEORGIS, R.; KOPPENHÖFER, A.; LACEY, L.; BALAIR, G.; DUNCAN, L.; GREWAL, P.; SAMISH, M.; TAN, L.; TORR, P.; TOL, R. 2006. Successes and failures in the use of parasitic nematodes for pest control. Biological Control 38: 103-123. [ Links ]
GIAYETTO, A. L.; CHICHÓN, L. I. 2006. Distribución, gama de huéspedes y especificidad de cinco poblaciones de Heterorhabditis bacteriophora (Nematoda: Heterorhabditidae) del alto Valle de Rio Negro y Neuquén, Argentina. Revista de Investigación Agropecuaria 35 (002): 163-183. [ Links ]
GRIFFEN, C. T.; FINNEGAN, M. M.; DOWNES, M. J. 1994. Environmental tolerances and the dispersal of Heterorhabditis: survival and infectivity of European Heterorhabditis following prolonged immersion in seawater. Fundamental and Applied Nematology 17 (5): 415-421. [ Links ]
HUERTA DE LA PEÑA, A.; TRUJILLO, J.; EQUIHUA, A.; CARRILLO, J. 1990. Enemigos naturales y evaluación preliminar de dos nematodos para biocontrol de Copturus aguacatae (Coleoptera: Curculionidae), en Atlixco, Puebla, México. Agrociencia 1 (3): 47-56. [ Links ]
INEGI. 2006. Aguacate Hass: Exportaciones Nacionales. Instituto Nacional de Estadística Geografía e Informática (INEGI). México. 3 p. [ Links ]
KAYA, H. K.; AGUILLERA M., M.; ALUMAI, A.; CHOO, H. Y.; DE LA TORRE, M.; FODOR, A.; GANGULY, S.; HAZAR, S.; LAKATOS, T.; PYE, A.; WILSON, M.; YAMANAKA, S.; YANG, H.; EHLERS, R. U. 2006. Status of entomopathogenic nematodes and their symbiotic bacteria from selected countries or regions of the world. Biological Control 38: 134-155. [ Links ]
LACEY, L. A.; FRUTOS, R.; KAYA, H. K.; VAIL, P. 2001. Insect pathogens as biological control agents: Do they have a future? Biological Control 21: 230-248. [ Links ]
LEWIS, E. E.; CAMPBELL, J.; GRIFFIN, C.; KAYA, H.; PETERS, A. 2006. Behavioral ecology of entomopathogenic nematodes. Biological Control 38: 66-79. [ Links ]
McCOY, C. W.; SHAPIRO, D. I.; DUNCAN, L. W.; NGUYEN, K. 2000. Entomopathogenic nematodes and other natural enemies as mortality factors for larvae of Diaprepes abbreviatus (Coleoptera: Curculionidae). Biological Control 19: 182-190. [ Links ]
NOM-066-FITO-2002. 2002. Especificaciones para el manejo fitosanitario y movilización del aguacate. Disponible en: www.senasica.gob.mx/?doc=696. Fecha de revisión: 20 octubre 2011. [ Links ]
PIMENTEL, D.; EDWARDS, C. A. 1982. Pesticides and ecosystems. BioScience 32 (7): 595-600. [ Links ]
POINAR, G. O.; KARUNAKAR, G. K.; DAVID, H. 1992. Heterorhabditis indicus n. sp. (Rhabditida: Nematoda) from India: separation of Heterorhabditis spp. by infective juveniles. Fundamental and Applied Nematology 15: 467-472. [ Links ]
RAMOS-RODRIGUEZ, O. R.; CAMPBELL, J. F.; LEWIS, E. E.; SHAPIRO-ILAN, D. I.; RAMASWAMY, S. B. 2007. Dynamics of carbon dioxide release from insects infected with entomopathogenic nematodes. Journal of Invertebrate Pathology 94: 64-69. [ Links ] [ Links ]
SAGARPA. 2009. Plan Rector Nacional Sistema Producto Aguacate. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). México. 43 p. [ Links ]
SALAZAR-GARCIA, S.; ZAMORA-CUEVAS, L.; VEGA-LOPEZ, R. 2005. Actualización sobre la Industria del Aguacate en Michoacán, México. California Avocado Society, Yearbook 87: 45-54. [ Links ]
SAS. 1999. SAS Software for Windows Version 4.10. SAS Institute, Cary N.C., USA. [ Links ] [ Links ]
SHAPIRO-ILAN, D. I.; McCOY, C. W. 2000. Susceptibility of Diaprepes abbreviatus (Coleoptera: Curculionidae) larvae to different rates of entomopathogenic nematodes in the greenhouse. Florida Entomologist 83 (1): 9. [ Links ]
SHAPIRO-ILAN, D. I.; GOUGE, D. H.; PIGGOTT, S. J.; FIFE, J. P. 2006. Application technology and environmental considerations for use of entomopathogenic nematodes in biological control. Biological Control 38: 124-133. [ Links ]
SHAPIRO-ILAN, D. I.; COTTRELL, T. E.; MIZELL, R. F.; HORTON, D. L.; DAVIS, J. 2009a. A novel approach to biological control with entomopathogenic nematodes: Prophylactic control of the peach tree borer, Synanthedon exitiosa. Biological Control 48: 259-263. [ Links ] [ Links ]
SHAPIRO-ILAN, D. I.; LEWIS, E. E.; CAMPBELL, J. F.; KIM-SHAPIRO, D. B. 2012. Directional movement of entomopathogenic nematodes in response to electrical field: effects of species, magnitude of voltage, and infective juvenile age. Journal of Invertebrate Pathology 109: 34-40. [ Links ]
STOCK, P. S.; KAYA, H. K. 1996. A multivariate analysis of morphometric characters of Heterorhabditis species (Nemata: Heterorhabditidae) and the role of morphometrics in the taxonomy of species of the genus. The Journal of Parasitology 82 (5): 806-813. [ Links ]
STUART, R. J.; BARBERCHECK, M. E.; GREWAL, P. S.; TAYLOR, R. A. J.; HOY, C. W. 2006. Population biology of entomopathogenic nematodes: Concepts, issues, and models. Biological Control 38: 80-102. [ Links ]
TALAVERA C., M.; PADILLA C., M. 2003. Reconsideraciones técnicas al ciclo biológico del barrenador de ramas del aguacate (Copturus aguacatae, Kissinger). Proceedings V World Avocado Congress. Pp. 445-448. [ Links ]
UNRUH, T. R.; LACEY, L. A. 2001. Control of codling moth, Cydia pomonella (Lepidoptera: Tortricidae), with Steinernema carpocapsae: Effects of supplemental wetting and pupation site on infection rate. Biological Control 20: 48-56. [ Links ]
WOODRING, J. L.; KAYA, H. K. 1988. Steinernematidae and Heterorhabditid nematodes: A handbook of biology and techniques. Bulletin 331. Arkansas Agriculture Experiment Station, Fayeteville, Arkansas. 28 p. [ Links ]